Контрольна робота 11 клас: "Періодичний закон і Періодична система хімічних елементів"
Контрольна робота з теми:
«Періодичний закон та Періодична система хімічних елементів»
Варіант 1
- Вкажіть елемент 2 періоду, який виявляє найсильніші неметалічні властивості:
а) Li; б) Ne; в) F; г) C; д) N.
- В ряду атомів хімічних елементів Li – Be – B – C:
а) Збільшується радіус; б) збільшується електронегативність; в) зменшується число електронів зовнішнього енергетичного рівня; г) зменшується загальна кількість електронів в атомах.
-
Вкажіть кількість частинок, що містить ядро нукліду Ванадію
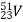 :
:
а) 51 нейтрон і 23 електрони; б) 51 протон і 28 нейтронів; в) 23 протони і 28 нейтронів;
г) 23 нейтрони і 51 протон; д) 74 нейтрони і 23 протони.
- Правильним є твердження. Ступінь окиснення -3 у сполуках можуть виявляти елементи:
а) побічної підгрупи ІІІ групи; б) головної підгрупи ІІІ групи; в) побічної підгрупи ІV групи;
г) головної підгрупи V групи; д) побічної підгрупи VI групи.
- Вкажіть, у якому стані атом Хлору має електронну конфігурацію 1s22s22p63s23p33d2
а) у першому збудженому стані; б) в основному стані;
в) у другому збудженому стані; г) у третьому збудженому стані.
- Вкажіть формулу сполуки, утвореної Флуором та Йодом, якщо в ній Йод виявляє найвищий ступінь окиснення:
а) ![]() .
.
- Встановіть відповідність електронної формули ЙОНУ елемента:
А- 1s2 1.![]()
Б - 1s22s22p63s23p63d104s24p6 2.![]()
В - 1s22s22p63s23p6 3.![]()
Г - 1s22s22p63s23p6 4.![]()
- Встановіть відповідність між хімічним елементом та його характеристикою:
А- Бром 1. Найбільш електронегативний елемент;
Б - Карбон 2. Найбільш електронегативний елемент ІV групи;
В - Натрій 3. Найменш електронегативний елемент ІІ періоду;
Г - Флуор 4. Найбільш електронегативний елемент IV періоду;
5. Найменш електронегативний елемент ІІІ періоду;
- Дайте характеристику хімічного елемента № 33 а саме:
- вкажіть положення елемента у Періодичній системі кількість протонів, електронів та нейтронів;
- складіть електронну та графічну формулу цього елемента, вкажіть кількість неспарених електронів;
- напишіть електронну конфігурацію атома цього елемента у збудженому стані;
- Вкажіть усі можливі валентні стани та ступені окиснення, що характерні для цього елемента.
- Завдання з відкритою відповіддю
Чому елементи з порядковими номерами 8 і 16 знаходячись в одній групі, виявляють різну вищу валентність? Відповідь обгрунтуйте на основі електронної будови атомів.
Контрольна робота з теми:
«Періодичний закон та Періодична система хімічних елементів»
Варіант 2
- Вкажіть, яка з поданих нижче характеристик атомів елементів періодично змінюється:
а) відносна атомна маса; б) кількість енергетичних рівнів у атомі; в) кількість електронів на зовнішньому енергетичному рівні; г) кількість нейтронів;
- Вкажіть формулу сполуки, утвореної Флуором та Бромом, якщо в ній Бром виявляє ступінь окиснення у другому збудженому стані:
а) ![]() .
.
- Вкажіть елемент ІІІ групи, який виявляє найсильніші металічні властивості:
а) B; б) Tl; в) Nh; г) Ac; д) Al.
- Вкажіть, у якому стані атом Фосфору має електронну конфігурацію 1s22s22p63s13p33d1:
а) у першому збудженому стані; б) в основному стані;
в) у другому збудженому стані; г) у третьому збудженому стані.
- В ряду атомів хімічних елементів F – Cl – Br – I:
а) Збільшується радіус атома; б) збільшується електронегативність; в) збільшуються неметалічні властивості; г) зменшуються відновні властивості.
-
Вкажіть кількість частинок, що містить ядро нукліду Ванадію
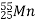 :
:
а) 25 нейтронів і 30 протонів; б) 25 протонів і 30 нейтронів; в) 55 нейтронів і 25 протонів;
г) 55 протонів і 30 нейтронів; д) 80 нейтронів і 25 електронів.
- Встановіть відповідність між зарядом ЙОНУ та кількістю електронів у ЙОНІ елемента:
Кількість електронів у йоні Йон елемента
А- 54 1.![]()
Б - 2 2.![]()
В - 10 3.![]()
Г - 36 4.![]()
- Встановіть відповідність між хімічним елементом та його характеристикою:
А- Літій 1. Має найбільший радіус атома у своїй групі;
Б - Натрій 2. Має найбільшийж радіус атома у ІІ періоді;
В - Радій 3. Проявляє найбільші кислотні властивості;
Г - Флуор 4. Має найбільші відновні властивості у ІІІ періоді;
5. Має найменші відновні властивості у ІІІ періоді.
- Дайте характеристику хімічного елемента № 35 а саме:
- вкажіть положення елемента у Періодичній системі кількість протонів, електронів та нейтронів;
- складіть електронну та графічну формулу цього елемента, вкажіть кількість неспарених електронів;
- напишіть електронну конфігурацію атома цього елемента у збудженому стані;
- Вкажіть усі можливі валентні стани та ступені окиснення, що характерні для цього елемента.
- Завдання з відкритою відповіддю
На основі електронної будови атомів поясніть, чому фтор не проявляє валентності, що дорівнює номеру групи у якій він розташовується.


про публікацію авторської розробки
Додати розробку
