Контрольна робота з теми: “Хімічні реакції”
Контрольна робота з теми:
“Хімічні реакції”
Варіант 1
- (1б.) Електролітична дисоціація якої сполуки є необоротним процесом?
а) HNO3
б) HCl
в) Cu(OH)2
г) H2SO
- (1б.) Який вчений вперше створив гальванічний елемент?
а) Лекланше
б) Гальвані
в) Бекетов
г) Деніе
- (1б.) Як змінюється швидкість реакції: 2СО + О2 = 2СО2, якщо зменшити об’єм газової суміші у 3 рази:
а) збільшиться у 3 рази
б) збільшиться у 6 раз
в) збільшиться у 9 раз
г) збільшиться у 27 раз
- (1б.) Укажіть правильне твердження щодо хімічної рівноваги:
а) після встановлення хімічної рівноваги реакція зупиняється
б) якщо система перебуває в рівноважному стані, концентрація речовин не змінюється
в) хімічні рівновага настає тільки в необоротних реакціях
г) стан хімічної рівноваги неможливо порушити жодними чинниками
- (1б.) Позначте речовини, при взаємодії яких утворюється осад:
а) цинк гідроксид та натрій гідроксид
б) кальцій карбонат та нітратна кислота
в) натрій хлорид та калій нітрат
г) арґентум нітрат та калій хлорид
- (1.5 б.) Установіть відповідність між явищем, що свідчить про перебіг хімічної реакції та її реагентами:
|
Явище |
Реагенти |
|
А) натрій хлорид і калій сульфат |
|
Б) натрій сульфат і барій хлорид |
|
В) ортофосфатна кислота і натрій гідроксид |
|
Г) калій карбонат і хлорид на кислота |
|
|
Д) натрій гідроксид і калій хлорид |
- (1.5 б.) Установіть відповідність між складовими гальванічного елемента, напрямом руху заряджених частинок і цифрами на рисунку:
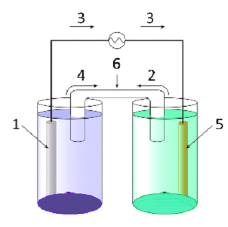
|
1 |
А) рух аніонів |
|
2 |
Б) катод |
|
3 |
В) рух катіонів |
|
4 |
Г) анод |
|
5 |
Д) рух електронів |
|
|
Е) сольовий місток |
- (2б.) Якою є реакція середовища водних розчинів ферум(ІІІ)хлориду, калій нітрату та магній нітрату? Відповідь обґрунтуйте за допомогою рівнянь реакцій гідролізу.
- (2б.) Взаємодією залізі з хлоридною кислотою 200 г з масовою часткою гідроген хлориду 18,25% добули водень об’ємом 10 л . Обчислити вихід продукту реакції газоподібної речовини.
Варіант 2
- (1б.) Розчин якої солі під час гідролізу матиме кисле середовище?
А) Na2SO4
Б) Fe(NO3)2
В) К2CO3
Г) ВаCl2
- (1б.) Який вчений сформулював загальний принцип зміщення хімічної рівноваги?
А) Лавуазьє
Б) Хоффмани
В) Гей-Люссак
Г) Ле Шательє
- (1б.) У скільки разів збільшиться швидкість реакції: СО + Сl2 = СОСl2, якщо тиск у системі збільшиться у 3 рази:
А) збільшиться у 3 рази
Б) збільшиться у 6 раз
В) збільшиться у 9 раз
Г) збільшиться у 12 раз
- (1б.) Позначте правильне твердження щодо принципу Ле-Шательє:
А) збільшення концентрації однієї з речовин у рівноважній системі зміщує рівновагу таким чином, щоб максимально її витратити
Б) збільшення концентрації однієї з речовину рівноважній системі зміщує рівновагу таким чином, що її концентрація ще додатково збільшується
В) підвищення тиску в рівноважній системі зміщує рівновагу в бік збільшення сумарного об’єму
Г) підвищення температури в рівноважній системі зміщує рівновагу в бік екзотермічної реакції
- (1б.) Позначте речовини, взаємодія яких не відбувається:
А) цинк гідроксид та натрій гідроксид
Б) арґентум нітрат та калій хлорид
В) натрій хлорид та калій нітрат
Г) кальцій карбонат та нітратна кислота
- (1.5 б.) Установіть відповідність між явищем, що свідчить про перебіг хімічної реакції та її реагентами:
|
Явища |
Реагенти |
|
А) натрій хлорид і калій сульфат |
|
Б) натрій сульфат і барій хлорид |
|
В) ортофосфатна кислота і натрій гідроксид |
|
Г) калій карбонат і хлорид на кислота |
|
|
Д) натрій гідроксид і калій хлорид |
- (1.5 б.) Установіть відповідність між типами і схемами хімічних реакцій:
|
Типи хімічних реакцій |
Схеми хімічних реакцій |
|
А) Ca + Cl2 → CaCl2 |
|
Б) NH3 → N2 + H2 |
|
В) CaCO3 → CaO + CO2 |
|
Г) Na + H2O → NaOH + H2 |
|
|
Д) BaO + H2O → Ba(OH)2 |
- (2б.) Спрогнозуйте середовище розчинів солей: калій нітрату, магній нітрату, натрій сульфіду. Складіть рівняння гідролізу.
- (2б.) Унаслідок взаємодії натрію кількістю речовини 0,2 моль з водою добули водень об’ємом 1,916 л ( за н.у.). Обчислити вихід продукту реакції.


про публікацію авторської розробки
Додати розробку
