Коспект уроку "Закон Авогадро. Молярний об'єм газів"
Тема. Закон Авогадро. Молярний об'єм газів.
Мета: сформувати знання про закон Авогадро, молярний об’єм газу та навчити користуватись ними в розрахунках; розвинути поняття про кількість речовини та способи її обчислення; формувати науковий світогляд, виховувати допитливість, вміння працювати в колективі.
Обладнання: періодична система хі мічних елементів, «хімічні пазли», малюнки із зображенням об'ємів різних речовин кількістю речовини 1 моль
Хід уроку
І. Актуалізація опорних знань
1. На дошці в довільному порядку прикріплені малюнки з позначеннями фізичних величин та частини формул, що дозволяють їх обчислити, значення сталої Авогадро. Учні мають утворити з цих частин завершені формули
2. Перевірка домашнього завдання (задачі)
ІІ. Мотивація навчальної діяльності
- Обговорення малюнку. Як залежить відстань між частинками, густина речовин від їх агрегатного стану? За яких умов змінюється агрегатний стан речовини? Чи всі речовини можна перевести в газоподібний агрегатний стан?

- Проаналізуйте, який об’єм займають речовини кількістю речовини 1 моль. Який їх агрегатний стан?
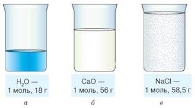
- Порівняйте об’єми газів гелію та хлору кількістю речовини 1 моль. Чому кулька з хлором лежить, а з гелієм прагне злетіти?

Чи легко зважити гази? Як їх зручніше відміряти?
Отже, існує залежність кількості речовини та об’єму? Сьогодні її визначимо та навчимось робити обчислення
ІІІ. Формування нових знань і вмінь
- Що таке «Нормальні умови»?
1 моль якої б речовини ми не брали, коли її перевести в газоподібний стан, то віддаль між молекулами стає настільки великою, що розміри самих молекул порівняно з відстанню між ними мізерні. Чи впливають розміри молекул газів на те, який об’єм займають ці гази?
Отже, розміри молекул не впливають на об'єм, а що ж тоді впливає ?
Щоб перевести речовину з твердого агрегатного стану в рідкий, а потім – в газоподібний, треба - що зробити? Якщо продовжимо гріти, то й об'єм продовжить зростати? Тоді на об'єм газів впливає - ? (температура)
Чи можна стискати гази? Вам доводилось накачувати велосипедні колеса? Чи сильно змінювався їх об'єм при цьому? Чому вони ставали після накачування твердими? Отже, на об'єм можна вплинути, змінивши - ? ( тиск)
Тому, щоб порівнювати об'єми різних газів кількістю речови 1 моль, варто їх вимірювати за однакових умов – при однакових температурі й тиску. Вченими прийнято всі ці обчислення робити за нормальних умов.
За IUPAC (після 1982 року) нормальні умови:
- температура 273,15 К (0°С, 32°F);
- абсолютний тиск 100,00 кПа (14,504 фунтів на квадратний дюйм, 0,987 атм, 1,000 бар). (До 1982 року 101, 3 кПа)
- Молярний об’єм газів.
Як ви обчислюєте густину на уроках фізики?
ρ=m/V, V= ?
ρ(Н2О пари)= 0,8 г/л, яка маса 1 моль води? М(Н2О пари)=18г/моль. Обчисліть об’єм 1 моля води. V(Н2О пари)=18:0,8= ?
ρ(О2) = 1,43 г/л, який об’єм 1 моля кисню? V(О2) =32:1,43= ?
ρ(Н2) = 0,09 г/л, V(Н2) = ?
ρ(СН4) =1,71 г/л, V(СН4) = ?
Яке значення об’єму одного моля для кожного газу виходить? Чому воно щоразу однакове?
Отже, молярний об'єм газу – об'єм його 1 моля:
![]()
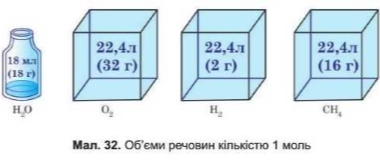
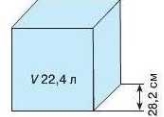
Як уявити об’єм 22,4 л?
- Закон Авогадро та наслідок з нього
Прочитайте на ст. 111 підручника. Проаналізуйте мал. 37 на ст. 111 та обидва твердження.
- Обчислення кількості газуватої речовини з використанням значенням її об’єму.
1 моль газу – займає об’єм 22,4 л. ( Чи є різниця, який газ беремо?)
тоді 2 моль газу - ?
10 моль газу - ?
0,5 моль газу - ?
Як виразити цю залежність формулою? Чи маєте пропозиції? (Згадайте відомі вам формули для обчислення кількості речовини)
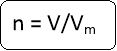 , де Vm = …
, де Vm = …
IV. Узагальнення й систематизація знань. Розв’язування розрахункових задач
«Хімічна естафета» (окремі з використаних тут завдань взято з підручника для 8 кл Дячук)
1. Який об’єм займають за нормальних умов: а) 2 моль азоту; б) 0,5 моль кисню; в) 0,25 моль азоту?
2. Яка кількість речовин кисню міститься за нормальних умов: а) в 1 м3; б) 11,2 л; в) 224 м3
3. Подумайте, як можна обчислити масу газоподібної речовини або число її частинок, знаючи об’єм речовини? Як обчислити об'єм, знаючи ці величини?
Виведіть відповідні формули, використовуючи всі відомі способи обчислення кількості речовини…
4 . Подумайте, як розв’язати задачі на 1 дію:
Який об’єм займають за нормальних умов: а) 10 г водню; б) 60,2*1023 молекул водню?
- Де міститься більше молекул амоніаку — у 100 г чи в 100 л (н. у.)?
V. Підсумки
- Що сподобалось? Що вдалось?
- Що не сподобалось?
- Що візьму з собою?
VІ. Домашнє завдання.
Вивчити §20, виконати вправу 137 на ст. 114 підручника (П. П. Попель)


про публікацію авторської розробки
Додати розробку
