Презентація "Молярна маса речовини"
Про матеріал
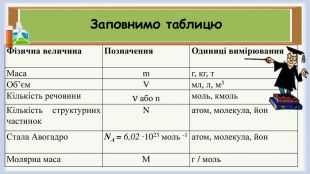
Презентація до уроку на тему Молярна маса речовини. Дається теоретична частина та розв'язок задач. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку








































-

Безсонова Оксана
21.01.2023 в 18:14
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Палій Людмила Олександрівна
11.01.2023 в 21:16
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
24.01.2022 в 20:56
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Франчук Мар'яна Віталіївна
16.01.2022 в 16:28
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 1 відгук