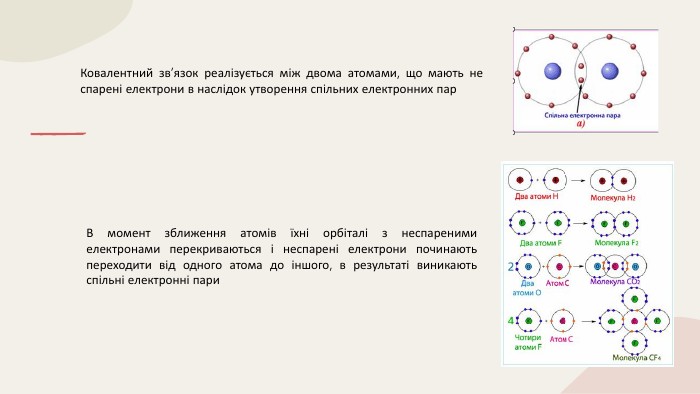
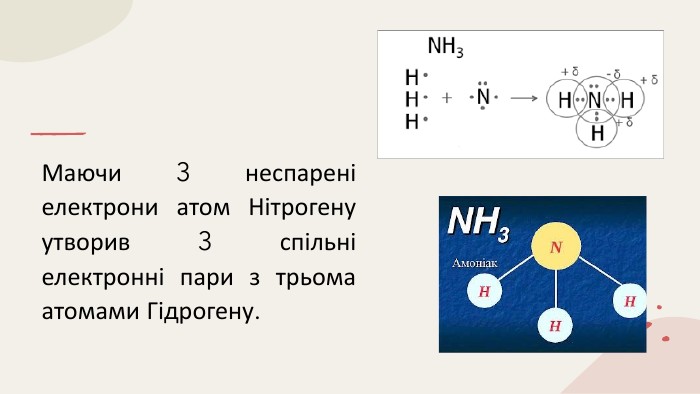
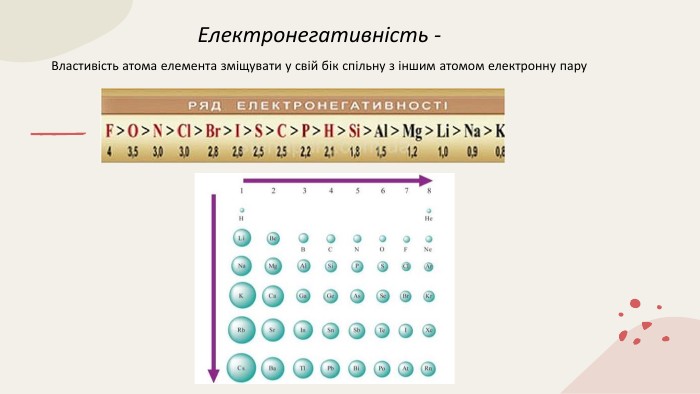
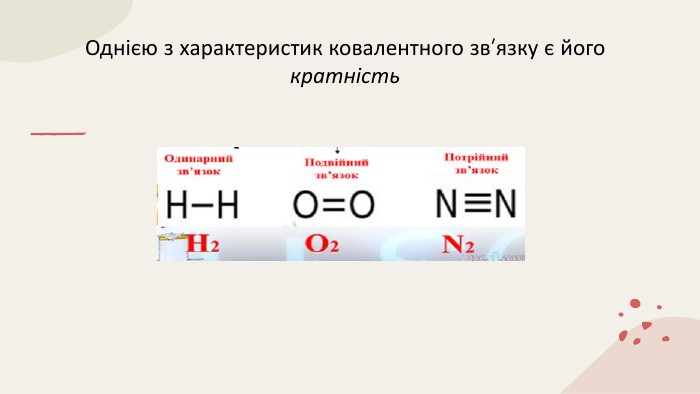
Ковалентний зв'язок 11 клас
Про матеріал
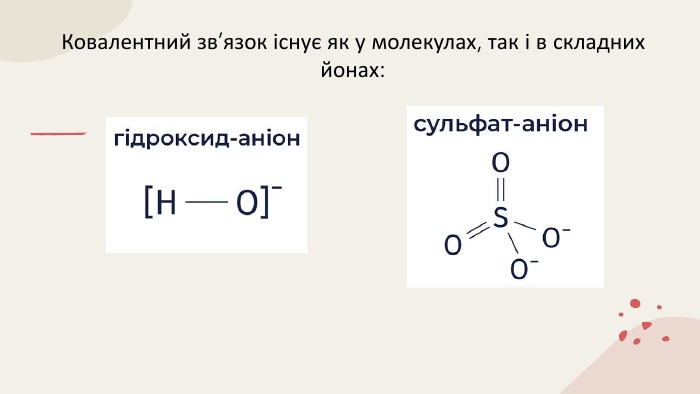
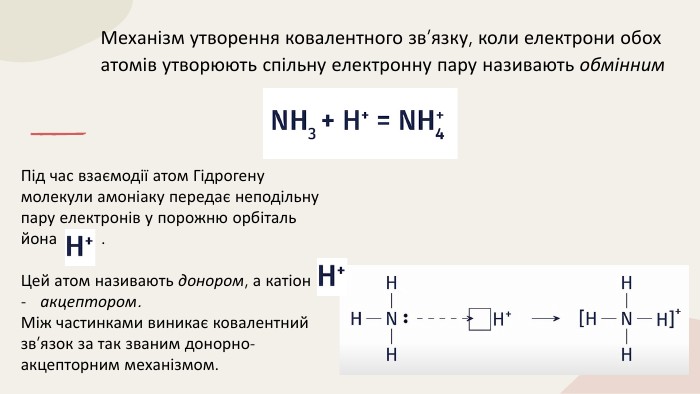
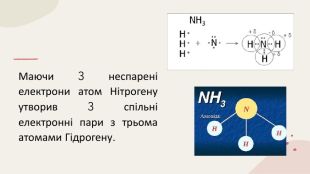
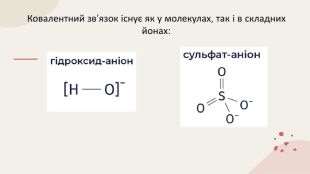
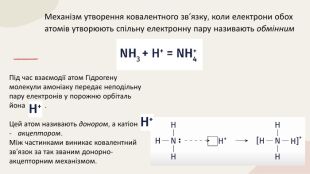
Ковалентний зв'язок. Полярний і неполярний. Механізм утворення. Донорно-акцепторний та обмінний. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку