Конспект лекції з теми Сірка та її сполуки
Чортківський державний медичний коледж
Конспект
з хімії на тему:
«Сульфур та його сполуки»
викладач хімії : Зацерковний М.С.
Чортків
Сульфур
Хімічні властивості
Хімічна активність сірки також доволі висока. При нагрівання вона реагує майже з усіма елементами.
1. Взаємодія з металами.
- 2Cu + S = Cu2S
2. Взаємодія з неметалами.
- S + O2 = SO2↑
- H2 + S = H2S ↑
Застосування. Найбільша маса сірки і природних сульфідів витрачається на вироблення сульфатної кислоти.
Оксиди сульфуру
Сульфур утворює два кислотні оксиди: оксид сульфуру (IV) SO2 і оксид сульфуру (VI) SO3.
Оскид сульфуру (IV) SO2 (діоксид сульфуру, сірчастий газ) – це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Дуже легко розчиняється у воді (в 1л води при 200С розчиняється 43 л SO2.
Застосування. Найважливіша галузь застосування оксиду сульфуру (IV) SO2 – це виробництво сульфатної кислоти H2SO4.
Фізіологічна дія. Оксид сульфуру (IV) SO2 токсичний. Невелика концентрація його у повітрі викликає подразнення слизових оболонок дихальних органів і очей.
Вплив на навколишнє середовище. Діоксид сульфуру SO2 один з основних забрудників повітря, він отруює навколишнє середовище.
Звідки ж береться діоксид сульфуру SO2 у повітрі?
Природним джерелом SO2 є окислення сірководню H2S атмосферним киснем й озоном:
- 2H2S + 3O2 = 2SO2 + 2H2O
- H2S + O3 = SO2 + H2O
Діоксид сульфуру SO2, потрапляючи у повітря, викликає утворення “кислотних дощів”, шкідливих для усього живого.
Оксид сульфуру (IV) SO3 (триоксид сульфуру) – безбарвна рідина, яка за температури, нижчої від 170С, кристалізується, перетворюючись на довгі шовковисті кристали. Дуже легка речовина, сильний окисник. Токсичний, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки шкіри, енергійно руйнує органічні сполуки. Зберігають його у запаяних скляних посудинах.
Оксид сульфуру (VІ) на повітрі димить, бурхливо взаємодіє з водою з виділенням великої кількості теплоти, утворюючи сульфатну кислоту:
- SO3 + H2O = H2SO4
Застосовується оксид сульфуру (IV) SO3 у виробництві сульфатної кислоти H2SO4. У лабораторній практиці він використовується як водовбирний засіб.
Сульфатна кислота
Сульфатна кислота H2SO4 (безводна, 100%-ва) – важка безбарвна оліїста рідина. Густина її концентрованого розчину (w(H2SO4) = 98%) за стандартних умов 1,84 г/см3. вона нелегка, запаху не має. Надзвичайно гігроскопічна. Активно вбирає вологу. Змішується з водою у будь-яких співвідношеннях. Розчинення сульфатної кислоти у воді супроводжується виділенням великої куль ості теплоти, що може призвести до закипання води і розбризкування кислоти.
Розбавлена сульфатна кислота виявляє всі хімічні властивості, характерні для кислот:
- Зміна кольору індикатора.
- Дисоціація кислоти.
І ступінь H2SO4 Н+ + HSO -4 – гідрогенсульфат-іон
ІІ ступінь HSO –4 Н+ + SO -24 – сульфат-іон.
- Взаємодія з основами.
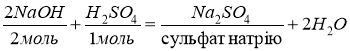
![]()
- Взаємодію з оксидами металів.
MgO + H2SO4 = MgSO4 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
- 5. Взаємодія з солями.
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
2KNO3 + H2SO4 = K2SO4 + 2HNO3
- 6. Взаємодія з металами.
Mg + H2SO4 = MgSO4 + H2
Zn + H2SO4 = ZnSO4 + H2
Fe + H2SO4 = FeSO4 + H2
Застосування сульфатної кислоти і сульфатів
Сульфатна кислота є важливим продуктом хімічної промисловості. Вона у великих кількостях застосовується у виробництві мінеральних добрив, волокон, пластмас, барвників, вибухових речовин, у металургії в процесі добування міді. Нікелю, урану та інших металів. Використовується також як осушувач газів.
Серед сульфатів велике практичне значення мають мідний і залізний купороси CuSO4 5H2O i FeSO4 7H2O.
Чесна Сірка і Нечиста Сила
«ПОРТРЕТ»
Сульфур — незвичайний хімічний елемент. Ще на зорі цивілізації він ввійшов до міфів і священних обрядів. На Близькому Сході, а пізніше в християнській Європі сірку вважали речовиною пекла; запах палаючої сірки став ознакою диявола.
Але елемент № 16 — це не тільки містика. Він брав участь у природних катаклізмах і біохімічних процесах, його вивчали хіміки й металурги, використовували лікарі, садівники, ткачі, сукновали, капелюшники. У наш час сірчана кислота стала однією з головних речовин хімічної промисловості.
Деякі способи застосування сірки чисті, гуманні й шляхетні, інші мимоволі нагадують про диявола й нечисту силу.
Що ж особливого в цьому шістнадцятому елементі, чому його згадують у творах містиків, художній літературі й навіть у Біблії?
Почасти це пов'язано з поширенням Сульфуру в природі, почасти — із його хімічними властивостями. Сульфуру дуже багато в земній корі — 0,05 % за вагою. Подекуди в Середземномор'ї і на Близькому Сході сірки повнісінько в ґрунті в самородному вигляді. Сірка (жовтий камінь) там зазвичай утворювалася при відновленні сульфатів бактеріями. Особливо багато жовтого каменю було на Сицилії, там його добувають із давнини до наших днів. Домішки бітумів, карбонатів, сульфатів, глини іноді надавали йому незвичайного кольору, аж до червоного, бурого і чорного.
Поблизу від вулканів зустрічаються жовті натіки, кірки й кристали сірки. Елемент виривався з надр у вигляді сірководню, при окислюванні якого виділявся у вільному вигляді. Жителі Апеннін і Балкан, Малої Азії і Близького Сходу добре знали про ядучі випаровування, що виходили із землі в деяких місцях. їх можна було, наприклад, спостерігати поблизу Неаполя, де розташовані Флегрейські поля — накопичення валів, тріщин, провалів. Часом їх застеляють дим і сірчистий газ. Вважалося, що там олімпійські боги боролися з гігантами.
Сульфур також входить до складу нафти, асфальту, бітуму. При горінні цих речовин поширювався характерний запах, за яким безпомилково впізнавали сірку. До речі, усупереч поширеній думці, пахне не сам Сульфур, а його сполуки: сірчистий газ, сірководні й меркаптани, відомі своїм смородом. У вологому повітрі здрібнена сірка окислюється й перетворюється на сірчистий газ. Саме його мали на увазі, коли говорили про запах сірки.
ВИНУВАТИЦЯ НЕЩАСТЬ
В історії стосунків сірки й людей були темні сторінки. Виділяючись із вулканів і вулканічних тріщин, сульфур оксид, або сірководень, траплялося, вбивав тисячі нещасливих. Це трапилося з давньогрецьким ученим Плінієм Старшим, що загинув під час виверження Везувію, і з безліччю інших людей.
Багато шкоди завдавали домішки сірки: псували метали, знижуючи їхню міцність. І тому з давнини до наших днів одне з головних завдань металургів — очистити руду від домішок сірки.
Металургія в давнину була оточена таємницею. І пізніше, у середні віки, ковалі були особливими людьми, їх вважали кимсь на зразок чаклунів. А на початку нашої ери зі спроб удосконалити метали виникла алхімія. Багато сульфідів блищать, мов метали. Серед них пірит, залізний колчедан (FeS2), халькозин, або мідний блиск (CuS2), халькопірит, або мідний колчедан (CuFeS2). Шість із семи металів, відомих древнім, зустрічаються у вигляді сульфідів. Можливо, алхіміки вважали ці руди недосконалими металами, у яких є одна цінна якість — блиск і немає іншої — ковкості.
Однак з них шляхом випалу й відновлення можна було одержати справжні метали. Оскільки при прожарюванні на повітрі з них виділявся сірчистий газ, алхіміки могли визнати сірку складовою частиною будь-якої руди і будь-якого металу, навіть золота.
Сіркою називали «горюче начало» металів, адже при випалюванні вона вигорала. Іншою складовою частиною, що відповідає за ковкість, вважали ртуть.
Перші християни уникали язичеської мудрості й ставилися до алхіміків вороже. Можливо, вони приписували недоступне їм знання підступам нечистої сили. Пізніше церква примирилася з алхімією, однак під час переходу від феодалізму до капіталізму їхні стосунки знову зіпсувалися. Налякані інквізицією люди, у тому числі й освічені, знову почали вважати алхімію підозрілим, чаклунським заняттям, і не дивно, що вони пов'язували її з підступом диявола.
На жаль, свідоме використання сірки принесло не менше лиха, ніж її випадкова участь у людських справах. Найгіршими словами можна згадати чорний порох. Мільйони убитих людей, зруйновані фортеці й міста, катастрофи на порохових заводах, поневолення народів, і, між іншим, винищування багатьох видів тварин — ось рахунок, який можна висунути його користувачам. Чим не диявольське зілля? Саме так і називали його в Європі, як тільки він там з'явився, що, однак, не заважало нарощувати виробництво чорного пороху.
На рахунку іприту жертв менше, але його застосування в XX столітті як бойової отруйної речовини злякало громадськість європейських країн. Цю сполуку, схожу за запахом на гірчицю (через це її Ще називали гірчичним газом), уперше випустили на ворога німецькі війська. 12 липня 1917 року біля бельгійського міста Іпр хмари отруйного газу покрили англо-французькі частини. Чи міг подумати академік Зелінський, який відкрив у 1886 році дихлордіетилсульфід, що синтезована ним сполука одержить назву іприт і стане причиною загибелі й каліцтв 40 тисяч людей тільки в Першій світовій війні? Що мільйони снарядів з цією речовиною скинуть у Балтійське море або відправлять на склади, де вони будуть поступово руйнуватися, загрожуючи новими катастрофами?
Не до таких страшних, але все-таки неприємних наслідків призводило спалювання сірки разом із корисними копалинами Коли почалася промислова революція і кочегари почали годувати вугіллям ненаситні топки, сульфур оксид разом із димом вилітав у трубу.
До тих самих наслідків призводило і спалювання нафти, і видобуток самої сірки, коли її виварювали з породи.
І тільки кілька десятиліть тому вчені з'ясували, що сірчистий газ не просто забруднює повітря, але багато його перетворюється на кислотні дощі, які гублять рослини. При цьому особливо страждають хвойні ліси.
У темних справах були помічені не тільки сам Сульфур та двоокис, але також і сірководень. Цей газ виділяється з тріщин поблизу вулканів і утворюється при гнитті органічних залишків, які завжди містять Сульфур. І хоча він чимало попрацював у хімічних лабораторіях, де з його допомогою проводили якісний аналіз металів і їхніх солей, сморід і отруйність створили йому досить погану репутацію.
Ще один прояв сірки може посісти хоч і скромне, але цікаве місце в цьому списку. Відьми, чаклуни, маги тощо, трапляється, спалюють волосся ворога або замовника. При цьому утворюється сірчистий газ, адже у волоссі молекули білка кератину скріплені атомами Сульфуру.
НА СТОРОЖІ ЧИСТОТИ
Не слід пов'язувати сірку з витівками нечистої сили. Відповідно до Біблії, сам Господь використовував її для покарання грішників на землі, у Содомі й Гоморрі, під землею, у пеклі.
Мабуть, саме тому в ХШ—XVII століттях у Європі, яка марила дияволом, нечисту силу пов'язували із запахом сірки. Люди теж із незапам'ятних часів застосовували сірку приблизно з цією ж метою Одіссей, наприклад, винищивши ненависних кандидатів на руку Пенелопи, знищував сам їхній дух, спалюючи сірку. Сіркою язичницькі жерці обкурювали храми під час церемоній. Можливо, вони здогадувалися, що в такий спосіб можна припинити поширення заразних хвороб. Мабуть, і ця процедура зіграла свою роль у приписуванні нечистій силі запаху сірки, адже для перших християн язичницькі жерці були слугами диявола. Як би там не було, такий спосіб дезінфекції щасливо дожив до початку XX століття. Лікарі, щоправда, зазначали, що він допомагає не при будь-якій інфекції, зате досить зручний, а іноді (наприклад, при знищенні збудників холери на поверхні предметів) і цілком надійний.
У медицині сірка знайшла безліч інших застосувань. її часто використовували у вигляді мазі при шкірних захворюваннях. Великий філософ, лікар Авіценна в «Каноні медицини» наводить рецепти не менше двох десятків ліків, до складу яких входить сірка. Ртутним ефіопом (чорним меркурій сульфідом) і кіновар'ю (червоним меркурій сульфідом) арабські медики лікували шкірні хвороби, а купрум і цинк сульфідом — очні. Великий лікар середньовіччя Парацельс вважав, що лихоманка й чума виникають від надлишку в організмі Сульфуру. Правда, він розумів під нею не елемент, а якесь міфічне начало: якщо воно було в природі (макрокосмі), воно повинно було входити і до складу людини (мікрокосму).
Дерматологи дотепер виписують препарати сірки для лікування корости і грибкових захворювань. «При взаємодії сірки з органічними речовинами утворюються сульфіди та пентатіонова кислота, які характеризуються протимікробною і протипаразитною дією», — пише з цього приводу авторитетний медичний довідник. До речі, саме цю мазь варила в каструльці булгаковська героїня, відьма Гелла, нею вона лікувала хворе коліно Воланда.
Атоми Сульфуру входять до складу величезної кількості ліків, перерахувати які неможливо. Найвідоміші серед них — сульфаніламідні препарати. Вони зв'язуються з одним із ферментів, що виробляється мікроорганізмом, й інгібують його, тобто не дають ферментові захоплювати з цитоплазми параамінобензойну кислоту й синтезувати фолієву. У результаті такі мікроорганізми гинуть. Подібні препарати застосовують і у ветеринарії.
Сірка допомагає боротися з комахами, кліщами і хворобами рослин, які викликає та ж сама «погань»: бактерії й гриби.
Мелену й колоїдну сірку, вапняно-сірчаний відвар протягом тривалого часу використовували для захисту рослин від грибкових захворювань: борошнистої роси, гнилизни, парші, плямистості. Не було забутим і давнє обкурювання.Сполуками Сульфуру консервували плоди й овочі, захищали кораблі від обростання і рибальські мережі від гниття. Порошком сірки знешкоджують пролиту ртуть.
Нарешті, сірка допомагає наводити чистоту в буквальному значенні: сульфатна група входить до складу молекул синтетичних миючих засобів.
СУЛЬФУР В ОРГАНІЗМІ - ВНУТРІШНІЙ ОХОРОНЕЦЬ
У нашому організмі теж є кілька сполук Сульфуру, призначених для захисту, насамперед — для знешкодження агресивних сполук, що утворюються при окислюванні органічних речовин. Входить Сульфур і до складу коферменту А — однієї з ключових сполук в обміні білків, жирів і вуглеводів. Саме він спрямовує реакції, у ході яких із цих речовин утворюється енергія. А оскільки енергія потрібна для боротьби з будь-якими шкідливими впливами, чи то віруси, чи бактерії або отрути, кофермент А можна вважати важливим борцем за здоров'я організму і його внутрішню чистоту.
Сульфур входить до складу безлічі сполук усередині нас і ззовні. Серед них є отрути та протиотрути, речовини агресивні й захисні, причетні до чистоти й пов'язані з нечистотами. Колись сірку вважали знаряддям кари для грішників, міткою нечистої сили, містичним началом металів. У наші дні відомості про отруйність пестицидів, що містять Сульфур, із науки перекочовують у міфи індустріальної епохи. Історія продовжується.
Додаток:Поняття про алотропію.
Хімічні елементи у вільному стані існують у формі простих речовин. Так, елемент Оксиген утворює дві прості речовини – кисень О2 та озон О3.
Озон. Якщо на кисень подіяти електричним розрядом, то з’являється характерний запах свіжості – утворюється газоподібний озон:
Кисень поглинає енергію і перетворюється на озон, а озон самовільно розкладається, утворюючи кисень.
Обидві прості речовини – кисень О2 і озон О3 – утворені одним і тим самим хімічним елементом – Оксигеном, а властивості у них різні.
Явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою, називається алотропією, а самі прості речовини – алотропними формами (модифікаціями).
Властивості кисню й озону.
|
Властивості простих речовин |
Прості речовини |
|
|
кисень |
озон |
|
|
Агрегатний стан за стандартних умов |
Газ |
Газ |
|
Колір |
Безбарвний |
Синій |
|
Запах |
Без запаху |
Різкий, своєрідний |
|
Розчинність (у 100 об’ємах Н2О при 200С) |
3 об’єми |
49 об’ємів |
|
Густина газу за н.у. |
1,43 г/л |
2,14 г/л |
|
Температура кипіння |
-1930С |
-1120С |
|
Температура плавлення |
-2190С |
-1920С |
|
Фізіологічна дія |
Неотруйна |
Дуже отруйний |
|
Хімічні властивості |
Окисник |
Дуже сильний окисник |
|
Реакційна здатність |
Висока |
Дуже висока |
Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральний масел; як дезинфікуючий засіб у медицині; як окисник ракетного палива.
Проте буває й інша причина алотропії – різна структура кристалів. З таким типом алотропії можна ознайомитися на прикладі сірки.
Сірка за стандартних умов – крихка кристалічна речовина жовтого кольору. Погано проводить теплоту і не проводить електричного струму. У воді не розчиняється краще розчиняється в деяких розчинниках (у сірковуглеці CS2, бензині, етері та ін.).
І в розчинах, і в кристалах сірка складається з циклічних молекул S8, які за формою нагадують корону. Але в кристалах ці молекули можуть бути упаковані по-різному.
Якщо молекули розташовані щільно, утворюється алотропна форма ромбічна сірка. Менш щільне упакування молекул спричинює виникнення іншої алотропної форми – моноклінної сірки.
Якщо сірку розплавити і швидко охолодити, утворюється ще одна алотропна форма: пластична сірка – коричнева губоподібна маса.
Властивості ромбічної і моноклінної сірки
|
Властивості простих речовин |
Сірка |
|
|
ромбічна |
моноклінна |
|
|
Колір |
Лимонно-жовтий |
Блідо-жовтий, майже безбарвний |
|
Густина |
2,07 г/л |
1,96 г/л |
|
Температура плавлення |
112,80С |
119,30С |
1


про публікацію авторської розробки
Додати розробку
