Урок-подорож "АЛЮМІНІЙ: ФІЗИЧНІ І ХІМІЧНІ ВЛАСТИВОСТІ"
Урок-подорож «Алюміній: фізичні і хімічні властивості»
Цілі уроку: розширити знання учнів про хімічний елемент та метал алюміній, розкрити фізичні властивості алюмінію на основі його будови, вивчити хімічні властивості алюмінію; формувати навички складати рівняння хімічних реакцій, що підтверджують відновні властивості алюмінію; розвивати комунікативні вміння, встановлювати причинно-наслідкові зв’язки, робити висновки; виховувати інтерес до вивчення хімії, відповідальність за доручену справу.
Обладнання: Періодична таблиця хімічних елементів Д.І.Менделєєва, ряд активності металів, мультимедійна дошка, колекція «Алюміній», реактиви для демонстрування досліду.
Основні поняття і терміни: фізичні властивості алюмінію, хімічні властивості алюмінію, відновник, алюмотермія, сплави.
Методи і методичні прийоми: словесні (розповідь, пояснення, бесіда, розповідь з елементами бесіди), наочні (демонстрування схем, колекцій, дослідів); репродуктивні (бесіда) та пошукові (створення та розв’язування проблемних ситуацій); інтерактивні методичні прийоми, гра.
Тип уроку: урок засвоєння нових знань.
Форма уроку: урок-подорож
Хід уроку
І. Організаційний момент
Я затятий мандрівник. Ще з дитинства подорожі
навчали мене так само, як і формальна освіта
Девід Рокфеллер
Вчитель. Доброго дня! Запрошуємо вас у дивовижний світ подорожі, де ви дізнаєтеся багато цікавого! Подорож – це цікаві зустрічі та знайомство з новими речовинами. Шановні учасники нашої мандрівки, ця подорож проходитиме на висоті наукових знань зі швидкістю думки. Ви отримаєте корисну інформацію та практичні поради, які зможете використовувати у повсякденному житті.
ІІ. Актуалізація опорних знань
Прийом «Відкритий мікрофон»
1. Що знаходиться у вузлах кристалічних ґраток металів?
2. Що таке металічний зв'язок?
3. Перечисліть типові властивості металів?
4. Вкажіть найпоширеніший металічний елемент у земній корі?
- Назвіть метал, з якого виробляють електричні дроти через його високу електропровідність?
- Оксид цього хімічного елемента входить до складу дорогоцінного каміння. Назвіть цей оксид.
ІІІ. Мотивація навчальної діяльності
Прийом «Здивуй»
Метал алюміній не схильний до впливів навколишнього середовища і дивно легкий, вважався одним із найцінніших: його вартість протягом декількох років після відкриття перевищувала вартість золота. Не дивно, що історія використання алюмінію починається зі створення ювелірних прикрас і дорогих декоративних предметів. Одна з найбільших колекцій виробів з алюмінію (більше 16 тис. предметів) знаходиться у Франції – країні, де цей метал був вперше отриманий хімічним шляхом.
Імператор Франції Наполеон III забажав виготовити алюмінієві кіраси (елемент натільного захисного озброєння, що захищав груди і спину) для воїнів своєї армії. І за його приписом відомому французькому хіміку Анрі Етьен Сент-Клер Девілю були надані необмежені засоби для відшукування способу отримання алюмінію у великій кількості. У 1854р. Сент-Клер Девіль розробив новий, але дуже дорогий спосіб отримання алюмінію, тому Наполеону III довелося обмежити своє бажання виготовленням алюмінієвих кірас тільки для невеликої групи кірасирів, які становили особисту охорону імператора.
У 1855р. вироби з алюмінію були представлені у вітрині на Всесвітній виставці в Парижі, що знаходилася по сусідству з діамантами французької корони. Наполеон III, не приховуючи гордості за відкриття, зроблене під його персональним заступництвом, називав алюміній «своїм металом».
Оксид алюмінію. Рубін та сапфір не просто коштовне каміння, а дорогоцінні камені першої категорії. Їхня хімічна формула — Al2O3. Сапфіри і рубіни – це знамениті різновиди корунду. Корунд відомий людству з давніх-давен. Розкішні вироби з рубіну та сапфіру були популярні в Месопотамії та Єгипті, Індії, Персії, Китаї. Самоцвіти закохували в себе красою переливів, чистотою ліній і глибокими кольорами. Тож не дивно, що виготовлені з нього коштовності були окрасою царських скарбниць. Завдяки глибокому забарвленню і красивому астеризму (так називають гру світла у вигляді зірки) коштовні камені здавна вважалися воістину королівським подарунком. Подарувати рубін або сапфір правителю сусідньої країни в знак мирних намірів – верх дипломатичного етикету.
ІV. Повідомлення теми, мети, завдань уроку
V. Вивчення нового матеріалу
Станція «Історична»
Виступ учня-історика. Сьогодні алюміній є одним з найпоширеніших у застосуванні металом. Але його промислове виробництво було налагоджено лише у XIX ст. Тривалий час алюміній не виходив за стіни хімічної лабораторії. Ще у 1808 р. англійський фізик і хімік Хемфрі Деві спрогнозував існування металу, який є основою галунів, і назвав його алюміум, а пізніше алюмінум. Протягом 1808–1810 рр. він намагався електролітично виділити цей метал з глинозему, проте його спроби не мали успіху.
Вперше отримати АlСl3, вдалося датському фізику Гансу Крістіану Ерстеду в 1825 р. Вже тоді було відомо, що калій більш активний метал, ніж алюміній. Таким чином, Ерстед вирішив за допомогою будь-якої сполуки калію витіснити алюміній з його солі. Проте досліди з амальгамою калію не дали бажаного результату. Чистий алюміній отримати так і не вдалося. На цьому і закінчилися спроби Ерстеда упіймати невловимий метал.
Німецький хімік Фрідрих Велер вирішив відвідати Ерстеда в Копенгагені та детальніше ознайомитися з його роботами, пов’язаними з пошуками способів добування алюмінію з глинозему. Велер цілеспрямовано почав перевіряти досліди Ерстеда. За два роки дослідів за методикою Ерстеда він так і не отримав переконливих результатів. Не зважаючи на невдачу, молодий учений (йому було тоді 27 років) наполегливо продовжував своє полювання на цей метал. У нових дослідах він використав замість амальгами калію чистий калій, хоча робота з ним представляла великі труднощі та небезпеку. І ось 22 жовтня 1827 року «звіра» було спіймано. Вдалося його отримати зовсім небагато – всього тридцять грамів. Це була переконлива, але ще не остаточна перемога. Ретельно вивчивши досвід своїх попередників, Деві та Ерстеда, уникаючи їхніх помилок, Велер ставив дедалі нові й нові досліди, видозмінюючи їх в тому або іншому напрямку. Спроби отримати метал у вигляді зливка або хоч би великих зерен залишалися безрезультатними. Знадобилося 18 років наполегливих шукань! У 1845р. вони увінчалися успіхом. Велер отримав новий метал у вигляді зерен величиною з шпилькову головку.
У 1886 р. двоє молодих людей, американський студент Чарльз Мартін Холл і французький інженер Поль Луї Туссен Еру, незалежно один від одного відкрили один і той же спосіб одержання алюмінію. Електролітичний спосіб – електроліз – дозволяв добувати велику кількість алюмінію. З цієї миті слава алюмінію як дорогоцінного металу меркне і починається його тріумфальна хода світом.
Перший алюмінієвий завод в Україні запрацював 1933 у м. Запоріжжі.
Прийом «Відновлення втраченого»
|
Що? |
Де? |
Коли? |
Хто? |
|
Алюміній (назва) |
|
1808 |
|
|
|
Данія |
|
Ганс Крістіан Ерстед |
|
Добування алюмінію |
|
1845 |
|
|
Електроліз |
|
|
Чарльз Мартін Холл, Поль Луї Туссен Еру |
|
|
Запоріжжя |
|
|
Станція «Положення в ПС»
Гра «Скачки» (https://learningapps.org/watch?v=ptkatq6xa22)

- Яка кількість протонів та нейтронів у ядрі атома алюмінію?
А)протонів 14, нейтронів 13 В)протонів 13, нейтронів 14
Б)протонів 13, нейтронів 13 Г)протонів 14, нейтронів 14
- Вкажіть електронну формулу атома алюмінію
А)1s22s22p63s13p1 В)1s22s22p63s2
Б)1s22s22p63s23p1 Г)1s22s22p63s1
- Назвіть стійкий ступінь окиснення алюмінію А)-2 Б)+2 В)-3 Г)+3
4. Вкажіть кількість енергетичних рівнів у атомі А)2 Б)3 В)4 Г)5
5. Назвіть кількість електронів, що знаходиться на зовнішньому енергетичному рівні А)5 Б)4 В)3 Г)2
6. В якому періоді та в якій групі знаходиться алюміній
А)2 період, ІІІа група Б)3 період, ІІа група
В)3 період, ІІІв група Г)2 період, ІІІа група
7. Вкажіть формулу оксиду алюмінію зі ступенем окиснення +3
А)Al2O Б)AlO В)Al2O3 Г)Al(OН)3
8. Який заряд ядра атома алюмінію? А)+11 Б)+12 В)+13 Г) +14
9. Назвіть, який елемент має найбільш виражені металічні властивості?
А)бор Б)алюміній В)силіцій Г)карбон
10. В якій трійці хімічних елементів радіус атома алюмінію є найбільшим?
А)алюміній – силіцій – фосфор Б)натрій – магній – алюміній
В)бор – алюміній – галій Г)всі відповіді правильні
11. Вкажіть електронну формулу катіону Al+3
А)1s22s22p63s23p1 Б)1s22s22p63s03p0
В)1s22s22p63s23p0 Г)1s22s22p63s1
12. Яку кількість валентних електронів містить атом алюмінію?
А)3 Б)2 В)14 Г)13
13. У рядку Al2O3 – SiO2 – Р2O5 властивості оксидів змінюються
А)від амфотерних до кислотних Б)від основних до амфотерних
В) від основних до кислотних Г)від основних через амфотерні до кислотних
14. Амфотерність – це здатність речовин виявляти
А) основні властивості Б) кислотні властивості
В)основні та кислотні властивості Г)всі відповіді неправильні
15. Який із гідроксидів проявляє амфотерні властивості?
А)Mg(OH)2 Б)Al(OН)3 В)Ва(ОН)2 Г)Са(ОН)2
Станція «Фізична»
Гра «Фізичні властивості алюмінію» (https://learningapps.org/view26993693)

колір – сріблясто-білий
густина – 2,7 г/см3
температура плавлення – 6600С
кристалічна гратка – гранецентрована кубічна
пластичність – прокатується в листи і фольгу
температура кипіння – 2452 °C
електричний струм – добре проводить
провідник – електричного струму
р-елемент – алюміній
агрегатний стан – твердий
блиск – металевий .
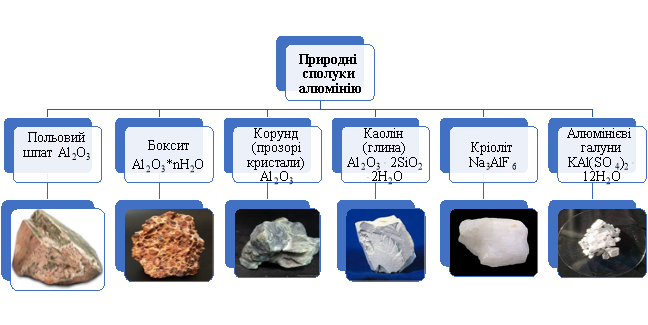
Вчитель. Алюміній є найпоширенішим металічним елементом на Землі. Його вміст у земній корі становить 8 % (за масою). В Україні великі поклади алюмінієвої руди у вигляді бокситів і глинозему зустрічаються в Приазов'ї, на Закарпатті та в межах Українського кристалічного щита — тектонічної смуги, яка простягається вздовж середньої течії Дніпра.
Заповнення схеми «Природні сполуки алюмінію»
Станція «Хімічна»
Вчитель. Алюміній — активний метал. Деяка пасивність алюмінію в хімічних реакціях за звичайних умов зумовлена утворенням на його поверхні тонкої, міцної оксидної плівки, тому за звичайних умов алюміній не реагує з киснем. Концентровані сульфатна й нітратна кислоти пасивують алюміній, їхні розчини середньої концентрації поступово його розчиняють.
Відеодемонстрація « Взаємодія алюмінію з йодом»
https://www.youtube.com/watch?v=BrquN4x9yz4
Бесіда
- Які ознаки хімічної реакції?
- Чому після додавання води починається реакція? Чим виступає вода?
- Екзотермічна чи ендотермічна реакція?
- Напишіть рівняння реакції
Демонстрація «Взаємодія алюмінію з водою»
Гострим предметом знищуємо захисну плівку на алюмінієвому дроті та поміщаємо його у пробірку з водою.
Бесіда
- Які ознаки хімічної реакції?
- Спрогнозуйте, який газ виділяється?
- Напишіть рівняння реакції
Прийом «Хімічний практикум»
![]() - Запишіть схеми окисно-відновних реакцій та перетворіть їх на рівняння хімічних реакцій. Складіть окисно-відновний баланс, зазначте окисник і відновник, процеси окиснення та відновлення
- Запишіть схеми окисно-відновних реакцій та перетворіть їх на рівняння хімічних реакцій. Складіть окисно-відновний баланс, зазначте окисник і відновник, процеси окиснення та відновлення
+ О2 ![]() Al2O3
Al2O3
+ Е ![]() AlnЕm
AlnЕm
+ НnR ![]() AlхRу + Н2
AlхRу + Н2
+ СuCl2 ![]() AlCl3 + Сu
AlCl3 + Сu
Al + 6НNО3(конц) ![]() Al(NО3)3 + 3NО2 + 3Н2О
Al(NО3)3 + 3NО2 + 3Н2О
t
+ 6Н2SО4(конц) ![]() Al2(SО4)3 + 3SО2 + 6Н2О
Al2(SО4)3 + 3SО2 + 6Н2О
Станція «Амфотерність»
Вчитель. Алюміній в ряду активності перебуває зліва від водню, а оксид і гідроксид алюмінію – амфотерні сполуки. Сукупність цих чинників уможливлює взаємодію між металом і лугом, між металом і кислотою. Наведене рівняння (1) описує реакцію алюмінію з твердим лугом при нагріванні за відсутності води. Якщо з металом взаємодіє луг у водному розчині (2), (3), то утворюються розчинні алюмінати.
2Al + 6NаОН ![]() 2Nа3АlО3 + 3Н2 (1)
2Nа3АlО3 + 3Н2 (1)
2Al + 6NаОН (надлишок) + 6Н2О ![]() 2Nа3 [Аl(ОН)6] + 3Н2 (2)
2Nа3 [Аl(ОН)6] + 3Н2 (2)
2Al + 2NаОН + 6Н2О ![]() 2Nа[Аl(ОН)4] + 3Н2 (3)
2Nа[Аl(ОН)4] + 3Н2 (3)
- У рівняннях (1), (2), (3) встановіть ступінь окиснення кожного хімічного елемента.
Станція «Алюмотермія»
Робота з термінами
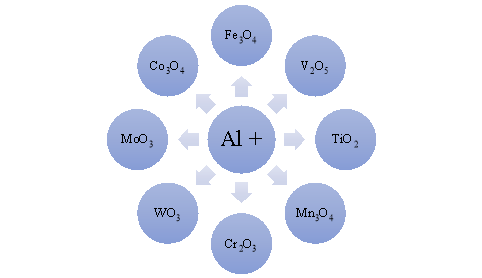
Алюмотермія – спосіб відновлення металів з їхніх оксидів за допомогою алюмінію.
Цей спосіб (алюмотермія) був відкритий російським хіміком професором Харківського університету М.М. Бекетовим в середині XIX ст. При взаємодії алюмінію з оксидами металів виділяється багато тепла, внаслідок чого температура суміші-реагенту сягає 3000 °С. Алюмінотермічним способом одержують у вільному стані такі метали, як хром, ванадій, манган і інші.
Вправа «Хімічна лабораторія»
- Добудьте метали – Fe, Cr, V, Mn, Ti, W, Mо, Со. Запишіть схеми окисно-відновних реакцій та перетворіть їх на рівняння хімічних реакцій. Складіть окисно-відновний баланс, зазначте окисник і відновник, процеси окиснення та відновлення .
Станція «Технічна»
Виступ учня-техніка. Алюміній отримують електролізом розчину
глинозему – Al2O3 в розплавленому кріоліті Na3[AlF6] при 950-960°C. Алюміній є цінним конструкційним матеріалом. Він відносно легкий, але досить міцний. Тому з алюмінію виготовляють легкі й довговічні будівельні конструкції. Багато алюмінію потребує авіаційна промисловість. Дюралюмінієм обшивають корпуси літаків. Пилоподібний алюміній та деякі його сполуки використовують як тверде ракетне пальне. Алюміній легко піддається штамповці, він стійкий до корозії, а його сполуки нетоксичні. Завдяки цьому з алюмінію виготовляють столові прибори, посуд, бляшанки, кухонні ємності. Через свою високу відбивну здатність та легкість напилення алюміній є ідеальним матеріалом для виготовлення дзеркал.
Сплави на основі алюмінію – це дюралюміній Al-Cu-Mg, авіалі Al-Mg-Cu-Si, силуміни Al-Si та ін. Дюралюміній – високоміцний, герметичний сплав, який витримує значні статичні та вібраційні напруження. Сплав широко використовується в авіабудуванні, при виробництві швидкісних потягів. Авіалі – це жароміцні сплави, які мають добру пластичність. високу корозійну стійкість та добре зварюються. Авіалі характеризуються тим, що зберігають високу міцність протягом тривалого часу. Їх використовують для виготовлення листів, труб, лопатей гвинтів в авіації, кованих деталей для двигунів, рам, для виготовлення лопатей повітряних гвинтів вертольотів, корпусів годинників, декоративних елементів оздоблення автомобілів і т.д. Силуміни Al-Si - це група легких ливарних сплавів, які мають підвищену корозійну стійкість у вологому і морському середовищах, легкі та дешеві. Недоліком сплавів є крихкість. Використовуються силуміни для виготовлення деталей складної конфігурації, головним чином у авто-, авіа- та суднобудуванні, хімічному машинобудуванні. Також використовуються у виробництві
кулькових кранів та змішувачів для води, що дає змогу здешевити ці вироби порівняно з латунними аналогами.
VІ. Узагальнення і систематизація знань
Станція «Діагностична»
Квіз «Алюміній» (https://view.genial.ly/634a707dd1d0d90012c86046/interactive-content-blackboard-quiz )
1. Які спорові рослини є концентраторами алюмінію?
А) Мохи Б) Плауни В) Папороті
2. Які властивості виявляють сполуки алюмінію?
А) Кислотні Б) Основні В) Амфотерні
3. Як називається порошкоподібна суміш алюмінію з оксидами деяких металів?
А) Парамагнітна суміш Б) Оксидна суміш В) Термітна суміш
4. Яким є середовище у водному розчині алюміній хлориду?
А) Кисле Б) Лужне В) Нейтральне
5. Які солі алюмінію входять до складу цементу?
А) Алюмінати натрію Б) Алюмінати кальцію В) Флуоралюмінати
- У реакціях з неметалами алюміній є:
А) Окисником Б) Відновником В) Окисником і відновником
7. Яка сіль утворюється при взаємодії алюмінію із сіркою?
А) Алюміній сульфат Б) Алюміній сульфіт В)Алюміній сульфід
8. Який газ витісняє алюміній, взаємодіючи із розчинами лугів?
А) Кисень Б) Озон В) Водень
9. Реакції, що лежать в основі алюмотермії використовують для отримання:
А) Металів Б) Оксидів металів В) Оксидів неметалів
10. За яких умов алюміній реагує з концентрованою нітратною кислотою?
А) При нагріванні Б) При охолодження В) За звичайних умов
Вправа «Віднови втрачене» (https://learningapps.org/view26994701)

Алюміній – _______елемент ____ групи ___ періоду періодичної системи хімічних елементів. _____ _____формула зовнішнього рівня його атома. При хімічних взаємодіях алюміній ______три електрони, проявляючи ступінь окиснення___. Отже, алюміній – це _______. Алюміній – легкий, _____метал, що має високу ____і ___. Він реагує з неметалами, ___, _____ і розчинами солей. Одержують алюміній _____ з Al2O3 у розплавленому кріоліті. Оксид і гідроксид алюмінію – _____ сполуки, які взаємодіють з ______та ______оксидами, кислотами та лугами.
Довідка: металічний, ІІІа, 3, електронна, енергетичного, 3s23p1 , віддає, +3, відновник, пластичний, теплопровідність, електролізом, електропровідність, кислотами, лугами, амфотерні, кислотними, основними.
VІІ. Підведення підсумків
Прийом «Аналіз епіграфа»
Учні зачитують епіграф, записаний на дошці, визначають, чому саме ці слова доречні на сьогоднішньому уроці
VІІІ. Рефлексія
Прийом «Закінчи речення»
Учням пропонується закінчити речення…
Я зрозумів, що можу ...
Мене здивувало ...
Мене надихнуло ...
ІХ. Домашнє завдання
Опрацювати параграф підручника
Використана література
- Гутник М. В. Зародження промислової металургії й машинобудування. Матеріали 12-ї Всеукраїнської наукової конференції «Актуальні питання історії науки і техніки» (Конотоп, 3–5 жовтня 2013 р.). – Київ : Центр пам’яткознавства НАН України і УТОПІК, 2013. С.92 –95.
2. Уроки-ігри та інші форми ігрової діяльності у курсі хімії: навч.-метод. посіб. уклад. К. М. Задорожний. Харків: Основа, 2008. 126 с.
3. Ярошенко О.Г., Новицька В.І. Завдання і вправи з хімії. Навчальний посібник. Київ: Станіца-Київ, 2008. 234 с.


про публікацію авторської розробки
Додати розробку
