Матеріал до уроку з теми "Роль хімії в житті суспільства і людини"
Розробка інтегрованого уроку(здвоєного) для учнів 9 чи 11 класів вчителя хімії КЗО «СЗШ №31» ДМР Яремчук Ольги Яківни
|
|
Роль хімії та суспільства у розумінні природничо-наукової карти світу, творчо самореалізації особистості. |
|
Предметні компетентності: |
Узагальнити знання учнів з науково-світоглядних питань на матеріалі хімії, находити внесок хімії у формування наукової картини світу; формувати вміння грамотна застосовувати знання з хімії у трудовій діяльності, спілкуватись з природою та в побуті. |
|
Соціальні компетентності: |
Сприяти розвитку гуманістичних рис особистості учнів, вміння самореалізації особистості в різних аспектах діяльності; розвивати вміння працювати з різними джерелами інформації. |
|
|
Виховувати почуття колективізму, підтримувати один одного, самореалізації концепції «Я-особистість». |
|
Тип уроку : |
Урок узагальнення і систематизації знань. |
|
|
Тематична дискусія, захист презентацій, фронтальна бесіди, робота з картами, виконання тесту. |
|
Обладнання: |
Мультимедійна засоби навчання, мультимедійні таблиці «Вміст хімічних елементів в земній корі», Періодична система хімічних елементів Д.І.Менделеєва, стіннівки «Словник науки», «Дерево пізнання». |
|
Девіз уроку: |
«Ми самі маємо стати тією зміною, яку ми хочемо бачити у світі». Махатма Ганді |
|
Хронометраж : |
|
|
Хід уроку |
|
|
Організаційний момент : |
За час навчання в школі ми декілька разів проводили інтерактивні уроки з учителем фізики, біології, історії, географії. Ви переконувались, що всі ці науки, як і інші, тісно пов’язані між собою. Знання з кожного предмета дають змогу уявити цілісність природи її нероздільність, взаємозалежність. Хтось із вас має хороший запас знань і може обґрунтувати свої погляди на світ, іншим зробити це не просто. Але маю надію, що кожен знає основу. Сьогодні ми з вами проведемо мандрівку-експрес в світ наукової хімії. |
|
Мотивація навчальної діяльності : |
Зараз я прочитаю вірш, яким ми починали навчання з хімії в 7 класі, своє знайомство з цікавою і таємничою наукою: Видите камень вот тот, придорожный? Камень как камень… Обычный… Возможно. Как бы о нём поточнее узнать? Надо науку на помощь призвать. Как пишется «камень», научит грамматика. Размеры и форму найдёт математика. Физика массу отыщет и вес. Минералогия взглянет на срез. «Это кремень», - она скажет ребятам, - И называют его силикатом. Археология скажет: « Находка! Справа на камне видна обработка!» «Жил в этой местности древний народ…» - Дальше история слово берёт. Камень в овраге лежит придорожном… Камень простой? Или, может быть сложный? О камне ты всё ли узнал, человек? Наука поможет! Не каменный век! Діти! Я згадую ваші відповіді тоді, і хочу почути тепер: що показує нам цей вірш «Перша розмова» Ю.Єфимовський (висловлюються різні думки, але вони більш глибок, змістові ніж у 7 класі). Дійсно цей вірш показує, що колись предмет, що нас оточує не є простим. Його можуть вивчати багато наук, бо є закони які спільні для всіх. |
|
Тема і компетентності уроку: |
Кожна мандрівка починається з підготовки, тож давайте доведемо, що ми готові до цього |
|
Фронтальна бесіда: |
Я задоволена вашими відповідями, ви проклали місток до нової мандрівки і ми вирушаємо. Перед вами на столі лежить аркуш паперу з Деревом пізнання. Намалюйте себе на цьому дереві, де ви зараз знаходитесь на вашу думку і за допомогою якого знаряддя ви туди потрапили(дробина, крила, рухи чи ще щось). в ході уроку ми ще раз повернемось до цього і ви зробите інший малюнок самого себе, можливо вони будуть схожі один на одного, а можливо ви провинитесь вище. Побачимо. Зробіть усе.
Рухаємось далі і зробимо екскурс в історію науки. |
|
Випереджувальні завдання: |
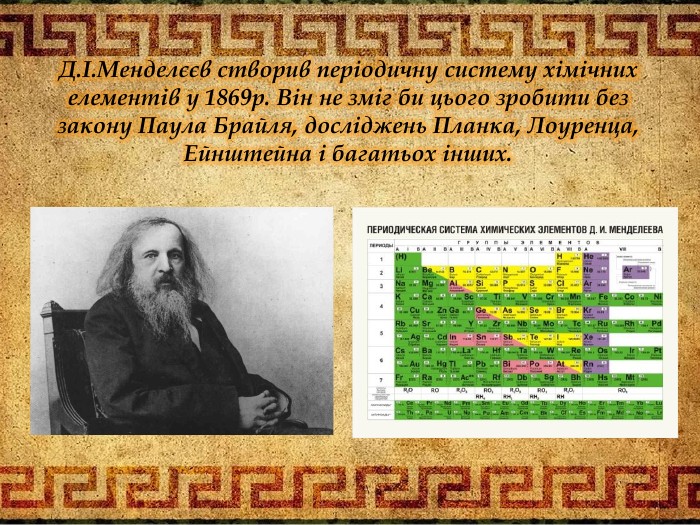
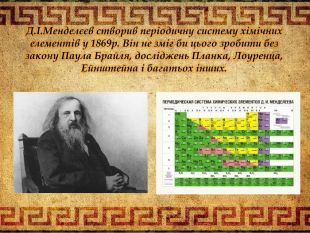
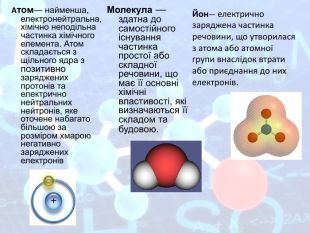
Два учні мали завдання підготуватися до цього і ми їх слухаємо. Презентація учнів «Стежинами науки хімії» висвітлює не тільки етапи становлення хімічної науки, але й історичні події, що відбулися в цей час. Шановні старшокласники, ви переконуєтесь в тому що наукові події перетинаються з історичними. Що ж є фундаментом хімії? На це питання відповіли вчені і атомна гіпотеза, що всі тіла складаються з атомів. «Можно плыть по реке, и парить в облаках И шагать по земле, увязая в песках, Но сгущается пар, застывает река, А твердейшая бронза порою мягка. Птица в небе парит и в песок упадёт, И травой прорастёт, – рассуждал Демокрит. – Видно, чем-то похожа на камень вода. И в далёком родстве светлячок и звезда. Что всё это роднит: облака и гранит, Человека и звёзды и птиц? Сложен мир. Сложен мир из мельчайших частиц» – Так считал древний грек Демокрит.» Діти цей вірш також доводить, що світ, природа, тіла все має взаємозв’язок і це доводять закони і теорії багатьох вчених: фізиків, географів, біологів, математиків, хіміків, філософів і інших. Два учні мали випереджувальне завдання і представляють нам його. Презентація «Лист нащадків». Шановні вчителі! Ми були б дуже щасливі, зустрітися з вами в реальному житі і засвідчити вам свою повагу і захоплення вашими працями. Адже саме вони дають нам змогу відкрити світ знань. Ми схиляємо голову перед Ісааком Ньютоном, який визначив що атоми мають проміжки і між ними діють сили притягання і відштовхування, а молекули- це механічне поєднання атомів. М.В. Ломоносов і Джон Дальтон створили атомно-молекулярне вчення в середині XVIII століття. Анрі Беккерель в 1896 році відкрив явище радіоактивності, а Марія Складовська Кюрі відкрила радіоактивні елементи. Джон Томсон встановив в 1897 році, що до складу атома входять електрони. Ернест Резерфорд і Нільсом Бор в 1911 році створили планетарну модель атома. Українські вчені Іваненко і Ганон в 1932 довели, що атомні ядра формуються протонами і нейтронами і визначають масу атома. Д.І. Менделєєв створив Періодичну систему хімічних елементів 1869 році. Та він не зміг би цього зробити без законів Пауля, Бройля, Ейнштейна та багатьох інших. Надіємось що і серед нас будуть послідовники великих людей чиї імена занесені в історію науки золотими літерами. З повагою до вас вдячні нащадки. Рухаємось далі. Наша мандрівника дійшла до питання законів, завдяки яким хімія стала не тільки теоретичною, а й практичною наукою. Першим ми розглянемо закон збереження маси речовини- основоположником якої є Антуан Лавуазьє, саме він ввів в хімію кількісний закон. Хто пам’ятає цей закон? Так аса речовини під час хімічної реакції залишається незмінною, тому що при цьому залишається незмінним атоми, а отже, і їх маса. Проведемо дослід за допомогою прикладу збереження маси. Діти, потрібно пам’ятати що застосовуючи цей закон, застосовується і закон збереження енергії. Давайте згадаємо теорію Сванта Арреніуса- теорію електролітичної дисоціації і доведемо практично:
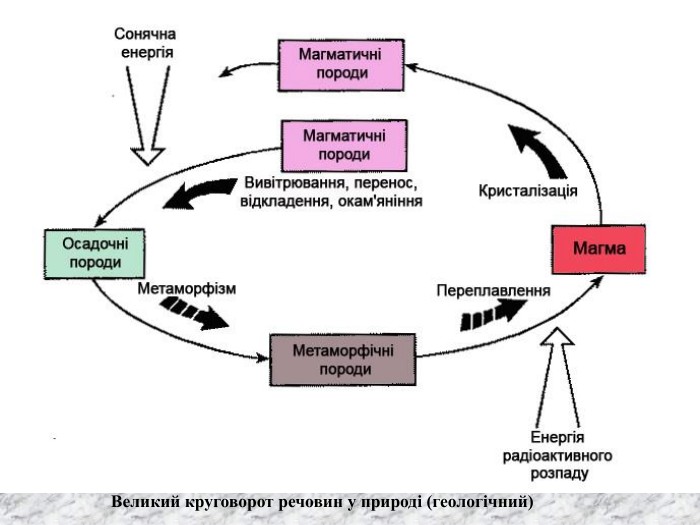
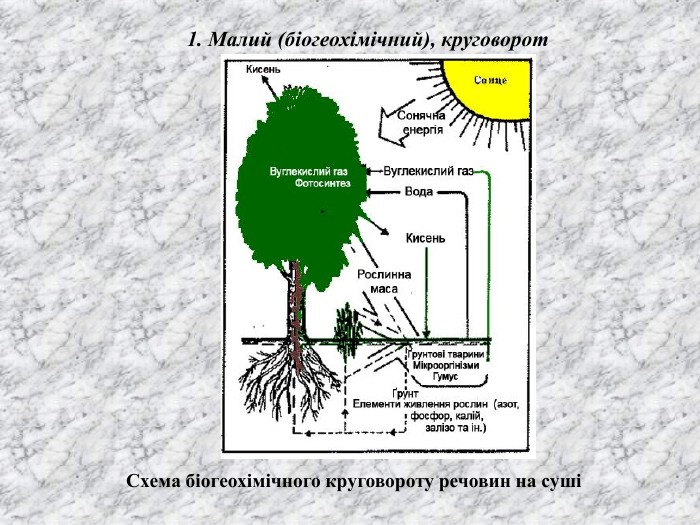
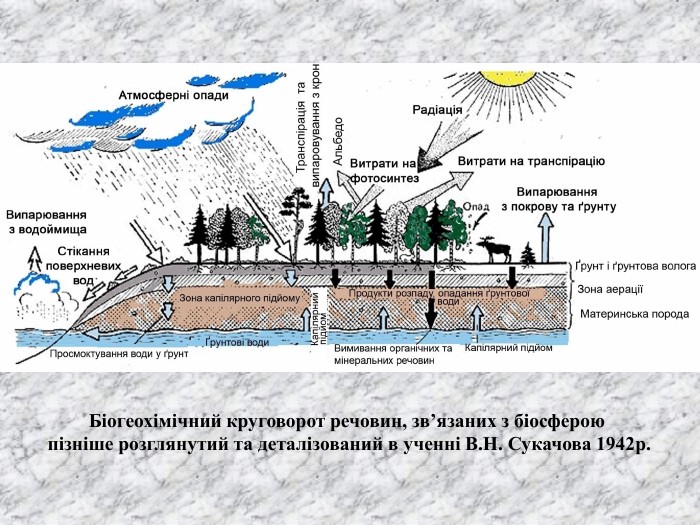
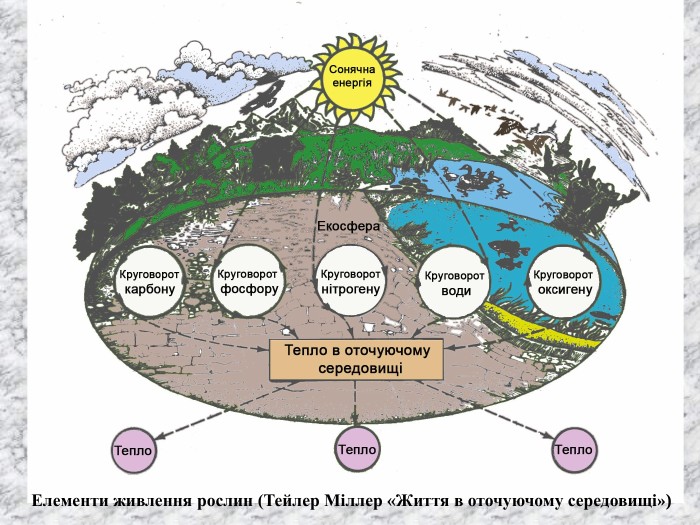
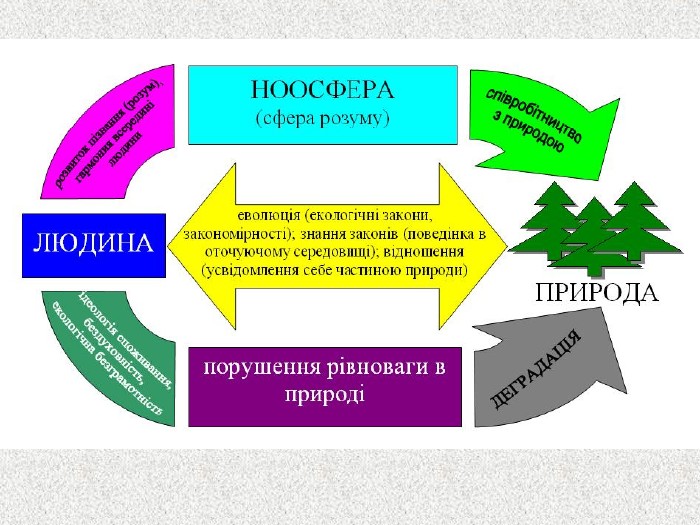
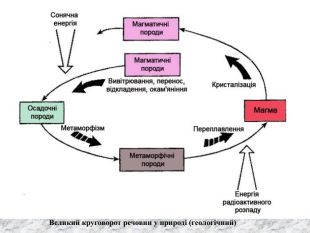
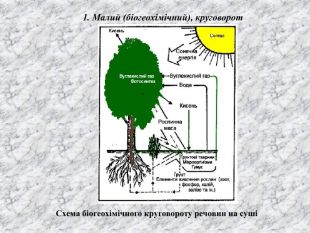
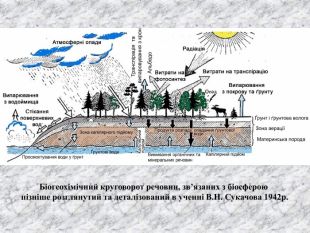
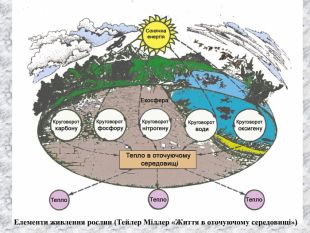
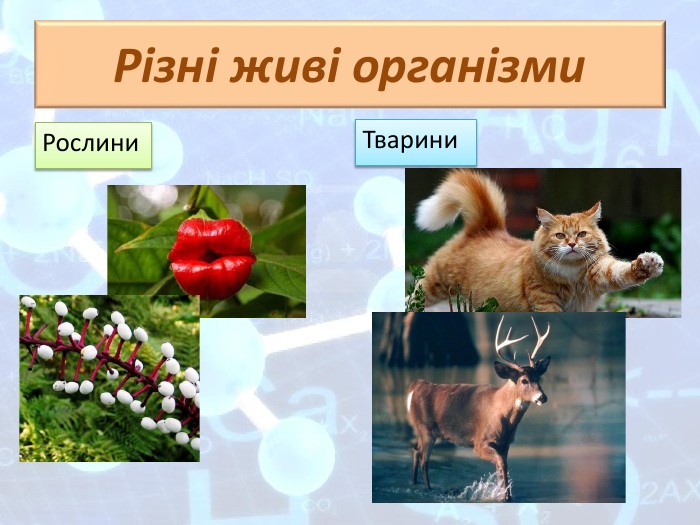
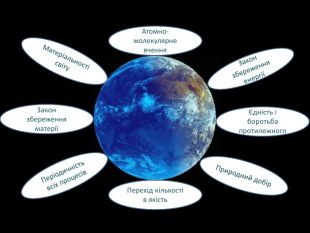
Перший учень показує презентацію «Закони хімії». На нашій планеті Земля, живуть різні живі істоти. Нас оточують ліси, дерева, озера, річки, повітря. Все це складає біосферу? Що таке біосфера?(геологічна оболонка Землі, насичена живими організмами, відкрита саморегульована система). Діти. У Степана Щипачова є такі рядки: «Другого ничего в природе нет Ни здесь, ни там, в космических глубинах: Всё – от песчинок малых до планет – Из элементов состоит единых» Розгляньте схему «Вміст хімічних елементів в живій і не живій природі» і зробіть висновок про єдність всього що є на Землі, про однаковий елементарний склад. Презентація «В.І. Вернадський і біосфера».
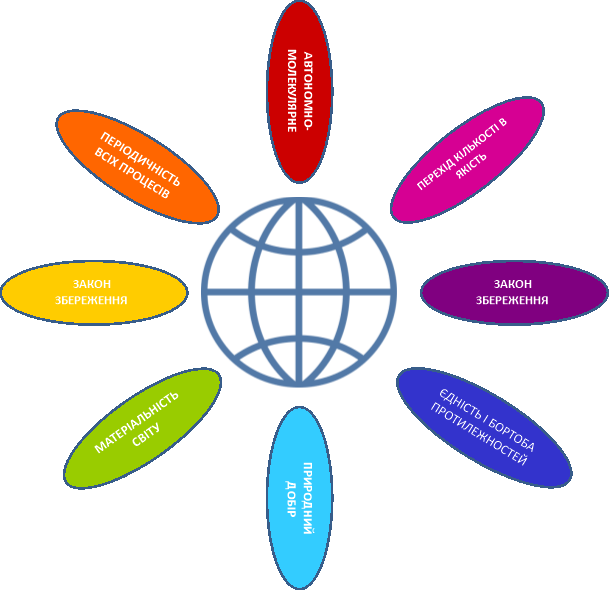
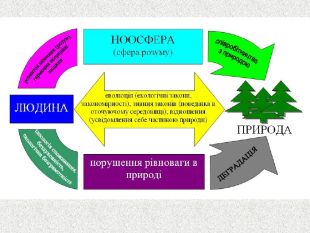
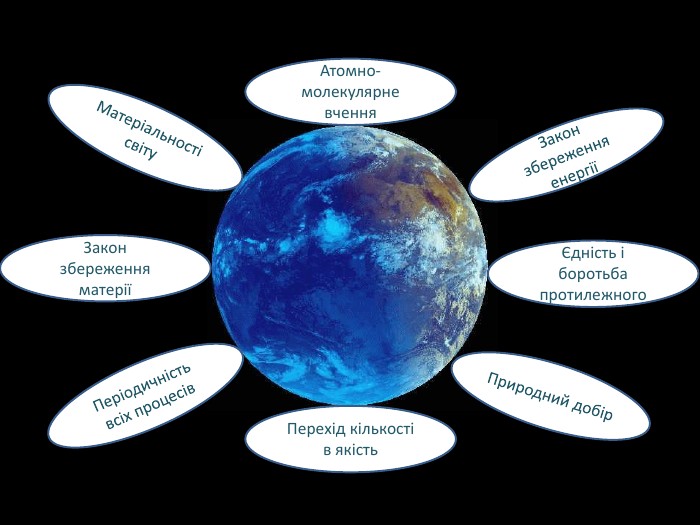
Наша планета Земля дуже унікальна. Ми разом з тваринами, рослинами і іншими живими істотами ділимо цей світ і повинні посилити рішучість в захисті самих себе. «Мы – частица Вселенной. Живём или нет – Для Вселенной, конечно же, то равнозначно. Но для нас, для землян, нет больше планет! Мир спасти от СЛУЧАЙНОСТИ – наша задача!» Ми знаємо, що природа єдина і ми лише її частина. Тому значення законів природи допомогли нам зберегти Землю. |
|
Закріплення матеріалу: |
Прошу всіх занотувати собі в зошити закони єдності природи |
|
|
|
|
Повертаємось до нашого дерева пізнання. Покажіть де ви зараз знаходитися, на тому самому місці, піднялись вище, чи впали до низу? |
|
|
Рефлексія: |
Шановні одинадцятикласники! Хочеться щоб ви запам’ятали цей урок і винесли з нього щось хороше для себе. Щоб ви почували себе особистістю завжди, де б ви не були і яку роботу не робили. Уявіть зараз себе частиною Всесвіту. Все що обертається навколо вас потрібне і доцільне. Краплина дощу і гарна сніжинка, капелька води і шматочок скла, пісчинка і кусочок металу, квітка і метелик, дерево і листочок. Все рухається і періодично змінюється, все складається з атомів- цих маленьких частинок природи. Я бажаю вам не тільки брати все від природи, а й повертати туди, брати активну участь у перетворення тільки корисних. |
|
Домашнє завдання: |
Розв’язати задачі екологічного змісту, які отримуєте на картках. Скласти самим, хоча б одну екологічну задачу. |
Автор уроку: ЯРЕМЧУК ОЛЬГА ЯКІВНА
Вчитель хімії КЗО « СЗШ № 31 « ДМР

про публікацію авторської розробки
Додати розробку