Матеріали до уроку з біології у 8 класі з теми: «Підшлункова залоза: фізіологічний опис та патології»
1
«Підшлункова залоза:
фізіологічний опис та патології»
ЗМІСТ
1. Загальна морфофункціональна характеристика підшлункової залози ссавців
2. Морфофункціональна характеристика і джерела ембріонального розвитку підшлункової залози
4. Цитофізіологія ендокринних острівців підшлункової залози. Ацинозно-інсулярні клітини
5. Патофізіологічні стани підшлункової залози
6.1 Метаболічні ускладнення цукрового діабету
6.2 Порушення травлення і всмоктування ліпідів
6.3 Порушення депонування жирів
6.4 Порушення розщеплення білків їжі і засвоєння утворюющихся амінокислот
ВСТУП
Підшлункова залоза людини і тварин - складна, котра поєднує екзокринні і ендокринні функції. Екзокринної частина секретує близько 30 ферментів, що входять в панкреатичний сік, який синтезується під дією панкреозимина (холецистокинина) клітинами слизової оболонки 12-палої кишки.
Сік являє безбарвну рідина лужної реакції (pH 7,2 - 8,0): містить білки - до 340 мг; неорганічні речовини - бікарбонати, кальцій, фосфор, хлориди; щільні речовини - до 1,5% і ферменти - трипсин, хімотрипсин, еластазу, карбооксіпептідазу, фосфоліпазу, дипептидаза, протаміназу, нуклеазу, амілазу, мальтазу, лактазу, ліпазу та інші речовини. Склад, обсяг, активність підшлункового соку залежить від характеру вживається харчування [1].
Ендокринна частина залози представлена розсіяними в стромі і між ацинусами залози панкреатическими острівцями. У людини їх 1 - 3% від обсягу органу, великої рогатої худоби - 2,8 - 4,1%, інших тварин - 2,5 - 3,5%. Сумарна маса острівців людини досягає 2,4 - 4,5 г, великої рогатої худоби - 11,4 - 13,2 г, коні - 7,5 - 9,0 г, свині - 3,3 - 4,5 г, собаки - 0,4 - 3,2 г [1, 2].
Структурною одиницею панкреатичних острівців є альфа, бета, дельта - клітини (А, B, D). Ці клітини синтезують глюкагон, інсулін, соматостатин, вазоактивний інтестинального пептид (ВІП), панкреатичний поліпептид, гастрин, липокаин, ваготонін, калікреїн, центропнеін.
ОСНОВНА ЧАТИНА
1. Загальна морфофункціональна характеристика підшлункової залози ссавців
Підшлункова залоза - це орган змішаної секреції, оскільки містить як екзокринну частина, секретується панкреатичний сік, так і ендокринний апарат.
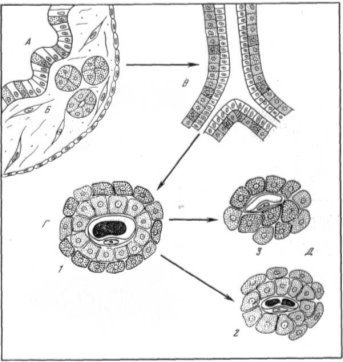
Рисунок 1 – Схема етапів еволюції форм структурної організації ендокринної частини підшлункової залози хребетних. А - інсулярний апарат безчерепних (заліза мозаїчно-клітинного типу); Б - інсулярний апарат круглоротих (скупчення і фолікули Лангерганса); В - ендокринна частина підшлункової залози хрящових і кистеперих риб ( «зовнішній епітелій»); Г - ендокринна частина підшлункової залози костистих риб, земноводних, плазунів, птахів і ссавців ( «змішані» панкреатичні острівці); Д - ендокринна частина підшлункової залози птахів ( «темні» і «світлі» панкреатичні острівці); 1 - А - клітина; 2 - В - клітина; 3 - Д-клітинами [5].
У всіх ссавців ендокринна частина підшлункової залози організована у вигляді панкреатичних острівців (острівці Лангерганса). Сумарно клітинний склад цього відділу залози у різних видів ссавців представлений: А - клітинами (або за іншою термінологією ά - клітинами), В (або β) - клітинами, Д (або G) - клітинами, РР - клітинами і δ - клітини). Але тільки А -, В - і Д - клітини виявлені у всіх ссавців. При цьому А - клітини у більшості видів ссавців становлять 24 - 27% популяції клітин панкреатичних острівців, а у людини 15%. Вони продукують глюкагон, котрий депонується в їх секреторних гранулах, які проявляють оксифільні властивості. Глюкагон стимулює розщеплення глікогену і жирів, що веде до швидкої мобілізації енергії [4].
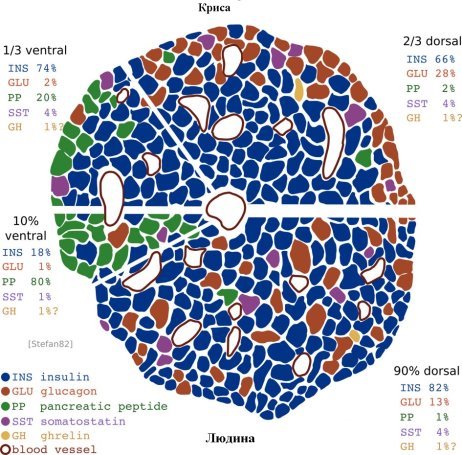
Рисунок 2 – Діаграма показує структурні відмінності між щури острівців (вгорі) і люди острівців (внизу), а також вентральної частини (зліва) і спинної частини (праворуч) підшлункової залози. Різні типи клітин мають кольорове маркування. Гризунів острівців, на відміну від людини з них показують характерну інсуліну ядро [3].
В (або β) - клітини складають близько 70% і розташовуються переважно в центрі острівців. Їх гранули проявляють базофільні властивості. Вони продукують інсулін, який, впливаючи на рецептори клітин - мішеней (це в основному печінку, скелетні м'язи, жирові клітини), є головним регулятором гомеостазу глюкози. Він стимулює мембранний транспорт глюкози і утворення глікогену, а також бере участь у регулюванні ліпідного та білкового обміну. При зменшенні синтезу інсуліну або порушення в клітинах - мішенях рецепторів інсуліну розвивається цукровий діабет.
Д (або G) - клітини секретують гастрин, що стимулює секрецію соляної кислоти в шлунку. Деякі пухлини підшлункової залози призводять до різкого збільшення рівня гастрину.
РР-клітини (F - клітини згідно з іншою термінологією) секретують панкреатичний поліпептид - один з регуляторів харчового режиму за рахунок пригнічення секреції панкреатичного соку.
δ - клітини острівців Лангерганса секретують гормон соматостатин, який в підшлунковій залозі пригнічує гормональну активність утворення інсуліну і глюкагону.
Слід зауважити, що соматостатин синтезується і багатьма нейронами центральної нервової системи, а також клітинами ряду внутрішніх органів. Він є потужним регулятором функцій ендокринної та нервової систем. Так, наприклад, пригнічує синтез і секрецію гормону росту, адренокортикотропного гормону і тіротропіна в гіпофізі [1, 4, 8, 11].
2. Морфофункціональна характеристика і джерела ембріонального розвитку підшлункової залози
Підшлункова залоза (pancreas) має дольчату будову. Зовні покрита капсулою, від якої всередину органа відходять перегородки. Внутридолькова сполучна тканина виражена слабо (1-2% обсягу). Капсула і строма залози розвиваються з мезенхіми, паренхіма - з ентодерми і підрозділяється на екзокринну (97% обсягу часточок) і ендокринну (1-2%) частини (рис. 2) [1, 12,].
Екзокринної частина організована подібно складної альвеолярно-трубчастою залозі, складається з ацинусів (аденомери) розміром 100-150 мкм, вставних, внутришньодолькових, міждолькових і загального вивідного проток. Виробляє панкреатичний сік, багатий травними ферментами (1,2-2 л / добу, рН 7,8-8,4) [12 - 14].
Внутрідолькові протоки (ductus interacinosi, ductus intralobulares) вистелені одношаровим кубічним епітелієм. Междолькові протоки (ductus interlobulares) і загальний проток - одношаровим призматичним епітелієм. Епітеліоцити вивідних проток відрізняються слабким розвитком органел. У призматичному епітелії проток виявляються поодинокі гормонопродукуючі ендокріноціти і слизові бокаловидні екзокріноціти.
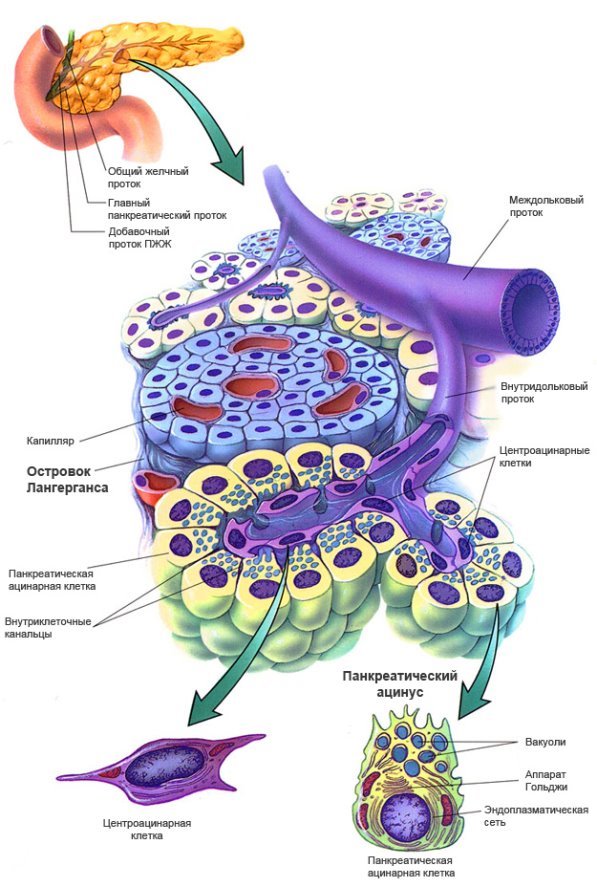
Рисунок 3 – Загальна структура підшлункової залози [15].
Вставні протоки (ductus intercalates) - камбіальний відділ екзокринної частини залози. Вони вистелені одношаровим плоским епітелієм.
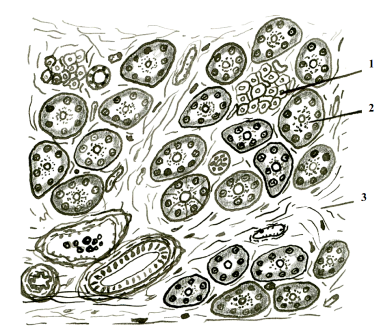
Рисунок 4 - Підшлункова залоза (схема): 1 - панкреатичний острівець, 2 - ацинус, 3 - міждолькова сполучна тканина [12].
У власній пластинці слизової оболонки загального вивідного протока є слизові залози, в гирлі - лейосфінктер (гладка м'язова тканина мезенхимной природи) [13, 16].
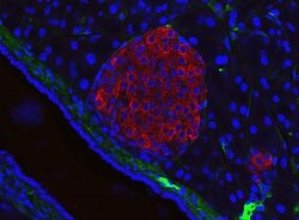
Рисунок 5 - Острівці Лангергансу у типповій близкості до кровеносного сосуду; червоний колір – інсулін, синій – ядра [13].
Ендокринна частина представлена панкреатичними острівцями Лангергансу (insulae pancreaticae) розміром 100-200 мкм, об'єднуючими кілька сотень ендокринних клітин інсулоцітов (insulocyti), кровоносні капіляри (фенестрірованого типу), нервові волокна і елементи сполучної тканини (з переважанням ретикулярних волокон) [15].
3. Панкреатичний ацинус
Ацинуси мають вузький просвіт і містять клітини двох типів - великі конічної форми аціноціти (acynocyti), що виступають верхівками в просвіт, і дрібні сплощень центроацінозні клітини (cellulae centroacinosi), що вистилають просвіт кінцевих відділів залози і не пов'язані з базальної мембраною епітелію (рис. 4) [12, 14].
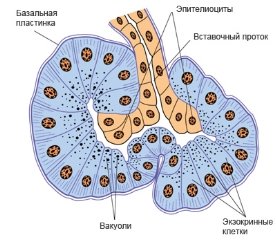
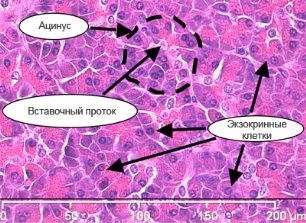
Рисунок 6 - Ацинус і вставний проток підшлункової залози (схема та фотографія забарвлення гематоксилін-еозином) [11, 15].
У ациноцитів розрізняють базальну гомогенну зону, яка містить округле ядро з ядерцем, гранулярну ендоплазматичну мережу і фарбується базофильно, а також апікальню зимогену зону, розташовану над комплексом Гольджі в над'ядерній області цитоплазми, що депонує оксіфільні секреторні гранули з профермента. Вони здатні (в активній формі в дванадцятипалій кишці) перетравлювати всі компоненти їжі (трипсин і хемотріпсін - білки, ліпаза і фосфоліпаза - жири, амілаза - полісахариди, еластаза - еластин, РНКаза і ДНКаза - нуклеїнові кислоти). Порушення вироблення ферментів призводить до порушення травлення і всмоктування речовин. Активація ферментів всередині залози викликає її перетравлення [12,16].
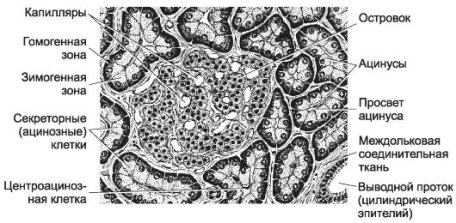
Рисунок 7 – Будова екзокрінної частини підшлункової залози: ацинуси, що складаються з полярно діференційованіх секреторних клітін [12].
У секреторних циклі ацинарних клітин умовно виділяють 4 фази: поглинання вихідних речовин, синтез секрету, накопичення і виділення (спокою, екструзії, агранулярна і регранулярна, фаза спокою може бути відсутнія) загальною тривалістю 1,5-2 ч. У звичайному стані з 8-10 ациноцитів 1-2 клітини функціонують асинхронно з іншими, що дає можливість підшлунковій залозі виробляти панкреатичний сік безперервно.
Надходження з періацінарних гемокапілярів в ацинарні клітини речовин, необхідних для синтезу секрету, здійснюється шляхом дифузії, осмосу, активного транспорту та ендоцитозу.
Морфологічними ознаками активізації транспорту речовин і синтезу секрету є:
1) збільшення кількості мікроворсинок, фенестр, кавеол і піноцитозних бульбашок в ендотеліоцитах періацінарних капілярів;
2) розпушення внутрішнього електронно-щільного шару базальних мембран ендотелію і епітелію ацинуса;
3) розширення базальних складок цитоплазми ациноцитов, від- почковиваніе від базальної плазмолеми піноцитозних бульбашок;
4) розширення цистерн гранулярних ендоплазматичної мережі, заповнення їх просвіту волокнистим продуктом;
5) набухання і зближення з базальної плазмолеммой і цистернами ретикулума мітохондрій;
6) збільшення розміру ядер, ядерець, кількості фібрилярних центрів і гранулярного компоненту ядерець, їх зміщення до каріолемми, збільшення кількості ядерних пор і складок ядерної оболонки в ацинарних клітинах.
Синтезовані в гранулярних ендоплазматичної мережі білки за допомогою транспортних бульбашок переміщаються в комплекс Гольджі, який розташовується на апікальному полюсі. Цистерни диктіосом збільшуються в розмірах. Від їх транс-поверхні відбруньковуються конденсаційні вакуолі, що містять матеріал помірної електронної щільності. Вакуолі дозрівають в зимогенові гранули з електронно-щільним вмістом. Комплекс Гольджі при накопиченні секрету відтісняється до ядра. Розміри ядра і ядерець зменшуються. Цистерни гранулярних ендоплазматичної мережі розпадаються на фрагменти, втрачають частину рибосом.
Виділення секрету відбувається в основному за мерокріновим типом через «неушкоджену» плазмолему, коли в місці її контакту з мембраною, навколишню зімогенову гранулу, спочатку формується гібридна мембрана, а потім вузька пора діаметром 10-20 нм, через яку секрет покидає клітину. Екзоцитоз вмісту зімогенових гранул через широку пору діаметром 50-60 нм супроводжується включенням матеріалу мембран секреторних гранул в плазмолему, збільшенням розмірів клітин, їх дегрануляцією. Цистерни комплексу Гольджі перетворюються на вакуолі, що зміщуються до апикального полюсу.
У фазу відновлення (2-3 год) «надлишок» мембранного матеріалу плазмолеми використовується на утворення везикул, які повертають його в комплекс Гольджі. Розміри ацинарних клітин зменшуються, вони стають темнішими за рахунок збільшення кількості вільних рибосом в цитоплазмі. Відбувається відновлення компонентів опорно-рухової системи клітин, що відчуває напругу в момент виділення секрету.
Рідка частина панкреатичного соку, що містить воду і НСО3– іони, що забезпечують створення лужного середовища, необхідної для активізації проферментів зімогенових гранул, секретується центроацинозними клітинами і епітеліоцитами вставного протоку по апокриновому типу. Дані клітини мають сплощену форму, паличкоподібне ядро і слабо розвинені органели [1, 11, 12].
4. Цитофізіологія ендокринних острівців підшлункової залози. Ацинозно-інсулярні клітини
Інсулоціти (insulocyti) - дрібні світлі ендокринні клітини з округлим ядром, ядерцем, гранулярних ендоплазматичної мережею, комплексом Гольджі, мітохондріями і гранулярними секреторними везикулами, що містять гормони пептидної природи. Розрізняють 5 основних типів інсулоцітов: А-, В-, D-, Dі і РР-клітини (рис. 6).
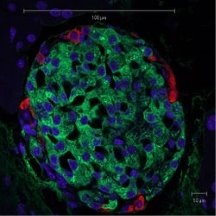
Рисунок 8 - Ультраструктура панкреатичного острівця: зелений колір – продукція інсуліну, червоний – глюкагону, синій – ядра [15, 16].
Іноді виявляються ЕС-клітини, що виробляють біогенний амін серотонін, і G-клітини, що секретують гастрин.
А-клітини (ацидофіли) складають 20-25% від загальної кількості інсулоцитів, розташовуються на периферії острівців, мають овальну форму, секреторні гранули забарвлюються кислими барвниками, з вузьким світлим ореолом та електронно-щільної серцевиною, що містить гормон глюкогон, стимулюючий глікогеноліз, ліполіз і підвищення рівня глюкози в крові.
В-клітини (базофіли) складають 60-70%, розташовуються в центрі острівців, мають овальну форму, секреторні гранули забарвлюються базофильно, з широким світлим ореолом та електронно-щільної серцевиною, містять цинк і гормон інсулін, стимулюючий поглинання глюкози клітинами різних тканин (при недостатності вироблення інсуліну у хворих діабетом відзначається підвищення рівня глюкози в крові).
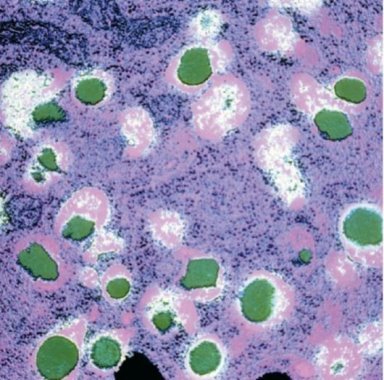
Рисунок 9 - Гранули інсуліну в бета-клітинах (ТЕМ) [15].
D-клітини (дендритичні) складають 5-10%, розташовуються на периферії острівців, мають променисту полігональну форму, великі помірної електронної щільності секреторні гранули, що містять гормон соматостатин, який пригнічує діяльність ациноцитів, А- і В-клітин острівців.
Dі-клітини відрізняються від ендокріноцитів типу D більш дрібними секреторними гранулами. Вони виробляють ВІП, який стимулює зовнішньосекреторну діяльність підшлункової залози [17, 18].
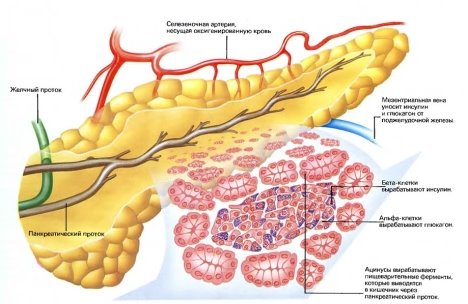
Рисунок 10– Структура ендокринних острівців підшлункової залози [13].
РР-клітини (що виробляють панкреатичний поліпептид) складають 25%, розташовуються на периферії острівців, містять дрібні поліморфні секреторні гранули з гомогенним матриксом різної електронної щільності. Пригнічують активність ациноцитів [19].
Крім того, навколо острівцем розташовуються ацінозно-інсулярні клітини, які містять як зімогенні секреторні гранули, так і везикули з гормонами. С.Г.Часовніков (1871-1920), один з основоположників вітчизняної ендокринології, що завідував кафедрою гістології Томського університету (1912-1920), в 1900 р вперше запропонував розглядати подібні секреторні клітини як перехідні (проміжні) між екзокринними і ендокринними [1, 12].
5. Патофізіологічні стани підшлункової залози
Найбільш часто в підшлунковій залозі виникають запальні і пухлинні процеси.
Панкреатит, запалення підшлункової залози, має гострий або хронічний перебіг.
1. Гострий панкреатит розвивається при порушенні відтоку панкреатичного соку (дискінезія проток), проникненні жовчі в вивідний проток залози (біліопанкреатичний рефлюкс), отруєнні алкоголем, аліментарних порушеннях (переїдання) і ін. Зміни залози зводяться до набряку, появи біло-жовтих ділянок некрозу (жирові некрози ), крововиливів, фокусів нагноєння, помилкових кіст, секвестрів. При домінуванні геморагічних змін, які стають дифузними, кажуть про геморагічний панкреатит, гнійного запалення - про гострий гнійний панкреатит, некротичних змін - про панкреонекроз.
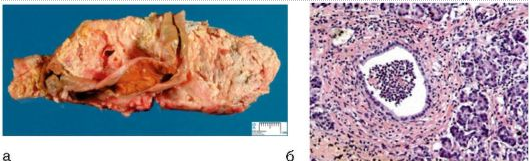
Рисунок 11 – Патоморфологія панкреонекрозу і панкреатиту: а - макропрепарат підшлункової залози: панкреонекроз; б - микропрепарат: гострий серозно-гнійний панкреатит (забарвлення гематоксилін-еозином; х100)
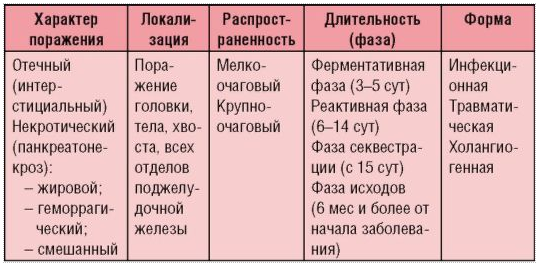
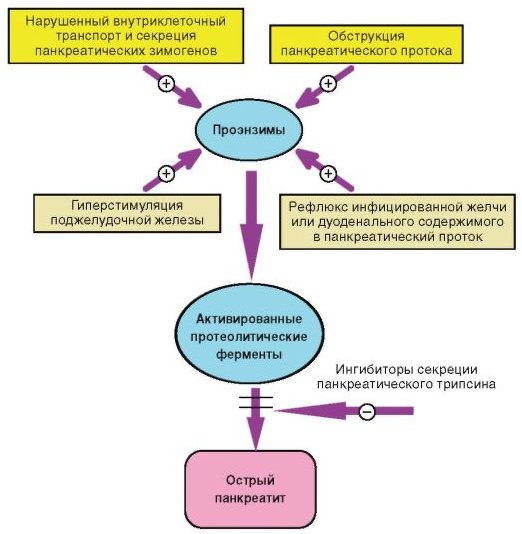
Рисунок 12 – Патогенез гострого панкреатиту
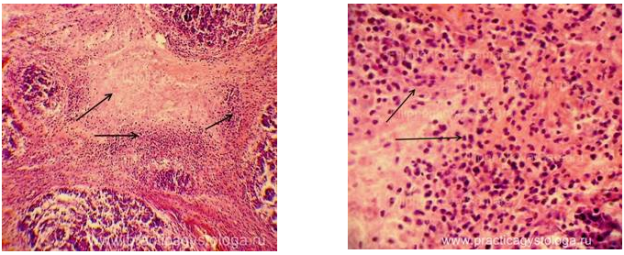
Рисунок 13 – Картина осередкового гострого гнійно-некротичного панкреатиту. На тлі сітчастого склерозу, вираженого набряку строми вогнища некрозу тканини залози з вираженою лейкоцитарної інфільтрацією (стрілки). Забарвлення: гематоксилін і еозин. Збільшення х100 і х250.
2. Хронічний панкреатит може бути наслідком рецидивів гострого панкреатиту.
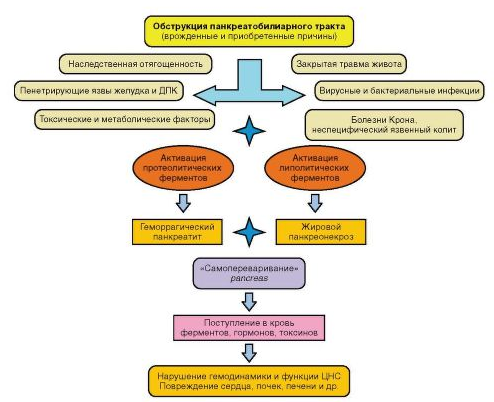
Рисунок 13 – Патогенез хронічного панкреатиту
Причиною його є також інфекції та інтоксикації, порушення обміну речовин, неповноцінне харчування, хвороби печінки, жовчного міхура, шлунка, дванадцятипалої кишки. При хронічному панкреатиті переважали не деструктивно-запальні, а склеротичні і атрофічні процеси в поєднанні з регенерацією ацінозних клітин і утворенням регенераторних аденом. Склеротичні зміни ведуть до порушення прохідності проток, утворення кіст. Рубцова деформація залози поєднується з звапнінням її тканини. залоза зменшується, набуває хрящову щільність. При хронічному панкреатиті можливі прояви цукрового діабету.
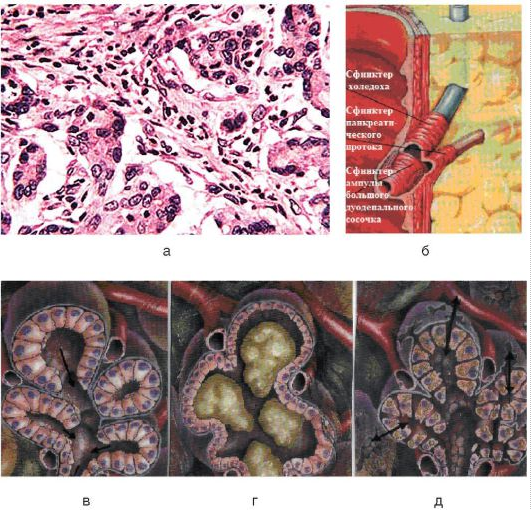
Рисунок 14 – Патоморфологія захворювань підшлункової залози: а - микропрепарат при хронічному панкреатиті (забарвлення гематоксилін-еозином; х250); б - анатомічні елементи сфінктера Одді; в - нормальні ацинуси підшлункової залози; г - муковісцидоз; д - хронічний панкреатит (стрілками вказано розширення міжклітинних просторів)
Смерть хворих на гострий панкреатит настає від шоку, перитоніту.
Рак підшлункової залози. Він може розвинутися в будь-якому її відділі (головка, тіло, хвіст), але частіше виявляється в голівці, де має вид щільного сіро-білого вузла. Вузол здавлює, а потім і проростає протоки підшлункової залози і загальний жовчний протік, що викликає розлади функції як підшлункової залози (панкреатит), так і печінки (холангіт, жовтяниця). Пухлини тіла і хвоста підшлункової залози нерідко досягають значних розмірів, так як тривалий час не викликають серйозних розладів діяльності залози і печінки.
Рак підшлункової залози розвивається з епітелію проток (аденокарцинома) або з ацинусів паренхіми (ацинарну або альвеолярний рак). Перші метастази виявляються в лімфатичних вузлах, розташованих безпосередньо біля головки підшлункової залози; гематогенні метастази виникають в печінці та інших органах.
6. Порушення обміну речовин
При порушенні вуглеводного обміну можуть розвиватися стану гіперглікемії (концентрація глюкози в крові більше 5,5 ммоль / л) і гіпоглікемії (менше 3,3 ммоль / л). Рівень глюкози в крові залежить від виду проби (цільна кров, венозна або капілярна, плазма) і від режиму взяття проби (натще - рівень глюкози вранці після не менш ніж 8-годинного голодування; через 2 години після глюкозотолерантний тесту) (табл. 12- 3). У клініці виділяють ще один показник рівня глюкози в крові - постпрандіальна гликемия - це рівень глюкози через 2 години після звичайного прийому їжі (не більше 7,5 ммоль / л).
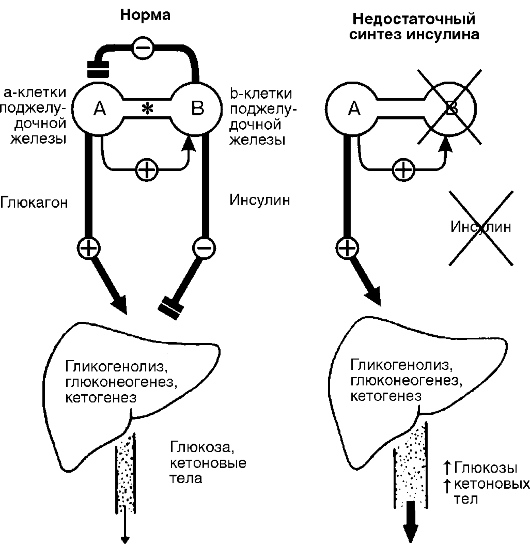
Рисунок 15 - Ефекти інсуліну і глюкагону в нормі і при інсулінової недостатності. У нормі печінка утворює приблизно 10 г / ч глюкози, з них 65-75% в результаті дії глюкагону на глікогеноліз, глюконеогенез. Інсулін може пригнічувати секрецію глюкагону α-клітинами незалежно від рівня глюкози в крові. У печінці інсулін пригнічує утворення глюкози і кетонових тіл. При зменшенні відносини інсулін / глюка- гон збільшується утворення глюкози і кетонових тіл у печінці.
Гіперглікемія у людини зустрічається частіше, ніж гіпоглікемія. Розрізняють такі типи гіперглікемій.
Фізіологічні гіперглікемії. Це бистрообратімие стану. Нормалізація рівня глюкози в крові відбувається без будь-яких зовнішніх коригуючих впливів. До них відносяться:
1.Аліментарна гіперглікемія. Обумовлена прийомом їжі, що містить вуглеводи. Концентрація глюкози в крові наростає внаслідок її швидкого всмоктування з кишечника. Активація секреції гормону β-клітинами острівців Лангерганса підшлункової залози починається рефлекторно, відразу після потрапляння їжі в порожнину рота і досягає максимуму при просуванні їжі в дванадцятипалу кишку і тонкий кишечник. Піки концентрацій інсуліну й глюкози в крові збігаються за часом. Таким чином, інсулін не тільки забезпечує доступність вуглеводів їжі до клітин організму, але й обмежує підвищення концентрації глюкози в крові, не допускаючи втрату її з сечею.
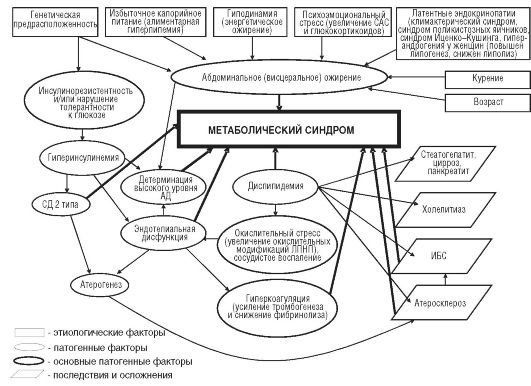
Рисунок 16 - Етіологічні, патогенетичні фактори та наслідки метаболічного синдрому
2. Нейрогенная гіперглікемія. Розвивається у відповідь на емоційний стрес і обумовлена викидом в кров великої кількості катехоламінів, що утворюються в мозковій речовині надниркових залоз і реалізують свої гіперглікемічні ефекти (див. Табл. 12-2). Вивільнювана глюкоза швидко виходить в кров, зумовлюючи гипергликемию. Фізіологічний сенс цього феномена полягає в забезпеченні термінової мобілізації резерву вуглеводів для використання їх як джерел енергії (окислення) в майбутній підвищеної рухової активності в умовах стресу.
Патологічні гіперглікемії. Причинами їх розвитку є:
1) нейроендокринні розлади, коли порушені співвідношення рівня гормонів гіпо- та гіперглікемічного дії. Наприклад, при захворюваннях гіпофіза, пухлинах кори надниркових залоз, при феохромоцитомі, гіперфункції щитовидної залози; при недостатній продукції інсуліну, глюкагономах;
2) органічні ураження центральної нервової системи, розлади мозкового кровообігу різної етіології;
3) порушення функцій печінки при цирозі;
4) судомні стани, коли відбувається розщеплення глікогену м'язів і освіту лактату, з якого в печінці синтезується глюкоза;
5) дія наркотичних речовин (морфін, ефір), що збуджують симпатичну нервову систему і тим самим сприяють розвитку гіперглікемії.
Найбільш часто зустрічається гіперглікемія при недостатності інсуліну і (або) його дії, яка лежить в основі цукрового діабету.
6.1 Метаболічні ускладнення цукрового діабету
Основні патогенетичні фактори метаболічного пошкодження включають наступні процеси:
1. Неферментативні гликозилирование білків - з'єднання глюкози з вільними аміногрупами білків - колагену, Кристалін, гемоглобіну та ін.
2. Ферментативне гликозилирование полягає в підвищенні швидкості перетворення глюкози в сорбітол і маннитол, що призводить до їх накопичення в клітинах і міжклітинній речовині сітківки, кришталика, клубочках нирок, ендотеліоцитах, шванновских клітинах, нейронах.
3. Різкі добові коливання тиску крові (через різке підвищення концентрації глюкози після прийому їжі).
4. Формування внутрішньоклітинної гіперосмолярності (за рахунок утворення сорбітолу).
5. Пошкодження вільними радикалами («окислювальний стрес»).
6.2 Порушення травлення і всмоктування ліпідів
Для нормального травлення і всмоктування ліпідів в кишечнику визначальне значення має взаємодія таких факторів, як:
1) вироблення підшлунковою залозою ліполітичного ферменту ліпази;
2) надходження з жовчю жовчних кислот, емульгуючих жири та продукти їхнього розпаду, що активують панкреатичну липазу та беруть участь у всмоктуванні жирних кислот (всмоктується комплекс жирних і жовчних кислот);
3) захоплення продуктів перетравлення ліпідів клітинами слизової оболонки тонкого кишечника;
4) перетворення в стінці кишечника всосавшихся продуктів гідролізу ліпідів у частинки (хиломікрони) для подальшого транспорту їх в лімфатичні судини і далі в кровотік.
При порушенні будь-якого з цих процесів розвивається стеаторея - надмірний вміст жиру у випорожненнях.
Причинами порушення травлення і всмоктування ліпідів є:
1. Дефіцит або низька активність панкреатичної ліпази (ураження підшлункової залози), що призводить до порушення розщеплення жирів.
2. Недостатнє надходження жовчних кислот в кишечник (при гепатитах, цирозах, холециститах, обтураційній жовтяниці та ін.) Викликає порушення емульгування і розщеплення жиру, а також перенесення продуктів його гідролізу до всмоктуючої поверхні епітелію кишечника.
3. Дефіцит гормонів шлунково-кишкового тракту (холецистокінін, гастрин та ін.), Що регулюють скорочення стінок жовчного міхура, процеси емульгування і розщеплення жирів, їх транспорт через кишкову стінку.
4. Поразка епітелію тонкого кишечника різними отрутами (флоридзин, монойодуксусная кислота) та інфекційними агентами, інактивує ферментні системи ресинтезу триацилгліцеролів епітелію тонкого кишечника, а також процеси фосфорилювання і дефосфорілірованія в стінці кишечника.
5. Авітаміноз А, В, С (оскільки ці вітаміни є коферментами відповідних біохімічних реакцій).
6. Надмірне споживання з їжею Са і Mg, що призводить до утворення нерозчинних у воді солей жирних кислот (мила).
7. Дефіцит холіну в їжі або недостатнє його утворення з метіоніну при малобілкової харчуванні гальмує реабсорбцію ліпідів.
8. Зміна діяльності нервової і ендокринної систем: перерізання блукаючого нерву послаблює всмоктування жирів з кишечника, аналогічно діє наркоз; адренокортикотропний гормон (АКТГ) і тироксин посилюють всмоктування жиру. При нестачі гормонів кори надниркових або надлишку адреналіну всмоктування жиру сповільнюється.
9. Посилена перистальтика кишечника і діарея перешкоджають реабсорбції більшої частини жиру.
10. Порушення метаболізму ліпідів в ентероцитах з утворенням аномальних білково-ліпідних комплексів погіршує всмоктування жиру і викликає утворення жирових скупчень у стінці тонкого кишечника і в дрібних лімфатичних протоках, що блокує відтік лімфи.
Дефіцит ліпідів в організмі може бути пов'язаний не тільки з порушенням їх всмоктування в кишечнику, але і з посиленням їх виведення. Організм може втрачати ліпіди з сечею (ліпідурія), що спостерігається при липоидном нефрозі. Можливі втрата ліпідів сальними залозами (екзема, вугрі) і вихід ліпідів з депо при травматизації великих ділянок жирової тканини і кісткового мозку.
Наслідками нестачі ліпідів є:
1) розвиток гіповітамінозу (жиророзчинних вітамінів А, D, Е, К);
2) виникнення дефіциту незамінних поліненасичених жирних кислот з наступним порушенням синтезу біологічно активних речовин (лейкотрієни, простагландини та ін.). Це, як правило, супроводжується випаданням волосся, запальним ураженням шкіри, виникненням некротичних вогнищ і екзематозних явищ, ураженням нирок, втратою здатності до розмноження;
3) розвиток виснаження.
6.3 Порушення депонування жирів
Порушення нейроендокринної регуляції жирового обміну. Маса тіла людини знаходиться під складним контролем нервногуморальних впливів, що визначають харчову мотивацію і рівень основного обміну. Центри регуляції харчової поведінки і основного обміну знаходяться в супраоптичних ядрах гіпоталамуса і контролюються таламусом, лімбічної системою і корою. Центр голоду локалізована в вентролатеральних, а центр насичення - в вентромедіальної ядрах подбугорья (пов'язаний з центром голоду синапсами, які передають гальмівні імпульси). Нейрони центру голоду виробляють нейропептид Y, який активує кортико-лимбичні структури мозку і стимулює почуття голоду, спонукаючи до пошуку їжі. Емоційно-поведінкові аспекти прийому їжі регулюються відділами, розташованими в кортикальной частини лімбічної системи (поясна звивина, гіпокамп, інфраорбітальна область) і в мигдалині, руйнування якої викликає байдужість до характеру пропонованої їжі.
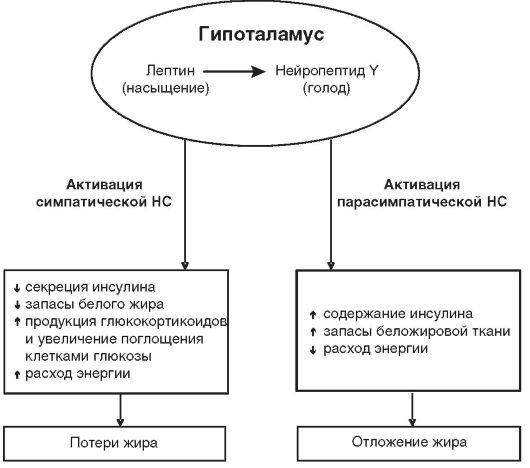
Рисунок 17 - Взаємозв'язок між центральною нервовою системою і лептином.
Ожиріння - надлишкове відкладення жиру в жировій тканині. Ожиріння значно підвищує ризик розвитку артеріальної гіпертонії, цукрового діабету 2 типу, атеросклерозу, тому дуже важливо стежити за своєю вагою. Вважається, що людина страждає ожирінням, якщо його маса перевищує нормальну більш ніж на 20% і продовжує збільшуватися далі. Цією недугою страждає більше третини дорослого населення Росії. У 1998 р Всесвітня організація охорони здоров'я (ВООЗ) визнала ожиріння хронічним захворюванням. За статистикою ВООЗ, в економічно розвинених країнах близько 30% дорослих і до 10% дітей мають ту чи іншу форму і ступінь ожиріння. У вікових групах після 50 років це захворювання зустрічається частіше. За останнє десятиліття кількість таких хворих у світі збільшилася майже в два рази і за оцінкою фахівців в 2025 р їх кількість становитиме 300 млн чоловік. Ситуація тим більше складна, що з кожним роком збільшується число молодих людей, страждаючих ожирінням, знижується загальна тривалість життя населення земної кулі у зв'язку з важкими захворюваннями, супутніми ожирінню.
У огрядних людей старше 50 років смертність збільшується на 50% порівняно з особами, які мають ожиріння. У жінок з ожирінням частіше зустрічаються рак ендометрія, яєчника, шийки матки, жовчного міхура та молочної залози, у чоловіків - рак передміхурової залози і товстої кишки, зниження потенції. Жирова тканина, складова в нормі 15-20% від маси тіла у чоловіків і 20-29% у жінок, - це метаболічно активна утворення.
Ожиріння може виникати як самостійне захворювання - в цьому випадку говорять про первинний ожирінні. Вторинне ожиріння - це синдром, що виникає внаслідок гормональних або інших розладів в організмі.
6.4 Порушення розщеплення білків їжі і засвоєння утворюющихся амінокислот
У шлунку і кишечнику відбувається гідролітичні розщеплення білків їжі до пептидів і амінокислот під впливом ферментів шлункового соку (пепсин, гастриксин), панкреатичного (трипсин, хімотрипсин, еластаза та карбоксипептидази) і кишкового (амінопептидази, діпептідази) соків. Утворені при розщепленні білків амінокислоти всмоктуються стінкою тонкого кишечника в кров і споживаються клітинами різних органів. Порушення цих процесів має місце при захворюваннях шлунка (запальні і виразкові процеси, пухлини), підшлункової залози (панкреатити, закупорка проток, рак), тонкого кишечника (ентерити, діарея, атрофія слизової, стану мальдигестії і мальабсорбції). Такі великі оперативні втручання, як видалення шлунка або значної частини тонкого кишечника, також супроводжуються порушенням розщеплення і засвоєння білків їжі. Засвоєння харчових білків порушується при лихоманці внаслідок зниження секреції травних ферментів.
Недостатність засвоєння білків їжі супроводжується дефіцитом амінокислот і порушенням синтезу власних білків. Недолік харчових білків не може бути повністю компенсований надлишковим введенням і засвоєнням яких-небудь інших речовин, так як білки є основним джерелом азоту для організму.
Синтез білків відбувається в організмі безперервно протягом усього життя, але найбільш інтенсивно відбувається в період внутрішньоутробного розвитку, в дитячому та юнацькому віці.
Розрізняють такі види синтезу білка в залежності від його призначення:
• регенераційний, пов'язаний з процесами фізіологічної та репаративної регенерації;
• синтез зростання, що супроводжується збільшенням маси і розмірів тіла;
• стабілізуючий, пов'язаний з відшкодуванням структурних білків, втрачених у процесі дисиміляції, що сприяє підтриманню структурної цілісності організму;
• функціональний, пов'язаний зі специфічною діяльністю різних органів (синтез гемоглобіну, білків плазми крові, антитіл, гормонів та ферментів).
Причинами порушення синтезу білка є:
• відсутність достатньої кількості амінокислот;
• дефіцит енергії в клітинах;
• розлади нейроендокринної регуляції;
• порушення процесів транскрипції або трансляції інформації про структуру того чи іншого білка, закодованої в геномі клітини.
Найбільш частою причиною порушення синтезу білка є нестача амінокислот в організмі внаслідок:
1) розладів травлення і всмоктування;
2) пониженого вмісту білка в їжі;
3) харчування неповноцінними білками, в яких відсутні або є в незначній кількості незамінні амінокислоти, які не синтезуються в організмі .
ЗАКЛЮЧЕННЯ
Структурною одиницею панкреатичних острівців є альфа, бета, дельта - клітини (А, B, D). Ці клітини синтезують глюкагон, інсулін, соматостатин, вазоактивний інтестинального пептид (ВІП), панкреатичний поліпептид, гастрин, липокаин, ваготонін, калікреїн, центропнеін. Поразка і недолік B-клітин в панкреатичних острівцях призводить до зниження синтезу інсуліну і розвитку цукрового діабету. Це захворювання широко поширене у людини і слабо вивчене у тварин. Тому актуальність теми даної роботи не викликає сумніву.
ПЕРЕЛІК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Клиническая эндокринология и ее физиологические основы. /Под ред. Н.А. Юдасва. Пер. с англ. Изд.: «Медицина», М., 2000. 560с
- Киршенблат Я.Д. Общая эндокринология. Изд: «Высшая школа». М., 1995.- 316 с.
- Савельев С.В. Сравнительная анатомия систем позвоночных: учебн. /С.В.Савельев. Изд.:ГЭОТАР-МЕД. М. 2001.-272с.
- Физиология человека и животных (общая и эволюционно-экологическая), В 2-х частях. Под ред. Когана А.Б. Изд.: «Высшая школа». М. 1984, I-я часть - 360 с., II часть – 288 с.
- Талызин Ф.Ф., Улисова Т.Н. Материалы к сравнительной анатомии систем органов позвоночных. Учебное пособие для студентов. М., 1974.-71 с.
- Шмидт Г.А. Эмбриология животных. Часть II. Частная эмбриология. Гос. изд.: «Советская наука», М., 1953.-404с
- Лейбсон Л.Г. Основные черты структурной и функциональной эволюции эндокринной системы позвоночных. Журн. эвол. биохимии и физиологии, 1967, т.3., №6, с. 532 – 544.
- Елецкий Ю.К., Яглов В.В.. Эволюция структурной организации эндокринной части поджелудочной железы позвоночных. Изд. Наука. М., 1978. – 166с.
- .Эндокринные железы: Вопросы развития структуры и регуляции функций. Труды. – М., 1974. – 202с.
- Гуртовой Н.Н., Матвеев Б.С., Дзержинский Ф.Я. Практическая зоотомия позвоночных. Земноводные и пресмыкающиеся./Под ред. Б.С. Матвеева и Н.Н. Гуртового. Изд.: «Высшая школа», М., 1978.- 406 с.
- Гистология, цитология и эмбриология. Учебная литература для студентов мед. вузов./Под ред. Ю.И. Афанасьева, Н.А. Юриной. Издание пятое, переработанное и дополненное. Изд.: «Медицина», М., 1999.- 744с.
- Розен В.Б. Основы эндокринологии. Изд.: «Высшая школа».М., 1980.- 344с.
- Анатомия человека. Под ред. Л.Л.Колесникова, С.С. Михайлова. – 1-е изд., перераб. и дополн.Изд.–:ГЭОТАР – МЕД., М. 2004.-816с.
- Быков В.Л. Частная гистология человека (краткий обзор. курс). – 2-е издание. Изд.– СПГ, 1997. – 300с.
- Кузнецов С.Л. Атлас по гистологии, цитологии и эмбриологии / С.Л.Кузнецов, Н.Н.Мушкамбаров, В.Л.Горячкина. - М.: Медицинское информационное агентство, 2002. - 374 с.
- Сапин М.Р., Никитюк Д.Б., Шестаков А.М. Вопросы классификации и закономерности строения малых желёз в стенке полых и внутренних органов // Морфология. - 2006. - Т. 129, № 1. - С. 18-23
- Эмбриональный гистогенез и постнатальное развитие органов человека. Учебно-методическое пособие (развитие регулирующих систем). Под ред. О.В. Волковой. Изд.: «Медицина». М., 2003- 71 с
- Быков В.Л., Исеева Е.А. Функциональная морфология эпителия слизистой поджелудочной железы // Морфология. - 2006.- Т. 129, № 3. - С. 7-21.
- Привес М.Г. Анатомия человека: учебник /М.Г.Привес, Н.К. Лысенков, В.И. Бушкович. – 12е изд., перераб. и дополн. – СПб.:Изд.: Дом СПбМАПО, 2005. -720с.
- Инсулин - в норме и при патологии: учебное пособие. - Мкртумян А.М. 2008. - 64 с.
- Гистология. Атлас для практических занятий. Учебное пособие. : Бойчук Н.В., Исламов Р.Р., Кузнецов С.Л., Челышев Ю.А. 2008г. - 160 с.
- Патофизиология. Основные понятия: учебное пособие / Под ред. А.В. Ефремова. - 2010. - 256 с.


про публікацію авторської розробки
Додати розробку
