Металічні елементи у періодичній системі, особливості будови атомів, металічний звязок. фізичні властивості металів.
1
Тема. Місце металічних елементів у періодичній системі, особливості будови атомів. Фізичні властивості металів. Метали у природі.
Мета:
Навчальна: поглибити знання студентів про металічні елементи, їх розташування у періодичній системі, загальні фізичні властивості металів, особливості будови атомів і речовин; розширити уявлення про види хімічного зв'язку з допомогою поняття про металічний хімічний зв'язок; показати вплив зв'язку на фізичні властивості речовин, утворених металічними елементами; ознайомити студентів зі сполуками металічних елементів у природі;
Розвиваюча: розвивати у студентів наукове світосприйняття,уміння аналізувати, порівнювати, узагальнювати й робити висновки на підставі здобутих знань; прищеплювати навички пошукової роботи;
Виховна: сприяти формуванню вмінь доводити свою думку, аргументувати її.
Тип заняття: засвоєння нових знань – бінарне заняття (хімія, фізика)
Форми роботи: індивідуальна, групова, фронтальна, парами.
Методи: лекція, евристична бесіда, робота з текстом підручника, демонстраційний експеримент, випереджальне завдання, індивідуальна робота.
Обладнання: періодична система хімічних елементів Д.І. Менделєєва, ряд активності металів, моделі металевих кристалічних ґраток, таблиці «Металічні кристалічні ґратки», колекція металів та їх сплавів, підручник «Хімія.10клас» О.Попель.
Очікувані результати:
Після заняття студенти повинні:
знати: розташування металічних елементів у періодичній системі хімічних елементів, особливості будови атомів металічних елементів, будову кристалічної ґратки металів, загальні фізичні властивості металів, поширення металічних елементів у природі;
уміти: складати схеми будови атомів металів, пов'язувати будову металів з їхніми фізичними властивостями.
Хід заняття
І. Організаційний момент.
1. Привітання.
2. Перевірка присутніх.
3. Готовність студентів до заняття(на столах: додатки, набори «Метали і сплави» та чистий аркуш паперу, необхідний для закріплення знань).
4. Мета всіх природничих наук – формування повної картини цілісності світу і щоб досягнути цієї мети, сьогоднішнє заняття ми проведемо поєднуючи ваші здобуті знання з фізики.
ІІ. Мотивація навчальної діяльності (створення позитивного емоційного настрою студентів)
Д. І. Менделєєв сказав: «Шлях до розвитку і, врешті – решт, до щастя людини пролягає через її працю».
Тому нам потрібно гарно попрацювати, адже лише ту роботу, яка приносить людям користь, можна назвати працею. Я бажаю вам успіху сьогодні та позитивних емоцій на шляху до досягнення своєї мети. Ну що ж почнімо!
В ПСХЕ 118 елементів. Більша їх частина (4/5) – метали. Людина використовує метали в техніці, в побуті, в самих різноманітних галузях своєї діяльності. Пригадайте, які метали є у вас вдома? Ми будемо вивчати метали: їх будову, властивості, добування та застосування. Почнемо із будови металів та їх фізичних властивостей. Багато що вам вже відомо із попередніх занять з хімії, інших предметів, побуту, тож, сподіваюся на вашу активну допомогу.
Ви вже багато знаєте про широке застосування металів. Проте, чи знаєте ви, що їх доцільне використання обумовлене будовою та властивостями металів. Наприклад,
• Чому дроти роблять із металів, а не з пластику?
• Чому молоток, цвяхи, пилку виготовляють із металу?
• Чому ручку сковорідки найчастіше покривають спеціальним покриттям?
Пояснення усім цим явищам ми дамо сьогодні на занятті.
ІІІ. Оголошення теми та мети заняття
Тема нашого заняття… ( так,ми недаремно розпочали розмову про метали…); мета…
Ми будем працювати за таким планом:
1. Розташування хімічних елементів у періодичній системі
2. Будова атомів металічних елементів
3. Загальні фізичні властивості металів.
4. Метали у природі
Деякі наші студенти отримали випереджальне домашнє завдання. Тому, у нас у гостях сьогодні будуть видатні вчені-фізики, які розкажуть нам про будову атома, а також, історик, філолог та біолог, які розкажуть нам про роль металів у житті людини.
Проблемне питання
«Що є причиною потемніння яблука»
ІІІ. Актуалізація опорних знань
На попередніх заняттях ми вивчали неметалічні елементи: давайте пригадаємо де розташовані неметалічні елементи в періодичній системі?
Подивіться на періодичну систему хімічних елементів й визначте елементи 40 і 53.
• Це металічні чи неметалічні елементи? (Індивідуально-пошукова робота з підручником та періодичною системою хімічних елементів Д.І.Менделєєва)
ІV. Сприйняття й усвідомлення студентами нового матеріалу
1. Розташування метелічних елементів у періодичній системі
Знаючи розташування неметалічних елементів, легко можна визначити розташування металічних(слайд)-пояснення
Висновок
У періодичній системі хімічних елементів металічні елементи розташовані на початку періодів (виняток – 1-й період), у всіх побічних підгрупах, переважно в лівій нижній частині періодичної системи. Металічним елементом є елемент 41, тому що він розташований у побічній підгрупі.
2. Будова атомів металічних елементів – розглянемо будову атома з фізичної точки зору.
• 3 повідомлення + відео
• хімія надзвичайно чарівна наука, адже де і ще можна з 2-ох небезпечних речовин добути таку потрібну речовину, як кухонна сіль(яка формула?) –NaСl.
Чому сіль – «біла смерть»? – із-за Хлору. Але разом – це необхідна речовина для нашого організму. Чому вони дружать між собою? Що зумовлює їхнє єднання?
Будь-яку властивість речовини можна пояснити виходячи із її електронної будови. Яка електронна будова атома Na?- студент йде до дошки; яка будова атома Сl? – біля дошки
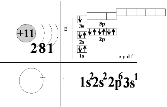
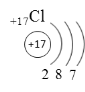 Пояснення викладача
Пояснення викладача
Робота самостійно-Запишіть електронні конфігурації атомів двох металів. Знайдіть, що є спільного?
Mg 1S22S22P63S2;Al 1S22S22P63S23Р1
Висновок:(роблять студенти)
- На зовнішньому енергетичному рівні знаходиться невелике число електронів (1 – 3).
- Метали мають невелику електронегативність, тому легко віддають валентні електрони, тим виявляють відновні властивості.(слайд)
Na – 1e- → Na+ (11Na+ 1S22S22P63So)
Mg – 2e- → Mg2+ (12Mg+ 1S22S22P63So)
АІ – 3e- → АІ3+ (13АІ+ 1S22S22P63So)
Вправа 2. «Хрестики-нулики»
Виграшний шлях – хімічні елементи, в атомах яких чотири енергетичні рівні.
|
AI |
O |
Ca |
|
H |
Ge |
Be |
|
Fe |
Hg |
Ba |
3.Фізичні властивості
Як ви вважаєте чим відрізняються фізичні і хімічні властивості?
Випереджаюче навчання(студент) – проект Фізичні властивості металів
Фізичні властивості металів
Специфічні фізичні властивості металів
1. Металічний блиск і колір
Метали відбивають промені світла, а не пропускають їх, як скло, і не вбирають, як сажа. Срібло найкраще відбиває світло, тому має найбільший блиск (дзеркала, ялинкові іграшки). У більшості металів сріблястий блиск, але у золота і цезію – жовтий, у міді – червоний.
2. Висока електропровідність і теплопровідність
• Чому при доторканні рукою до металічного предмета відчуваємо холод, а до дерев’яного – ні?
(Тепло долоні швидко передається металу, він стає теплішим, а долоня холоднішає. Дерево погано проводить тепло, тому, торкаючись його рукою, ми не відчуваємо холоду).
Ця властивість металів зумовлена наявністю усуспільнених електронів, що можуть відносно вільно рухатися.
Ag, Cu, Au, Al, Mg, Zn, Fe, Pb……….
Електропровідність - і теплопровідність спадає
3. Ковкість, пластичність
Пластичність – здатність необоротно деформуватися під дією механічних навантажень. Пластичність обумовлена будовою металічної кристалічної ґратки .
Золото – найеластичніший з металів. 1г золота можна витягнути у дріт завдовжки 2 км. Із шматочка величиною із сірникову головку можна отримати лист площею 50 м2, лист в 0,0001мм у 500 раз тонше за волосину.
Найбільш крихкі з металів – хром, манган, стибій.
Неспецифічні фізичні властивості металів
Температура плавлення
![]()
![]() Метали
Метали
легкоплавкі тугоплавкі
tпл < 1000° С tпл > 1000° С
лужні, лужноземельні метали, Cu, Fe,Cr, Ti, Mo….
Mg, Al, Pb, Sn, Zn…… tпл W ~3400°С
tпл Hg = - 38,87°С
![]() Твердість
Твердість
![]() Метали
Метали
м’які тверді
лужні метали, хром, вольфрам
свинець.
![]() Густина
Густина
![]() Метали
Метали
Легкі Важкі
ρ < 5 г/см3 ρ> 5 г/см3
літій,натрій, магній, осмій, цинк, залізо, свинець,
алюміній ртуть, золото
Висновок(робить викладач з студентами)
4. Метали у природі
За поширеністю у природі металічні елементи поступаються неметалічним. Розглянемо діаграму «Поширеність металічних елементів у Земній корі».
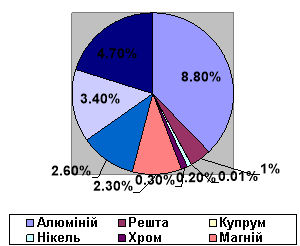
• Які металічні елементи є найпоширенішими у природі?
• Які елементи трапляються дуже рідко?
Де ми ще зустрічаємо метали і яка їхня роль в природі та житті людини? – послухаєм наших гостей. (Заслуховування повідомлень студентів про важливість функції металів в життєдіяльності організмів та господарській діяльності людини.)
Історик. Відкриття металів є найвидатнішою за своїми історичними наслідками подією в історії людства. Від ударів шматок металу не розбивався, як шматок каменю, а плющився, податливо набуваючи необхідної форми. На зміну кам'яному століттю прийшли бронзове та залізне століття. У давні часи було відомо тільки сім металів. Ця кількість відповідала числу відомих тоді планет: Сонце (золото), Юпітер (олово), Місяць (срібло), Марс (залізо), Меркурій (ртуть), Сатурн (свинець), Венера (мідь). Алхіміки вважали, що під впливом променів планет у надрах Землі народжуються ці метали.
Філолог. Метали відіграють настільки велику роль у житті людей, що вони склали про них
Прислів'я: «Слово – срібло, а мовчання… (золото)
Загадки: «Я з металами стою, хоча легкий немов олія. Я трапляюся всюди: у посудині, у склі, у кухонній солі» (Na),
Порівняння , де застосовуються назви металів
Золоте серце; Золоті руки; Залізна воля; Залізний характер; Сивина як срібло; Швидкий, як ртуть
Біолог.Деякі метали необхідні для нормальної життєдіяльності людського організму: Fe, Mg, Ca, Cu, Na,AI, Co, Mo, Zn. Вони містяться у мікроконцентраціях, їх називають мікроелементами. Наприклад,
Кальцій – найпоширеніший в організмі метал, його нестача призводить до карієсу, ламкості кісток.
Магній – основа магнезії MgO, яку застосовують у медицині при лікуванні підвищеної кислотності та печії чи при отруєнні кислотами;
Калій входить до складу лінз;
Паладій застосовують у виготовленні білого золота чи зубних протезів;
Тантал і титан застосовують у виробництві кісткових протезів;
Метали є в складі різних органів людини?
Са – в кістках, Сu – в печінці, Mn – в серці, Zn – в зубах, Fe – в крові,
As – в нирках, Au – в крові.
Ферум бере участь у дихальних процесах. Організм дорослої людини містить 3-3,5 г Fe 3+, з них 75% входить до складу гемоглобіну. Найбільш багаті на йониФеруму печінка й селезінка. Нестача Феруму часто є причиною хлорозу у рослин і анемії в живих організмах (тварин і людини).
Нестача заліза в організмі – це: постійна втома, бліда і суха шкіра, головні болі, запамо-рочення і вічне бажання поспати – це сигнал того, що в організмі не вистачає заліза. Особливо при вагітності. Де взяти його? – лідер –це свиняча печінка, риба куряча печінка, варена квасоля; багато в горіхах, гречці, гарбузове насіння та яблуках.
Виклад хімії. Отже, чи можемо ми дати відповідь на проблемне питання:«Що є причиною потемніння яблука» - студенти дають відповідь
ІV. Закріплення і узагальнення знань
1. Інтерактивна технологія «Бліц-опитування» (по 2пит рядами)
1. Скільки електронів мають метали на зовнішньому енергетичному рівні? (1-3)
2. З яких частинок складається атом металу? (електрони, протони і нейтрони)
3. Який метал має найбільшу електропровідність? (Ag)
4. Що є причиною потемніння яблука?(окиснення заліза)
5. Який метал можна розплавити на руці? (t пл. Cs=28,5°C)
6.Фізична властивість металів, що зумовлена здатністю відбивити світлові промені (блиск)
- Компютерне тестування(пит. 1 бал)
1. Назвіть кількість електронів Алюмінію:
А. 13; В. 10;
Б. 27; Г. 24.
2. Який метал має найбільшу пластичність?
А. Ni; В. Au;
Б. Li; Г. Fe.
3.Позначте елемент, який розташований у побічній підгрупі:
А. Берилій; В. Стронцій;
Б. Магній; Г. Цинк.
4. Позначте назву металічного елемента:
А. Фосфор; В. Оксиген;
Б. Магній;Г. Хлор.
5. Найлегший з металів?
А. Са; В. Оs;
Б. Li; Г. Fe.
6.Фізична властивість металів, що зумовлена здатністю відбивати світлові промені
А. Колір; В. Тепллопровідність;
Б. Пластичність; Г. Блиск.
7.Вкажіть кількість електронів, що можуть розміщуватись на s орбіталі:
А. не більше 2; В. не більше 10;
Б. не більше 6; Г. не більше 14.
8. Кількість енергетичних рівнів в атомі елемента визначається:
А. номером періоду; В. протонним числом;
Б. номером групи; Г. нуклонним числом
9.Виберіть з наведеного переліку чорний метал:
А. мідь; В. цинк;
Б. залізо; Г. алюміній.
10. Найважчий з металів?
А. Са; В. Оs;
Б. Li; Г. Fe.
11.Метал, що характеризується легкістю, високими електропровідністю та теплопро-відністю, пластичністю, широко застосовується в побуті і промисловості
А. Са; В. Au;
Б. Fe; Г. Al.
12.Назвіть метал, який за звичайних умов перебуває в рідкому стані:
А. натрій; В. ртуть;
Б. калій; Г. свинець
Правильні відповіді
- А; 4. Б; 7. А; 10. В;
- В; 5. Б; 8. А; 11. Г;
- Г; 6. Г; 9. Б; 12. В.
V. Рефлексія за методом «Мікрофон»
• Що нового ви дізналися про метали під час заняття?
•Що нового ви дізналися для себе як для майбутнього медика, для своєї професійної діяльності?
• Чи сподобалось вам заняття?
VІ. Підбиття підсумків заняття.
Оцінювання роботи студентів, мотивація виставлення оцінок.
V ІІ. Домашнє завдання
Обов’язкове:
- Опрацювати конспект.
- Здійснити перетворення:
Al →Al2O3 → AlCl3 → Al(OH)3 → Al2O3 → Al
Fe → FeCl2 → Fe(OH)2 → FeO
Fe → FeCl3 → Fe(OH)3 → Fe2О3
Додаткове:
Створити проект на тему: «Загальні хімічні властивості металів. Корозія металів, захист від корозії»
Хімію пізнавайте, любіть та поважайте!


про публікацію авторської розробки
Додати розробку
