Метан – найпростіша органічна сполука. Молекулярна, електронна та структурна формули метану. Поширення в природі. Фізичні та хімічні властивості: реакції повного окиснення, заміщ
Урок 33
Тема уроку. Метан – найпростіша органічна сполука. Молекулярна, електронна та структурна формули метану. Поширення в природі. Фізичні та хімічні властивості: реакції повного окиснення, заміщення.
МЕТА УРОКУ: розглянути метан як найпростішу органічну речовину;
ознайомити учнів з будовою молекули метану, типом гібридизації електронних
орбіталей атома Карбону;
розкрити значення методу моделювання для вивчення будови та властивостей речовин;
навчити писати молекулярну, структурну, електронну формули молекули;
поглибити знання про поширення органічних сполук у природі на прикладі метану;
ознайомити з фізичними та хімічними властивостями метану;
показати зв’язок будови молекули метану та властивостей сполуки;
поглибити знання про способи отримання метану в лабораторних умовах, поширенням метану в природі та його застосуванням;
продовжити формувати вміння аналізувати досліди, робити висновки про хімічні властивості метану на основі експерименту;
вчити використовувати набуті теоретичні знання під час розв’язання практичних завдань;
розвивати логічне мислення, пам’ять, уміння спостерігати і аналізувати досліди, складати рівняння реакцій;
виховувати інтерес до вивчення хімії, самостійності в навчанні.
ТИП УРОКУ: вивчення нового матеріалу.
ОСНОВНІ ПОНЯТТЯ: реакція заміщення (галогенування по радикальному типу), реакція окиснення, горіння, термічного розкладу.
ОБЛАДНАННЯ: моделі молекули метану, пробірка, газовідвідна трубка, промивалка, кристалізатор, циліндр, горілка, штатив (Дослід 11: відношення метану до бромної води та перманганату калію), презентація до уроку, http://www.youtube.com/watch?v=rzdITkWA-hA&feature=youtu.be - медіа-фільм про гібридизацію електронів у атомі Карбону, моделі молекул органічних речовин, http://www.chemistry.ssu.samara.ru/chem2/index2.htm - відношення метану до бромної води та перманганату калію; http://www.youtube.com/watch?v=hrdVO02_PQo - відео-досліди про хімічні властивості метану, http://www.chemistry.ssu.samara.ru/chem2/flash/clor0.swf - анімація реакції хлорування, http://www.chemistry.ssu.samara.ru/chem2/flash/clor_s.swf - анімація реакції хлорування зі звуковим коментарем, http://www.chemistry.ssu.samara.ru/chem5/link255.htm - відомості про Коновалова, http://www.expres.ua/tech/2013/09/25/94279-sklasty-konkurenciyu-nasa-poshuku-zhyttya-marsi-vyrishyla-indiya - про виявлення метану у Всесвіті.
ТЕХНІКА БЕЗПЕКИ: дотримуватися правил роботи з горючими газами та нагрівальними приладами.
ФОРМИ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ: фронтальна робота, розповідь учителя, складання реакцій.
МЕТОДИ НАВЧАННЯ: самостійна робота, робота в групах – “навчання разом”, дискусійна - “мозковий штурм”, “ситуація з життя”, диференційний підхід до домашнього завдання.
ПЛАН УРОКУ
- Організація классу. Мотивація навчальної діяльності.
- Перевірка домашнього завдання. Актуалізація опорних знань. Фронтальна робота за
запитаннями.
- Вивчення нового матеріалу:
а) Метан, його молекулярна, електронна та структурна формули.
б) Фізичні властивості метану.
в) Добування метану в лабораторії
г) Хімічні властивості метану:
- Хімічні властивості метану за н.у. (відношення метану до бромної води та перманганату калію).
- Горіння – повне окиснення.
- Термічний розклад.
- Реакції заміщення – галогенування по радикальному типу.
- Реакція нітрування (реакція Коновалова).
д) Поширення метану в природі.
IV. Закріплення і систематизація знань учнів, осмислення об’єктивних зв’язків у вивченому
матеріалі.
V. Повторення вивченого матеріалу під час бесіди.
VI. Первинний контроль знань під час виконання тестових завдань
VII. Підбиття підсумків уроку.
VIII. Домашнє завдання.
ХІД УРОКУ
- Мотивація навчальної діяльності.
Ми розглянемо найпростішу органічну речовину метан, ознайомимося з будовою його молекули, типом гібридизації електронних орбіталей атома Карбону в молекулі метану, навчимося писати молекулярну, структурну, електронну формули молекули, вивчимо фізичні та хімічні властивості метану, виявимо зв’язок будови та властивостей молекули метану, дізнаємося про поширення в природі та його застосування. (Слайд 1)
II. Перевірка домашнього завдання.
Актуалізація опорних знань.
а) Фронтальна робота за питаннями: Пригадаємо! Гра «так» чи «ні» (Слайди 2-3).
б) Дискусійна бесіда
♦ Поясніть, чому в органічних сполуках атом Карбону проявляє валентність IV. (слайд 4 )
Узагальнення вчителя
У переважній більшості випадків Карбон в органічних сполуках - чотиривалентний. Це пов'язано з тим, що під час утворення ковалентного зв'язку атом Карбону переходить у збуджений стан, за якого електронна пара на 2s-орбіталі роз'єднується і один електрон займає вакантну р-орбіталь.
♦ 3 якими особливостями будови атома Карбону пов'язана різноманітність органічних сполук? (слайд 5)
Узагальнення вчителя
Карбон — особливий елемент. Жоден інший хімічний елемент не здатний утворювати таку кількість сполук (приблизно 6,5 млн органічних сполук). Причина цієї різноманітністі полягає в тому, що атоми Карбону здатні:
1) з’єднуватися один з одним у ланцюги різної будови — відкриті (нерозгалужені, розгалужені, замкнені);
2) утворювати не лише прості (одинарні), але й кратні (подвійні, потрійні) зв’язки: Н3С-СН3, Н2С=СН2, НС≡СН;
3) утворювати міцні зв’язки майже з будь-яким іншим елементом;
4) існувати ізомери, речовини які мають однаковий склад, але різну будову та властивості.
Ці унікальні властивості Карбону пояснюються: наявністю на зовнішньому енергетичному рівні (2s і 2p) чотирьох електронів (тому атом Карбону не схильний ні віддавати, ні приєднувати вільні електрони з утворенням йонів) та дрібним розміром атома (порівняно з іншими елементами IV групи). Внаслідок цього Карбон утворює переважно ковалентні, а не іонні зв’язки, і проявляє валентність IV.
♦ Що таке гібридизація? (слайд 6)
Узагальнення вчителя
Гібридизація — це явище змішування різних за формою й енергією електронних орбіталей з утворенням однакових за формою й енергією гібридних орбіталей.
Вивчення нового матеріалу
Метан, його молекулярна, електронна та структурна формули
Найпростіша органічна сполука — метан, утворена одним атомом Карбону й чотирма атомами Гідрогену.
- Молекулярна формула метану СН4. Його молярна маса 16 г/моль, масова частка Карбону в метані
75%. Відносна густина метану за воднем - 8, за киснем - 0,5. (слайд 7)
• Електронна формула метану – ![]()
-
Структурна формула —
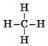
У процесі утворення молекули метану в атомі Карбону відбувається sp3-гібридизація електронних хмарин. У процесі sp3-гібридизації відбувається цілковите змішування однієї s- і трьох р-орбіталей з утворенням чотирьох гібридних орбіталей. Утворені гібридні орбіталі асиметричні й дуже витягнуті в один бік від ядра. Вони відштовхуються одна від одної під кутом 109° 28', тому молекула метану в просторі являє собою тетраедр. (слайди 8-9)
Розглядаємо модель молекули метану: 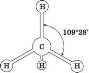
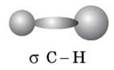
У молекулі метану між атомами Карбону й Гідрогену утворюються чотири однакові за силою й довжиною ковалентні слабко-полярні σ-зв’язки. σ-зв’язок — це ковалентний зв’язок, утворений у результаті перекривання орбіталей уздовж лінії зв’язку (що єднає центри атомів). σ-зв’язок міцний, має значну енергію.
http://www.youtube.com/watch?v=rzdITkWA-hA&feature=youtu.be
Фізичні властивості метану (слайд 10)
За нормальних умов метан - це безбарвний горючий газ, без запаху та смаку, майже вдвічі легший за повітря, тому його можна збирати витісненням води і повітря. Дуже малорозчинний у воді, але добре розчиняється в органічних розчинниках. tпл = -182,5°С, tкип = -161,5°С. При охолодженні до -1620С ( за нормального тиску) перетворюється на рідину.
Добування метану в лабораторії (слайд 11)
- Шляхом нагрівання суміші ацетату натрію з гідроксидом натрію
СН3СООNa + NaОН → Na2СО3 + СН4↑
- Шляхом взаємодії карбіду алюмінію з водою
АІ4С3 + 12Н2О → 4АІ(ОН)3 + 3СН4↑
Хімічні властивості метану (слайди 12-14) http://www.youtube.com/watch?v=hrdVO02_PQo
1.За н.у. метан досить інертний: (слайд 12) http://www.chemistry.ssu.samara.ru/chem2/index2.htm
- не реагує з лугами і кислотами;
- не окиснюється перманганат калію (KMnO4);
- не знебарвлює бромну воду (Вr2).
Дослід 11: відношення метану до бромної води та перманганату калію – Метан отримуємо прокалюванням безводного ацетату натрію з гідроксидом натрію.
СН3СООNa + NaОН → Na2СО3 + СН4↑
Пропускаємо метан через розчин перманганату калію. Ніяких змін не спостерігаємо. Бромна вода також не змінює забарвлення. Отже, метан стійкий до окиснювачів і не вступає в реакцію з бромом за даних умов.
2. Горіння – повне окиснення.
Метан горить характерним блакитним полум'ям з виділенням великої кількості теплоти, утворюючи вуглекислий газ і воду.
СН4 + 2О2 →СО2↑ + 2Н2О; ∆Н = 890 кДж/моль
У разі нестачі кисню метан окиснюється не повністю. І тоді замість карбон(IV) оксиду CO2 утворюється карбон(II) оксид CO, відомий як чадний газ.
2CH4 + 3O2 → 2CO↑ + 4H2O.
Запамятай! Суміш СН4 і О2 дуже вибухонебезпечна. Спричинює аварії в шахтах, може статися вибух в приміщенні.
3. Термічний розклад
t›1000°C
СН4 → С + 2Н2↑
Водень, який утворюється при термічному розкладі (вище 1000 °C) використовують для синтезу амоніаку та соляної кислоти, а сажу - для добування гуми і фарб.
4. Реакції заміщення – галогенування по радикальному типу (слайд 13) http://www.chemistry.ssu.samara.ru/chem2/flash/clor0.swf - анімація реакції хлорування
http://www.chemistry.ssu.samara.ru/chem2/flash/clor_s.swf - анімація реакції хлорування зі звуковим коментарем
|
Метан вступає в реакції заміщення. Серед реакцій заміщення найбільше значення мають реакції галогенування (хлорування, бромування) та нітрування. Реакція хлорування відбувається при освітленні суміші метану і хлору розсіяним ультрафіолетовим промінням (або при нагріванні). В ході реакції відбувається поступове заміщення атомів Гідрогену в молекулі метану атомами Хлору. Продуктами реакції є відповідно на першій стадії хлорометан CH3Cl і HCl, на другій - дихлорометан CH2Cl2 і HCl, на третій - трихлорометан CHCl3 і HCl; і на четвертій - тетрахлорометан CHCl4 і HCl. Це ланцюгова реакція, яка відбувається за вільнорадикальним механізмом. Вивченням механізму таких реакцій займався російський учений Микола Миколайович Семенов, за що й був нагороджений Нобелівською премією. |
hν СН4 + Cl2 → CH3Cl + HCl хлорметан hν CH3Cl + Cl2 → CH2Cl2 + HCІ дихлорметан hν CH2Cl2+ Cl2 → CHCl3 + HCl трихлорметан (хлороформ) hν CHCl3 + Cl2 → CCl4 + HCl тетрахлорметан Сумарне рівняння: hν СН4 + 4Cl2 → CCl4 + 4HCl |
5. Реакція нітрування (реакція Коновалова) (слайд 14) http://www.chemistry.ssu.samara.ru/chem5/link255.htm - відомості про Коновалова
Механізм реакції нітрування метану вперше дослідив російський учений Коновалов, і тому ця реакція носить його ім’я. Реакція нітрування метану відбувається при температурі 140 °С в присутності суміші двох концентрованих кислот - нітратної і сульфатної. Суміш цих кислот називають нітруючою сумішшю. У результаті реакції нітрування утворюється нітроментан CH3NO2 (застосовують як розчинник, напівпродукт для синтезу вибухових речовин, як реактивне паливо) і вода:
140-1500С, р
СН3 - Н + НО -NО2 → CH3 - NО2 + H2О
(розбавлена) нітрометан
Поширення метану в природі (слайди 15-16)
Метан дуже поширений у природі. Він є головною складовою частиною багатьох горючих газів як природних, так і газів, що виділяються під час сухої перегонки деревини, торфу, кам’яного вугілля. Неабиякі запаси метану «законсервовано» у твердих газових гідратах: у порожнинах кристалічних ґраток льоду містяться молекули метану. Чимало метану в складі копального (рудникового) газу міститься у кам'яно-вугільних пластах та у сольових копальнях. Вибухи суміші метану з киснем повітря часто спричиняють масову загибель шахтарів.
Цікаво?
У позаминулому столітті в сольовій копальні «Камера Спалена», що в горі Величка (Польща), були робітники, яких називали «грішниками, що каються». Вони надягали мокрий одяг з каптурами і повзали шахтами. Тримаючи в руці довгі ціпки, на кінці яких жевріли смолоскипи. У такий спосіб вони випалювали метан під стелею, не дозволяючи його концентрації сягнути критичної межі.
Пізнавально!
Виходи метану на земну поверхню трапляються в сейсмоактивних місцевостях, у місцях розломів земної кори, на дні океану. У природі метан утворюється внаслідок анаеробного бродіння рослинних решток у болотах, річковому мулі (болотний газ), під час перетравлювання їжі великою рогатою худобою. Біогаз – продукт переробки фекалій і сміття – також переважно складається з метану.
Цікаво?
Болотний газ хімічними методами вперше дослідив італійський природодослідник Алессандро Вольта у 1776р. Він встановив його відмінність від водню. Болотний газ у неглибокій замуленій водоймі збирали у товстостінну склянку банку або пляшку, занурюючи її у воду, щоб вона заповнилася рідиною. Потім повертали її догори дном, вставляли лійку і збирали метан. Дно розпушували за допомогою ціпка. Коли в склянці збирався газ, її закорковували під водою і виймали на поверхню.
Метан є не тільки на Землі. Він становить основу атмосфери планет Юпітер, Уран, Нептун і Сатурн. Метан також виявлено в газах поверхневого ґрунту Місяця. Величезні озера рідкого метану є на поверхні Титана, найбільшого природного супутника Сатурна. http://www.expres.ua/tech/2013/09/25/94279-sklasty-konkurenciyu-nasa-poshuku-zhyttya-marsi-vyrishyla-indiya
Застосування метану (слайди 16-19)
Застосування метану досить різноманітне і базується на його властивостях. Завдяки великій теплотворній здатності цей газ використовують як екологічно чисте паливо в побуті, промисловості та на транспорті. Широко застосовують речовини, які добувають з метану: водень, ацетилен, сажу. Він є вихідною сировиною у виробництві формальдегіду, метилового спирту, а також різних синтетичних продуктів. Хлорометан використовується в органічному синтезі; дихлорометан і трихлорометан - як розчинники; тетрахлорометан - як засіб для гасіння вогню.
Цікаво?
Продукти хлорування метану використовують не лише як розчинники. Хлороформ має яскраво виражену анестезуючу дію, тому раніше його застосовували в медицині для знеболювання.
В 1831 р. хлороформ незалежно один від одного добули Самюель Гутрі, Юстус Лібіх і Ежен Суберейн. Хімічну формулу встановив французький хімік Дюма і в 1834 р. запропонував назву «хлороформ». В 1847 р. акушер Джеймс Симпсон уперше використав хлороформ для загального наркозу під час приймання пологів.
Пізнавально!
Тетрахлорометан - продукт повного заміщення атомів Гідрогену в молекулі метану на атоми Хлору - не горить. Тому тривалий час його використовували під час гасіння пожеж оскільки важка пара цієї речовини перекриває доступ повітря і миттєво припиняє горіння. Проте гасіння полум'я техрахлорометаном може супроводжуватися утворенням дуже отруйного газу фосгену СОСІ2. Тому гасити вогонь у закритих приміщеннях тетрахлорометаном можна тільки з відповідними пересторогами. Усі продукти хлорування метану - токсичні речовини, до того ж сприяють руйнуванню озонового шару.
IV. Закріплення і систематизація знань учнів, осмислення об’єктивних зв’язків у вивченому
матеріалі.
1.Виберіть молекулярну формулу метану:
|
а) СН4 |
б) С02 |
в) ССІ4 |
г) СНСІ3 |
2.Виберіть форму молекули метану:
|
а) Площинна |
б) Тетраедрична |
в) Трикутна |
г) Лінійна |
3. Виберіть характеристику реакції повного окиснення метану:
|
а) Необоротна |
б) Ендотермічна |
в) Ионного обміну |
г) Сполучення |
4. Метан, що виходив з газовідвідної трубки, підпалили (мал. 20.6,1), трубку занурили в посудину з хлором (мал. 20.6,2). Поясніть, чому жовто-зелене забарвлення хлору поступово зникає (мал. 20.6,3), а під час наближення посудини з концентрованим водним розчином амоніаку з'являється (мал. 20.6,4) «дим без вогню» (пригадайте, ви спостерігали це явище під час вивчення хімії у 7-му класі).

- Повторення вивченого матеріалу під час бесіди.
1) Назвіть причину використання метану як палива.
2) Поясніть, чому метан називають блакитним паливом.
3) Чому число атомів Гідрогену в молекулах вуглеводнів парне?
4) Які ланцюги можуть утворювати між собою атоми Карбону?
5) Доведіть склад метану експериментальним шляхом.
6) Наведіть щонайменше по дві причини того, чому: а) медики припинили використання хлороформу для анестезії; б) вогнегасники, заряджені тетра-хлорометаном, практично вийшли з ужитку
7) Дев'ятикласники Антон і Тамара посперечалися. Антон стверджував, що метан - перспективне паливо для двигунів майбутнього, які полегшать процес освоєння космосу й уможливлять міжпланетні польоти. Тамара заперечувала: запаси метану на Землі швидко вичерпуються, тож перспективи не такі вже й райдужні... Долучіться до їхньої дискусії, аргументуйте свою думку.
8) Оцініть вірогідність повідомлення ЗМІ: «Метан традиційно транспортують трубопроводами або в балонах. Група науковців під керівництвом професора Ендрю Купера з університету Ліверпуля виявила, що газуватий метан можна акумулювати в суміші дрібнодисперсного кварцу й води. До комерціалізації розробки ще дуже далеко, тим паче до її масового застосування. Але перші кроки, безсумнівно, зроблено». Аргументуйте свою думку.
VII. Підбиття підсумків уроку.
VIII. Домашнє завдання.
Опрацювати матеріал §21, стор.124-129, відповісти на запитання до нього;
Виконати вправи 1-6, стор. 129.
Творче завдання. Підготувати повідомлення про застосування метану. Пояснити, на яких властивостях метану ґрунтується ця сфера його застосування.


про публікацію авторської розробки
Додати розробку
