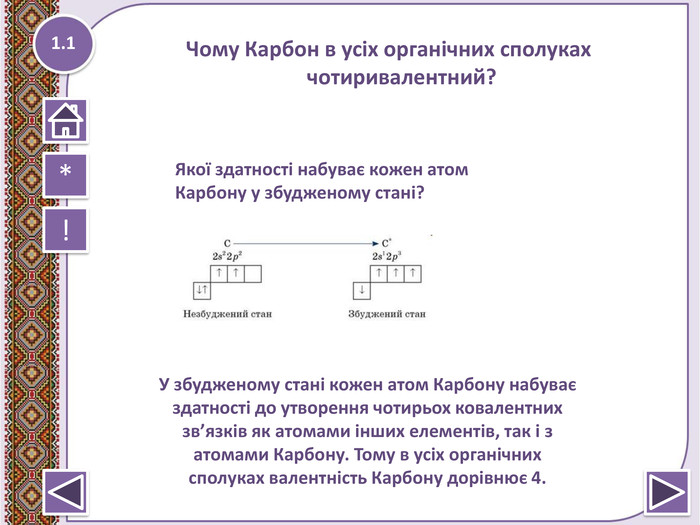
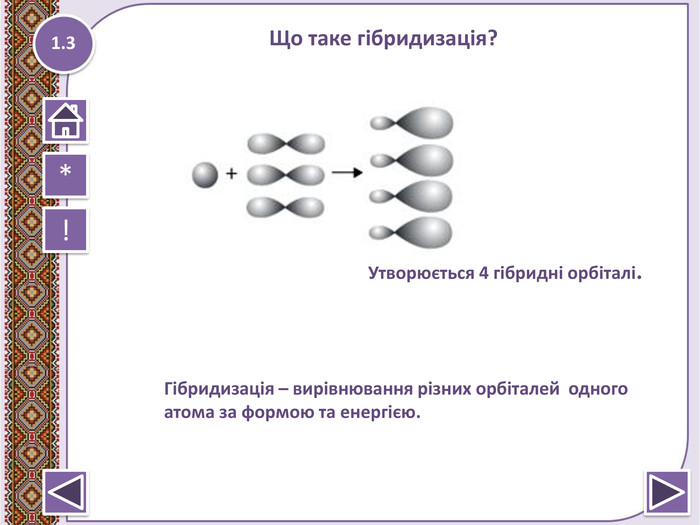
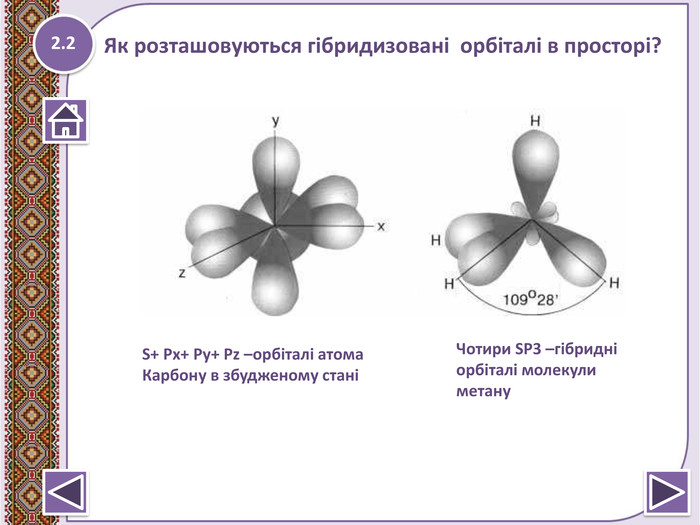
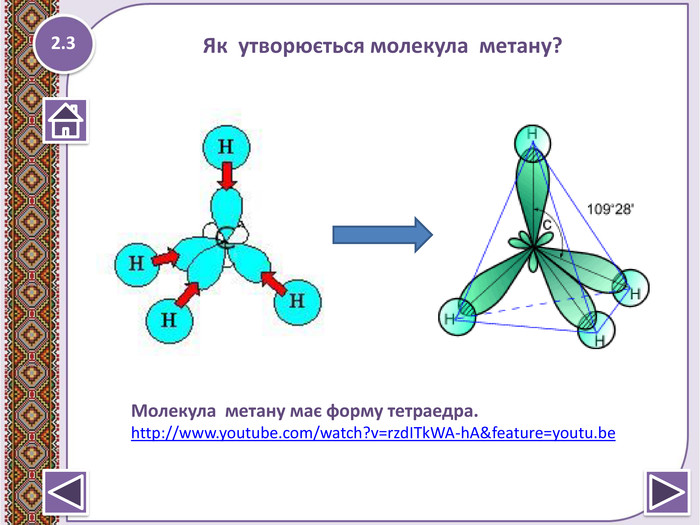
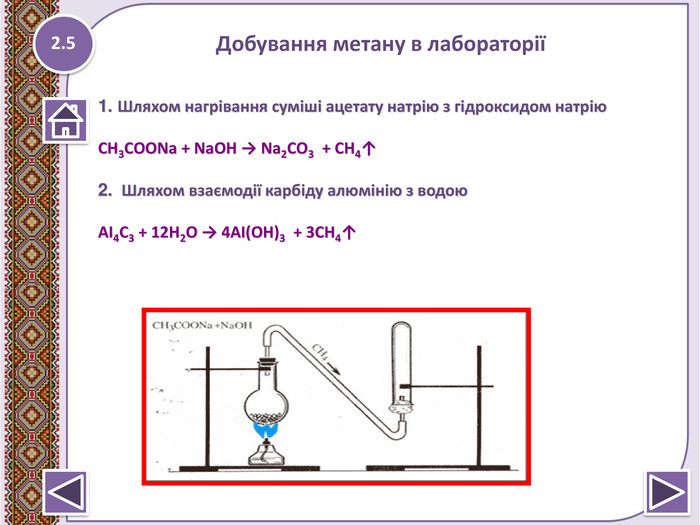
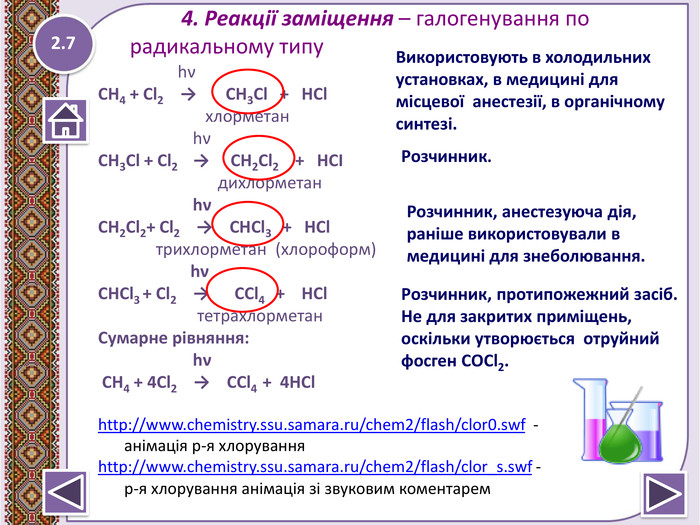
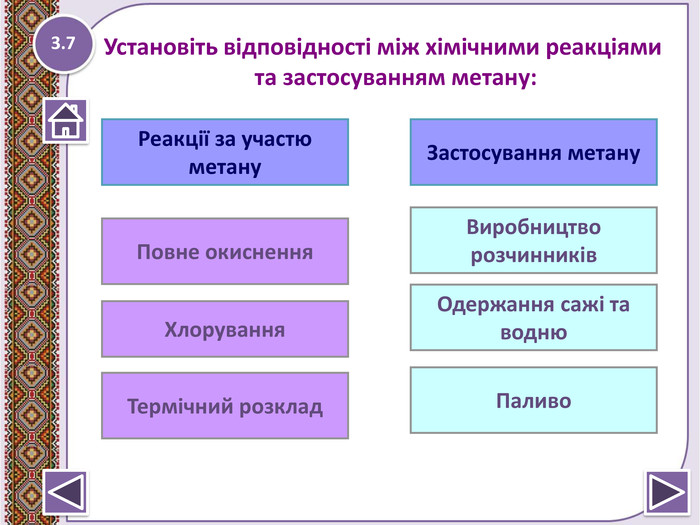
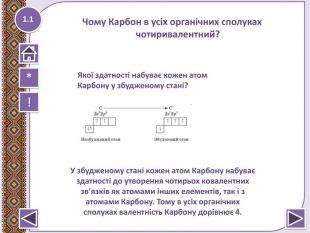
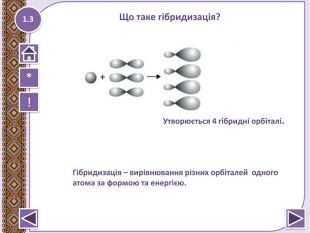
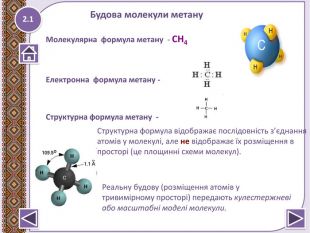
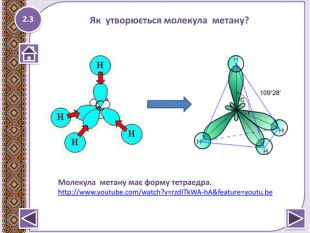
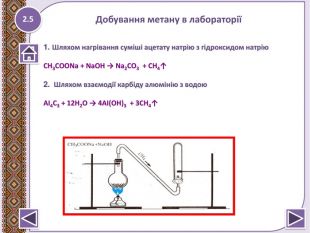
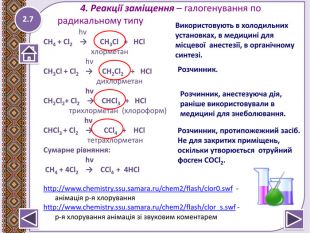
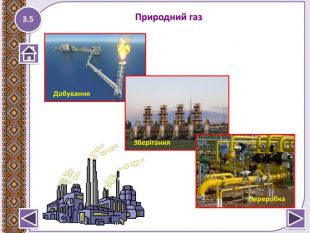
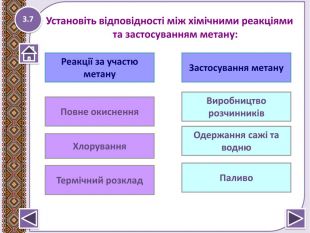
Метан – найпростіша органічна сполука. Молекулярна, електронна та структурна формули метану. Поширення в природі. Фізичні та хімічні властивості: реакції повного окиснення, заміщ
Про матеріал
Презентація до уроку "Метан – найпростіша органічна сполука. Молекулярна, електронна та структурна формули метану. Поширення в природі. Фізичні та хімічні властивості: реакції повного окиснення, заміщення." Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія для загальноосвітніх навчальних закладів з поглибленим вивченням хімії 9 клас (Бутенко А.М.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку