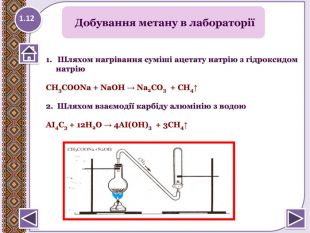
Вуглеводні. Насичені та ненасичені вуглеводні: їх склад, будова, фізичні та хімічні властивості.

















![Реакції окислення:а) Реакція Вагнера3 CH2 = CH2 + 2 КМn. О4+4 Н2 О →3 НО-СН2-СН2-ОН+ 2 КОН + 2 Мn. О2↓ етиленгліколь (етандіол) КМn. О4,(Н+), t0 Cб) СН3-CH = CH-СН3 + 4[О] → 2 СН3 СООН (оцтова кислота)2. Реакція горіння (з виділенням великої кількості теплоти)С2 Н4 + 3 O2 → 2 СО2↑ +2 Н2 О +QЯкісне визначення ненасичених вуглеводнів -знебарвлення розчину калій перманганату і бромної води. http://www.chemistry.ssu.samara.ru/chem2/index2.htm Хімічні властивості етилену2.6 Реакції окислення:а) Реакція Вагнера3 CH2 = CH2 + 2 КМn. О4+4 Н2 О →3 НО-СН2-СН2-ОН+ 2 КОН + 2 Мn. О2↓ етиленгліколь (етандіол) КМn. О4,(Н+), t0 Cб) СН3-CH = CH-СН3 + 4[О] → 2 СН3 СООН (оцтова кислота)2. Реакція горіння (з виділенням великої кількості теплоти)С2 Н4 + 3 O2 → 2 СО2↑ +2 Н2 О +QЯкісне визначення ненасичених вуглеводнів -знебарвлення розчину калій перманганату і бромної води. http://www.chemistry.ssu.samara.ru/chem2/index2.htm Хімічні властивості етилену2.6](/uploads/files/294366/161470/174103_images/33.jpg)






![г) гідрогенгалогенування - приєднання НСІ, НBr, тощоhttp://www.chemistry.ssu.samara.ru/chem1/flash/Ad. E.swf інтерактивна анімація. СН≡СН +НСІ→ СН2=СН-СІ +НСІ→ СН3-СНСІ2 д) Утворення ацетиленідів. http://www.chemistry.ssu.samara.ru/chem2/link_v9.htm СН≡СН + Na. NH2 →Na. Н≡СNa+NH3 СН≡СН + 2[Cu(NH3)2]OH → Cu. НС≡ССu+ 4 NH3 +2 H2 OHCCH+2[Ag(NH3)2]OH Ag. CCAg +4 NH3+2 H2 O 3.8 Натиснути на малюнок для перегляду відео г) гідрогенгалогенування - приєднання НСІ, НBr, тощоhttp://www.chemistry.ssu.samara.ru/chem1/flash/Ad. E.swf інтерактивна анімація. СН≡СН +НСІ→ СН2=СН-СІ +НСІ→ СН3-СНСІ2 д) Утворення ацетиленідів. http://www.chemistry.ssu.samara.ru/chem2/link_v9.htm СН≡СН + Na. NH2 →Na. Н≡СNa+NH3 СН≡СН + 2[Cu(NH3)2]OH → Cu. НС≡ССu+ 4 NH3 +2 H2 OHCCH+2[Ag(NH3)2]OH Ag. CCAg +4 NH3+2 H2 O 3.8 Натиснути на малюнок для перегляду відео](/uploads/files/294366/161470/174103_images/50.jpg)



![а) СН3-СН=СН2 + НСl ?б) СН2=СН-СН2-СН3 + НBr ?в) СН3-СН2-СН=СН2 + НОН ?г) СН2-CH2-CBr2- СН3 + KOH ? t0 С, кат. д) СH3- СH2- СH3 → ? е) HCCH+ [Ag(NH3)2]OH ? t 0 С, р є) СН3- Н + НО -NО2 → ? (Н+), t0 C ж) СН3-CH = CH-СН3 + КМn. О4 → ? t0 С, кат. з) СН≡ СН → ? Закінчіть рівняння реакцій4.4 а) СН3-СН=СН2 + НСl ?б) СН2=СН-СН2-СН3 + НBr ?в) СН3-СН2-СН=СН2 + НОН ?г) СН2-CH2-CBr2- СН3 + KOH ? t0 С, кат. д) СH3- СH2- СH3 → ? е) HCCH+ [Ag(NH3)2]OH ? t 0 С, р є) СН3- Н + НО -NО2 → ? (Н+), t0 C ж) СН3-CH = CH-СН3 + КМn. О4 → ? t0 С, кат. з) СН≡ СН → ? Закінчіть рівняння реакцій4.4](/uploads/files/294366/161470/174103_images/62.jpg)







































































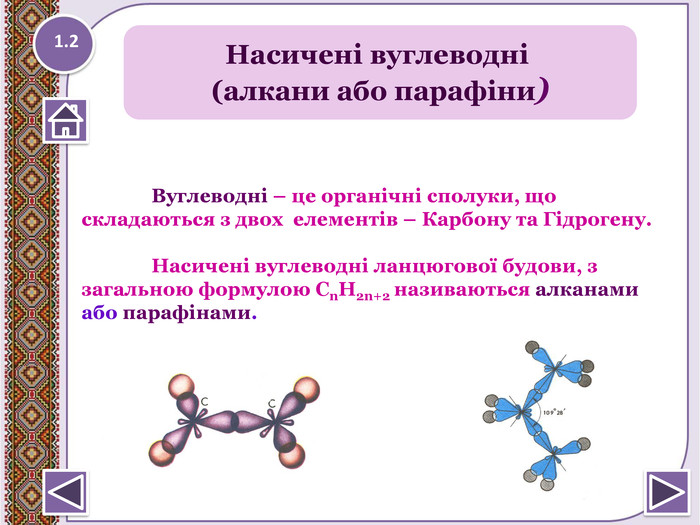
Теоретичні заглибинки: Насичені вуглеводні. Алкани:їх склад, будова, фізичні та хімічні властивості. Перевіримо свої знання: тест-контроль. Цікавинки. Розглянемо такі питання: Ненасичені вуглеводні. Алкени: їх склад, будова,фізичні та хімічні властивості. Ненасичені вуглеводні. Алкіни: їх склад, будова,фізичні та хімічні властивості.134625 Задачі з практичним змістом.
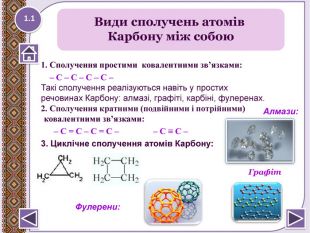
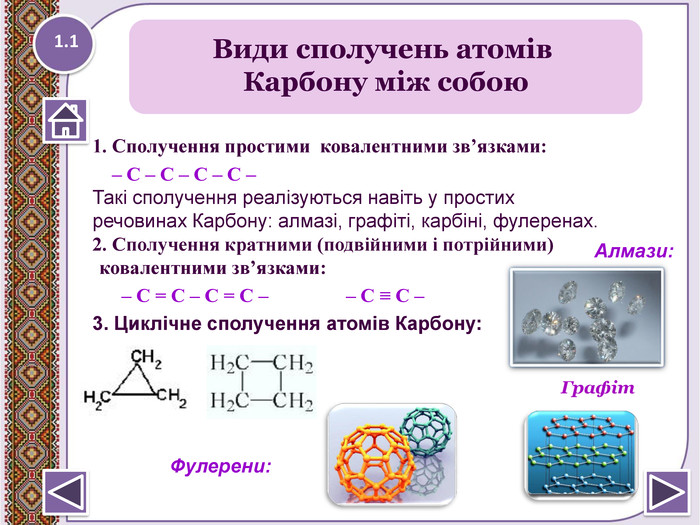
1. Сполучення простими ковалентними зв’язками: – С – С – С – С –Такі сполучення реалізуються навіть у простих речовинах Карбону: алмазі, графіті, карбіні, фулеренах.2. Сполучення кратними (подвійними і потрійними) ковалентними зв’язками: – С = С – С = С – – С ≡ С – 3. Циклічне сполучення атомів Карбону: Алмази: Фулерени: Види сполучень атомів Карбону між собою1.1 Графіт
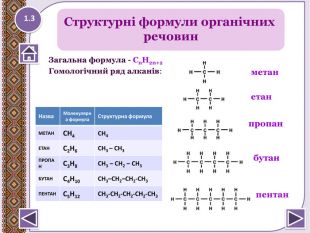
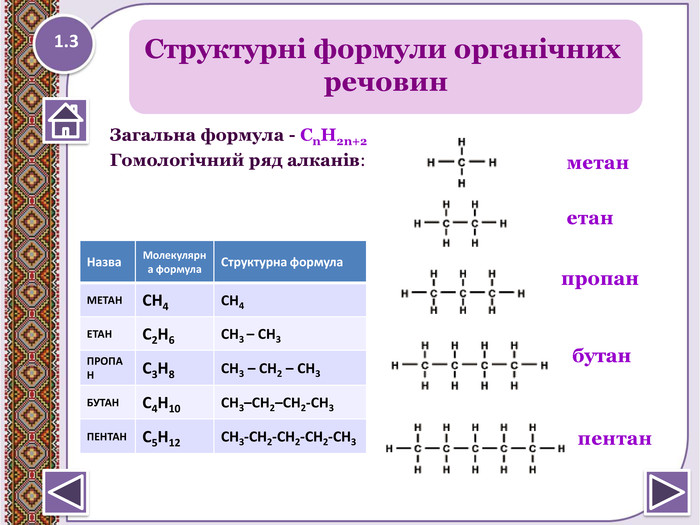
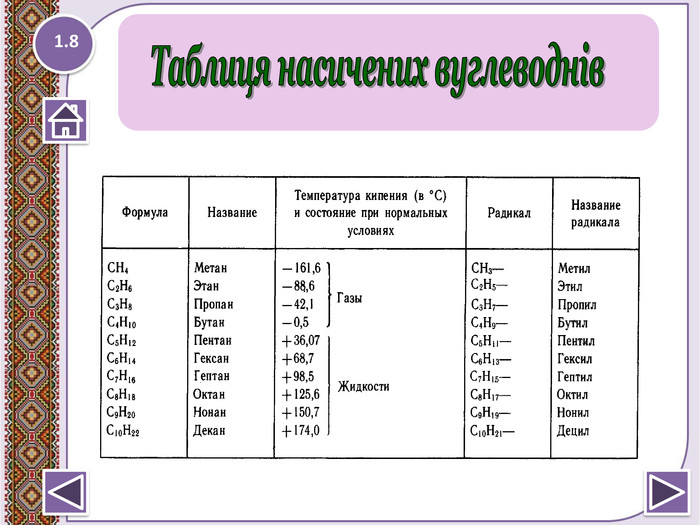
Загальна формула - Сn. H2n+2 Гомологічний ряд алканів: Назва. Молекулярна формула. Структурна формула. МЕТАНСН4 СН4 ЕТАНС2 Н6 СН3 – СН3 ПРОПАНС3 Н8 СН3 – СН2 – СН3 БУТАНС4 Н10 СН3–СН2–СН2-СН3 ПЕНТАНС5 Н12 СН3-СН2-СН2-СН2-СН3 метанетанпропанбутанпентан. Структурні формули органічних речовин1.3
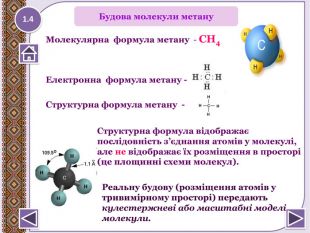
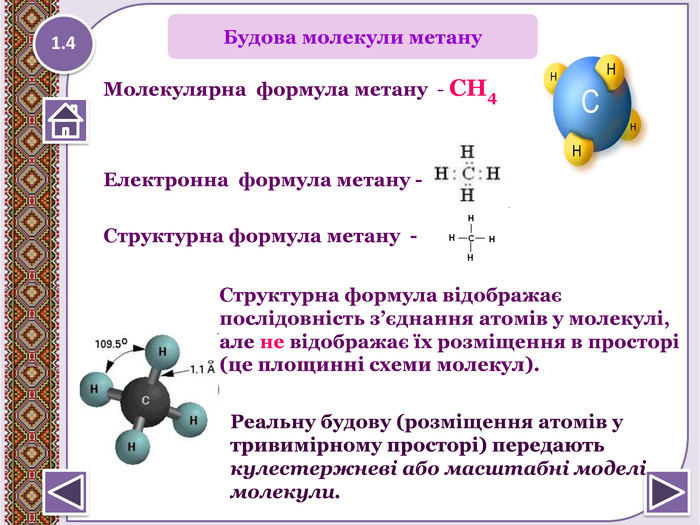
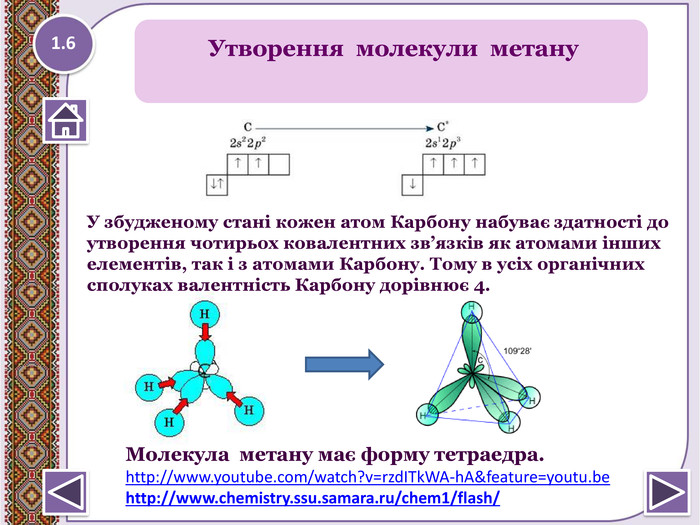
Молекулярна формула метану - СН4 Електронна формула метану - Структурна формула метану - 1.4 Структурна формула відображає послідовність з’єднання атомів у молекулі, але не відображає їх розміщення в просторі (це площинні схеми молекул). Реальну будову (розміщення атомів у тривимірному просторі) передають кулестержневі або масштабні моделі молекули. Будова молекули метануstyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.type
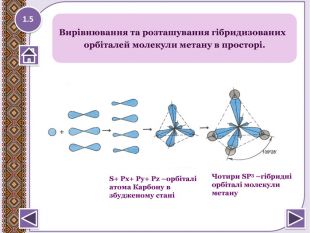
1.5 S+ Рх+ Ру+ Рz –орбіталі атома Карбону в збудженому станіЧотири SP3 –гібридні орбіталі молекули метану. Розташування гібридизованих орбіталей молекули метану в просторі. Вирівнювання та розташування гібридизованих орбіталей молекули метану в просторі.109028’style.colorfillcolorfill.type
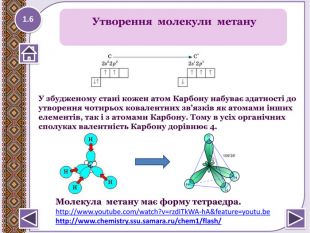
1.6 Молекула метану має форму тетраедра.http://www.youtube.com/watch?v=rzd. ITk. WA-h. A&feature=youtu.be http://www.chemistry.ssu.samara.ru/chem1/flash/ Утворення молекули метану. У збудженому стані кожен атом Карбону набуває здатності до утворення чотирьох ковалентних зв’язків як атомами інших елементів, так і з атомами Карбону. Тому в усіх органічнихсполуках валентність Карбону дорівнює 4.style.colorfillcolorfill.type
1.7 Горючий газ. Безбарвний. Без запаху та смаку Легший за повітря (Мr(СН4) = 16, Мr(пов) = 29)Майже не розчиняється у воді, але розчиняється в органічних розчинниках. tпл = -182,5°С tкип = -161,5°СПри охолодженні до -1620 С ( за нормального тиску) перетворюється на рідину. Фізичні властивості метану
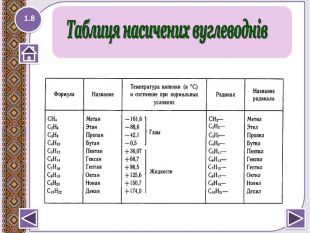
Температури плавлення і кипіння зростають зі збільшенням молекулярної маси та довжини головного вуглеродного ланцюга. За нормальних умов нерозгалуджені алкани від CH4 до C4 H10 — гази; від C5 H12 до C13 H28 — рідини; починаючи з C14 H30 і далі — тверді речовини. Температури плавлення і кипіння знижуються від менш розгалуджених до більш розгалуджених. Так, наприклад, при 20°C н-пентан — рідин, а неопентан — газ. Газоподібні алкани горять безбарвним або блідо-голубим полум’ям з виділенням великої кількості теплоти. Фізичні властивості алканів1.10
1.11 Алкани нерозчинні у воді, але розчиняються в органічних розчинниках. Алкани від С1– С4 - без запаху, а від. С5– С17 мають характерний “ бензиновий запах ”. Алкани - ізолятори (діелектрики). Алкани від С3 – С4 легко скраплюються. Суміш цих газів (балонний газ) використовується як паливо. Фізичні властивості алканів
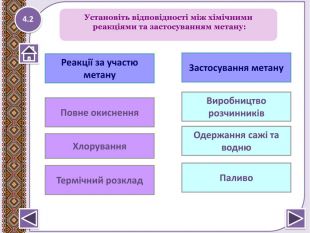
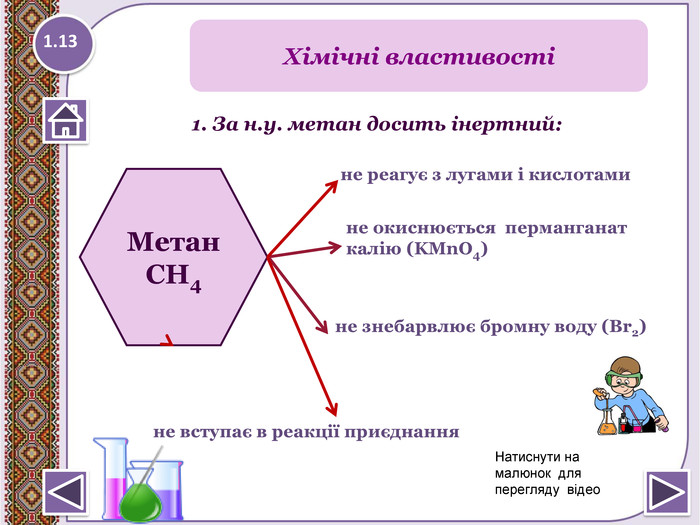
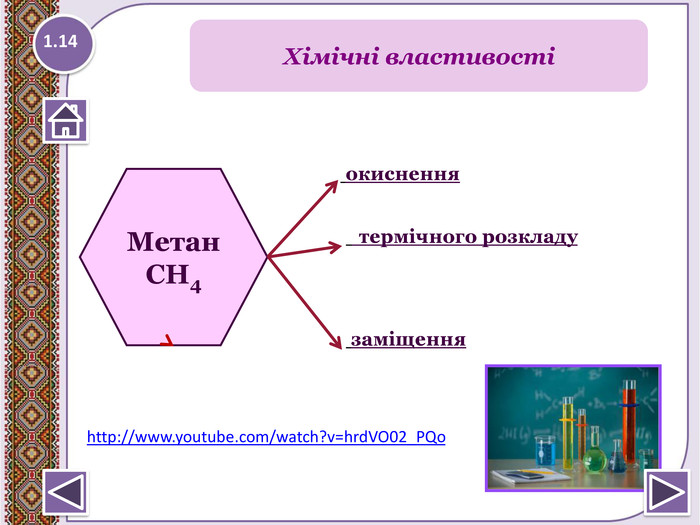
2. Горіння – повне окиснення. СН4 + 2 О2 → СО2↑ + 2 Н2 О +Q; ∆Н = 890 к. Дж/моль. У разі нестачі кисню метан окиснюється неповністю.І тоді замість карбон (ІУ) оксиду СО2 утворюєтьсякарбон (ІІ) оксид СО, відомий як чадний газ.2 СН4 + 3 О2 → 2 СО↑ + 4 Н2 О Запамятай! Суміш СН4 і О2 дуже вибухонебезпечна. Спричинюєаварії в шахтах, може статися вибух вприміщенні. Хімічні властивості1.15
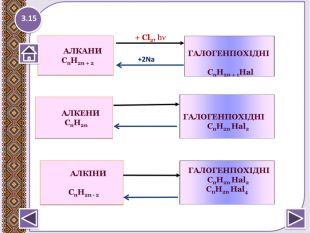
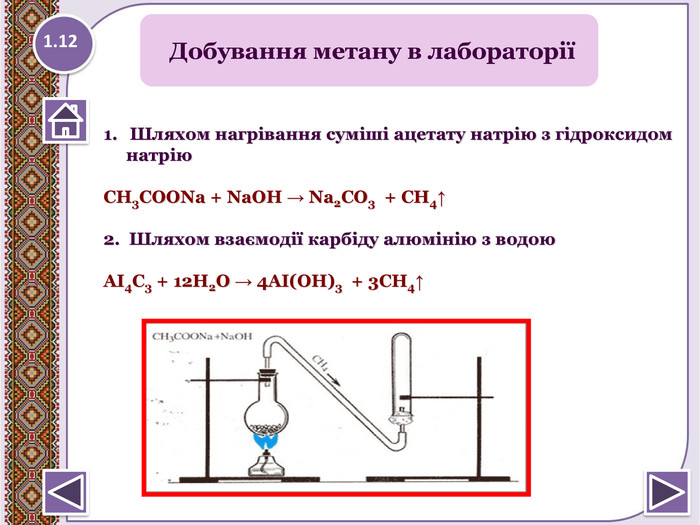
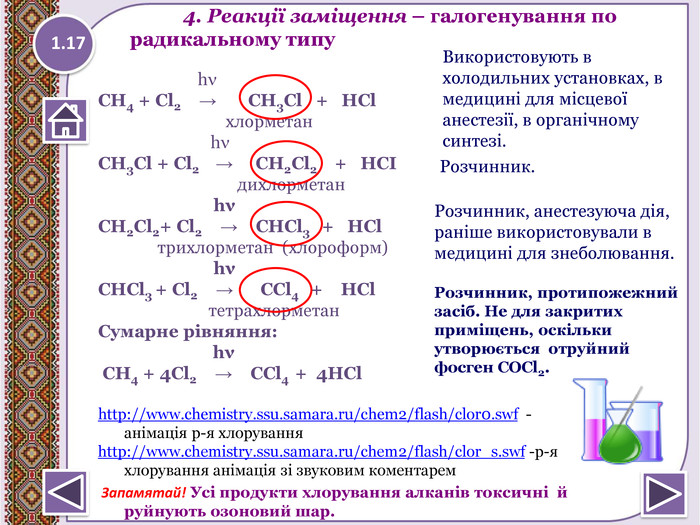
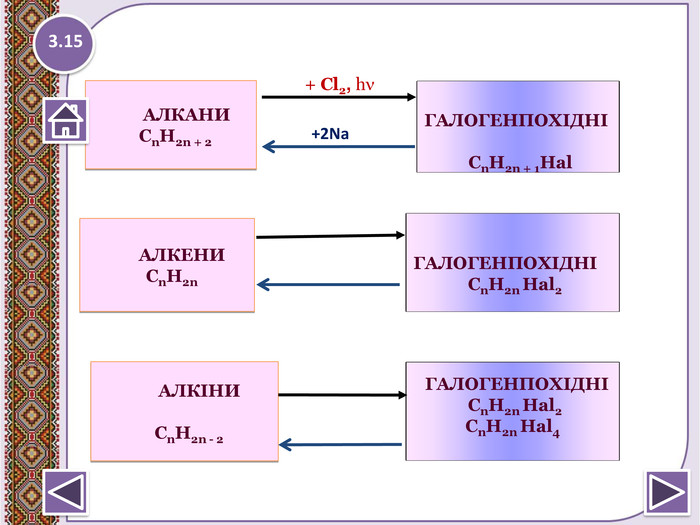
4. Реакції заміщення – галогенування по радикальному типу 1.17 hνСН4 + Cl2 → CH3 Cl + HCl хлорметан hνCH3 Cl + Cl2 → CH2 Cl2 + HCІ дихлорметан hνCH2 Cl2+ Cl2 → CHCl3 + HCl трихлорметан (хлороформ) hνCHCl3 + Cl2 → CCl4 + HCl тетрахлорметан Сумарне рівняння: hν СН4 + 4 Cl2 → CCl4 + 4 HClhttp://www.chemistry.ssu.samara.ru/chem2/flash/clor0.swf -анімація р-я хлоруванняhttp://www.chemistry.ssu.samara.ru/chem2/flash/clor_s.swf -р-я хлорування анімація зі звуковим коментарем Запамятай! Усі продукти хлорування алканів токсичні й руйнують озоновий шар. Використовують в холодильних установках, в медицині для місцевої анестезії, в органічному синтезі. Розчинник. Розчинник, анестезуюча дія, раніше використовували в медицині для знеболювання. Розчинник, протипожежний засіб. Не для закритих приміщень, оскільки утворюється отруйний фосген СОСl2.
Метан входить до складу природного газу (98%), є важливим компонентом попутного нафтового газу.Є головною складовою газів, що виділяються під час сухої перегонки деревини, торфу, кам’яного вугілля.Є в складі копального газу міститься у кам'яно-вугільних шахтах ( рудниковий газ). Утворюється внаслідок анаеробного бродіння рослинних та тваринних решток у болотах (болотний газ).1.19 Поширення метану в природі
Присутній у газах грязьових вулканів (понад 95 %). Розчинений у водах океанів, морів, озер. Метан виявлено в атмосфері планет Земля, Юпітер, Сатурн, Уран, Нептун та в газах поверхневого ґрунту Місяця. Величезні озера рідкого метану є на поверхні Титана, найбільшого з природних супутників Сатурна. http://www.expres.ua/tech/2013/09/25/94279-sklasty-konkurenciyu-nasa-poshuku-zhyttya-marsi-vyrishyla-indiya1.20
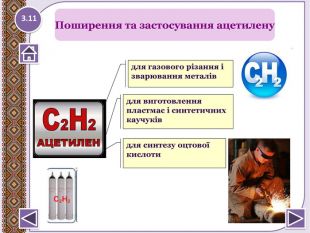
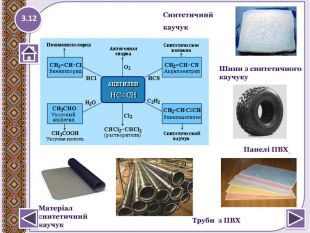
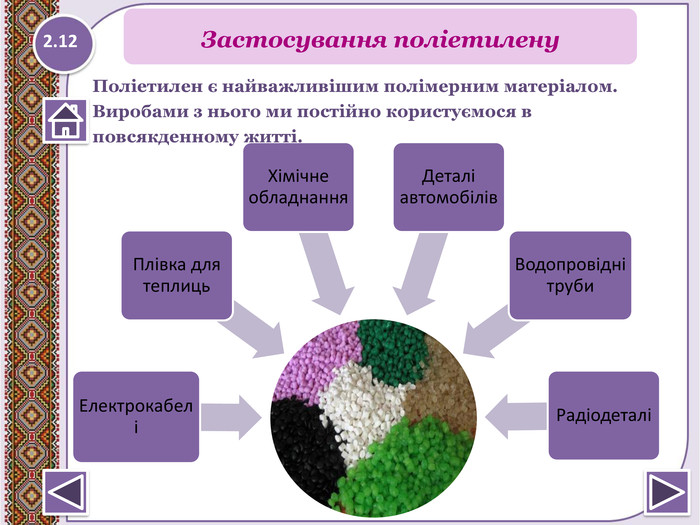
Застосування метануопалювання житлових будинків;як паливо для автотранпорту, електростанцій;як сировину в хімічній промисловості для здобуття різних органічних речовин, наприклад пластмас; З нього добувають:сажу для виготовлення друкарської фарби і гуми;водень для синтезу амоніаку;1.21 NH3 Застосування метану
хлоретан – в медицині для швидкого охолодження шкіри та м’язів при вивихах та розтягах;парафін (С18 – С35) – використовує ться в медицині (парафінотерапія);вазелінова олія (до С25) - використовують у медицині, парфумерії, косметології;вазелін (до С25) - у медицині для виготовлення мазей;спрей-заморозку «Doc Sprt» використовують для швидкого охолодження шкіри і м’язів при вивихах і розтягненнях. Містить зріджені пропан і бутан.1.22 NH3 Застосування алканів
2 Ненасичені вуглеводні – органічні сполуки, що мають кратні зв’язки між атомами Карбону (подвійні – С = С – або потрійні – С ≡ С – )Етиленові вуглеводні - органічні сполуки, що мають один подвійний зв’язок (1-σ и 1-π ) між атомами Карбону. Загальна формула - Сn. H2n С2 Н4 - етен (етилен)С3 Н6 - пропен. С4 Н8 - бутен. Ненасичені вуглеводні (алкени та алкіни )http://www.youtube.com/watch?feature=player_detailpage&v=S1j2 H06v. Zt. Q http://www.chemistry.ssu.samara.ru/chem1/flash/
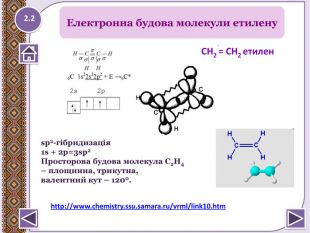
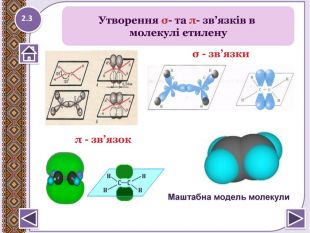
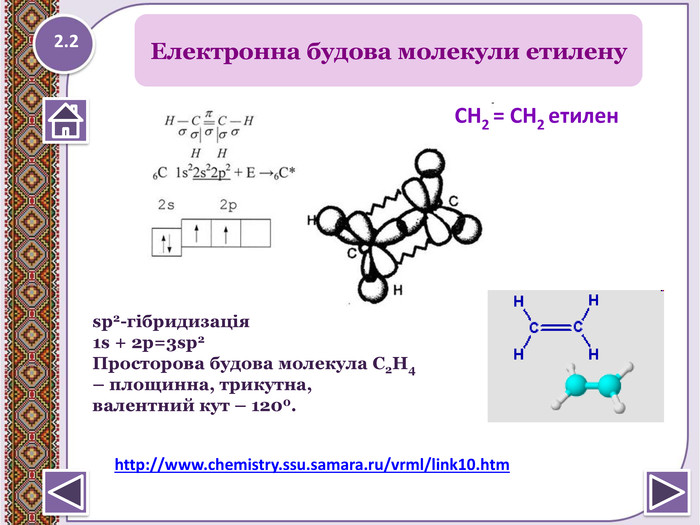
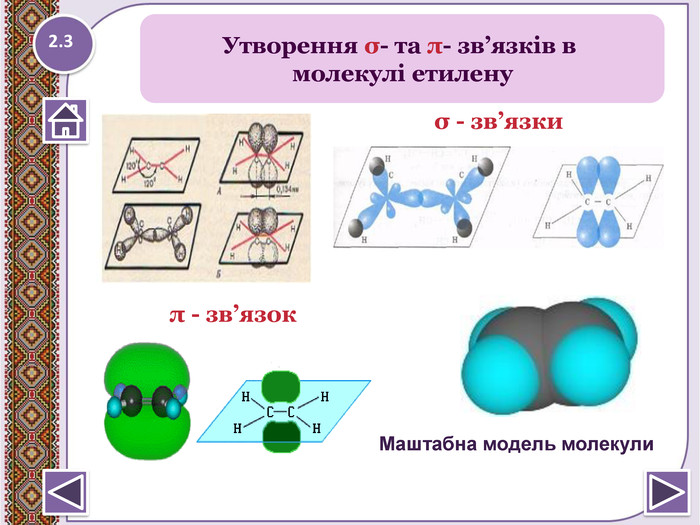
Кожна молекула алкенів містить два атоми Карбону вsp2- гібридизації. Це другий валентний стан Карбону.1s + 2p = 3sp2- гібридизовані орбіталі утворюють σ-зв’язкипід кутом 120о . Негібридизовані р - електрони утворюють π- зв’язок, якийрозташовується перпендикулярно площини молекули. π-зв’язок дуже неміцний і легко поляризується. LC=C=0,134 нм. Будова етилену (етену)1.212.1
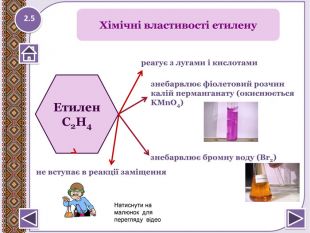
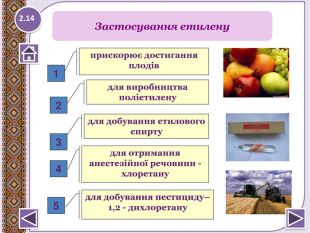
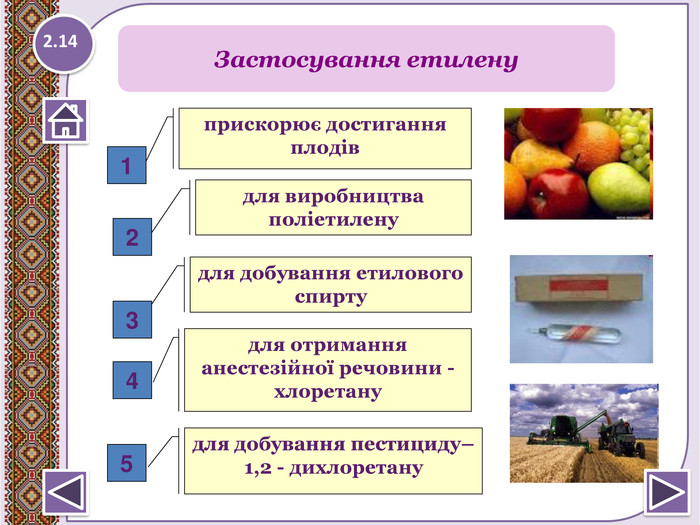
Фізичні властивості етилену безбарвний горючий газ; дуже слабким солодкуватим запахом; трохи легший за повітря; малорозчинний у воді (25,6мл в 100мл води при 00 С), етанолі (359мл при 00 С); добре розчинний в органічних розчинниках; tплав = - 169,2 ̊С; tкип = - 103,7 ̊С; вибухонебезпечний; має властивості фітогормонів- сповільнює ріст, прискорює старіння клітин, дозрівання та опадання плодів; слабкий інгаляційний анестетик.2.4
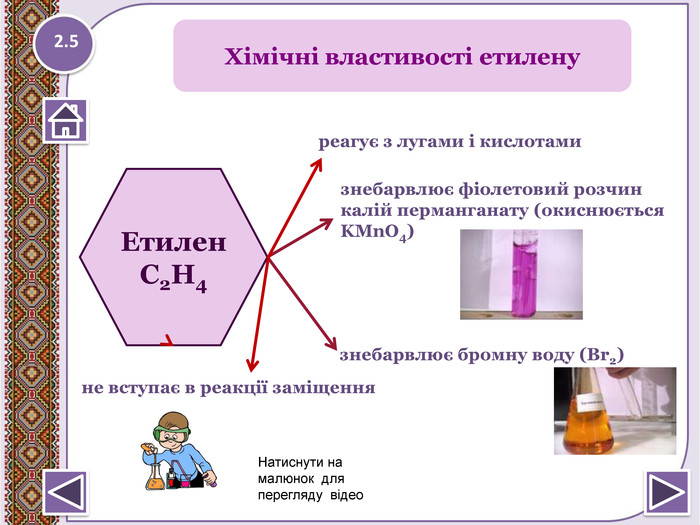
Реакції окислення:а) Реакція Вагнера3 CH2 = CH2 + 2 КМn. О4+4 Н2 О →3 НО-СН2-СН2-ОН+ 2 КОН + 2 Мn. О2↓ етиленгліколь (етандіол) КМn. О4,(Н+), t0 Cб) СН3-CH = CH-СН3 + 4[О] → 2 СН3 СООН (оцтова кислота)2. Реакція горіння (з виділенням великої кількості теплоти)С2 Н4 + 3 O2 → 2 СО2↑ +2 Н2 О +QЯкісне визначення ненасичених вуглеводнів -знебарвлення розчину калій перманганату і бромної води. http://www.chemistry.ssu.samara.ru/chem2/index2.htm Хімічні властивості етилену2.6
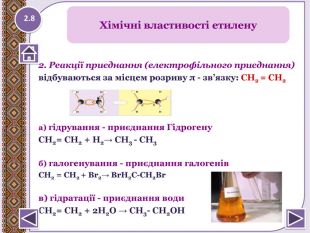
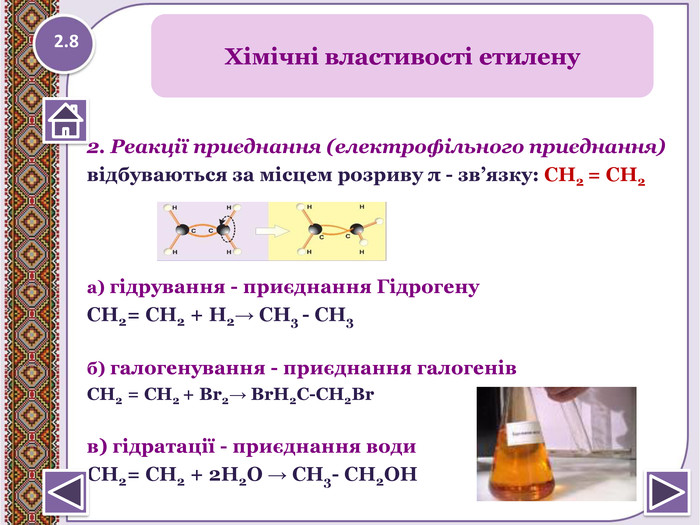
2. Реакції приєднання (електрофільного приєднання)відбуваються за місцем розриву π - зв’язку: СН2 = СН2 а) гідрування - приєднання Гідрогену. СН2= СН2 + Н2→ СН3 - СН3 б) галогенування - приєднання галогенів. CH2 = CH2 + Br2→ Br. H2 C-CH2 Brв) гідратації - приєднання води СН2= СН2 + 2 Н2 О → СН3- СН2 ОНХімічні властивості етилену2.8
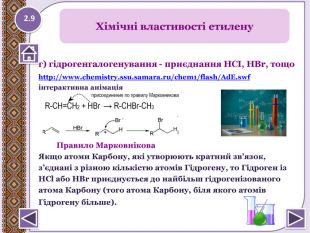
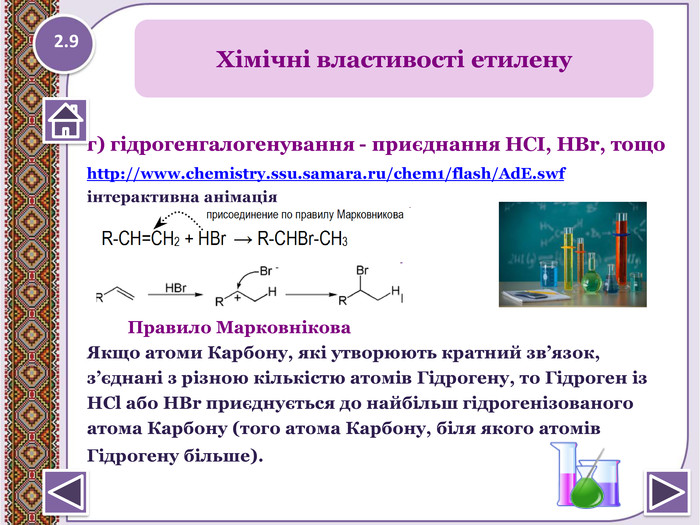
г) гідрогенгалогенування - приєднання НСІ, НBr, тощоhttp://www.chemistry.ssu.samara.ru/chem1/flash/Ad. E.swf інтерактивна анімація Правило Марковнікова Якщо атоми Карбону, які утворюють кратний зв’язок,з’єднані з різною кількістю атомів Гідрогену, то Гідроген із. НСl або НВr приєднується до найбільш гідрогенізованогоатома Карбону (того атома Карбону, біля якого атомів. Гідрогену більше). полімеризація - n. СН2= СН2 → (-СН2- СН2-)n. Хімічні властивості етилену2.9
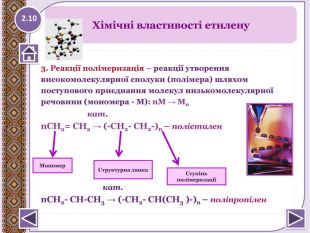
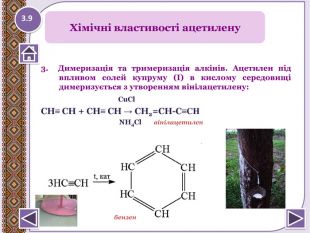
3. Реакції полімеризація – реакції утвореннявисокомолекулярної сполуки (полімера) шляхомпоступового приєднання молекул низькомолекулярноїречовини (мономера - М): n. М → Мn кат.n. СН2= СН2 → (-СН2- СН2-)n – поліетилен кат.n. СН2- СН-СН3 → (-СН2- СН(СН3 )-)n – поліпропілен. Хімічні властивості етилену. Структурна ланка. Ступінь полімеризаціїМономер 2.10
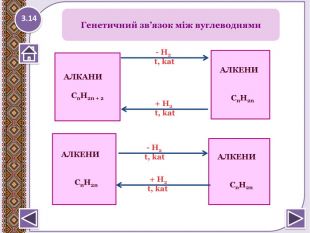
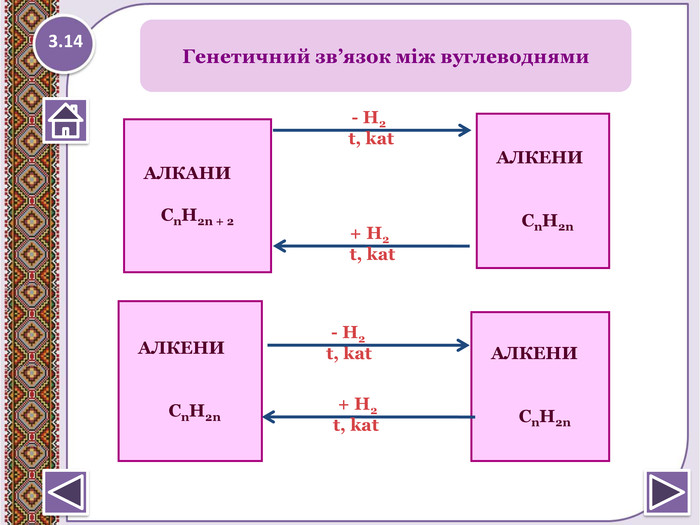
Крекінг алканів. Сn. H2n+2→ Сm. H2m + Сp. H2p+2, де m+p=n, наприклад. С7 H16 → СН3-СН=СН2 + С4 H10 Дегідрогалонуванням галогеналканів при дії спиртовогорозчину лугу СH3- СHBr- СH3 + КОН/спирт → СH3- СH=СH2 + НBr + H2 О Дегідратація спритів при підвищеній температурі (>1400 С) в присутності водозабираючих реагентів H2 SO4 СH3- СH2- СH2 ОН → СH3- СH=СH2 + H2 О Дегалогенуванням дигалогеналканів, що мають атомигалогену у сосідніх атомів Карбону, при дії активних металів. СH3- СHBr- СH2 Br + Mg → СH3- СH=СH2 + Mg. Br2 Дегідруванням алканів при 500°С: Сr2 O3 СH3- СH2- СH3 → СH3- СH=СH2 + H2 ↑У природі етилен не зустрічається у вільному стані черезвисоку активність молекул. Етилен утворюється під часпереробки нафти. Отримання алкенів2.13
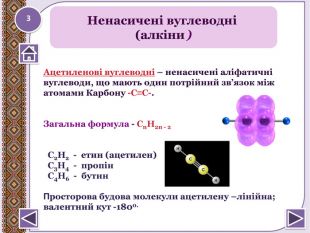
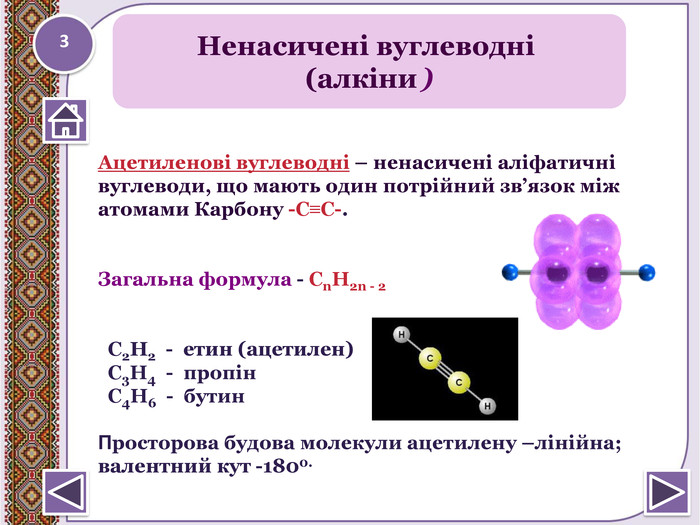
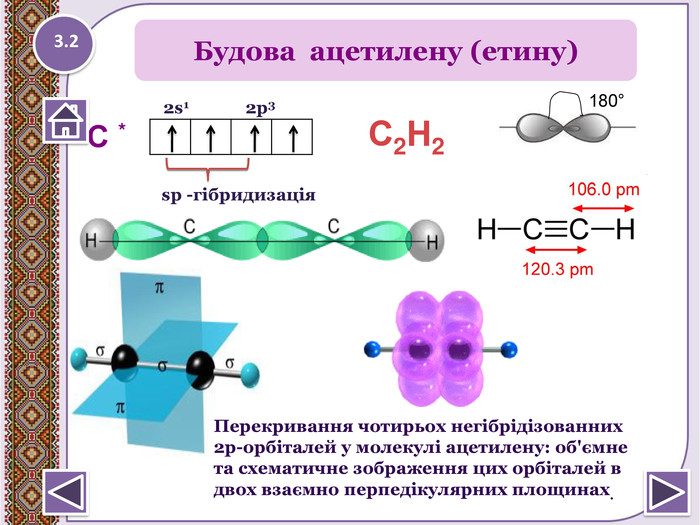
Ацетиленові вуглеводні – ненасичені аліфатичні вуглеводи, що мають один потрійний зв’язок між атомами Карбону -С≡С-. Загальна формула - Сn. H2n - 2 С2 Н2 - етин (ацетилен) С3 Н4 - пропін С4 Н6 - бутин. Просторова будова молекули ацетилену –лінійна;валентний кут -1800. Ненасичені вуглеводні (алкіни )3
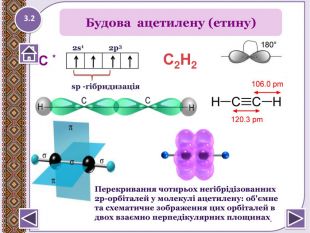
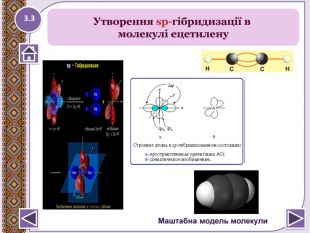
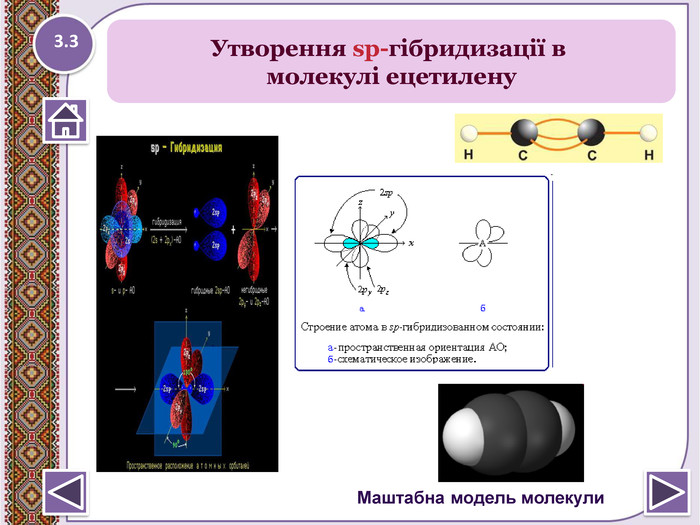
Потрійний зв’язок C≡C здійснюють 6 спільних електрони. В утворенні такого зв’язку приймають участь атоми. Карбону в sp- гібридизованому стані. Кожен з них має подві sp- гібридизовані орбіталі напрвлені одна до одної підкутом 180о і дві негібридизовані р-орбіталі, розміщені підкутом 900 відносно одна одної і гібридизованих орбіталей. Електронна будова молекули ацетиленуhttp://www.chemistry.ssu.samara.ru/vrml/link10.htmhttp://www.chemistry.ssu.samara.ru/chem1/flash/ 3.1
Фізичні властивостібезбарвний газ;майже без запаху;помірно розчинний у воді (1150 мл в 1 л води при 15° С та атм. тиску);добре розчинний органічних розчинниках, особливо в ацетоні;при сильному охолодженні відразу переходить в білу кристалічну речовину, минаючи рідкий стан; при стисненні розкладається з вибухом (зберігають в балонах, заповнених активованим вугіллям, що просочене ацетоном, в якому ацетилен розчиняється під тиском в великих кількостях)tкип = - 84 ̊С; легший за повітря;вибухонебезпечний. Фізичні властивості ацетилену3.4
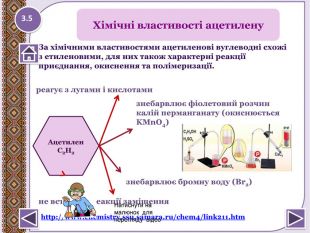
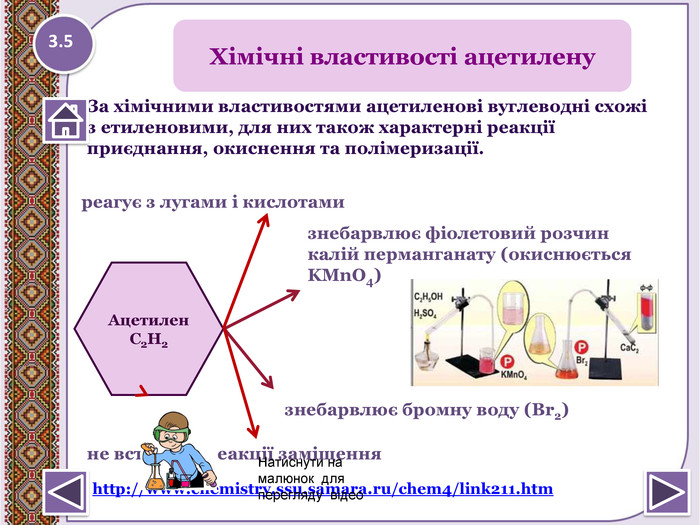
не вступає в реакції заміщення. Ацетилен С2 Н2реагує з лугами і кислотами. Хімічні властивості ацетиленузнебарвлює фіолетовий розчин калій перманганату (окиснюється KMn. O4) знебарвлює бромну воду (Вr2)3.5 За хімічними властивостями ацетиленові вуглеводні схожі з етиленовими, для них також характерні реакціїприєднання, окиснення та полімеризації.http://www.chemistry.ssu.samara.ru/chem4/link211.htm Натиснути на малюнок для перегляду відео
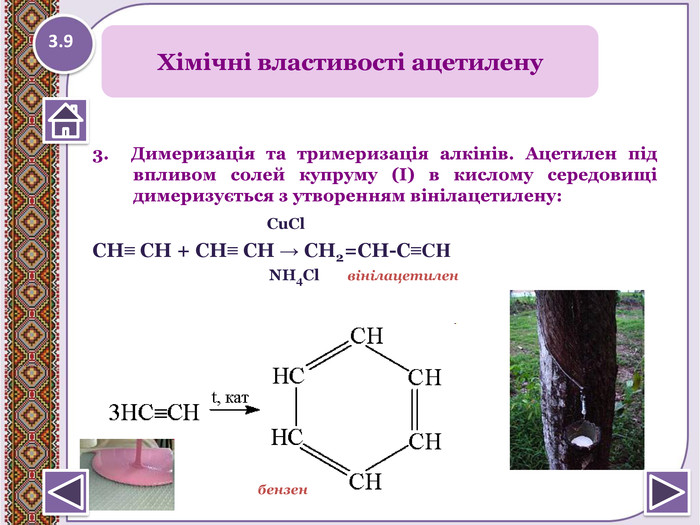
Реакції окислення:1. 3 CH ≡ CH + 8 КМn. О4+ 4 Н2 О → НОО-С-С-ООН + 8 КОН + 8 Мn. О2↓ щавлева кислота 2. Реакція горіння (з виділенням великої кількості теплоти)С2 Н2 горить яскравим полум’ям з виділенням копоті, так як вмолекулі ацетилену масова частка Карбону більша, ніж в молекулі етилену.2 С2 Н2 + 5 O2 → 4 СО2↑ +2 Н2 О +QЯкісне визначення ненасичених вуглеводнів -знебарвлення розчину калій перманганату і бромної води http://www.chemistry.ssu.samara.ru/chem2/index2.htm 3.6 Натиснути на малюнок для перегляду відеоppt_xxshearppt_xppt_xxshearppt_xppt_xxshearppt_xppt_xxshearppt_xppt_xxshearppt_xppt_xxshearppt_xppt_xxshearppt_xppt_xxshearppt_xppt_xxshearppt_xppt_xxshearppt_x
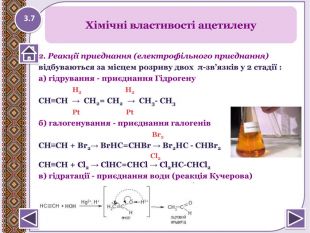
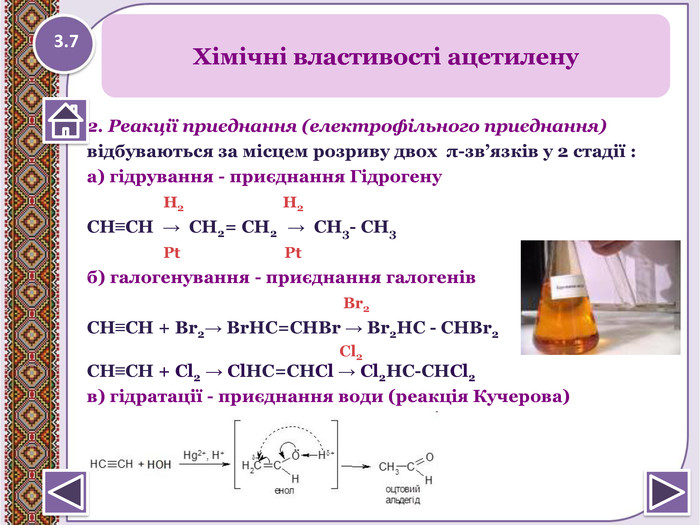
2. Реакції приєднання (електрофільного приєднання)відбуваються за місцем розриву двох π-зв’язків у 2 стадії :а) гідрування - приєднання Гідрогену Н2 Н2 СН≡СН → СН2= СН2 → СН3- СН3 Pt Ptб) галогенування - приєднання галогенів Br2 СН≡СН + Br2→ Br. HC=CHBr → Br2 НC - CНBr2 Cl2 СН≡СН + Cl2 → Cl. HC=CHCl → Cl2 HC-CHCl2 в) гідратації - приєднання води (реакція Кучерова)Хімічні властивості ацетилену3.7
г) гідрогенгалогенування - приєднання НСІ, НBr, тощоhttp://www.chemistry.ssu.samara.ru/chem1/flash/Ad. E.swf інтерактивна анімація. СН≡СН +НСІ→ СН2=СН-СІ +НСІ→ СН3-СНСІ2 д) Утворення ацетиленідів. http://www.chemistry.ssu.samara.ru/chem2/link_v9.htm СН≡СН + Na. NH2 →Na. Н≡СNa+NH3 СН≡СН + 2[Cu(NH3)2]OH → Cu. НС≡ССu+ 4 NH3 +2 H2 OHCCH+2[Ag(NH3)2]OH Ag. CCAg +4 NH3+2 H2 O 3.8 Натиснути на малюнок для перегляду відео
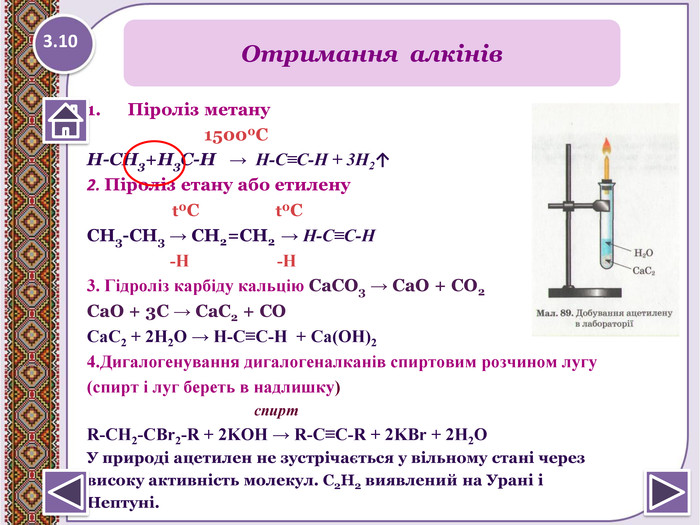
Піроліз метану 15000 СН-СН3+Н3 С-Н → Н-С≡С-Н + 3 Н2↑2. Піроліз етану або етилену t0 С t0 ССН3-СН3 → СН2=СН2 → Н-С≡С-Н -H -H3. Гідроліз карбіду кальцію Са. СО3 → Са. О + СО2 Са. О + 3 С → Са. С2 + СОCa. C2 + 2 H2 O → Н-С≡С-Н + Ca(OH)24. Дигалогенування дигалогеналканів спиртовим розчином лугу(спирт і луг береть в надлишку) спирт. R-CH2-CBr2-R + 2 KOH → R-C≡C-R + 2 KBr + 2 H2 O У природі ацетилен не зустрічається у вільному стані черезвисоку активність молекул. C2 Н2 виявлений на Урані іНептуні. Отримання алкінів3.10
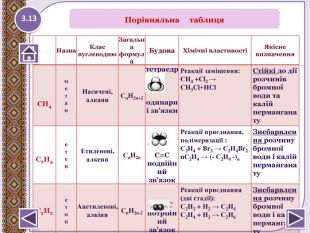
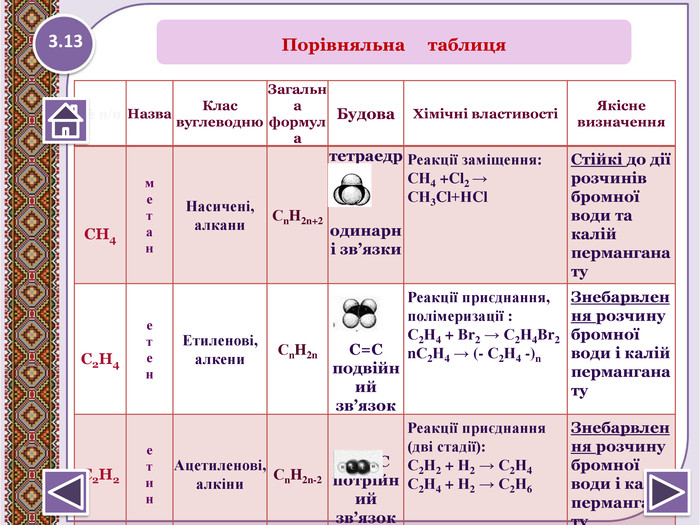
№ п/п. Назва. Клас вуглеводню. Загальна формула. Будова. Хімічні властивостіЯкісне визначення. СН4метан. Насичені,алкани. Сn. H2n+2 тетраедродинарні зв’язки. Реакції заміщення: СН4 +Cl2 →СН3 Cl+НCl. Стійкі до дії розчинів бромної води та калій перманганату. С2 Н4 етен. Етиленові,алкени. Сn. H2n С=Сподвійний зв’язок. Реакції приєднання, полімеризації : С2 Н4 + Br2 → С2 Н4 Br2 n. С2 Н4 → (- С2 Н4 -)n Знебарвлення розчину бромної води і калій перманганату. С2 Н2етин. Ацетиленові,алкіни. Сn. H2n-2 С ≡ С потрійнийзв’язок. Реакції приєднання (дві стадії): С2 Н2 + Н2 → С2 Н4 С2 Н4 + Н2 → С2 Н6 Знебарвлення розчину бромної води і калій перманганату. Порівняльна таблиця3.13
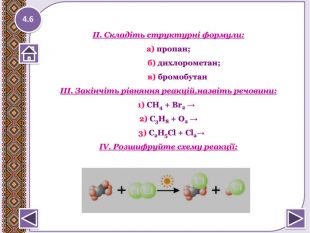
а) СН3-СН=СН2 + НСl ?б) СН2=СН-СН2-СН3 + НBr ?в) СН3-СН2-СН=СН2 + НОН ?г) СН2-CH2-CBr2- СН3 + KOH ? t0 С, кат. д) СH3- СH2- СH3 → ? е) HCCH+ [Ag(NH3)2]OH ? t 0 С, р є) СН3- Н + НО -NО2 → ? (Н+), t0 C ж) СН3-CH = CH-СН3 + КМn. О4 → ? t0 С, кат. з) СН≡ СН → ? Закінчіть рівняння реакцій4.4
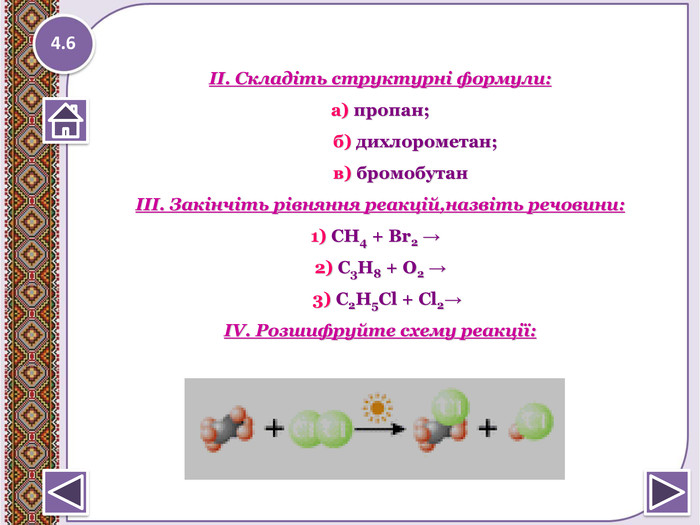
I. Виконайте тестові завдання:1. Вкажіть хімічну формулу болотного газу: а) СО; б) СО2; в) СН4; г) С2 Н62. Молекулярна формула пропану: а) С3 Н6; б) С3 Н8; в) С2 Н6; г) СН43. До якого типу реакцій відноситься реакція хлору з метаном? а) обміну; б) заміщення; в) приєднання; г) розкладу4. Яка формула дихлорметану? а) СН2 Сl2; б ) С2 Н2 Сl2; в) С2 Н3 Сl2; г) С2 Н4 Сl25. Серед запропонованих речовин виберіть гомологи етану: а) С2 Н6; б) С4 Н8; в) С5 Н12; г) С3 Н66. Насичені вуглеводні вступають у реакції: а) приєднання; б) заміщення з галогенами; в) термічного розкладу; г) окиснення калій перманганатом7. Вкажіть галузі застосування метану: а) паливо; б) виготовлення поліетилену; в) добування синтез - газу; г) виробництво етилового спирту. Картка для роботи в групі4.5style.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.type
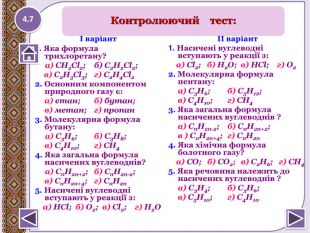
І варіант1. Яка формула трихлоретану? а) СН2 Сl2; б) С2 Н2 Сl2; в) С2 Н3 Сl3; г) С2 Н4 Сl22. Основним компонентом природного газу є: а) етан; б) бутан; в) метан; г) пропан3. Молекулярна формула бутану: а) С3 Н6; б) С3 Н8; в) С4 Н10; г) СН44. Яка загальна формула насичених вуглеводнів? а) Сn. H2n+2; б) Сn. H2n-2; в) Сn. H2n+4; г) Сn. H2n 5. Насичені вуглеводні вступають у реакції з: a) HCl; б) O2; в) Cl2; г) H2 OІІ варіант1. Насичені вуглеводні вступають у реакції з: а) Cl2; б) H2 O; в) HCl; г) O2 2. Молекулярна формула пентану: а) С3 Н6; б) С5 Н12; в) С4 Н10; г) СН43. Яка загальна формула насичених вуглеводнів ? a) Сn. H2n-2; б) Сn. H2n+2; в ) Сn. H2n+4; г) Сn. H2n 4. Яка хімічна формула болотного газу? а) СО; б) СО2; в) С2 Н6; г) СН45. Яка речовина належить до насичених вуглеводнів ? a) С3 Н4; б) С3 Н6; в) С5 Н10; г) С4 Н10 Контролюючий тест:4.7
Поставте кількість балів,що відповідає рівню Ваших знань:1. Усна відповідь (1 бал) ___2. Робота в групі (справився сам – 2 бали, з допомогою групи - 1 бал, не справився – 0 балів): Відповіді на тести (0 -2 бали) ___ Складання формул речовин (0 – 2 бали)___ Складання рівнянь реакцій (0– 2 бали)___3. Контролюючий тест ( 5 балів ) ___ Загальна кількість балів за урок ____ КАРТКА САМООЦІНКИ4.8
Тест 1. Установіть відповідності :1. СН3-СН2-СН3 а) пентадіен-1,42. СН2=С=СН2 б) пропан3. СН3-СН2-СН=СН2 в) пропадіен4. СН2=СН-СН2-СН=СН2 г) бутен-12. Оскільки вуглеводні горять, то їх можна використовувати як:а) мастило для змазування;б) паливо;в) розчинники;г) харчові добавки.3. Суміш яких вуглеводнів використовується як побутовий газ в газових плитах:а) Метан і бутан;б) Пропан і бутан;в) Етан і пропан;г) Гептен і пентан;д) Пропін і пропан. 4.9
4. Який вуглеводень зайвий в поданому переліку речовин? а) Пентадієн-1,3 б) Гексадієн-1,4 в) Гептадієн-2,4 г) Бутадієн-1,3 д) Нонадієн-3,55. Який вуглеводень не піддається гідруванню?а) Пентен-2б) 2-метилгексанв) Пропадієнг) Бутин-26. Яке визначення є вірним?а) В молекулі пропена є потрійний зв’язок.б) Пентадієн містить два π- зв’язки?в) 3-метилпентен-2 - це вуглеводень, що має розгалуджену будову. г) Пропен не гідрується.д) Бутин-2 – это насичений вуглеводень.7. Складіть рівняння гідратації бутена-1.8. Знайдіть характеристики, що підходять вуглеводню – пентину-2:а) Це ненасичений вуглеводень.4.10
б) Він легко реагує з розчинами галогенів.в) Він не піддається горінню.г) В його молекулі є два π-зв’язки.д) Він належить до класу алкенів.е) Він може гідруватися з утворенням алкана.є) Він має розгалуджену будову.9. Знайдіть помилки в тексті. В молекулах ненасичених вуглеводнів є лише одинарні зв’язки. В молекулах алкенів є кратний потрійний зв’язок. Алкандієни можуть гідрогалогенуватися з утворенням дигалогенпохідних алкенів. Алкіни мають таку ж загальну молекулярну формулу, як і алкени. Етилен – це найлегший алкін. В молекулі ацетилену є подвійний зв’язок. Ненасичені вуглеводні отримують за реакцією гідрування алканов. 4.11
1. Гомологічний ряд насичених вуглеводнів називається:а) алкіни; б) алкени; в) алкани. 2. У будові етиленових вуглеводнів між атомами Карбону розміщений:а) один подвійний зв’язок; б) два подвійних зв’язки;в) один потрійний зв’язок.3. Для ацетиленових вуглеводнів характерний тип гібридизації атомних орбіталей Карбону:а) sp3 – гібридизація;б) sp2 – гібридизація;в) sp – гібридизація.4. Для ненасичених вуглеводнів характерні реакції:а) заміщення;б) приєднання; в) заміщення і приєднання. Картка № 14.12
5. Загальна формула алканів:а) Сn. H2n; б) Сn. H2n-2; в) Сn. H2n+2 6. Виберіть структурну формулу бутину:а) СН3 – СН2 – СН2 – СН3 б) СН2 = СН – СН2 – СН3в) СН ≡ С – СН2 – СН3 7. Виберіть реакцію заміщення:а) СН4 + 2 О2 → СО2 +2 Н2 Об) С2 Н2 + Н2 → С2 Н4в) СН4 + Cl2 → СН3 Cl + НClг) С2 Н4 + НCl → СН3 – СН2 Cl8. Якісною реакцією на ненасичені вуглеводні є реакція:а) знебарвлення розчину калій перманганату;б) знебарвлення бромної води;в) знебарвлення розчину калій перманганату і бромної води.4.13
Органічні речовини, що складаються тільки з двох елементів - Карбону і Гідрогену називаються:а) вуглеводи; б) вуглеводні; в) аміни.2. Хімічна формула метану:а) СН4; б) С2 Н4; в) С2 Н2. 3. У складі алкінів наявні:а) 2 π – зв’язки; б) 1 π – зв’язок; в) σ-зв’язок. 4. Як якісно відрізнити ацетилен від пропану:а) за здатністю горіти безбарвним полум’ям;б) за здатністю утворювати вибухонебезпечні суміші з повітрям;в) за здатністю знебарвлювати розчин перманганату калію5. Виберіть формули алкенів:а) С2 Н4 б) С4 Н10 в) С2 Н2 г) С3 Н6 д) С5 Н12 Картка № 24.14
6. Отримати із алкенів насичені вуглеводні можна реакцією:а) гідрування;б) дегідрування;в) гідратації.7. Загальна формула насичених вуглеводнів:а) Сn. Н2n б) Сn. Н2n+2 в) Сn. Н2n-28. Виберіть структурну формулу пентену:а) СН3 – С ≡ С – СН2 – СН3б) СН3 – СН = СН – СН2 – СН3в) СН3 – СН2 – СН2 – СН2 – СН39. Виберіть реакцію горіння:а) СН4 + 2 О2 → СО2 +2 Н2 Об) С2 Н2 + Н2 → С2 Н4в) СН4 + Cl2 → СН3 Cl + НClг) С2 Н4 + НCl → СН3 – СН2 Cl4.15
1. Валентність Карбону в органічних сполуках: а) IV б) II в) III г) II або IV 2. Один з рядів вуглеводнів, що має загальну формулу. Сn. Н2n, називається:а) насичені вуглеводні; б) етиленові вуглеводні;в) ацетиленові вуглеводні.3. Для насичених вуглеводнів характерний тип гібридизації атомних орбіталей Карбону:а) sp2 – гібридизація; б) sp3 – гібридизація;в) sp – гібридизація.4. Назвіть продукти горіння метану:а) чадний газ і водень;б) вуглекислий газ і вода;в) вуглекислий газ і водень. Картка № 34.16
5. Які реакції у алкінів відбуваються легше, ніж у інших вуглеводнів: а) заміщення;б) приєднання;в) приєднання і заміщення.6. Виберіть формули алканів:а) С4 Н8 б) СН4 в) С3 Н8 г) С3 Н4 д) С4 Н67. Виберіть структурну формулу пропану:а) СН3 – СН = СН2б) СН3 – СН2 – СН3в) СН3 – С ≡СН8. Виберіть реакцію приєднання:а) СН4 + 2 О2 → СО2 +2 Н2 Об) СН4 + Cl2 → СН3 Cl + НClв) С2 Н4 + Cl2 → Cl. СН2 – СН2 Cl + НCl4.17
1. Розподіліть за класами і назвіть речовини: а) С2 Н2; б) С3 Н8; в) С6 Н12; г) СН4; д) С4 Н6 2. Встановіть відповідність між структурною формулою і назвою сполуки: 1) СН3 –СН = СН - СН2 - СН3; а) пентан; 2) СН 3 - СН 2 – СН2 - СН3; б) бутин; 3) СН ≡ С – СН 2 - СН3; в) бутан; г) пентен 3. Допишіть рівняння реакцій: а) СН4 + Br2 → б) С3 Н8 + O2 → в) С2 Н4 + Cl2 → г) С2 Н2 + Н2 →Тест (І рівень)4.19
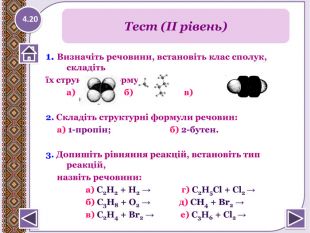
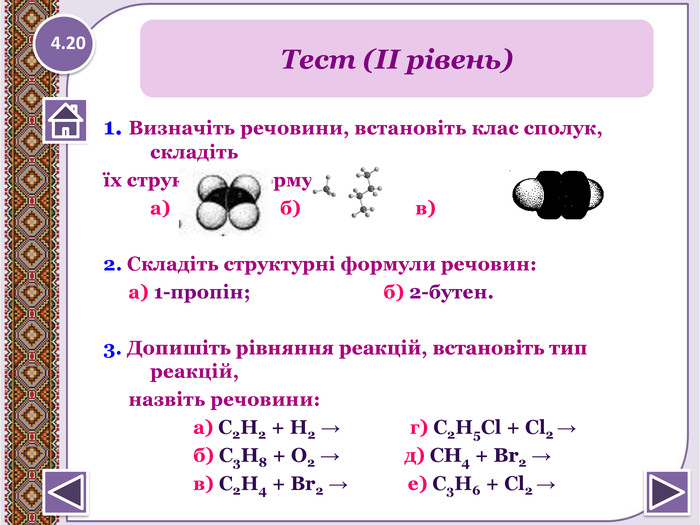
1. Визначіть речовини, встановіть клас сполук, складітьїх структурні формули: а) б) в)2. Складіть структурні формули речовин: а) 1-пропін; б) 2-бутен.3. Допишіть рівняння реакцій, встановіть тип реакцій, назвіть речовини: а) С2 Н2 + Н2 → г) С2 Н5 Cl + Cl2 → б) С3 Н8 + O2 → д) СН4 + Br2 → в) С2 Н4 + Br2 → е) С3 Н6 + Cl2 → Тест (ІІ рівень)4.20
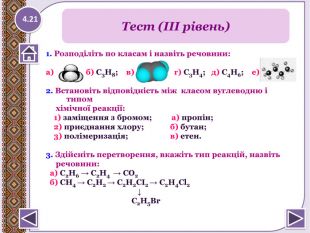
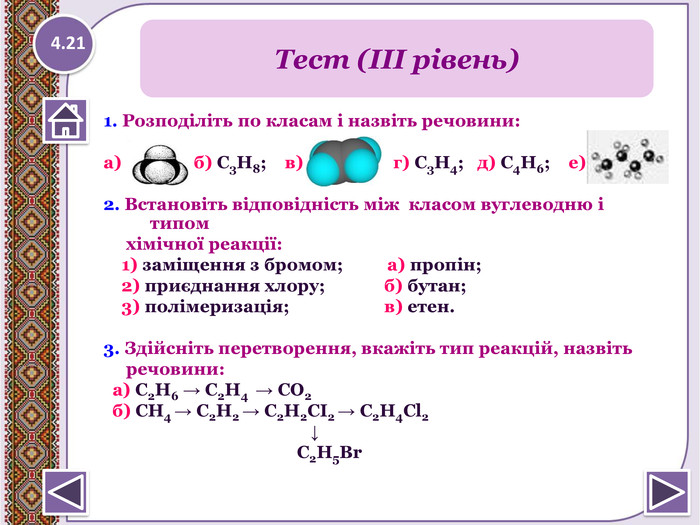
1. Розподіліть по класам і назвіть речовини:а) б) С3 Н8; в) г) С3 Н4; д) С4 Н6; е) 2. Встановіть відповідність між класом вуглеводню і типом хімічної реакції: 1) заміщення з бромом; а) пропін; 2) приєднання хлору; б) бутан; 3) полімеризація; в) етен.3. Здійсніть перетворення, вкажіть тип реакцій, назвіть речовини: а) C2 H6 → C2 H4 → CО2 б) CH4 → C2 H2 → C2 H2 СІ2 → C2 H4 Cl2 ↓ C2 H5 Br Тест (ІІІ рівень)4.21
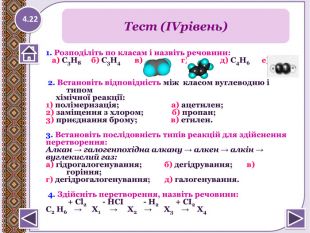
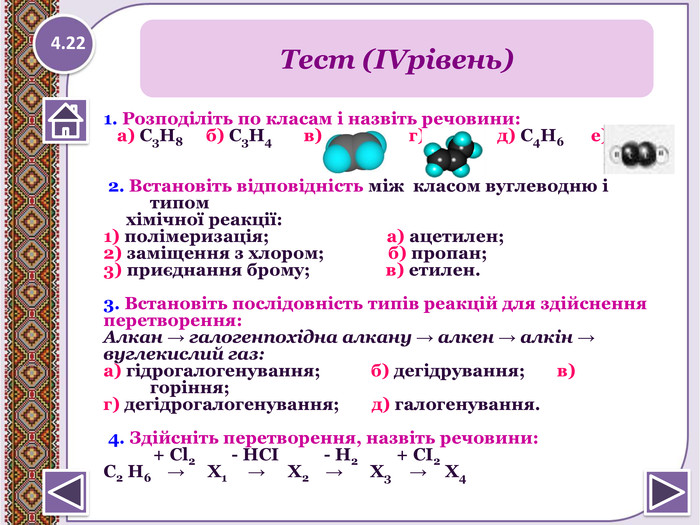
1. Розподіліть по класам і назвіть речовини: а) С3 Н8 б) С3 Н4 в) г) д) С4 Н6 е) 2. Встановіть відповідність між класом вуглеводню і типом хімічної реакції:1) полімеризація; а) ацетилен;2) заміщення з хлором; б) пропан; 3) приєднання брому; в) етилен.3. Встановіть послідовність типів реакцій для здійсненняперетворення: Алкан → галогенпохідна алкану → алкен → алкін →вуглекислий газ:а) гідрогалогенування; б) дегідрування; в) горіння;г) дегідрогалогенування; д) галогенування. 4. Здійсніть перетворення, назвіть речовини: + Cl2 - НСІ - Н2 + СІ2 C2 H6 → Х1 → Х2 → Х3 → Х4 Тест (ІVрівень)4.22
1. Вкажіть валентність Карбону в органічних сполуках: а) два; б) три; в) чотири; г) п'ять 2. Вільний радикал – це частинка з: а) неспареним електроном та негативним зарядом; б) неспареним електроном при відсутності заряду; в) неспареним електроном та позитивним зарядом; г) вільною електронною парою та негативним зарядом; д) вільною електронною парою при відсутності заряду. 3. Вкажіть насичений вуглеводень, який не має ізомерів: а) бутан; б) пентан; в) гексан; г) етан; 4. Вкажіть формулу речовини, яка є хлоропохідною метану: а) С3 Н6 Сl3; б) СН3 Сl; в) С2 Н4 Сl2; г) С2 Н5 Сl. 5. Вкажіть загальну формулу насичених вуглеводнів: а) Сn. Н2n; б) Сn. Н2n-2; в) Сn. Н2n+ 2; г) С2n. Н2n+2. Тест: Теорія Бутлерова. Насичені вуглеводні.4.23
6. Вкажіть формулу речовини, яка належить до насичених вуглеводнів: а) С3 Н8; б) С3 Н6; в) С3 Н4; г) С2 Н2. 7. Виберіть правильне твердження. Гомологи —це сполуки, які...а) мають подібну будову молекул і різні хімічні властивості;б) мають подібну будову молекул і подібні хімічні властивості, але відрізняються між собою за складом на одну чи кілька груп СН2;в) відрізняються між собою на кілька груп СН2 і мають однаковий якісний і кількісний склад;г) містять однакову кількість атомів Карбону і Гідрогену.8. Вкажіть хімічну формулу болотного газу:а) СО; б) СO2; в) СН4; г) С2 Н6; д) С3 Н8.9. Виберіть правильне твердження. Гомологічна різниця складу —це...а) група СН2; б) група СН3; в) група СН;г) група атомів, на яку відрізняються між собою перший і четвертий члени гомологічного ряду.10. Вкажіть формулу хлоропропану:а) С3 Н6 Сl; б) С3 Н7 Сl; в) С3 Н8 Сl; г) С4 Н9 Сl. 4.24
11. Вкажіть правильне твердження. Етил — це...а) насичений вуглеводень складу С2 Н6;б) одновалентний радикал складу С2 Н5;в) насичений вуглеводень складу С3 Н8;г) одновалентний радикал складу СН3. 12. Виберіть правильне твердження. Ізомерами називають сполуки, які мають... а) однакову молекулярну формулу, але різний порядок сполучення атомів у молекулі і відповідно різні властивості;б) однакову молекулярну формулу і просторову будову, але різні властивості; в) різні молекулярні формули, але подібну просторову будову і властивості;г) різні молекулярні формули і просторову будову, але подібні властивості. 13. Вкажіть формулу дихлоретану: а) СН2 Сl2; б) С2 Н2 Сl2; в) С2 Н3 Сl2; г) С2 Н4 Сl2; д) С3 Н6 Сl2.4.25
14. Виберіть правильне твердження. Насичені вуглеводні вступають у реакції... а) приєднання, заміщення, взаємодії з лугами;б) приєднання, термічного розкладу, взаємодії з кислотами в) окиснення калій перманганатом, термічного розкладу;г) заміщення з галогенами (Вr2, F2, Сl2), термічного розкладу, горіння.15. Вкажіть, до якого типу хімічних реакцій належить реакція хлору з метаном:а) обміну; б) сполучення; в) заміщення; г) розкладу. 16. Вкажіть продукти реакції повного горіння вуглеводнів:а) вода і чадний газ; б) вуглекислий і чадний гази; в) вуглекислий газ і вода; г) вуглекислий газ.17. Назвіть речовину: CH2 Br–CHBr–CH2 Br.а) 1,1,2-трибромпропан; б) 1,2,3-трибромпропан; в) 2,1,2-трибромпропан; г) 1,2,3-бромпропан; д) правильної відповіді немає. 18. Назвіть речовину: CH2 Br–CHBr–CHBr–CH2 Br.а) 1,1,2,3-тетрабромбутан; б) 1,2,3,4-тетрабромбутан;в) 2,1,2-трибромбутан; г) 1,2,3,4-бромпропан; д) правильної відповіді немає.4.26
19. Які з перелічених сполук належать до насичених: C2 H6, C2 H7 N, C2 H4, C6 H14, C6 H12, C6 H10, C6 H8, C6 H4 Cl2, C6 Cl6, C6 Cl12? а) C2 H6, C6 H14; б) C2 H6, C2 H4, C6 H14, C6 H12; в) C2 H4, C6 H12; г) C6 H10, C6 H8, C6 H4 Cl2; д) правильної відповіді немає.20. Вкажіть назву шостого члена гомологічного ряду насичених вуглеводі:а) пентан; б) гептан; в) гексан; г) октан;д) нонан.21. Визначте гібридизацію атома Карбону в насичених вуглеводнях. Відповідь поясніть.а) sр; б) sр2; в) sр3; г) sр4; д) правильної відповіді немає.4.27
1. Вкажіть, скільки спільних електронних пар є між атомами Карбону в молекулі етилену:а) одна; б) дві; в) три; г) чотири; д) п'ять. 2. Вкажіть кількість спільних електронних пар є між атомами Карбону у молекулі ацетилену:а) 4; б) 5; в) 3; г) 2; д) 1. 3. Вкажіть назву речовини, яка утвориться в результаті повного гідрування ацетилену: а) пропан; б) етен; в) етан; г) пропен; д) бутан.4. Вкажіть, що спостерігається під час пропускання етену через бромну воду:а) розігрівання речовин; б) зміна кольору бромної води;в) знебарвлення бромної води; г) випадання білого осаду. 5. Вкажіть, до якого типу реакцій належить реакція приєднання атомів Гідрогену до молекули речовини:а) дегідратації; б) гідрування; в) дегідрування; г) гідролізу; д) гідратації. Тест: Ненасичені вуглеводні.4.28
6. Вкажіть, під час якого процесу утворюється 1,2-диброметан: а) бромування етану на світлі;б) приєднання молекули брому до молекули ацетилену;в) приєднання молекули брому до молекули етену;г) приєднання бромоводню до ацетилену, якщо кількості речовин НВr і С2 Н2 відносяться як 1 : 1;д) приєднання двох молекул брому до ацетилену.7. Атом Карбону в молекулі ацетилену знаходиться в стані:а) sр3-гібридизації; б) sр2-гібридизації; в) sр-гібридизації; г) негібридизованому; д) правильної відповіді немає. 8. Вкажіть реакції характерні для ненасичених вуглеводнів:а) заміщення й окиснення; б) приєднання та заміщення;в) приєднання й окиснення окисниками; г) термічного розкладання.9. Вкажіть назву речовини, яка утвориться під час неповного гідрування 1 -бутину:а) пропен; б) пропан; в) 1-бутен; г) 2-бутен; д) 1,3-бутадієн.4.29
10. До складу молекули вуглеводню гомологічного ряду ацетилену входить 5 атомів Карбону. Вкажіть його формулу:а) С5 Н10; б) С5 Н8; в) С5 Н12; г) С5 Н6; д) С5 Н5.11. Вкажіть речовину, яка утворюється на першій стадії приєднання водню до ацетилену:а) етан; б) етен; в) пропен; г) бутен; д) пропан. 12. Вкажіть формулу третього члена гомологічного ряду ненасичених вуглеводнів ряду етилену:а) С2 Н4; б) С5 Н10; в) С3 Н6; г) С4 Н8; д) С6 Н12. 13. Вкажіть вуглеводень, з якого у дві стадії можна одержати пропан:а) етен; б) пропен; в) пропін; г) бутен; д) пентадієн. 14. Вкажіть загальну формулу ненасичених вуглеводнів ряду ацетилену:а) Cn. H2n ; б) Сn. Н2n–2 ; в) Сn. Н2n+2; г) Сn. Н2n-6. 4.30
15. Вкажіть речовини, які можуть приєднувати ненасичені вуглеводні:а) лише водень і галогени;б) водень, галогени, галогеноводні, воду;в) лише водень і воду;г) лише воду та галогени;д) лише галогени та галогеноводні.16. Вкажіть формулу етиленового вуглеводню, молекула якого містить 8 атомів Карбону: а) С8 Н10; б) С8 Н14; в) С8 Н18; г) С8 Н16; д) С8 Н12.17. Атоми Карбону в етилені зв’язані зв’язками:а) одним ; б) одним ; в) одним та одним ; г) двома ; д) двома .18. У подвійному зв’язку алкену:а) -зв’язок міцніший за -зв’язок; б) - та -зв’язки однаково міцні; в) -зв’язок слабкіший за -зв’язок; г) -зв’язок і -зв’язок дуже слабкі; д) правильної відповіді немає.4.31
19. Згідно з правилом Марковникова протон від реагенту НХ приєднується до …… атома Карбону:а) первинного; б) вторинного; в) третинного; г) найбільш гідрогенізованого; д) найменш гідрогенізованого. 20. Позначте назву речовини, яка утвориться після приєднання бромоводню до молекули етену:а) 1,1-дибромоетан; б) бромоетен; в) 1,2-дибромоетан; г) бромоетан; д) бромпропан. 21. Визначте гібридизацію атома Карбону в етиленових вуглеводнях. Відповідь поясніть.а) sр; б) sр2; в) sр3; г) s2р2; д) правильної відповіді немає. 22. Не мають ізомерів вуглеводні:а) пропан; б) бутан; в) пентан; г) гексан; д) правильної відповіді немає.4.32
23. Для алкенів реакції:а) заміщення йдуть легше приєднання; б) заміщення та приєднання йдуть однаково легко; в) приєднання йдуть легше заміщення; г) приєднання йдуть важко, заміщення неможливе; д) заміщення йдуть, приєднання неможливе. 24. Визначте гібридизацію атома Карбону в ацетиленових вуглеводнях. Відповідь поясніть.а) sр; б) sр2; в) sр3; г) sр4.4.33
Об’єм повітря (н.у.), необхідний для повного спалювання 50 л метану (н.у.), лорівнює __л. Обчисліть, який об’єм карбон (ІV) оксиду утвориться внаслідок згоряння пропану об’ємом 15л. Сажу, добуту із метану, застосовують для виготовлення гуми, друкарських фарб. Визначте, яку масу сажі можна добути із 448 л метану. Ацетилен, що використовується для зварювальних робіт, добувають часто на місці в результаті взаємодії карбіду кальцію Са. С2 з водою. Який об’єм ацетилену можна добути із 71 кг карбіду кальцію з масовою часткою домішок 10%? Для знезаражування зерносховищ та проти філоксери винограду використовується 1,2 – дихлоретан. Який об’єм 1,2-дихлоретану утвориться при взаємодії 50 л етилену із 44,8 л хлору?Після пропускання 1,12 л суміші метану, етану й етилену у бромну воду,взяту у достатній кількості, залишилось 0,448 л газів. На спалювання цього залишку витрачено 1,232 л кисню. Всі об’єми відповідають однаковим умовам. Знайдіть об’єми газів, які були в початковій суміші. Давайте порахуємо5.1
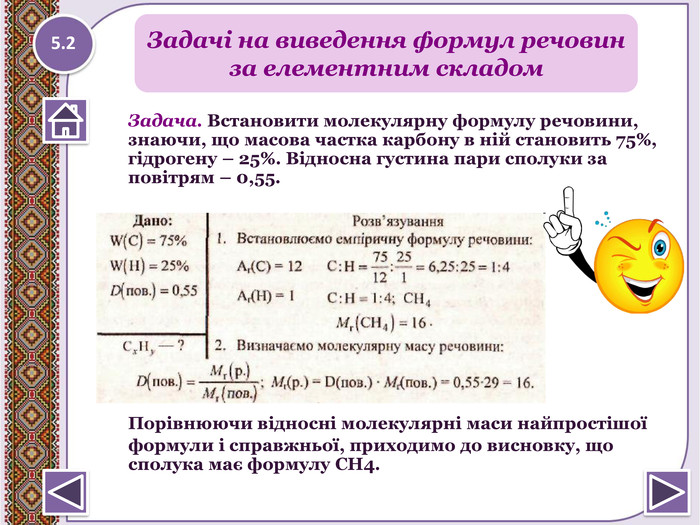
Задача. Встановити молекулярну формулу речовини, знаючи, що масова частка карбону в ній становить 75%, гідрогену – 25%. Відносна густина пари сполуки за повітрям – 0,55. Порівнюючи відносні молекулярні маси найпростішої формули і справжньої, приходимо до висновку, що сполука має формулу СН4. Задачі на виведення формул речовин за елементним складом5.2
1. При згорянні 1 моль газу утворюється 22,4 л оксиду карбону (IV) і 36 г води. Знайдіть молекулярну формулу сполуки і визначте, скільки літрів кисню потрібно для повного згоряння 1 я цього газу? (Відповідь. СН4; 2 л.)2. Суміш етану і пропану спалили в надлишку кисню (н. у.), а 6,72 л продуктів повного згоряння обробили надлишком вапняної води. При цьому утворилось 80 г осаду. Який склад вихідної суміші? (Відповідь. С2 Н6 – 2,24 л; С3 Н8 – 4,48 л). 3. Обчисліть кількість теплоти, що виділяється при згорянні 0,5 .моль метану, беручи до уваги, що тепловий ефект реакції згоряння метану становить 890 к. Дж/моль. (Відповідь. 445 к. Дж). 4. Виведіть молекулярну формулу хлорпохідного насиченого вуглеводню з масовою часткою хлору 89,9%, карбону – 10,1%. Відносна молекулярна маса цієї сполуки – 237. (Відповідь. С2 Сl6). 5. Виведіть структурні формули насичених вуглеводнів, якщо масові частки елементів такі: С – 82,76%; Н – 17,24%. (Відповідь. С7 Н16) 6. Яка структурна формула газу, що є насиченим вуглеводнем, якщо маса 5,6 л його (н. у.) становить 11 г? (Відповідь. С3 Н8).5.4
7. Який вуглеводень і яким об'ємом (н. у.) утвориться, якщо при взаємодії пропіонату натрію з 10 г Na. OH залишились невикористаними 3 г лугу? (Відповідь. С2 Н6, 3,92 л). 8. Який об'єм 0,25 М розчину гідроксиду натрію необхідних для нейтралізації оксиду карбону (IV), що виділився при повному згорянні 6,4г 2,2,3-три-метилгексану, до утворення кислої солі? (Відповідь. 1800 л)9. Який об'єм 0,25 М розчину гідроксиду натрію необхідну для повної нейтралізації 224 л продуктів згоряння (н. у.) природного газу в якому об'ємна частка метану становить 96%, етану – 1%, пропану – 1%, сірководню – 2%? (Відповідь. 10 л). 10. Який об'єм повітря потрібний для спалювання 18м3 металу за нормальних умов? Який об'єм оксиду карбону (IV) при цьому утвориться, якщо втрати становлять 10%? (Відповідь. У(пов.) =180 л?; V(CO)2=16,2 м3)11. Який об'єм метану можна добути з 12 кг карбіду алюмінію, що містить 5% домішок? (Відповідь. 5,32 м3). 12. Який об'єм метану виділиться при сплавлянні 20 г ацетату натрію і 18 г гідроксиду натрію? (Відповідь. 5,463 л). 13. Спалили 2 л метану і 1л пропану. Скільки літрів оксиду карбону (IV) добули, якщо втрати в першому випадку становлять 5%, а в другому – 7%? (Відповідь. 4,69 л).14. Для повного згоряння 0,5 л пропано-бутанової суміші було взято 4 5 п кисню. Після приведення речовин до нормальних умов об'єм газів дорівнював 3,4 л. Визначте об'ємну частку компонентів у вихідній і добутій сумішах (Відповідь. Вихідна суміш: 60% С3 Н8, 40% С4 Н10; добута суміш 50% СО2? 50% Н20).5.5
15. Для спалювання 15 л метану використали 100 л повітря збагаченого киснем. Обчисліть об'ємну частку кисню в такому повітрі. (Відповідь. 30%)16. Скільки літрів кисню необхідно для повного спалювання 3 л суміші метану і етану, відносна густина якої за повітрям становить 0,5? (Відповідь. 6,448 л). 17. Яка маса за нормальних умов: а) 20 л метану; б) 10 л пропану? (Відповідь. 14,29 г; 19,6 г). 18. Скільки молекул міститься в: а) 10 л метану; б) 20 л етану? (Відповідь. 2,68∙1023; 5,375∙1023).19. У посудині міститься 40 л етану при температурі 293 К і тиску 354,65 к. Па. Цей газ спалюють за нормальних умов. Визначте об'єм кисню, необхідний для спалювання даного об'єму етану. (Відповідь. 456,56 л). 20. Для добування 0,5 л метану було витрачено 200 г розчину ацетату натрію за реакцією Кольбе. Яка масова частка солі в розчині? (Відповідь. 1,83%).21. До 100,мл суміші метану, водню і азоту додали 150л/л кисню. Після реакції об'єм суміші становив 86 мл. Продукти реакції пропустили крізь розчин гідроксиду натрію, об'єм їх зменшився до 22.мл. Яка об'ємна частка компонентів вихідної суміші? (Відповідь. СН4 – 64%, N2 – 12%, Н2 – 24%). 22. Сполуку, що складається з карбону і гідрогену, спалили і одержали 55 г оксиду карбону (IV) і 27 г води. Яка формула сполуки, якщо густина її пари за повітрям дорівнює 2,48? (Відповідь. С5 Н12).5.6
23. Обрахуйте, скільки м3 оксиду карбону (IV) (при н.у.) і молей води утвориться при повному згорянні 10 кг гептану. (Відповідь. 13,3 м3; 0,71 моль). 24. Метан об'ємом 22,8 м3 піддали частковому згорянню у відповідній апаратурі, використовуючи при цьому суміш з масовою часткою кисню 85% (азоту – 15%). Який об'єм суміші використали? (Відповідь. 53,64 л/3).25. Яка маса в грамах при н.у.: а) 10 л метану; б) 11,2 л етану; в) 10л пропану; г) 44,8 л бутану. (Відповідь, а) 2,14 г; б) 1,5 г; в) 19,64 г; г) 116 г). 26. Яку масу карбіду алюмінію необхідно взяти для одержання 25 л метану (н.у.)? (Відповідь. 53,67 г).27. Який об'єм метану (н.у.) можна одержати з 20 кг карбіду алюмінію Аl4 С3? (Відповідь. 9,33 л) 28. Для проведення дослідів з метаном потрібно одержати для кожного учня 200 мл метану (н.у.). Скільки оцтово-кислого натрію потрібно для цього? (Відповідь. 0,73 г).5.7
29. Яку масу ацетату натрію потрібно взяти для одержання 10 л метану (н.у.)? (Відповідь. 33,6 г). 30. Було спалено 2 л метану і 1 л пропану. Який об'єм С02 утворився в кожному випадку? (Відповідь. 2 л; 3 л). 31. Який об'єм метану можна одержати з 25 г суміші натронного вапна і ацетату натрію, якщо масова частка ацетату натрію складає 30%? (Відповідь. 2,04 л).32. У результаті вибуху 4.мл суміші газоподібного вуглеводню і 25 мл кисню утворилося 12 мл СО2 і деяка кількість води. Після вибуху залишилося 5 мл кисню, що не прореагував. Усі виміри було зроблено за нормальних умов. Знайти формулу вуглеводню. (Відповідь. С3 Н8). 33. Який об'єм метану можна одержати з 10 кг карбіду алюмінію АІ4 С3, якщо масова частка домішок становить 4%? (Відповідь. 4,57 л).34. Скільки метану утворюється в результаті взаємодії 20 г ацетату калію з гідроксидом калію? (Відповідь. 4,48 м3). 35. Який об'ємі метану можна одержати з 25 г безводного ацетату натрію при нагріванні його із лугом, якщо масова частка домішок складає 2%? (Відповідь. 6,23 л).5.8
Ускладнені і комбіновані задачі1. Якого складу сіль утвориться і яка її масова частка в розчині, добутому при розчиненні в 76,4 мл розчину гідроксиду калію (р = 1,31 г/см ) з масовою часткою КОН 32% усього оксиду карбону (IV), що утворився при згорянні 6,4 л метану? (Відповідь. 35% К2 С03).2. Газова суміш, що складається з метану, оксиду карбону (II) і водню, має густину 0,857 г/л. Для повного спалювання 1 л суміші (н. у.) витрачається 4,52 л повітря. Визначте об'ємні частки водню, метану і оксиду карбону (ІІ) в суміші. (Відповідь. Н2 – 20%, СО – 50%, СН4 – 30%).3. Оксид карбону (IV), добутий при згорянні пентану, був пропущений крізь розчин, що містить 17,76 г гашеного вапна. При цьому утворилось 16 г карбонату і 12,96 г і гідрокарбонату кальцію. Який об'єм пентану спалений? (Відповідь. 1,433 л). 4. Для спалювання 2 л суміші етану і пропану, що знаходиться під тиском 403,3 к. Па і температурі 273 К, витрачено 155 л (н. у.) повітря. Визначте об'ємні частки компонентів у вихідній суміші. (Відповідь. 75% етану і 25% пропану). 5. При спалюванні деякої маси речовини, в склад якої входять карбон, гідроген і хлор, було добуто 0,44 г оксиду карбону (IV) і 0,18 г води. З хлору, що містився в даній масі речовини, після переведення його в хлорид-іон було добуто 2,86 г хлориду аргентуму. Визначте формулу речовини. (Відповідь. С2 Н2 О)5.10
6. При пропусканні 11,2л суміші метану, оксиду карбону (II) і оксиду карбону (IV) крізь розчин гідроксиду натрію, взятого в надлишку, об'єм вихідної суміші зменшився на 4,48 л. Для повного згоряння суміші, що залишилась, було витрачено 6,72 л кисню. Визначте об'ємні частки компонентів у вихідній суміші. (Відповідь. 40% СН4, 20,8% СО, 39,2% СН4).7. Знайдіть об'єм озонованого кисню, що містить 10% озону, необхідного для спалювання 21 л пропану. (Відповідь. 100 л). 8. При нагріванні органічного бромпохідного, в якому масова частка карбону складає 35% і гідрогену 6,6% зі спиртовим розчином Na. OH, утворюється сполука, 210 мг якої при спалюванні утворюють 660мг СО2 і 270 Н2 О. Відносна густина парів цієї сполуки за гелієм дорівнює 34,25. Яке бромпохідне піддавалося перетворенням? (Відповідь. С4 Н9 Вг). 9. При згорянні 8,96 л суміші метану, оксиду карбону (II) і етану но 13,44 л оксиду карбону (IV). Визначити мольний вміст в суміші етану (н.у.). (Відповідь. 0,2 моль Сг. Н6).10. Підпалили 50 мл суміші бутану і кисню (кисень в надлишку). Після закінчення реакції і приведення газів до нормальних умов об'єм скоротився на 17,5 мл. Визначити об'ємні частки бутану та СО2 суміші. (Відповідь. 10% С4 НІ0; 61,53% СО2).5.11
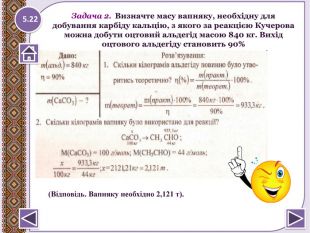
Задачі на визначення компонентів сумішіЗадача 1. Яка масова частка пентену-1 в суміші з пентаном, якщо 30 г суміші приєднують 12 г брому?Задача 2. Суміш етилену і пропілену об'ємом 3 л спалили і добутий оксид карбону (IV) пропустили крізь вапняну воду. При цьому утворилось 34,81 г осаду. Визначте об'ємні частки етилену і пропілену в суміші.5.12
1. Виведіть молекулярну формулу газу, знаючи, що масова частка карбонув ньому становить 85,7%, гідрогену – 14,3%. Відносна густина газу за воднем – 21. (Відповідь. С3 Н6). 2. При спалюванні 1г речовини утворилося 0,5 моль оксиду карбону (IV) і 0,5 моль води. 2,8 г пари цієї речовини (н. у.) займають об'єм 2,24 л. Визначте формулу речовини, яку спалювали. (Відповідь. С2 Н4). 3. На гідрування 2,8 г етиленового вуглеводню витрачається 0,896 л водню (н. у.). Яка молекулярна маса і формула цієї сполуки? (Відповідь. С5 Н10). 4. Відносна густина пари речовини за воднем – 28. Масова частка карбону в ній становить 85,72%, гідрогену – 14,28%. Сполука знебарвлює бромну воду. Що це за сполука? Виведіть всі її ізомери. (Відповідь. С4 Н8). 5. При згорянні 4,2 г речовини утворилось 13,2 г оксиду карбону (IV) і 5,4 г води. Відносна густина пари даної сполуки за повітрям становить 2,9. Яка це сполука? (Відповідь. С6 Н12).6. Скільки літрів етилену (н. у.) можна добути з 230 г етилового спирту, якщо масова частка його виходу становить 80%? (Відповідь. 89,6 л). 7. При пропусканні 92 г етилового спирту над нагрітим оксидом алюмінію добули 40 л етилену (н. у.). Визначте об'ємну частку виходу етилену. (Відповідь. 89,28%). 8. Абсолютний етиловий спирт масою 25 г змішали з безводною сульфатною кислотою і нагріли до температури 160º. Об'ємна частка виходу етилену становить 70,28%. Скільки літрів етилену було добуто? (Відповідь. 8,55 л).5.15
9. При гідратації етилену на 1 т спирту витрачається 700 кг етилену. Яка масова частка виходу спирту? (Відповідь. 86,95%). 10. Який об'єм етилену потрібний для добування 4 т етилового спирту, якщо масова частка виходу спирту становить 73,6%? (Відповідь. 2646,5 м3).11. Суміш пентану і пентену масою 1,2 г знебарвлює 5мл розчину брому (160 г брому в 1 л чотирьоххлористого вуглецю). Яка масова частка пентену в суміші? (Відповідь. 29,16%). 12. Скільки літрів пропену вступає в реакцію з хлороводнем, якщо при цьому утворюється 16 г суміші, в якій масова частка 2-хлорпропану 90%, а 1-хлорпропану – 10%? (Відповідь. 4,55 л). 13. При пропусканні етилену крізь рідкий бром маса склянки збільшилась на 38 г. Яка речовина і в якій кількості утворилась, скільки літрів етилену вступило в реакцію? (Відповідь. 217,4 г; 30,4 л). 14. Які масові частки гексену і гептену в суміші, якщо 5 г її приєднують 9 г брому? (Відповідь. 61,5% гексену і 38,5% гептену). 15. Скільки літрів етилену можна добути при дегідратації 100 лиг етилового спирту з масовою часткою С2 Н5 ОН 96% (р = 0,8 г/см3). (Відповідь. 37,4 л). 16. Суміш етану і етилену об'ємом 3 л пропустили крізь 250 г бромної води з масовою часткою брому 3% (р = 1,02 г/см2). Внаслідок реакції добуто 4,7 г диброметану. Визначте склад суміші та масу брому, що не прореагував. (Відповідь. С2 Н4 – 0,56 л; С2 Н6 – 2,44 л; Вг2 – 3,65 г). 5.16
17. При дії 30 г брому на суміш пентану і пентену-2 масою 12 г внаслідок реакції залишилось 7,1 г брому, що не прореагував. Який склад вихідноїсуміші? (Відповідь. 10,01 г пентену-2 і 1,98 г пентану). 18. Скільки літрів етилену (н. у.) можна добути з 230 г етилового спирту, якщо масова частка його виходу становить 80%? (Відповідь. 89,6 л). 19. Яка масова частка пентену в суміші пентану і пентену, якщо 2г її знебарвлюють 5 мл розчину брому, в 1 л якого його міститься 160 г? (Відповідь. 17,5%). 20. Який об'єм водню приєднається в присутності каталізатора до 40 г суміші газів, в якій масова частка пропену становить 22%, бутену – 58%, бутану – 20%? (Відповідь. 13,97 л). 21. Суміш етану, етилену і пропілену має відносну густину парів за воднем 15,9. До 1 л суміші добавили 1 л водню і добуту газову суміш пропустили над нагрітим каталізатором. При цьому її об'єм зменшився до 1,5 л (н. у.). Знайдіть склад вихідної суміші. (Вівповідь. С2 Н6 – 0,5 л; С2 Н4 – 0,3 л; С3 Н6 – 0,2 л). 22. Яка масова частка гексену-1 в суміші з гексаном, якщо 20 г її приєднують 8 г брому? (Відповідь. 21%).23. Скільки літрів пропену вступає у реакцію з хлороводнем, якщо при цьому утворюється 26 г суміші, в якій масова частка 2-хлорпропану становить 90 %, а 1-хлорпропану – 10%? (Відповідь. 7,59 л). 5.17
24. Суміш етилену і етану об'ємом 2 л пропустили в склянку з бромною водою. При цьому маса склянки збільшилась на 1,6 г. Яка об'ємна частка етилену в суміші? (Відповідь. 64%).25. Скільки грамів гексену і гептену міститься в суміші, якщо 5 г її приєднують 9 г брому? (Відповідь. 3,14 г гексену, 1,86 г гептену). 26. При дегідратації 31,25 мл етанолу (р = 0,8 г/см3) одержали 7,5 л етилену. Обчислити об'ємну частку виходу етилену. (Відповідь. 50,7%). 27. Скільки літрів етилену можна одержати з 92 г етилового спирту, якщо масова частка виходу становить 88%? (Відповідь. 39,42 л).28. Який об'єм повітря необхідний для спалювання 50 г етилену, якщо об'ємна частка кисню в повітрі 20%? (Відповідь. 600 л). 29. При дії на 25 л суміші пентену з інертним газом водню об'ємом 11,2 л одержали пентан. Чому дорівнює об'ємна частка пентену в суміші? (Відповідь. 44,8%).5.18
1. Суміш насиченого і етиленового вуглеводнів об'ємом 4,48 л., що містять однакову кількість атомів карбону, реагує з 1,12 л бромоводню. Продукт взаємодії етиленового вуглеводню з хлором в 56,5 раз важчий за водень. Визначте склад суміші. (Відповідь. 75% пропану і 25% пропілену). 2. Суміш 5 л етилену і пропану та 5 л водню пропустили над каталізатором. При цьому загальний об'єм зменшився до 8 л. Визначте об'ємні частки газів у вихідній суміші. (Відповідь. 40% етилену, 60% пропану). 3. При пропусканні 2,8 л (н. у.) суміші пропілену, бутилену і бутану крізь бромну воду прореагувало 16 г брому. Визначте об'єм кисню і повітря, які витрачаються на спалювання 20 л цієї суміші, якщо відносна густина за воднем дорівнює 26,1. (Відповідь. 5 л кисню, 25 л повітря). 4. Органічна речовина містить карбон і гідроген. Масова частка карбону становить 85,7%, гідрогену – 14,29%. Визначте формулу речовини, якщо її маса дорівнює 42 г при 400 К і тиску 506,625 к. Па, займає об'єм 3,28 л. (Відповідь. С6 Н12). 5. Суміш, що складається з метану і етилену, має відносну густину парів за повітрям 0,62. Визначте масову частку карбону в суміші. (Відповідь. 77,68%).5.20
Задачі на визначення масової або об'ємної часток виходу продукту Задача 1. При взаємодії 5 л ацетилену з водою в присутності іонів Hg2+ було добуто 5,2 г оцтового альдегіду. Яка масова частка виходу ацетальдегіду? М(СНз. СНО) = 44 г/моль;(Відповідь. Масова частка виходу оцтового альдегіду становить 88,28%).5.21
1. До 1 л суміші етану і ацетилену добавили 2 л водню. Добуту суміш пропустили над платиновим каталізатором. Об'єм суміші після реакції (н.у.) становить 1,8 л. Визначте об'ємну частку етану і ацетилену в суміші. (Відповідь. 40% ацетилену і 60% етану). 2. При взаємодії суміші карбідів кальцію і алюмінію масою 13,6 г з хлоридною кислотою добули 5,6 л ацетилену і метану. Скільки грамів кожного карбіду було в суміші? (Відповідь. 6,36 г Са. С2 і 7,24 г АІ4 С3). 3. Яка масова частка Са. С2 в технічному карбіді кальцію, якщо з 1 кг технічного карбіду добувають 204 л ацетилену? (Відповідь. 58,28%). 4. З 5 г ацетилену за реакцією Кучерова добуто 3 г оцтового альдегіду. Яка масова частка виходу альдегіду? (Відповідь. 35,46%). 5. Який об'єм повітря потрібно для повного спалювання 10 л ацетилену? (Відповідь. 125 л). 6. При гідратації ацетилену добули 5 т оцтового альдегіду. Який об'єм І ацетилену при цьому використовується, якщо об'ємна частка втрат становить І 5%? (Відповідь. 2672,72 л) 7. Скільки грамів брому вступає в реакцію з сумішшю етилену, метану і ацетилену об'ємом 3 л, якщо об'ємні частки етилену і метану відповідно дорівнюють 4,48% і 32,8%? (Відповідь. 27,84 г). 8. Який об'єм повітря витрачається на згоряння гексину-2 масою 8,2 г? (Відповідь. 95,2 л). 9. Який об'єм ацетилену необхідно витратити (н.у.) при реакції з бромом масою 8 г для добування 1,1,2,2-тетраброметану? (Відповідь. 560 мл). 10. Яка маса 44,8 л пропіну? (Відповідь. 80 г).5.24
11. Який об'єм повітря необхідний для згоряння 1 об'єму ацетилену, що містить 0,2 об'єми оксиду карбону (IV)? (Відповідь. 10 об'ємів). 12. Який об'єм ацетилену можна добути, якщо в колбу внести карбід кальцію масою 20 г, масова частка домішок в якому становить 15%, і поступово додати 0,5 л води? (Відповідь. 5,950 л). 13. При спалюванні 3,15 г речовини, що складається з карбону і гідрогену, утворилось 10,81 г оксиду карбону (IV) і 179 г води. Визначте формулу сполуки і масові частки карбону і гідрогену. (Відповідь. W(C) = 93,65%; W(H) = 6,3%; С5 Н4). 14. При спалюванні ацетилену об'ємом 36,5 л було витрачено 88,3 л кисню. Яка об'ємна частка негорючих домішок в ацетилені? (Відповідь. 3,24%). 15. Знайдіть молекулярну формулу речовини, знаючи, що масова частка карбону в ній становить 92,3%, а гідрогену – 7,7%. Відносна густина речовини за воднем – 13. (Відповідь. С2 Н2). 16. Виведіть молекулярну формулу речовини, при згоранні 2,24 л якої утворилось 4,48 л оксиду карбону (IV) і 1,8 г води. Маса газу об'ємом 1 я становить 1,67 г. (Відповідь. С2 Н2). 17. З ацетилену об'ємом 3,36 л (н. у.) добули бензол об'ємом 2,5 мл. Визначте масову частку виходу продукту, якщо густина бензолу становить 0,88 г/см}. (Відповідь. 56,4%). 18. При гідруванні 1,232 л ацетилену (н. у.) добуто суміш етану і етилену. Ця суміш може приєднати 4 г брому. Яка об'ємна частка етану в суміші? (Відповідь. 54,55%).5.25
19. Вуглеводень масою 2 г, у молекулі якого є один потрійний зв'язок, приєднує 16 г брому. Визначте вуглеводень, назвіть його, запишіть молекулярну і структурну формули. (Відповідь. С3 Н4). 20. Ацетилен, добутий з технічного карбіду кальцію масою 1 г, був перетворений в ацетиленід міді (І) масою 2,365 г. Яка масова частка домішок в технічному карбіді? (Відповідь. 0,42%).21. З технічного карбіду кальцію масою 400 г було одержано 120 г ацетилену. Яка масова частка домішок в такому карбіді? (Відповідь. 14,3%). 22. Скільки грамів бромистого вінілу треба взяти, щоб дією спиртового розчину лугу одержати 112 л ацетилену? (Відповідь. 335 г). 23. Скільки літрів повітря витрачається при повному згорянні 8,2г бути-лацетилену? (Відповідь. 95,2 л). 24. Який об'єм ацетилену можна одержати з 1 кг технічного карбіду кальцію, якщо масова частка Са. С2 в ньому 80%? (Відповідь. 280 л). 25. В лабораторії з ацетилену об'ємом 62,5 л одержали 50 г бензолу. Яка масова частка виходу бензолу? (Відповідь. 68,9%).5.26
Ускладнені і комбіновані задачі 1. Суміш азоту, ацетилену і аміаку об'ємом 40 мл змішали з 80.wz кисню і підпалили (горіння відбувалось без каталізатора). Після реакції (н.у.) об'єм суміші дорівнював 70,72 мл. Після пропускання суміші крізь луг об'єм її зменшився до 34,88 мл. Знайдіть об'ємне співвідношення газів у кінцевій суміші. (Відповідь. С2 Н2 : NH3 = 0,6 : 1). 2. Оксид карбону (IV), добутий при згорянні 2,8 л ацетилену, виміряного за нормальних умов, пропустили крізь 157,5 мл розчину гідроксиду натрію з масовою часткою Na. OH 6% (р = 1,06 г/см3). Визначте масову частку солі в розчині. (Відповідь. W(Na. HC03) 11,8%). 3. 560мл суміші етилену і ацетилену змішали з 440мл водню. Після пропускання добутої суміші над платиновим каталізатором (н.у.) її об'єм зменшився на 33,6% порівняно із загальним об'ємом вихідної суміші. Обчисліть об'ємні частки етилену і ацетилену у вихідній суміші і об'єм повітря, необхідний для повного спалювання суміші вуглеводнів. (Відповідь. 18,84% С2 Н4; 81,86% С2 Н2, 8,12 л повітря). 4. Обчисліть, у скільки разів зменшиться об'єм суміші ацетилену і етеленом після пропускання її крізь аміачний розчин оксиду аргентуму відомо, що 1,12л вихідної суміші може прореагувати в темноті з 33,82 л бром) (р = 3,14 г/см) (Відповідь. У 2 рази). 5. Крізь водний розчин брому пропустили 5,6 л (н.у.) газової суміші, що складається з бутану, пентану і бутилену. Прореагувало 12 г брому. Відносно густина газової суміші за воднем – 29,4. Визначте об'ємні частки і пін у суміші. (Відповідь. 60% С4 Н10; 10% С5 Н2; 30 % С4 Н8). 6. Спалили 400 мл вуглеводню в 1000 мл кисню. Об'єм газу після вивчення реакції (н.у.) становив 800 мл. Визначте формулу вуглеводню, якщо кисень прореагував повністю. (Відповідь. С2 Н2).5.28
Хочу більше знати Поширення метану в природі. Метан входить до складу природного газу (98%), є важливим компонентом попутного нафтового газу. Чимало метану в складі копального газу міститься у кам'яно-вугільних шахтах , тому його називають рудниковим газом. Вибухи суміші метану з киснем повітря (1:10) часто спричиняють масову загибель шахтарів. 6.1
Канарки дуже чутливі до вмісту в повітрі метану. Цю особливість використовували свого часу шахтарі, які, спускаючись під землю, брали з собою клітку з канаркою. Поки чутно спів пташки, можна було працювати спокійно. Якщо ж співу давно не було чутно, це означало, що слід підніматися вгору якнайшвидше, так як концентрація газу в шахті ставала небезпечною. 6.2 Які птахи допомагали шахтарям?
Цікаво! У 19 столітті в сольовій копальні «Камера Спалена», що в горі Величка (Польща), були робітники, яких називали «грішниками, що каються». Вони надягали мокрий одяг з каптурами і повзали шахтами. Тримаючи в руці довгі ціпки, на кінці яких жевріли смолоскипи. У такий спосіб вони випалювали метан під стелею, не дозволяючи його концентрації сягнути критичної межі. Чимало метану утворюється внаслідок анаеробного бродіння рослинних решток у болотах (тому його називають болотний газ), річковому мулі, під час перетравлювання їжі великою рогатою худобою. Біогаз – продукт переробки фекалій і сміття – також переважно складається з метану. 6.3
Цікаво! Болотний газ хімічними методами вперше дослідив у 1776р. італійський природодослідник Алессандро Вольта і встановив його відмінність від водню. Також це природне джерело метану вивчали Бертолле, Дальтон, Берцеліус тощо. Болотний газ у неглибокій замуленій водоймі збирали в такий спосіб. Товстостінну склянку або пляшку занурювали у воду, аби вона заповнилася рідиною, потім повертали її догори дном, вставляли лійку і збирали метан, розпушуючи дно за допомогою ціпка. Коли в склянці збирався газ, її закорковували під водою й після цього виймали на поверхню. 6.4
Трапляється метан і у Всесвіті. Його виявлено в атмосфері планет Юпітер, Сатурн, Уран і Нептун. Величезні озера рідкого метану є на поверхні Титана, найбільшого з природних супутників Сатурна. Величезні обсяги метану надходять в атмосферу з рисових полів, боліт, тваринних ферм тощо. Науковці стверджують, що це не лише сприяє глобальному потеплінню, а й виснажує озоновий шар планети. 6.5
У XIX столітті, під час впровадження зовнішнього освітлення із застосуванням світильного газу, група німецьких вчених помітила, що витік цього газу з газопроводу або з ліхтарів спричиняє опадання листя у дерев, що ростуть уздовж тіньового боку вулиці. Коли світильний газ набув більш інтенсивного використання, цей факт повідомили та підтвердили дослідники інших країн. У 1901 р. аспірантом Ботанічного інституту Петербурзького університету Дмитром Нелюбовим було відкрито, що активним компонентом, який спричиняє зазначені явища, є етилен. Пізніше різними вченими також було виявлено, що етилен має вплив майже на всі процеси росту, розвитку та старіння рослин. Сучасна фізіологія і біохімія рослин розглядає етилен як рослинний гормон, адже етилен є природним продуктом метаболізму рослин. У 1910 р. було виявлено, що гази, які виділяють апельсини, прискорюють достигання бананів, а у 1935 р. ідентифіковано етилен як природний продукт, що виділяється плодами і рослинними тканинами. Пізніше його було знайдено в усіх досліджених типах плодів, у квітках, листі, стеблах та коренях багатьох видів рослин, а також у деяких грибах. З історії етилену6.10
Своєю назвою плащ макінтош зобов’язаний шотландському хіміку Чарльзу Макінтошу, який в 1823 году винайшов непромокну тканину. Дивно, що це відкриття він зробив зовсім випадково. В ході одного з дослідів Макінтош пролив на рукав жакета розчин каучука, але забув видалити пляму. Через деякий час він помітив, що рукав жакета не промокає. Через рік Макінтош відкрив фірму з виробництва непромокних плащів і продовжив свої досліди, почав використовувати вовну для створення теплого і одночасно з цим водонепроникного матеріалу. Проте носити одяг з прорезинової вовни було практично неможливо — вона була надто важкою, і до того ж натуральні масла, наявні в вовні з часом раз’їдали резину. Сполучення інших тканин з каучуком також не вирізнялися надійністю — на холоді вироби ставали твердими та ламкими, а в спеку — липкими і майже плавилися. Але найголовніше — всі вони мали неприятний запах резини. Носити такий одяг були готові лише солдати армії та флоту, а от цивільне населення не спішило змітати з прилавків прорезинені плащі.“Історія макінтоша”6.11
Прорив наступив вже після смерті Чарльза Макінтоша, коли в 1831 році його компанія Charles Mackintosh and Co. об’єднала своє виробництво з підприємством Томаса Хенкока. Через десять років наполегливої праці Хенкок відкриває та патентує процес вулканізації гуми, який дає змогу отримувати носку, легку і, найголовніше, водонепроникну тканину. Шви на плащах також стали змазувати ррозчином гуми з наступною їх ізоляцією, в результаті чого вони ставали повністю водонепроникними, але при цьому погано вентилювалися та мали неприємний запах. Запах з часом навчилися приховувати, додаючи до гуми отдушку, проте дихаючу тканину вдалося створити лише в XX столітті. 6.12
Горіння суміші тетрахлорметану та циклогексану (1 : 1). В книзі Leonard A. Ford Chemical Magic (1959) міститься цікавий рецепт. Автор рекомендує приготувати суміш з 40 мл тетрахлориду вуглецю та 60 мл сіркоуглерода CS2, нанести декілька мілілітрів цієї суміші на долоню и підпалити. Суміш згорить жовтим полумям, не спричинивши шкоди долоні. http://chemistry-chemists.com/forum/viewtopic.php?p=11951#p11951 Вогонь на долоні6.13
В Антарктиді з льодовика Тейлора часом виходить Кривавий водоспад. Вода в ньому містить двовалентне залізо, яке, з'єднуючись з атмосферним повітрям, окислюється і утворює іржу. Це і додає водоспаду криваво-рудий колір. Однак двовалентне залізо у воді виникає не просто так - його виробляють бактерії, що живуть в ізольованій від зовнішнього світу водоймі глибоко під льодом. Ці бактерії зуміли організувати життєвий цикл при повній відсутності сонячного світла і кисню. Вони переробляють залишки органіки, а «дихають» тривалентним залізом з навколишніх порід. Чому водоспад у Антарктиді червоний? 6.14
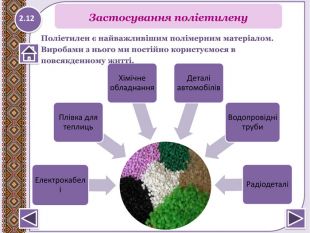
… поліетилен може зберігатися в ґрунті близько 200 років. … існує полімер, який здатен розтягуватись і скорочуватись як людський м’яз. Швейцарські хіміки Кюн і Тюркауч створили полімерну плівку, яка здатна під дією лугу розтягуватись, а під дією кислот скорочуватись. Якщо з цієї плівки створити м’яз товщиною 1 см, то він підніме вантаж 100 кг. … перші чоботи, аналоги гумових, винайшли індіанці. Ноги опускали в сік гевеї, потім деякий час тримали над димом. Так повторювали кілька разів. … якщо дрібні обрізки лінолеуму засипати в тару з під масляної фарби, залити ацетоном і геометрично закрити, то через півдоби можна отримати універсальний клей.6.15 Чи взнаєте ви, що….
… поліетиленовий пакет добре знайомий нам із повсякденного життя. Виявилося, що він є однією із причин вимирання велетенських черепах, основною їжею яких є медузи. З’ясувалося, що черепахи помилково вважають цей предмет медузами і ковтають його. Так під час розтину однієї із загиблих істот в її шлунку знайшли аж 15 таких виробів.… жувальна гумка уперше для продажу була виготовлена у 1869 р. американським винахідником Томасом Адамсом із соку тропічного дерева. Вона настільки смакував американцям, що стала частиною їхнього життя. Основу її становить полімер. 6.16 Чи взнаєте ви, що….
-
 Присяжна Олена Володимирівна 15.11.2022 в 13:33Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Присяжна Олена Володимирівна 15.11.2022 в 13:33Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Маринкова Майя Євгенівна 06.01.2022 в 22:58Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Маринкова Майя Євгенівна 06.01.2022 в 22:58Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку