Методична розробка :"Алгоритми розв'язання задач на визначення хімічногоелемента до теми:Періодична система хімічних елементів" елемента до теми :П
Алгоритми розв’зання задач на визначення хімічного елемента до теми : Періодична система хімічних елементів
Задача 1
Відношення молярних мас гідроксиду і карбонату двовалентного металу складає 1:1,28. Визначити формули відповідних сполук.
Дано :
![]()
_______________
Me(ОН)2 - ? Розв’язання :
Me С03 - ?
Загальна формула гідроксиду двовалентного металу - Me(ОН)2, а формула карбонату двовалентного металу - Me С03
За умовою задачі відношення молярних мас сполук : ![]()
Приймаємо , що Ar (Me)=x.
Молярна маса гідроксиду двовалентного металу M (Me(ОН)2)= x + 34 , а молярна маса карбонату двовалентного металу M (Me С03)= x+60.
Складаємо рівняння за відношенням молярних мас :
![]()
x+60 =1,28x+43,52 x = 58,9
Ar(Co)=58,9, Це Кобальт
Відповідь : формула гідроксиду – Co(ОН)2; Карбонату- Co С03
Задача 2
При повному згоранні суміші двох двовалентних металів масою 7 г утворилась суміш оксидів масою 9,75, а при взаємодії цієї ж суміші з хлоридною кислотою виділилась 2,24 л газу і нерозчинний осад масою 4,6 г. Визначте метал, що входить до складу суміші.
Розв’язання :
Дано:
m сум. металів = 7 г
m сум. оксидів металів = 9,7 г
 V газу = 2,24 л m нероз. осаду = 4,6 г
V газу = 2,24 л m нероз. осаду = 4,6 г
Метал - ?
1. З хлоридною кислотою прореагував один з металів, в результаті реакції виділився водень об’ємом 2,24 л.
𝑀𝑒1 + 2𝐻𝐶𝑙 = 𝑀𝑒𝐶𝑙2 + 𝐻2
n![]() .
.
n(𝐻2) = n(𝑀𝑒1)
Відповідно маса першого металу дорівнює 𝑚сум– 𝑚𝑀𝑒1 = 7г – 4,6г = 2,4г
M![]() , що дорівнює атомній масі Магнію.
, що дорівнює атомній масі Магнію.
2𝑀𝑔 + 𝑂2 = 2𝑀𝑔𝑂, m(MgO) = 40 г⁄моль.
𝑚(𝑀𝑔𝑂) = 0,1моль ∙ 40 г⁄моль = 4г
2. Маса другого металу дорівнює масі нерозчинного осаду 4,6 г, а маса його оксиду дорівнює
𝑚сум.оксид − 𝑚(𝑀𝑔𝑂) = 9,75 − 4 г = 5,75 г
За рівнянням для другого металу
2𝑀𝑒 + 𝑂2 = 2𝑀𝑒𝑂
знаходимо кількість речовини 𝑛2(𝑀𝑒) і 𝑛2(𝑀𝑒𝑂)
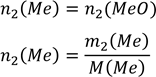
![]()
Приймаємо 𝑀2(𝑀𝑒) = 𝑥
𝑀2(𝑀𝑒𝑂) = 𝑥 + 16
Складаємо рівняння
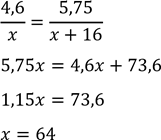
𝑀(𝐶𝑢) = 64 г⁄моль, другий метал – мідь .
Відповідь: суміш вихідних металів містила магній і мідь.
Задача 3
При взаємодії водневої сполуки одновалентного металу з водою, маса якої 100 г, одержали розчин із масовою часткою розчиненої речовини 2,38%. У результаті взаємодії маса реакційної суміші зменшилась на 0,2 г. Визначте метал і назвіть його водневу сполуку.
Дано :
m ( H2O) = 100 г W(MeOH) = 2,38%
m ( зменш.сум) = 0,2 г
_________________________
(Me), МеН - ? Розв’язання :
В результаті взаємодії гідриду металу з водою утворюється гідроксид металу та витискується водень МеН +𝐻2О = МеОН+ 𝐻2 .
Маса водню, що виділився, дорівнює зменшенню реакційної суміші -
0,2 г . Кількість речовини водню: n ![]() = 0,1 моль .
= 0,1 моль .
За рівнянням реакції кількості речовин реагентів і продуктів реакції однакові: n (MeH) = n (MeOH) = n (𝐻2) = 0,1 моль.
Якщо атомну масу металу прийняти за х, молярна маса гідриду металу дорівнює х + 1, а молярна маса гідроксиду металу дорівнює х + 17. Відповідно m (MeH) = 0,1 (x + 1), a m (MeOH) = 0,1 (x + 17)
Маса розчину гідроксиду металу:
mроз (MeOH)= 100 + 0,1(𝑥 + 1) − 0,2
Масова частка MeOH у розчині дорівнює 2,38% або 0,0238.
Користуючись залежністю
![]()
визначаємо атомну масу невідомого металу за рівнянням :

Відповідь : Цей метал літій, воднева сполука LiH (літій гідрид).
Задача 4.
Лужний метал масою 2, 221 г прореагував з надлишком брому. В результаті утворилось 4,297 г броміду. Визначити метал.
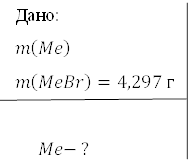
Розв’язання
Складаємо рівняння реакції взаємодії лужного (одновалентного) металу з бромом:
2𝑀𝑒 + 𝐵𝑟2 = 2𝑀𝑒𝐵𝑟
𝑛(𝑀𝑒) = 𝑛(𝑀𝑒𝐵𝑟) , приймаємо 𝑀(𝑀𝑒) = 𝑥,
n![]()
Складаємо рівняння
![]()
4,297x=2,221(x+80)
4,297x-2,221x=177,68 2,076x=177,68 x=85,5 𝐴𝑟(𝑅𝑏) = 85,47
Відповідь: Цей метал рубидій
Задача 4.
Лужний метал масою 2, 221 г прореагував з надлишком брому. В результаті утворилось 4,297 г броміду. Визначити метал.
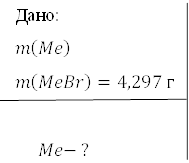
Розв’язання
Складаємо рівняння реакції взаємодії лужного (одновалентного) металу з бромом:
2𝑀𝑒 + 𝐵𝑟2 = 2𝑀𝑒𝐵𝑟
𝑛(𝑀𝑒) = 𝑛(𝑀𝑒𝐵𝑟) , приймаємо 𝑀(𝑀𝑒) = 𝑥, n![]()
Складаємо рівняння
![]()
4,297x=2,221(x+80)
4,297x-2,221x=177,68 2,076x=177,68 x=85,5 𝐴𝑟(𝑅𝑏) = 85,47
Відповідь: Цей метал рубидій
Задача 5.
Дві пластинки, які мають однакові масу і виготовлені з металу, що утворює двозарядні йони, занурили одну в розчин купрум (II) сульфату ,а другу в розчин плюмбум (II) сульфату. Через деякий час маса пластинки, зануреної в розчин купрум (II) сульфату зменшилась на 3,6% , а маса другої пластинки збільшилась на 6,675%. Зменшення молярної концентрацїі обох розчинів було однаковим. Визначити метал.
Розв'язання
Маса пластинки при витисненні ртуті збільшилась на 6,675%. Маса пластинки збільшилась за рахунок різниці атомних мас ртуті і металу , який перейшов у розчин.
Приймаємо атомну масу невідомого металу за х.
Вираз для різниці атомних мас буде (201 - x), а зменшення маси пластинки при витисненні ртуті буде відповідно (x - 64)
Маса пластинки в обох випадках однакова, то обидва вирази можна прирівняти :
![]() , або
, або ![]()
6,665(x-64) = 3,6 (201-x)
6,665x – 426,56 = 723,6-3,6x
10,265x = 1150,16 x = 112
Ar (Cd )= 112.
Відповідь: Пластинки виготовлені з кадмію, Аr (Cd) = 112.
Задача 6 .
Під час спалювання 3 г двовалентного металу утворилось 4,2 г його оксиду. Визначити елемент.
Дано :
m ( Me ) = 3 г m (MeO) = 4, 2 г ____________________ Me - ?
Розв'язання
За рівнянням реакції горіння двовалентного металу
2𝑀𝑒 + 𝑂2 = 2𝑀𝑒𝑂
визначаємо масу кисню
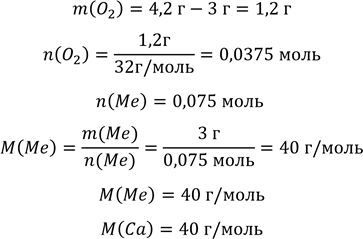
Відповідь : Це Кальцій.
Задача 7 .
Вищий оксид елемента відповідає формулі 𝐸2𝑂5. Сполука елемента з воднем - газ , що містить 17,65% Гідрогену. Визначити елемент .
Дано :
𝐸2𝑂5
𝑤(𝐻2) = 17,65%
_______________
Е - ?
Розв'язання :
Вищому оксиду 𝐸2𝑂5 віповідає воднева сполука складу 𝐸𝐻3 .
Визначаємо масову частку елемента у водневій сполуці:
Место для уравнения.
𝑤(𝐸)= 100% - 17,65% = 82,35% або 0,8235
![]() , приймаємо атомну масу елемента за х .
, приймаємо атомну масу елемента за х .
Складаємо рівняння
𝑥 = 0,8235 𝑥 + 2,4705
0,1765 𝑥 = 2,4705
𝑥 = 14
Ar (N) = 14
Відповідь : Цей елемент Нітроген
Задача 8 .
Хімічний елемент утворює з киснем оксид складу EO2 , густина парів якого за повітрям 3,62. Визначити елемент.
Дано :
EO2
Dпов (EO2) = 3,62
______________________________ E - ?
Розв’зання
Визначаємо молярну масу оксиду(EO2):
Место для уравнения.
М (EO2) =Dпов (EO2) ∙ 𝐴𝑟 (повітря)=3,62 ∙ 29 г/моль = 105 г/моль Приймаємо Ar (E) за х, відповідно Мr (EO2) = х + 16 ∙ 2 = 105
х = 73 Ar( Ge) = 73
Відповідь : Цей елемент Германій
Задача 9 .
Визначити місце елемента в періодичній системі за наступними даними: сполука з воднем EH2, вищій оксид - тверда кристалічна речовина з молекулярною масою 127.
Дано :
Воднева сполука EH2 Место для уравнения.
Вищий оксид EO3
Mr (EO3 ) = 127 ___________________
Е -?
Розв’язання :
Приймаємо атомну масу елемента за х.
Молекулярна маса оксиду складу EO3 відповідає математичному рівнянню:
𝑥 + 3∙16 = 127
𝑥 + 48 = 127
𝑥 =79
Ar (Se)= 79
Відповідь : Цей елемент Селен, порядковий номер 34, знаходиться в VI групі , головна підгрупа , 4 період .
Задача 10 .
Метал, що виявляє ступінь окиснення +4 , утворює оксид із масовою часткою оксигену 40% . Який це метал?
Дано: Розв’язання
 Ме +4 1. Метал ,що виявляє ступінь окиснення +4, утворює оксид складу МеО2.
Ме +4 1. Метал ,що виявляє ступінь окиснення +4, утворює оксид складу МеО2.
W(0)=40% 2. Масова частка металу в оксиді w(Me) = 100% - w(0) = 100%-40% = 60% або 0,6.
Ме-?
3. Приймаємо атомну масу металу за х, молярна маса оксиду дорівнює виразу 𝑥 + 2 ∙ 16
4. Складаємо вираз для визначення атомної маси металу: Ar (Me) = ![]() х
х ![]()
або х = 0,6 (х + 32)
0,4 х = 19,2 Х = 48
Ar (Ti) = 48
Відповідь: Цей метал титан.


про публікацію авторської розробки
Додати розробку
