Методична розробка до виконання лабораторної роботи з предмету «Хімія» на тему «Властивості і добування жирів» для здобувачів фахової передвищої освіти
Міністерство освіти і науки України
Кам’янський державний енергетичний технікум


Методична розробка
до виконання лабораторної роботи
з предмету «Хімія»
на тему «Властивості і добування жирів»
для здобувачів фахової передвищої освіти
Кривець А.А.
Камʼянське
2021
Укладач – Кривець А.А., викладач першої категорії.
Рецензент:
Н.В. Могіна – голова регіонального методичного об’єднання викладачів біології, екології і хімії, викладач фундаментальних дисциплін, спеціаліст вищої кваліфікаційної категорії, викладач-методист Кам’янського медичного коледжу.
Розглянуто і схвалено на засіданні ЦК природничо-наукових дисциплін Кам’янського державного енергетичного технікуму
Протокол № _ від ____________ року
Розглянуто і схвалено на засіданні методичної ради Кам’янського державного енергетичного технікуму
Протокол № __ від ____________ року
Розглянуто та рекомендовано для подальшого використання на заняттях, згідно навчальної програми, регіональним методичним об’єднанням викладачів біології і екології
Протокол № __ від ___________року
Укладач: Кривець А.А., викладач хімії та біології і екології, Кам’янського державного енергетичного технікуму.
Анотація: в даній методичній розробці питання теорії і практики об’єднані в єдину форму занять, починаючи з актуалізації теоретичних знань. Виконання дослідів побудоване як групове так і самостійне наукове дослідження: постановка задачі, її теоретичне обґрунтування та експериментальна перевірка. Лабораторні досліди виконуються за логічно побудованою схемою починаючи від дослідження властивостей ефірів, продовжуючи дослідженням хімічних властивостей розчинності жирів в різних розчинниках і завершуючи одержанням мила і проведення експерименту для доведення специфічних властивостей мила.

Зміст
- Вступ…………………………………………………………………….4
- Техніка безпеки …………………..…………………………………….5
- Естери, їх властивості ………………………………………………….7
- Жири їх властивості .…………………………………………………..8
- Лабораторні досліди….………………………………………………...10
- Питання для самоперевірки……………………………………………12
- Перелік використаної літератури……………………………………...13
ВСТУП
Складні ефіри - естери - це похідні кисневмісних кислот, у яких гідроксогрупи заміщені залишками спирту або фенолу. Найважливішою хімічною властивістю естерів є їх взаємодія з водою - гідроліз або омилення. Спосіб добування естерів базується на реакції етерифікації: взаємодія карбонових кислот з спиртом.
Жири - це повні естери триатомного спирту гліцерину та вищих карбонових кислот. Жири, як правило, легші за воду, не розчиняються в ній, добре розчиняються в органічних розчинниках. Жири, як і всі естери, під час нагрівання вступають в реакцію гідролізу) - омилюються.
Головною метою проведення даних лабораторних дослідів є формування та закріплення знань здобувачів фахової передвищої освіти про естери, жири, мило: їх склад, будову, номенклатуру, методи добування, фізичні і хімічні властивості, галузі застосування через наочний приклад.
Розвинути вміння і навички в написанні рівнянь реакцій, розширити знання учнів про розповсюдження і застосування естерів і жирів.
Розширити уявлення здобувачів освіти про органічні речовини, поглибити знання про генетичний зв'язок між органічними речовинами. Виховання зацікавленості, логічного мислення, розвитку творчих здібностей, що створює ситуацію успіху, за якої кожен відчуває свою інтелектуальну спроможність.
ТЕХНІКА БЕЗПЕКИ
Загальні правила роботи в хімічній лабораторії
1. У хімічній лабораторії потрібно працювати в халаті.
2. Забороняється приносити в лабораторію верхній одяг, залишати сумки в проходах.
3. У лабораторії забороняється бігати, голосно розмовляти, їсти, курити.
4. Кожен здобувач освіти повинен працювати тільки на закріпленому за ним робочому місці.
5. Робоче місце потрібно утримувати в чистоті і порядку, не загромаджувати його предметами, які не стосуються даної роботи.
6. Категорично забороняється працювати в лабораторії самостійно у відсутності лаборанта чи викладача.
7. Починати виконання лабораторної роботи можна лише з дозволу викладача.
8. При виконанні будь-якої роботи потрібно дотримуватись обережності, пам’ятаючи, що неакуратність, неуважність, недостатнє ознайомлення з приладами і властивостями речовин може бути причиною нещасних випадків.
9. Хімічні реакції слід проводити у строгій відповідності до методичних вказівок. Категорично забороняється будь-яке відхилення від умов виконання дослідів, що описані в методичній розробці.
10.Під час роботи слід зберігати тишу, порядок і дотримуватися правил безпеки. Забороняється займатися сторонніми справами.
11.Після закінчення роботи необхідно прибрати робоче місце, вимкнути електроприлади, перекрити газ і воду, здати робоче місце лаборантові (черговому студентові).
Естери, їх властивості
Естери – це похідні кисневмісних кислот, у яких гідроксигрупи кислоти заміщені залишками спирту або фенолу.
Загальна формула естерів органічних кислот:
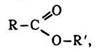
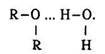
де R, R` – вуглеводневі радикали.
Класифікація. Розрізняють естери органічних та мінеральних кислот (азотної, сірчаної, фосфорної тощо). Серед естерів дво- чи багатоосновних кислот є кислі та середні.
Хімічні властивості. Найважливішою хімічною властивістю сетерів є їх взаємодія з водою – гідроліз або омилення. Якщо естер, наприклад оцтово-етиловий, нагрівати з водою за наявності неорганічної кислоти (або лугу), утворюються оцтова кислота (чи її сіль) та етиловий спирт:
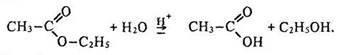
Гідроліз естерів – процес, протилежний реакції етерифікації:
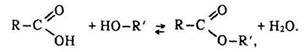
Щоб змістити рівновагу праворуч, точно в бік утворення естеру, треба за принципом Ле Шательє взяти в надлишку вихідну кислоту або спирт, відігнати естер, що утворюється, або видалити воду. Луг необоротно зміщує рівновагу в бік гідролізу, оскільки зв’язує кислоту, утворюючи сіль:
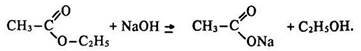
Одержання. Природні естери екстрагують з рослин органічними розчинниками. Промисловий спосіб їх добування базується на реакції етерифікації:
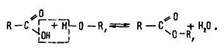
Слід пам’ятати, що в цій реакції вода утворюється з гідроксигрупи кислоти та атома водню спирту.
Використання. Естери застосовують як розчинники у харчовій промисловості (для приготування фруктових есенцій), косметиці, медицині (ізоамілнітрат, етилнітрат).
Жири, їх властивості
Жири – це повні естери триатомного спирту гліцерину та вищих жирних (аліфатичних) монокарбонових кислот. їх загальна формула
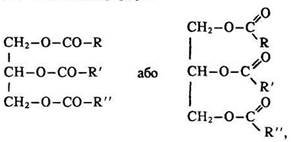
де R, R` і R" – радикали алканових і алкенових кислот з нерозгалуженим ланцюгом. Найчастіше це радикали стеаринової С17Н35СООН (СН3–(СН2)16–СООН), пальмітинової С15Н31СООН (СН3–(СН2)14–СООН) і олеїнової С17Н33СООН (СН3–(СН2)7–СН=СН–(СН2)7–СООН) кислот.
Хімічні властивості.
Гідрування. Чисті тригліцериди, особливо утворені алкановими кислотами, – хімічно досить інертні. Тригліцериди, що є похідними алкенових кислот, вступають в реакції, характерні для ненасичених сполук, наприклад, у реакцію гідрування (гідрогенізації):
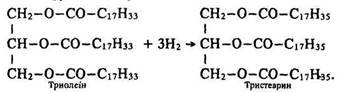
На реакції гідрогенізації базується спосіб перетворення рідких жирів на тверді, який застосовується в промисловості Для виготовлення маргарину.
Гідроліз. Жири, як і всі естери, під час нагрівання за наявності каталізаторів (оксидів магнію, кальцію, цинку, кислот) вступають в реакцію гідролізу – омилюються:
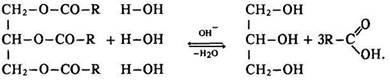
Ця реакція є оборотною. Для зміщення рівноваги праворуч – у бік утворення гліцерину та карбонової кислоти додають луг. Реакцію гідролізу жирів використовують у промисловості для добування гліцерину, карбонових кислот, мила.
Окислення. Природні жири під час зберігання на повітрі псуються, оскільки під дією активних ферментів частково розкладаються на вільні карбонові кислоти, а ненасичені жирні кислоти окислюються з утворенням альдегідів і кетонів.
Одержання. Жири виділяють з рослинних і тваринних організмів. Спосіб добування жирів на основі реакції етерифікації гліцерину та жирних кислот, винайдений французьким вченим М. Бертло в 1854 р., є економічно невигідним, і тому в промисловості не застосовується.
Використання. Жири як одна з головних складових частин раціону харчування людини та тварини необхідні для забезпечення нормальної життєдіяльності. В організмі під дією ферментів вони гідролізуються, потім з продуктів гідролізу синтезуються нові жири, характерні для даного організму.
Велика кількість жирів використовується для виробництва мила, гліцерину, карбонових кислот, плівкоутворювачів (оліф, лаків), а також у фармацевтичній та косметичній промисловості.
ЛАБОРАТОРНІ ДОСЛІДИ
Мета роботи:
Одержати в лабораторних умовах складні ефіри і мило. Ознайомитись з фізичними і хімічними властивостями жирів та мила.
Матеріали та обладнання:
Етанол (етиловий спирт), оцтова кислота, концентрована сульфатна кислота, етилацетат, рослинна олія. стеарин, гідроксид натрію, хлорид натрію, фенолфталеїн, хлорид кальцію, нітрат плюмбуму (ІІ), хлоридна кислота.
Спиртівка, штатив з пробірками, пробіркотримач, сірники.
Дослід 1. Одержання етилетаноату.
https://www.youtube.com/watch?v=J3ueiRBUKWA
В пробірку налийте 1 мл етанолу, 2 мл оцтової кислоти та 1 мл конц. сульфатної кислоти. Суміш взбовтайте та нагрійте на водяній бані, доки не відчуєте приємний аромат. Дайте рідині охолонути, потім вилийте в стакан з холодною водою. Зверніть увагу на запах ефіру. Де збирається ефір? Напишіть рівняння реакції.
Дослід 2. Розчинність , жирів у різних розчинниках.
https://www.youtube.com/watch?v=sLHd9znDv8I&t=7s
В три пробірки налийте по 1-2 краплі рослинної олії. Прилийте у першу 1 мл води, у другу - етанол, у третю - етилацетат. Взбовтайте вміст пробірки і дайте постояти. Чи у всіх речовинах розчиняються жири? Які речовини є добрими розчинниками жирів, а які поганими? Зробіть висновок про розчинність жирів.
Дослід 3. Одержання мила.
https://www.youtube.com/watch?v=Of9oztl_O5k&t=6s
В пробірку помістите 0,2 г стеарину, прилийте 2 мл води і нагрійте суміш, щоб стеарин розплавився. Після цього вливайте поступово струшуючи пробірку, розчин гідроксиду натрія. Що спостерігаєте?
Напишіть рівняння. До одержаного розчину прилийте 5 мл насиченого розчину хлориду натрія. В ньому стеарат натрія (мило) не розчинюється і вспливає на поверхню рідини.
Дослід 4. Властивості мила.
- https://www.youtube.com/watch?v=Q1kw0oOsihE
- https://www.youtube.com/watch?v=quWRs9ZBc_A
В чотири пробірки налийте розчин мила в першу додайте 1-2 краплі фенолфталеїну, в другу 1 мл розчину хлорида кальція, в третю - нітрату плюмбума (II), в четверту - хлоридної кислоти. Що спостерігаєте? Написати рівняння відповідних реакцій у молекулярному вигляді.
Зробіть висновок:
Питання для самоперевірки:
1. Що таке реакція етерифікації?
2. Написати рівняння реакцій добування простого та складного ефірів.
3. Яка існує різниця у будові твердих та рідких жирів?
4. Напишіть структурну формулу жира утвореного гліцерином з масляною, олеїновою та стеариновою кислотами.
Тест

Список використаної літератури:
- Величко Л.П., « Хімія» , Підручник для 10 класу закладів загальної середньої освіти, Київ: Школяр, 2018
2. Акімова I.I., Запорожець Н.В. Зошит для лабораторних та практичних робіт з
хімії. 9 клас. – Харків: Ранок, 2000. – с.64.
3. Астахов А.И., Касьяненко А.И. Химия – 4-е изд. – К.: Вища школа., 1982. - с.296.
4. Буринська Н.М. Основи загальної хімії, 11кл.: Пробний підручник для середніх загальноосвітніх навчальних закладів з поглибленим вивченням хімії. – К.; Ірпінь: ВТФ »Перун», 1997.- с. 176.
5. Буринська Н.М., Величко Л.П. Хімія, 10 кл.: Пщручник для середніх шкіл. – К.: Ірпінь: ВТФ «Перун», 2000. – с. 176.
6. Буринська Н.М., Величко Л.П. Хімія, 11 кл.: Підручник для середніх загальноосвніх закладів. – К.: Ірпінь: ВТФ «Перун», 2000. – с. 176.
7. Домбровський А.В., Лукашова H.I., Лукашов С.М. Хімія, 10-11 кл.: Органічна
хімія: Підручник для 10-11кл. середньої загальноосвітньої школи. – К.: Освіта, 1998. -
с. 192.
8. Чайченко Н.М., Скляр A.M. Основи загальної хімії: Підручник для 11кл.
середніх загальноосвітніх навчальних шкіл з поглибленим вивченням хімії. 2-ге вид.,
перероб. - К.: Освта, 1997. - с. 144.
9. http://zno.academia.in.ua/mod/book/view.php?id=3808&chapterid=1632


про публікацію авторської розробки
Додати розробку
