Презентація "Класифікація хімічних реакцій"
Презентація "Класифікація хімічних реакцій" допоможе вчителю узагальнити матеріал на прикінці вивчення теми 2 "хімічні реакції".





















ВСТУП Хімічні реакції – процеси, в результаті яких з одних речовин утворюються інші, що різняться від попередніх складом і будовою. Під час хімічних реакцій відбувається руйнування старих зв’язків між атомами і утворення нових. Ознаки хімічних реакцій: виділення газу; утворення осаду; 3) зміна кольору речовин; виділення або поглинання тепла і світла. Розглянемо класифікацію хімічних реакцій за різними ознаками. зміст
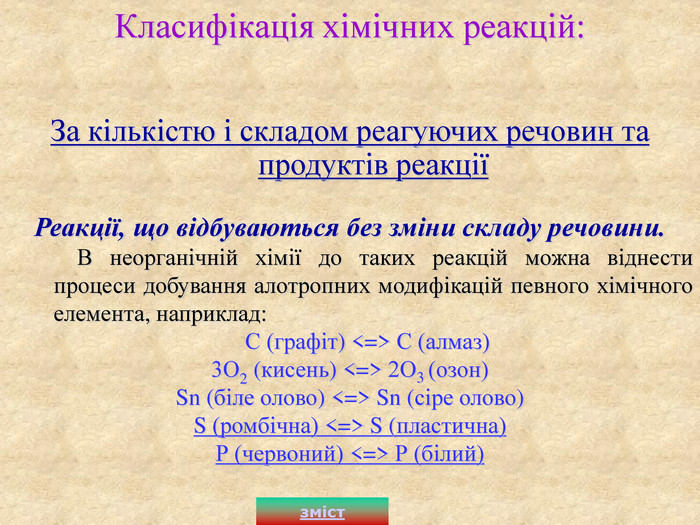
За кількістю і складом реагуючих речовин та продуктів реакції Реакції, що відбуваються без зміни складу речовини. В неорганічній хімії до таких реакцій можна віднести процеси добування алотропних модифікацій певного хімічного елемента, наприклад: С (графіт) <=> С (алмаз) 3О2 (кисень) <=> 2О3 (озон) Sn (біле олово) <=> Sn (сіре олово) S (ромбічна) <=> S (пластична) Р (червоний) <=> Р (білий) Класифікація хімічних реакцій: зміст
Реакції, що відбуваються зі зміною складу речовин. Реакції сполучення– це такі реакції, під час яких з двох і більше речовин утворюється одна складна речовина. В неорганічній хімії реакції сполучення можна розглядати на прикладі реакцій добування сульфатної кислоти із сірки: а) добування сульфур (IV) оксиду: S + O2 SO2 - з двох простих речовин утворюється одна складна; б) добування сульфур (VІ) оксиду: 2SO2 + O2 <=> 2SO3 - з простої і складної речовини утворюється одна складна; в) добування сульфатної кислоти: SO3 + H2O = H2SO4 - з двох складних речовин утворюється одна складна. зміст класифікація реакцій
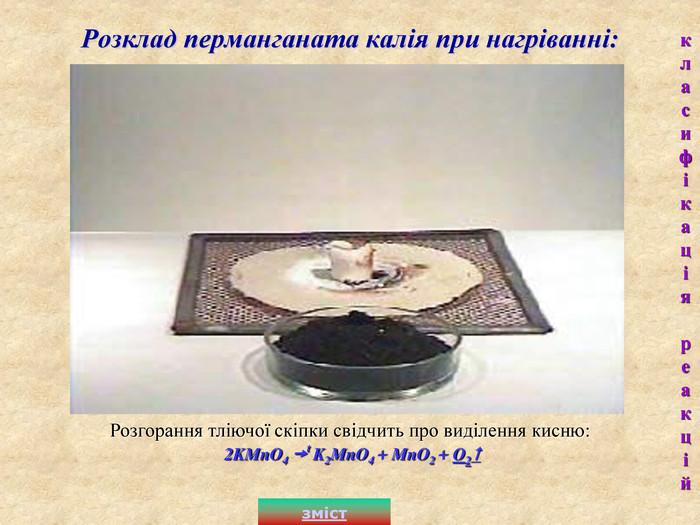
2. Реакції розкладу– це такі реакції, під час яких з однієї складної речовини утворюється кілька нових. В неорганічній хімії прикладом таких реакцій є реакції добування кисню в лабораторії: а) розклад меркурій (II) оксиду: 2HgO t 2Hg + O2 - з однієї складної речовини утворюються дві простих; б) розклад калія нітрата: 2KNO3 t 2KNO2 + O2 - з однієї складної речовини утворюються одна проста і одна складна; в) розклад перманганата калія: 2KMnO4 t K2MnO4 + MnO2 + O2 - з однієї складної речовини утворюються дві складних і одна проста. зміст класифікація реакцій
3. Реакції заміщення– це такі реакції, під час яких атоми простої речовини заміщають атоми одного з елементів складної речовини. Прикладом таких реакцій можуть бути реакції, що характеризують властивості металів: а) взаємодія лужнихабо лужноземельних металів з водою: 2Na + 2H2O = 2NaOH + H2 Са + 2Н2О = Са(ОН)2 + H2 б) взаємодія металів з кислотами в розчинах: Zn + 2HCl = ZnCl2 + H2 в) взаємодія металів з солями в розчинах: Fe + Cu SO4= FeSO4 + Cu г) металотермія: 2Al + Cr2O3 t Al2O3 + 2Cr зміст класифікація реакцій
4. Реакції обміну – це такі реакції, під час яких дві складні речовини обмінюються своїми складовими частинами. В неорганічній хімії це може бути блок реакцій, що характеризують властивості лугів: а) реакція нейтралізації, з утворенням солі і води: NaOH + HNO3 = NaNO3 + H2 O в йонному вигляді: ОН- + Н+ = Н2О б) реакція між лугом і сіллю з утворенням газу: 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2 H2O в) реакція між лугом і сіллю з утворенням осаду: СиSO4 + 2KOH = Cu(OH)2 + K2SO4 зміст класифікація реакцій
2. За зміною ступеня окиснення хімічних елементів утворених речовин: Окисно-відновні реакції: Окисно-відновні реакції – реакції, які відбуваються із зміною ступеня окиснення елементів. 0 +1 +2 0 0 0 +2 -2 а) Mg + H2SO4 = MgSO4 + H2 б) 2Мg +O2 = 2MgO 0 +2 0 +2 Mg – 2eЇ Mg – окиснення Mg – 2eЇ Mg 2 – окиснення +1 0 0 -2 2Н + 2eЇ H2 – відновлення O2 + 4eЇ 2O 1 - відновлення зміст класифікація реакцій
Неокисно- відновні реакції : До них відносяться реакції йонного обміну: Na2CO3 + 2HCl = 2NaCl + CO2 + H2O, реакції сполучення: Li2O + H2O = 2LiOH а також реакції розкладу: 2Fe(OH)3 t Fe 2O3 + 3H2O Неокисно-відновні реакції – реакції, що відбуваються без зміни ступенів окиснення елементів. зміст класифікація реакцій
3. З участю каталізатора: Каталізатори – це речовини, які приймають участь в хімічних реакціях, змінюючи їх швидкість та напрям, і при цьому після закінчення реакції залишаються незмінними якісно і кількісно. Некаталітичні реакції: Некаталітичні реакції - реакції, що відбуваються без участі каталізатора: 2HgO t 2Hg + O2 2Al + 6HCl t 2AlCl3 + 3H2 Каталітичні реакції: Каталітичні реакції – реакції, які відбуваються з участю каталізатора: t,MnO2 2KClO3 2KCl + 3O2 P,t CO + NaOH H-CO-ONa H2O 4Al + 3I2 2Al2I3 зміст класифікація реакцій
4. За агрегатним станом реагуючих речовин (фазовому складу): Гетерогенні реакції: Гетерогенні реакції – реакції, в яких реагуючі речовини і продукти реакції перебувають в різних агрегатних станах (в різних фазах): FeO(т) + СО(г) Fe(т) + СО2(г) + Q 2Al(т) + 3СuСl2 (р-р) = 3Сu(т) + 2AlCl3 (р-р) CaC2(т) + 2H2O(ж) = C2H2 + Ca(OH)2(р-р) Гомогенні реакції: Гомогенні реакції – реакції, в яких реагуючі речовини і продукти реакції перебувають в однакових агрегатних станах (в однакових фазах): 2С2Н6(г) + 7О2(г) 4СО2(г) + 6Н2О(г) 2 SO2(г) + O2(г) = 2SO3(г) +Q H2(г) + F2(г) = 2HF(г) зміст класифікація реакцій
5. За тепловим ефектом: Екзотермічні реакції: Екзотермічні реакції – реакції, що відбуваються з виділенням енергії в зовнішнє середовище. До них відносяться майже всі реакції сполучення. Екзотермічні реакції, які відбуваються з виділенням світла, відносяться до реакцій горіння, наприклад: 4Р + 5О2 = 2Р2О5 ΔH = - 560 кДж СН4(г) + 2О2(г) = О2(г) + 2Н2О (р), ΔΗ = -890 кДж Fe + S = FeS, ΔΗ = -100,26 кДж зміст класифікація реакцій
Эндотермічні реакції: Эндотермічні реакції – реакції, які відбуваються з поглинанням енергії. До них відносяться майже всі реакції розкладу, наприклад: Випалювання вапняку: СаСО3 t CaO + CO2 - Q ΔH = + Кількість енергії, яка виділяється або поглинається в результаті реакції, називають тепловим ефектом реакції, а рівняння хімічної реакції із зазначеним тепловим ефектом називають термохімічним рівнянням, наприклад: H2(г)+ Cl2(г) = 2HCl(г) ΔH = + 92.3 кДж N2(г) + O2(г) = 2NO ΔH = + 90.4 кДж зміст класифікація реакцій
6. За оборотністю процесу: Необоротні реакції: Необоротні реакції при певних умовах протікають тільки в одному напрямку. До таких реакцій можна віднести всі реакціїї обміну, що супроводжуються утворенням осаду, газу або малодисоціюючої речовини(води), а також всі реакції горіння: класифікація реакцій NaCl+AgNO3=NaNO3+AgCl↓ H2SO4+MgCO3=MgSO4+H2O+CO2↑ NaOH+HCl=NaCl+H2O. 2Mg + O2 = 2MgO 4Li + O2 = 2Li2O C + O2 = CO2 зміст


про публікацію авторської розробки
Додати розробку