Презентація хімія 8 клас "Основні класи неорганічних сполук"
Про матеріал
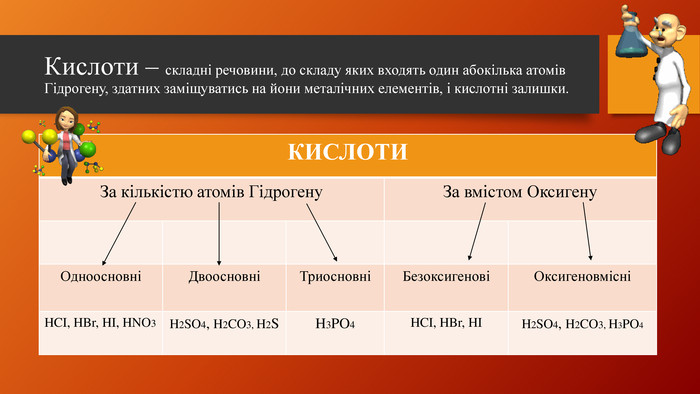
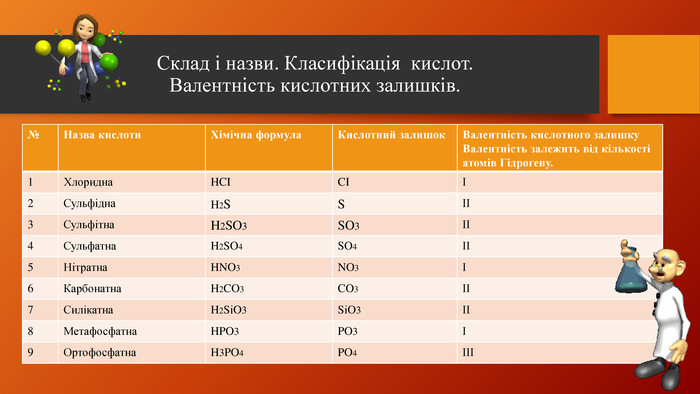
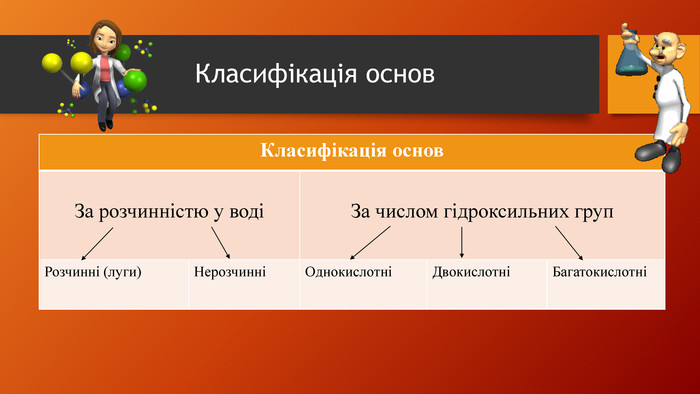
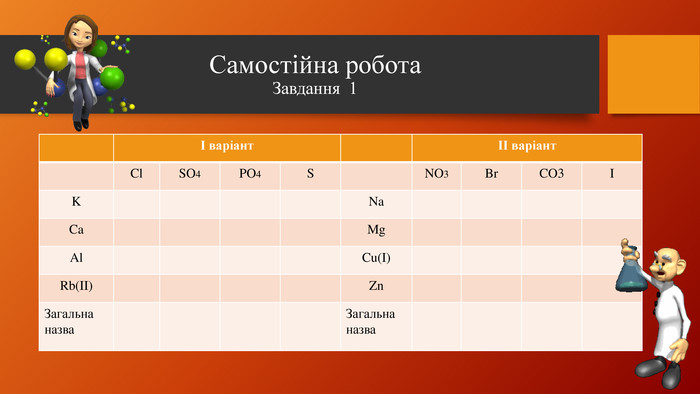
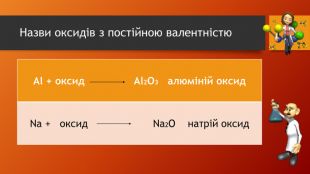
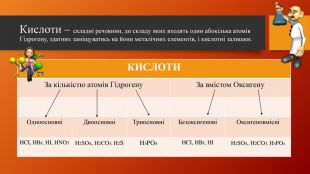
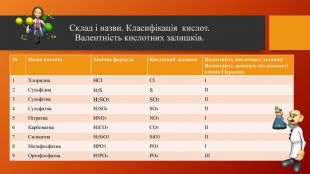
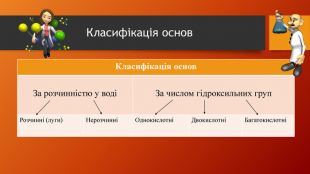
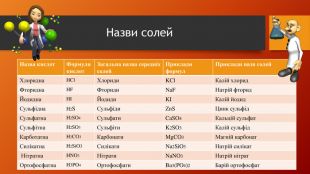
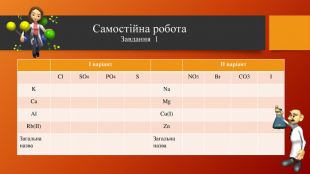
У презентації розкрита тема "Основні класи неорганічних сполук". Дана розробка допоможе вчителям провести урок, як дистанційно так і в хімічній аудиторії. У презентації наведені приклади та форми проведення заключного етапу уроку, що допоможе краще з'ясувати як діти засвоїли матеріал. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
ДЯКУЮ, КОЛЕГО!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку