Методична розробка уроку "Ферум як представник металічних елементів"
Урок з хімії "Ферум як представник металічних елементів", урок з використанням інформаційно-комунікаційних технологій, 10 клас. Тип уроку: засвоєння нових знань, вид уроку: дослідження.
Тема програми: «Металічні елементи та їх сполуки»
Тема уроку: «Ферум як представник металічних елементів
Мета уроку: поглибити знання про метали побічних підгруп
на прикладі Феруму; вивчити фізичні та хімічні
властивості заліза, засвоїти знання про
застосування заліза
Тип уроку: урок засвоєння нових знань
Вид уроку: урок – дослідження
Методи проведення: інноваційні: перегляд презентації, інтерактивні:
робота в групах, бліц-опитування,
«Хімічні читання» /прислів’я/; традиційні: розповідь з елементами бесіди, читання легенди, відео досліди: «Намагнічування», «Взаємодія заліза з киснем», «Взаємодія заліза з хлором», «Взаємодія заліза з сіркою», «Взаємодія заліза з кислотами», фронтальне опитування, самостійна робота.
КМЗ уроку: ряд напруг металів, періодична система хімічних елементів Д. І. Менделєєва, презентації, зразки виробів із заліза, магніт), яблука, мультимедійне обладнання.
Міжпредметні зв’язки: світова література, фізика, біологія, історія,
географія, математика, англійська мова,
астрономія, матеріалознавство, слюсарна справа
План проведення уроку
І. Організаційна частина. Перевірка готовності учнів до уроку.
ІІ. Актуалізація пізнавальної діяльності учнів.
ІІІ. Мотивація навчальної діяльності. Повідомлення теми, мети, завдань уроку.
ІV. Вивчення нового матеріалу
План вивчення
4.1 Ферум як хімічний елемент
4.2 Поширення в природі
4.3 Фізичні властивості заліза
4.4 Хімічні властивості заліза
4.5 Застосування
Хід уроку
І. Організаційний етап
Перевірка присутності учнів на уроці та готовності їх до уроку.
Музична пауза… /Пісня «Хімічні елементи»/
ІІ. Актуалізація опорних знань учнів
Бліц-опитування
- Який розділ хімії ми вивчаємо?
- Які групи металів за будовою останнього енергетичного рівня ви
знаєте?
- Охарактеризуйте властивості лужних, лужноземельних металічних
- елементів та алюмінію. Які з них спільні, а які відмінні?
- Від чого залежить хімічна активність металічного елемента?
- Який метал найпоширеніший на Землі?
- Опишіть фізичні властивості алюмінію.
- Опишіть хімічні властивості алюмінію.
- Які сполуки Алюмінію ви знаєте?
- Які властивості виявляють алюміній оксид та алюміній гідроксид?
ІІІ. Мотивація навчальної діяльності. Повідомлення теми, мети уроку
1. А чи знаєте ви що… У Єгипті в період Давнього й Нового царства цей метал спочатку застосовувався для ювелірних виробів – амулетів і прикрас. Ще в 14 ст. до н.е. він вважався дорогоцінним металом і з нього, як і з золота виготовляли прикраси. Поряд із золотом і сріблом входив до складу данини, що платили скорені народи Ассирії в 9 ст. до н.е.
- Тубільці Африки майже до середини 19 ст. вважали його дорожчим за всі метали. А жінки багатьох африканських племен носили на руках і ногах кільця, виготовлені з нього. Кількість прикрас на жінці свідчила про багатства її роду. Відомі випадки, коли на весілля наречену так навантажували прикрасами, що вона не могла рухатися без сторонньої допомоги. Мандрівники й мореплавці розповідали, що за один великий цвях тубільці могли віддати кілька ярдів місцевої тканини, а за десяток металічних костилів моряки одержували десять свиней.
Проблема:
Діти перед вами на столі багато різних речей (вироби із цього металу та яблука). А як ви думаєте, що їх об’єднує? І до чого тут яблуко? Давайте спробуємо на протязі уроку дізнатися про це.
ІV. Вивчення нового матеріалу
Сьогодні ми з вами продовжимо подорож по країні Металії, проведемо екскурсію туди, де мешкають метали побічних підруп, а саме Ферум та його сполуки


1. Ферум як хімічний елемент / розповідь викладача, демонстрація слайдів/
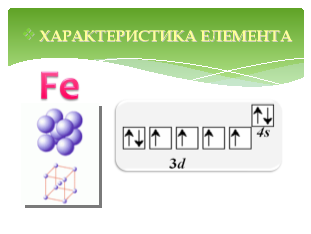
Ферум - металічний елемент VІІІ групи побічної підгрупи, ІV періоду. Зовнішній енергетичний рівень атома Феруму має типову для металічних елементів будову – на ньому розміщено 2 s – електрони. Водночас на d – підрівні третього енергетичного рівня міститься 6 електронів.
У сполуках Ферум проявляє ступені окиснення +2, +3, хоча за певних умов можна добути речовини зі ступенем окиснення +6.

2. Поширення Феруму в природі /розповідь легенди, демонстрація слайдів/
За поширенням у природі Феруму належить четверте місце, а серед металічних елементів – друге. Проста речовина залізо зустрічається переважно в уламках метеоритів, що досягли поверхні Землі.
До основних залізних руд відносяться:
Fe2O3 – червоний залізняк ( гематит)
Fe3O4 - магнітний залізняк (магнетит)
Fe2O3 · H2O – бурий залізняк (лимоніт)
FeS2 – залізний колчедан, пірит
FeCO3 – залізний шпат (сидерит)
В організмі людини міститься 4 – 5г Феруму. 65% із них – в гемоглобіні крові.
На території України знаходяться 30% розвіданих на території СНД покладів залізних руд. Найбільші родовища відкриті в Криворізькому, Кременчуцькому та Білогірському залізорудних басейнах.
Самородне залізо - крайня рідкість, в чистому вигляді зустрічається у вигляді метеоритного заліза. Найбільший у світі залізний метеорит, який спостерігали при падінні, 18 жовтня 1916 поблизу с. Богуславки, Далекосхідного краю /метеорит розбився на 2 осколки/


3. Фізичні властивості заліза /розповідь викладача, упереджувальні завдання / прислів’я/, демонстрація відеодосліду «Намагнічування»/
Чисте залізо – сріблясто – білий метал, досить м’який, ковкий, має сильні магнітні властивості. Густина заліза становить 7,87 г/см3, важкий метал, температура плавлення - 1539°С, тугоплавкий. Залізо та його сплави притягуються магнітом і легко намагнічуються в магнітному полі, є добрими провідниками струму й тепла. На магнітних властивостях заліза і його сплавів ґрунтується використання їх як матеріалу для виготовлення серцевин трансформаторів, вантажопідіймачів, телефонних мембран тощо.
У народному фольклорі людей різних національностей досить часто зустрічаються висловлювання про важливість і значення заліза у житті людини. Вам було підготувати прислів’я та приказки про залізо та його сплави.
Прислів’я:
«Скільки не бий по залізу, йому все дарма» (Азербайджанське)
«Терплячий навіть залізо розірве» (татарське)
«Людина міцніша за залізо, твердіша за камінь, ніжніша за троянду»(турецьке)
«З поганого заліза меча не викувати» (турецьке)
«Не гріте залізо не зігнеш» (українське)
«Залізо саме не стане м’яким» (корейське)
«Куй залізо, поки гаряче» (російське)
«Міцний як сталевий меч» (японське)
«Холодне залізо нема чого кувати» (сербське)
«У бою залізо дорожче, ніж золото» (татарське)
«Залізне здоровя» (українське)
4. Хімічні властивості заліза:
Мандруємо з вами далі і переходимо до вивчення хімічних властивостей феруму. Послухаємо наших «екскурсоводів»
1. Взаємодія з киснем /демонстрація відео “Взаємодія заліза з киснем”/
Залізо згорає в кисні сліпучим полум’ям, утворюючи залізну окалину
3Fe + 2O2=Fe3O4 (FeO∙ Fe2 O3) - залізна окалина
2. Взаємодія з хлором /демонстрація відео “Взаємодія заліза з хлором”/
2Fe + 3Cl2 = 2FeCl3
3. Взаємодія з сіркою /демонстрація відео “Взаємодія заліза з сіркою”/
Fe + S = FeS
4. Взаємодія з кислотами /демонстрація відео “Взаємодія заліза з хлоридною кислотою”/
Fe + 2HCl р. = FeCl2 + H2 ↑
Fe + H2SO4 р. = FeSO4 + H2 ↑
Залізо не взаємодіє з концентрованими сульфатною та нітратною кислотами, тому ці кислоти можна перевозити у сталевих цистернах.
5. Взаємодія заліза з водою (Під час пропускання парів води над нагрітим порошком заліза відбувається реакція, що супроводжується утворенням подвійного оксиду Fe3O4 і водню:
3Fe + 4H2O = Fe3O4 + 4H2↑
6. Взаємодія заліза із солями
Лабораторний дослід «Взаємодія заліза із розчином купрум (ІІ) сульфатом» КМЗ: розчин купрум (ІІ) сульфату, залізний гвіздок, пробірки, штатив для пробірок
Завдання: Добудьте відновлену мідь.
Для проведення досліду налийте у пробірку 3 мл розчину мідного купоросу і помістіть у цей розчин залізний гвіздок.
Спостерігайте за змінами, що сталися у пробірках, дайте їм пояснення. Результати спостереження, пояснення, молекулярне та йонні рівняння проведених реакцій запишіть у робочий зошит.
Fe + СuSO4 = FeSO4 + Cu Fe + CuCl2 —> FeCl2 + Cu
Запитання:
- До якого типу хімічних реакцій належить розглянута?
- Визначте відновник та окисник у цій реакції.
7. Застосування Феруму / цікаві факти про залізо, бесіда/
Письменник і вчений пізньої античності Пліній так висловився про роль заліза: «Рудокопи заліза видобувають для людини найкраще й найзлісніше знаряддя. Цим знаряддям прорізаємо ми землю, висаджуючи кущі, оброблюємо плодоносні сади й, обрізуючи дикі виноградні лози, примушуємо їх щоразу омолоджуватися. Цим знаряддям зводимо ми будівлі, руйнуємо камінь і використовуємо залізо на всі подібні потреби. Але тим же самим залізом вчиняємо війни, битви, грабунки й користуємося як зброєю не тільки обличчям до обличчя з ворогом, але й як летючим снарядом, що я вважаю злочинною підступністю людської винахідливості, бо для того, щоб смерть настигла людину, ми зробили її крилатою й надали залізу крила. Хай вина за це буде приписана людині, а не природі».
А зараз спробуємо дати відповідь на проблемне питання. Який метал об’єднує всі ці вироби, що є на столі та яблуко? Так, відповідь нам зрозуміла, адже це – ферум.


V. Закріплення вивченого матеріалу
Самостійна робота /робота в групах/
Дослідити, які деталі та механізми автомобілів виготовлені із заліза та його сплавів
VI. Підведення підсумків уроку
Викладач підводить підсумки уроку та виставляє оцінки, мотивуючи їх
IХ. Домашнє завдання.
Обов’язкове:
- опрацювати конспект
- Здійснити перетворення:
Варіант 1. Fe → FeCl2 → Fe(OH)2 → FeO
Варіант 2. Fe → FeCl3 → Fe(OH)3 → Fe2О3
Додаткове: підготувати реферат на тему «Застосування заліза»
1
-
-
Досконало, цікаво, корисно! Щира подяка Вам!
-
дякую за вашу творчу роботу


про публікацію авторської розробки
Додати розробку
