Методична розробка уроку хімії 10 класу на тему: «КАРБОНАТНА КИСЛОТА. CОЛІ КАРБОНАТНОЇ КИСЛОТИ»
Що утворюється під час взаємодії оксиду карбону (IV) з водою?
(Учні в процесі обговорення вносять свої доповнення.)
Учитель: Так, утвориться карбонатна кислота. Що це за сполука, які їй притаманні властивості, що за солі вона утворює ми розглянемо сьогодні на уроці. Запишіть будь ласка в зошитах сьогоднішнє число та тему уроку: "Карбонатна кислота. Солі карбонатної кислоти."
Міністерство освіти, науки, молоді та спорту України
Головне управління освіти і науки
виконавчого органу КМДА
НАВЧАЛЬНО-МЕТОДИЧНИЙ КАБІНЕТ
ПРОФТЕХОСВІТИ м. Києва
______________________________________________________________________
ДНЗ “Київське регіональне вище професійне училище будівництва”
Методична розробка уроку хімії 10 класу на тему:
«КАРБОНАТНА КИСЛОТА. CОЛІ КАРБОНАТНОЇ КИСЛОТИ»
Виконала
Кузьменко Ольга Сергіївна
викладач хімії та біології І категорії
ДНЗ «КРВПУБ»
Печерського району м. Києва
КИЇВ 2012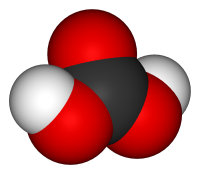 План-конспект уроку
План-конспект уроку
Тема: Карбонатна кислота. Cолі карбонатної кислоти
Мета:
Навчальна:
- продовжувати формувати в учнів наукову картину світу;
- продовжувати знайомство учнів з неорганічними речовинами;
-
продовжувати формувати поняття про мінеральні кислоти;
- формувати знання учнів про карбонатну кислоту як одну із слабких неорганічних кислот;
- ознайомити з її фізичними й хімічними властивостями;
- поглибити знання про середні й кислі солі, їх взаємоперетворення на прикладі карбонатів і гідрогенкарбонатів;
- ознайомити учнів з якісною реакцією на карбонат-іон;
- навчити розпізнавати карбонати, виявляти карбонат-іони у сполуках;
- з’ясувати значення карбонатів у природі та житті людини.
Виховна:
- продовжувати формувати науковий світогляд на основі знань про основні властивості, біологічну роль та застосування карбонатної кислоти та її солей;
- продовжувати виховувати в учнів ціннісне ставлення до екологічного благополуччя планети та власного здоров'я;
- висвітлювати творчі функції неорганічної хімії як науки та її роль у житті суспільства;
- формувати екологічне мислення, навички спільної діяльності, життєві компетенції;
Розвивальна:
- сприяти розвитку в учнів хімічної мови на основі вивчених понять;
- розвивати інтерес до вивчення хімії;
- продовжити процес формування навичок пошукової роботи, умінь робити висновки, узагальнювати, порівнювати;
- розвивати пізнавальну активність, сприяти формуванню уявлень про наукове пізнання світу;
- розвивати мислення, пам’ять, уяву, увагу;
- сприяти розвитку творчих здібностей учнів.
Практична:
- продовжувати знайомити учнів з хімічними методами дослідження;
- розвивати вміння спостерігати, класифікувати, пояснювати, узагальнювати, описувати хімічні процеси та явища;
- удосконалити навички проведення хімічного експерименту;
- продовжувати формувати вміння працювати з підручником, довідниками, практикумом та іншою додатковою літературою.
Методи: фронтальна та індивідуальна бесіда, розповідь, пояснення, демонстрація, розв'язування вправ та задач.
Обладнання та матеріали: Періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності; штатив з пробірками; газовідвідна трубка; розчини: хлоридної кислоти, метилового оранжевого, натрій карбонату, кальцій карбонату, вапняна вода; підручник, персональний комп'ютер, мультимедійна система.
Тип уроку: засвоєння нових знань.
Структура уроку
І. Організаційний етап ……………………………………..……………..… 1 – 2 хв
ІІ. Актуалізація опорних знань і чуттєвого досвіду учнів …….................. 3 – 5 хв
ІІІ. Мотивація навчально-пізнавальної діяльності учнів, повідомлення теми та мети уроку ………………………..……………………………………..……2 – 3 хв
IV. Вивчення матеріалу нової теми …………………………………..….15 – 20 хв
V. Узагальнення й систематизація знань учнів ……………………..…..10 – 15 хв
VІ. Підбиття підсумків уроку, повідомлення домашнього завдання …….1 – 2 хв
ХІД УРОКУ
І. Організаційний етап.
ІІ. Актуалізація опорних знань і чуттєвого досвіду учнів.
Інтерактивна технологія «Мікрофон».
Учитель. Про які речовини йде мова?
1. Він неодноразово спричиняв смерть, як людей, так і тварин. При отруєнні ним наступає кисневе голодування, оскільки він утворює стійку сполуку з гемоглобіном крові, що призводить до отруєнь і смерті людей.
(Чадний газ – СО.)
2. Він має здатність відновлювати метали з оксидів, тому використовується у металургії, а ще може горіти, виділяючи багато теплоти, і тому використовується разом з іншими газами як газоподібне паливо.
(Чадний газ – СО.)
3. Цей газ не отруйний в малих кількостях, але він не підтримує дихання і горіння, що є також небезпечно для людей і тварин. І коли його багато в приміщенні, де є люди, він спричиняє запаморочення голови, може викликати задуху.
(Вуглекислий газ – СО2.)
4. Газ, який використовують у вогнегасниках і таким чином рятують життя людей та їх майно під час пожеж.
(Вуглекислий газ – СО2)
5. Збільшення якого газу в атмосфері призводить до «парникового ефекту»?
(Вуглекислий газ – СО2)
ІІІ. Мотивація навчально-пізнавальної діяльності учнів, повідомлення теми та мети уроку.
Учитель: Який з оксидів карбону відносяться до солетворних, а який ні?
Що утворюється під час взаємодії оксиду карбону (IV) з водою?
(Учні в процесі обговорення вносять свої доповнення.)
Учитель: Так, утвориться карбонатна кислота. Що це за сполука, які їй притаманні властивості, що за солі вона утворює ми розглянемо сьогодні на уроці. Запишіть будь ласка в зошитах сьогоднішнє число та тему уроку: "Карбонатна кислота. Солі карбонатної кислоти."
IV. Вивчення матеріалу нової теми.
Учитель. Солетворному оксиду карбону (IV) – СО2 відповідає карбонатна кислота Н2СО3.
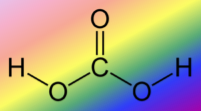
Структурна формула карбонатної кислоти
Карбонатна кислота Н2СО3 – нестійка сполука. Вона існує лише у водному розчині. Під час намагання виділити її з розчину вона легко розкладається на воду і оксид карбону (IV). У водному розчині має місце рівновага.
Н2О + СО2 ↔ Н2СО3 ↔ Н2О + СО2
Але спробуємо добути і довести її існування пропусканням вуглекислого газу крізь дистильовану воду, забарвлену розчином метилоранжу.
 Демонстраційний дослід.
Демонстраційний дослід.
Учитель пропускає вуглекислий газ крізь дистильовану воду. Вода, забарвлена метилоранжем, набуває рожевого забарвлення.
Результати досліду обговорюються і підводяться підсумки: при пропусканні вуглекислого газу крізь дистильовану воду утворюється карбонатна кислота, яка дисоціює ступінчасто:
І ступінь дисоціації:. Н2СО3 ↔ Н+ + НСО3-
ІІ ступінь дисоціації:. НСО3- ↔ Н+ + СО32-
Сумарне рівняння: Н2СО3 ↔ 2Н+ + СО32-
Рівновага значною мірою зміщена ліворуч. У водних розчинах карбонатна кислота – слабкий електроліт.
ХІМІЧНІ ВЛАСТИВОСТІ КАРБОНАТНОЇ КИСЛОТИ.
 1. Взаємодія з металами.
1. Взаємодія з металами.
Н2СО3 + Mg → MgСО3 + Н2↑
2. Взаємодія з оксидами металів.
Н2СО3 + MgО → MgСО3 + Н2О
3. Взаємодія з солями слабших кислот.
Н2СО3 + Nа2SіО3 → Nа2СО3 + Н2SіО3↓
4. Взаємодія з лугами.
Н2СО3 + NаОН → NаНСО3 + Н2О
Н2СО3 + 2NаОН → Nа2СО3 + 2Н2О
Учитель: Отже, Н2СО3 утворює два ряди солей: МеСО3 – карбонати, МеНСО3 – гідрогенкарбонати.
Розчинними у воді є карбонати Nа+, К+ NН4+;. Гідрогенкарбонати всі розчиняються у воді. Карбонати Натрію й Калію плавляться без розкладу, решта розкладаються внаслідок нагрівання й навіть у процесі кипіння.
СаСО3 → СаО + СО2↑
2NаНСО3 → Nа2СО3 + СО2↑ + Н2О
Які ж властивості солей карбонатної кислоти?
Пропоную вам дослідити їх у процесі виконання досліду «Виявлення карбонат-іонів у розчині».
Лабораторна робота 7. Якісна реакція на карбонат-іони
(Проводить учень, якого вибирає вчитель із бажаючих.)
У дві пробірки всипте потроху (аби тільки вкрилось дно) кальцій карбонату і натрій карбонату. В обидві пробірки додайте по 1 мл розбавленої хлоридної кислоти й одразу ж закрийте кожну пробірку пробкою з газовідвідною трубкою, кінець якої опустіть у пробірку з вапняною водою.
Що спостерігається? Напишіть рівняння реакцій в молекулярній, повній та скороченій іонних формах. Зробіть висновок, що є реактивом на карбонат-іони СО3-.
СаСО3 + 2НСl = СаСl2 + СО2↑ + Н2О
Nа2СО3 + 2НСl = 2NаСl + СО2↑ + Н2О
Са(ОН)2+ СО2↑ = СаСО3↓ + Н2О
Результати досліду обговорюють і висновок записують у зошити.
Учитель. Отже, якісною реакцією на солі карбонати є їх взаємодія з кислотами.
Для деяких карбонатів широко використовуються тривіальні назви: Nа2СО3 – кальцинована сода, Nа2СО3∙10Н2О – каустична сода, NаНСО3 – питна сода, К2СО3 – поташ, СаСО3 – крейда, мармур, вапняк.

 Карбонат натрію Nа2СО3 (кальцинована сода) і його кристалогідрат Nа2СО3∙10Н2О (каустична сода) використовуються у виробництві скла, мила, мийних засобів, барвників тощо. У великій кількості їх потребують целюлозно-паперова, текстильна, нафтова та інші галузі промисловості.
Карбонат натрію Nа2СО3 (кальцинована сода) і його кристалогідрат Nа2СО3∙10Н2О (каустична сода) використовуються у виробництві скла, мила, мийних засобів, барвників тощо. У великій кількості їх потребують целюлозно-паперова, текстильна, нафтова та інші галузі промисловості.

 Гідрогенкарбонат натрію NаНСО3 (питна сода) широко використовується під час випікання хліба, у харчовій промисловості, медицині, побуті. Питна сода входить до складу наповнювачів для вогнегасників.
Гідрогенкарбонат натрію NаНСО3 (питна сода) широко використовується під час випікання хліба, у харчовій промисловості, медицині, побуті. Питна сода входить до складу наповнювачів для вогнегасників.
Карбонат калію К2СО3 (поташ) застосовують для виготовлення мила, тугоплавкого скла, у фотосправі.


 Вапняк СаСО3 використовують для добування вапна, яке також застосовується у будівництві, а крім того, вноситься у грунт для зниження кислотності і поліпшення його структури. Крейду застосовують для побілки, а також у скляній, гумовій та інших галузях промисловості.
Вапняк СаСО3 використовують для добування вапна, яке також застосовується у будівництві, а крім того, вноситься у грунт для зниження кислотності і поліпшення його структури. Крейду застосовують для побілки, а також у скляній, гумовій та інших галузях промисловості.
 Мармур – це кристалічна гірська порода, яка складається з мінералів кальциту СаСО3 або доломіту СаMg(СО3)2. Забарвлення мармуру залежить від домішок, колір і рисунок проявляється тільки після полірування. Мармур буває білого, сірого, зеленого, червоного та інших кольорів, а частіше строкатим. Його добувають в кар'єрах монолітними блоками,
Мармур – це кристалічна гірська порода, яка складається з мінералів кальциту СаСО3 або доломіту СаMg(СО3)2. Забарвлення мармуру залежить від домішок, колір і рисунок проявляється тільки після полірування. Мармур буває білого, сірого, зеленого, червоного та інших кольорів, а частіше строкатим. Його добувають в кар'єрах монолітними блоками,  застосовують в
застосовують в  архітектурі і будівельній справі, електро- та сантехніці, для виготовлення скульптур. Родовища мармуру відомі в Італії, Греції, Франції, Норвегії, США, Україні, Російській Федерації та в інших країнах.
архітектурі і будівельній справі, електро- та сантехніці, для виготовлення скульптур. Родовища мармуру відомі в Італії, Греції, Франції, Норвегії, США, Україні, Російській Федерації та в інших країнах.


 Доломіт – СаMg(СО3)2 має домішки глини, вапняку, буває білого, сірого, іноді жовто-бурого кольору. Має широке практичне застосування як флюс у металургійній промисловості і сировина для виробництва вогнетривких матеріалів, вапна, магнію, магнезіальних цементів, у скляній і керамічній промисловостях, для виготовлення буту, щебеню, облицювального матеріалу.
Доломіт – СаMg(СО3)2 має домішки глини, вапняку, буває білого, сірого, іноді жовто-бурого кольору. Має широке практичне застосування як флюс у металургійній промисловості і сировина для виробництва вогнетривких матеріалів, вапна, магнію, магнезіальних цементів, у скляній і керамічній промисловостях, для виготовлення буту, щебеню, облицювального матеріалу.
Учитель. Які ще властивості характерні для солей карбонатів і гідрогенкарбонатів?
Учні на дошці записують рівняння реакцій перетворення карбонатів і гідрогенкарбонатів.
Са(ОН)2 + СО2↑ = СаСО3↓ + Н2О
СаСО3↓ + Н2О + СО2↑ = Са(НСО3)2
Са(НСО3)2 = СаСО3↓ + Н2О + СО2↑
 Учитель. У природі ґрунтові води разом з вуглекислим газом перетворюють карбонати в гідрогенкарбонати, що і призводить до вимивання покладів карбонатів в окремих місцях. Там і утворюються пустоти. При зміні температури гідрогенкарбонати знову розкладаються на карбонати, вуглекислий газ і воду. Так утворюються карстові печери.
Учитель. У природі ґрунтові води разом з вуглекислим газом перетворюють карбонати в гідрогенкарбонати, що і призводить до вимивання покладів карбонатів в окремих місцях. Там і утворюються пустоти. При зміні температури гідрогенкарбонати знову розкладаються на карбонати, вуглекислий газ і воду. Так утворюються карстові печери.
Я хочу запросити вас у маленьку уявну мандрівку в карстові печери Криму, а саме в печеру Еміне Баір Хосар. Проходячи довгими прохолодними коридорами печери Еміне Баір Хосар, ви ніби потрапляєте в підземне казкове царство. Прикрашені кристалами коридори тягнуться на сотні метрів, і в кожному місці вони інші, мають щось своє привабливе і неповторне. При штучному освітленні виблискують голчасті кристали та немов вкриті кришталем стіни. Звідки ж взялося це диво природи? Як утворилися підземні палаци, прикрашені кам'яними квітами? З чого зроблені ці чудеса? Ні, це не кришталеві предмети. Все це створено природою з сполук кальцію, а саме з карбонату та гідрогенкарбонату кальцію. Як утворюються сталактити та сталагміти у печерах?
Учень . Гідрогенкарбонати лужноземельних металів, на відміну від їх карбонатів, добре розчиняються у воді. Розчинністю гідрогенкарбонатів у воді пояснюється постійне пересування карбонатів у природі. Ґрунтові води, що містять СО2, проходячи крізь ґрунт і особливо крізь шари вапняку, розчиняють карбонат кальцію й виносять його з собою у вигляді гідрогенкарбонату в струмки, річки й моря. Звідти він потрапляє в організм морських тварин і йде на побудову їхніх кістяків або, виділяючи вуглекислий газ, знову перетворюється на карбонат кальцію і відкладається у вигляді вапняку і т.д.
. Гідрогенкарбонати лужноземельних металів, на відміну від їх карбонатів, добре розчиняються у воді. Розчинністю гідрогенкарбонатів у воді пояснюється постійне пересування карбонатів у природі. Ґрунтові води, що містять СО2, проходячи крізь ґрунт і особливо крізь шари вапняку, розчиняють карбонат кальцію й виносять його з собою у вигляді гідрогенкарбонату в струмки, річки й моря. Звідти він потрапляє в організм морських тварин і йде на побудову їхніх кістяків або, виділяючи вуглекислий газ, знову перетворюється на карбонат кальцію і відкладається у вигляді вапняку і т.д.
Учитель. Серед карбонатів є і коштовні камені. Які саме? 
Учень. Перли.
Учитель. Так це перли. Перли завжди вважалися символом найвищого прояву прекрасного. Що ж таке перли?
Учень. Перли спрадавна були одними з найкоштовніших каменів. Близько двох тисяч років тому на Сході вони служили навіть своєрідною валютою: ними сплачували податки, розраховувалися за товари. Із знаменитими перлами пов'язано багато історій, легенд, мабуть, тому що вони мають короткий вік – живуть не більше 100 – 150 років. Найвідоміша легенда про перли пов'язана з єгипетською царицею Клеопатрою. На бенкеті вона кинула в келех з вином дві безцінні перлини, які розчинилися, і запропонувала тост за Антонія – свого чоловіка. Вона була дуже незадоволена пропажею перлин. Спочатку думала, що їх вкрали раби, які обслуговували бенкет. Але придворний аптекар пояснив їй це явище, виправдавши рабів. З точки зору хімії ця історія цілком правдоподібна. Адже перли складаються з карбонату кальцію – найчастіше у вигляді мінералу арагоніту, іноді кальциту. Його там близько 90 %, все інше – органічна речовина і вода. Кальцій карбонат розчиняється навіть у карбонатній кислоті, утворюючи розчинну у воді сіль – кальцій гідрогенкарбонат. В даному випадку на бенкеті перли розчинилися у винній кислоті, яка є сильнішою за карбонатну кислоту, при цьому утворилася розчинна у воді сіль і виділився вуглекислий газ.
 Учитель. А де ж утворюються перли?
Учитель. А де ж утворюються перли?
Учень. Утворення перлів дуже цікавий процес. Серед різноманітних молюсків, які зустрічаються в морях і прісних водоймах, є такі, що виділяють перламутр. Виділяють його молюски як захист від сторонніх тіл, які потрапляють у мушлі й  подразнюють молюска або заважають його життєдіяльності. Це можуть бути піщинки, мікроорганізми, уламки стулок тощо. Молюск обгортає це стороннє тіло перламутром, утворюючи таким чином перлини. Залежно від того, в якому місці знаходиться стороннє тіло, перлини можуть утворюватися найрізноманітнішої форми – від правильної сферичної до пластинчастої. Цінність перлин залежить від райдужної гри, а отже від щільності зовнішніх шарів перлини. Перлини бувають різних кольорів: від найпоширенішого й найціннішого перламутрового до чорного. Зустрічаються також перлини рожеві, сірі, жовті, фіолетові.
подразнюють молюска або заважають його життєдіяльності. Це можуть бути піщинки, мікроорганізми, уламки стулок тощо. Молюск обгортає це стороннє тіло перламутром, утворюючи таким чином перлини. Залежно від того, в якому місці знаходиться стороннє тіло, перлини можуть утворюватися найрізноманітнішої форми – від правильної сферичної до пластинчастої. Цінність перлин залежить від райдужної гри, а отже від щільності зовнішніх шарів перлини. Перлини бувають різних кольорів: від найпоширенішого й найціннішого перламутрового до чорного. Зустрічаються також перлини рожеві, сірі, жовті, фіолетові.
Учитель. Перлини завжди були улюбленими прикрасами в багатьох народів, шанували їх за ніжну красу та оригінальну форму. На Русі, починаючи з найдавніших часів і кінчаючи царюванням Катерини II, жодна з прикрас не обходилася без перлин. На жаль, до нас не дійшла жодна старовинна перлина через їхню недовговічність. Як можна пояснити це явище?
 Учень. Короткий вік цих коштовностей пояснюється тим, що з часом органічна речовина, яка знаходиться в них, висихає, розкладається. Перлини захворюють, втрачають блиск, розм'якають і, нарешті, розпадаються. Окрім того, перлини дуже примхливі: вони не зносять тривалого контакту з жирами, кислотами, водою, гарячими предметами. Про це завжди повинні пам'ятати ті, хто має такі прикраси.
Учень. Короткий вік цих коштовностей пояснюється тим, що з часом органічна речовина, яка знаходиться в них, висихає, розкладається. Перлини захворюють, втрачають блиск, розм'якають і, нарешті, розпадаються. Окрім того, перлини дуже примхливі: вони не зносять тривалого контакту з жирами, кислотами, водою, гарячими предметами. Про це завжди повинні пам'ятати ті, хто має такі прикраси.
Учитель. Отже, перли і мінерали, що утворюють карстові печери мають одну й ту ж саму формулу – СаСО3.
V. Узагальнення й систематизація знань учнів.
 Учитель: На закріплення матеріалу виконаємо вправи:
Учитель: На закріплення матеріалу виконаємо вправи:
Завдання 1. Напишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
Са(ОН)2 → СаСО3 → Са(НСО3)2 → СаСО3 → СО2 → Na2CО3
Са(ОН)2 + СО2 → СаСО3 + Н2О
СаСО3 + СО2 + Н2О → Са(НСО3)2
Са(НСО3)2 + Са(ОН)2 → 2СаСО3 + 2Н2О
СаСО3 → СаО + СО2
СО2 + 2NаОН → Nа2СО3 + Н2О
Завдання 2. У процесі нагрівання кальцій карбонату масою 18,4 г утворилося 4,48 л СО2 (н. у.). Обчисліть масову частку домішок в даному зразку кальцій карбонату.
Розв’язок:
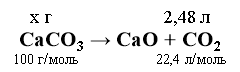
х = 2,48 * 100/22,4 = 11,1 (г)
W(д) = m(д)/m(р-ни+д) * 100%
m(д) = m(р-ни + д) - m(ч. р-ни)
m(д) = 18,4 - 11,1 = 7,3 (г)
W(д) = 7,3/18,4 * 100% = 39,7 (%)
Відповідь: 39,7 (%)
VІ. Підбиття підсумків уроку, повідомлення домашнього завдання.
 Опрацювати матеріал теми за §13 підручника Попель П.П.,Крикля Л.С. Хімія 10 клас
Опрацювати матеріал теми за §13 підручника Попель П.П.,Крикля Л.С. Хімія 10 клас
Творче завдання: підготувати письмово повідомлення про будівельні матеріали на одну з тем:
- Виготовлення скла: історія розвитку.
- Види скла, його застосування.
- Кераміка, її застосування.
- Цемент, бетон – фундамент сучасного будівництва.
Література
- Глінка М.Л. Загальна хімія. – К.: Вища школа, 1976
- Дудник В.В., Сорока Л.В. Інноваційні технології на уроках хімії. – Тернопіль: Навчальна книга – Богдан, 2008
- Попель П.П.,Крикля Л.С. Хімія 10 клас. – К.: Академія, 2010
- Старовойтова І.Ю., Люсай О.В. Усі уроки хімії 10 клас. – Харків: Основа, 2010
- Ярошенко О.Г. Хімія. Підручник для 10 класу загальноосвітніх навчальних закладів. – К.: Грамота, 2010
-1-


про публікацію авторської розробки
Додати розробку
