Методична розробка: ''Використання алгебраїчних систем рівнянь у розв'язанні хімічних задач"
Методична розробка :
Використання алгебраїчних систем рівнянь у розв’язанні хімічних задач.
Швець Наталія Миколаївна , вчитель хімії вищої категорії, старший учитель КЗ ''Гайворонський ліцей №2'' Гайворонської міської ради Кіровоградської області
Задача № 1
В результаті розчинення 152,8г сплаву міді, заліза і магнію у хлоридній кислоті виділилось 38,08л газу та 96г нерозчиненого
залишку. Визначте масові частки (%) металів у вихідному сплаві.
Дано: mспл(Fe,Cu,Mg) = 152,8 г Розв’язання.
 Vгазу = 38,08 л 1. Мідь не витискує водень із складу хлоридної mзал = 96 г кислоти, тому маса залишку це маса міді – 96 г .
Vгазу = 38,08 л 1. Мідь не витискує водень із складу хлоридної mзал = 96 г кислоти, тому маса залишку це маса міді – 96 г .
Залізо і магній витискують водень.
W(Cu),W(Fe),W(Mg) - ? 2. Визначаємо масу металів, що реагують з хлоридною кислотою: mсум – m(Cu) = 152,8 г – 96 г = 56.8 г
3. Складаємо вираз для визначення мас заліза та магнію:
n(Fe) * M(Fe) + n(Mg) * M(Mg) = 56,8 г 4. Кількість речовини водню:
![]()
5. Приймаємо за х - n(Н2), що виділився в реакції із залізом; за y - n(Н2), що виділився в реакції із магнієм.
6. Складаємо систему рівнянь: ![]()
вираз x = 1.7 – y підставляємо у друге рівняння 56(1.7 – y) + 24у = 56,8 y = 1,2 x = 1,7 – 1,2 = 0,5
7. За рівняннями реакцій Fe + 2HCl = FeCl2 + H2
Mg + 2HCl = MgCl2 + H2 n(Fe) = x або 0,5 моль
n(Mg) = y або 1,2 моль
8. Знаходимо маси металів: m(Fe) = 56 г/моль * 0,5 моль = 28 г m(Mg) = 24 г/моль * 1,2 моль = 28,8 г 9.Масові частки металів у сплавi:
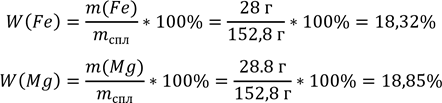
W(Cu) = 100% - (18.32% + 18.85%) = 62.83%
Відповідь: W(Cu)=62,83%, W(Fe)=18,32%, W(Mg)=18,85%
Задача № 2
Обчислити масові та об’ємні частки газів у суміші карбон (ІІ) оксиду і карбон (ІV) оксиду, відносна густина за воднем якої дорівнює 18,8.
|
Дано: |
Розв’язання. |
|
𝐷𝐻2 = 18,8 |
1. Знаходимо молярну масу суміші газів: |
![]()
![]() Сум(CO, CO2) Mсум = D(H2) * M(H2) = 18,8 * 2 г/моль = 38 г/моль
Сум(CO, CO2) Mсум = D(H2) * M(H2) = 18,8 * 2 г/моль = 38 г/моль
φ(CO), φ(CO2), 2. Якщо прийняти, що кількість речовини суміші 1 моль,
W(CO), W(CO2) - ? то об’єм суміші відповідно становить 22,4л, а маса 38г
3. Приймаємо n(CO) – x моль, n(CO2) – y моль
4. Складаємо вирази для визначення об’ємів компонентів суміші:
Vсум = V(CO) + V(CO2) = 22,4л
V(CO) = Vm * n(CO) = 22,4x
V(CO2) = Vm * n(CO2) = 22,4y
5. Складаємо рівняння: 22,4x + 22,4y = 22,4 або x + y = 1
6. Визначаємо масу компонентів суміші: m(CO) = n(CO) * M(CO) = 28x m(CO2) = n(CO2) * M(CO2) = 44y mсуміші = 28x + 44y = 38
7. Складаємо алгебраїчну систему: ![]()
знаходимо, що x = 1 – y , підставляємо цей вираз у друге рівняння:
28 ( 1 – y ) + 44y = 38 y = 0,625 x = 1 – 0,625 = 0,375 відповідно n(CO) = 0,375 моль n(CO2) = 0,625 моль
8. Знаходимо об’єми газів у суміші:
V(CO) = 0,375 моль * 22,4 л/моль = 8,4 л V(CO2) = 0,625 моль * 22,4 л/моль = 14 л
9. Знаходимо об’ємні частки газів:
![]()
φ(CO2) = 100% - 37,5% = 62,5%
10. Знаходимо маси газів:
m(CO) = n(CO) * M(CO) = 0,375 моль * 28г/моль = 10,5 г m(CO2) = n(CO2) * M(CO2) = 0,625 моль * 44г/моль = 27,5 г 11. Знаходимо масові частки газів у суміші:
![]()
W(CO2) = 100% - 27,6% = 72,4%
Відповідь: φ(CO) = 37,5%, φ(CO2) = 62,5%,
W(CO) = 27,6%, W(CO2) = 72,4%
Задача № 3
Об’єм суміші карбон (ІІ) оксиду і карбон (ІV) оксиду складає 15л. Маса суміші 27,18г. Знайти об’єм кожної речовини.
Дано: Розв’язання.
 Vсум (CO, CO2)=15л 1. Приймаємо за х - V(CO) mсум (CO, CO2)=27,18г y - V(CO2)
Vсум (CO, CO2)=15л 1. Приймаємо за х - V(CO) mсум (CO, CO2)=27,18г y - V(CO2)
V(CO), V(CO2) - ? 2. Об’єм суміші відповідає виразу: x + y = 15, а кількість речовини газів відповідно:
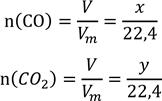
3.Маси газів знаходимо за формулами:
![]() , де M(CO) = 28 г/моль
, де M(CO) = 28 г/моль ![]() , де M(CO2) = 44 г/моль
, де M(CO2) = 44 г/моль
4. Визначаємо загальну масу суміші газів за рівнянням:
![]()
5. Складаємо алгебраїчну систему: 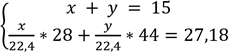
знаходимо вираз x = 15 – y i підставляємо його в друге рівняння
![]()
![]()
420 + 16y = 608,8 16y = 188,8 y = 11,8
Відповідно V(CO2) = 11,8л ,
а V(CO) = Vсум(СО, СО2) - V(CO2) = 15л – 11,8л = 3,2л
Відповідь: V(CO) = 3,2л
V(CO2) = 11,8л
Задача № 4
До розчину, що містить 6,25г суміші хлориду і броміду калію добавили надлишок аргентум (І) нітрату, внаслідок чого утворилось 10,39г суміші хлориду і броміду аргентуму. Визначити масові частки (%) вихідної і утвореної суміші.
Дано: Розв’язання. mсум (KCl, KBr) = 6,25г

![]() AgNO3(надл.) 1. Cкладаємо рівняння хімічних реакцій: mсум (AgCl, AgBr) = 10,39г KCl + AgNO3 = KNO3 + AgCl
AgNO3(надл.) 1. Cкладаємо рівняння хімічних реакцій: mсум (AgCl, AgBr) = 10,39г KCl + AgNO3 = KNO3 + AgCl
W(KCl), W(KBr), KBr + AgNO3 = KNO3 + AgBr
W(AgCl), W(AgBr) - ? 2. Приймаємо m(KCl) = x , m(AgCl) = y
m(KBr) = 6,25 – x m(AgBr) = 10,39 – y
3. За рівняннями реакцій кількості речовин пропорційні:
|
n(KCl) = n(AgCl) |
n(KBr) = n(AgBr) |
|
M(KCl) = 74,5 г/моль |
M(KBr) = 119 г/моль |
|
M(AgCl) = 143,5 г/моль |
M(AgBr) = 188 г/моль |
![]()
![]()
![]()
![]()
4. Складаємо алгебраїчну систему:
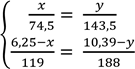
![]() y = 1,9 x
y = 1,9 x
5. Визначаємо маси хлориду і броміду калію:
119 * 1,9 x – 188 x = 61,41 38,1 x = 61,41 x = 1,6 m(KCl) = 1,6 г m(KBr) = mсум – m(KCl) = 6,25 г – 1,6 г = 4,65 г
6. Визначаємо масові частки вихідних речовин: ![]()
![]() W(KBr) = 100% - 25,6% = 74,4%
W(KBr) = 100% - 25,6% = 74,4%
7. Визначаємо маси аргентум (І) хлориду і аргентум (І) броміду. Так, як y = 1,9 x , a x = 1,6 * 1,9 = 3,04 m(AgCl) = 3,04 г , m(AgBr) = 10,39 г – 3,04 г = 7,35 г
8. Визначаємо масові частки продуктів реакції у суміші вихідних речовин:
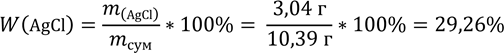
W(AgBr) = 100% - 29,26% = 70,74%
Відповідь: W(KCl) = 25,6% , W(KBr) = 74,4% ,
W(AgCl) = 29,26% , W(AgBr) = 70,74%


про публікацію авторської розробки
Додати розробку
