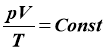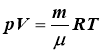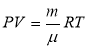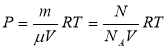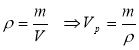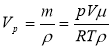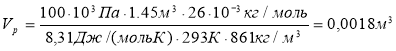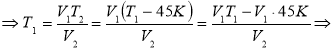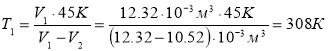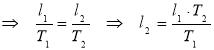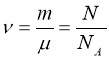Методична розробка занять з дисципліни "Фізика і астрономія" для ЗФПО з розділу "Молекулярна фізика"
Лекція 1
Тема: Основи Молекулярно – Кінетичної Теорії
План:
- Основні положення молекулярно-кінетичної теорії .
- Дослідні обґрунтування положень молекулярної-кінетичної теорії.
- Основні величини молекулярної фізики.
Як відомо, фізика вивчає найпростіші і найбільш загальні властивості матеріального світу. Цей світ різноманітний за видами матерії, формами її руху, характером просторово-часового існування. Тому залежно від мети дослідження розробляються відповідні методи і понятійний фізичний апарат.
В класичній механіці при вивченні рухів тіл нас не цікавила їхня внутрішня структура. Достатньо було змоделювати тіло у вигляді матеріальної точки і вивчати закони механічного руху. Якщо механічний рух тіла не залежить від внутрішньої структури, то властивості самих тіл і пов’язані з ними агрегатні стани (їх зміни) залежать від того з яких частинок тіла складаються і як ці частинки рухаються та взаємодіють між собою. Саме вивченням цих питань і займається молекулярна фізика.
Молекулярна фізика – розділ фізики, в якому вивчається будова, фізичні властивості і агрегатні стани речовини на основі їхньої мікроскопічної будови.
- Основні положення молекулярно-кінетичної теорії.
На початку 19століття англійський вчений Д. Дальтон показав, що багато закономірностей явищ природи можна пояснити використовуючи уявлення про атоми і молекули, і науково обґрунтував молекулярну будову речовини.
Молекулярно-кінетична теорія − вивчає властивості тіл (речовини) на основі введення уявлень про їхню внутрішню будову.
В основі молекулярно-кінетичної теорії лежать підтверджені теоретично і експериментально
Основні положення молекулярно-кінетичної теорії:
- Усі тіла складаються з молекул, між якими існують проміжки.
- Молекули речовини перебувають у безперервному хаотичному русі.
- Молекули взаємодіють між собою.
Молекула − це найменша стійка частина речовини, яка зберігає хімічні властивості цієї речовини.
Тепловий рух – це хаотичний рух молекул речовини в результаті взаємодій та багаторазових зіткнень. Тепловий рух пов’язаний з температурою: чим вища температура, тим інтенсивніший рух молекул. При нагріванні тіла середня швидкість руху його молекул зростає і тому збільшується кінетична енергія (![]() ), а при охолодженні – зменшується. Отже, тепловий рух визначає наявність у молекул кінетичної енергії.
), а при охолодженні – зменшується. Отже, тепловий рух визначає наявність у молекул кінетичної енергії.
Сили молекулярної взаємодії: Оскільки до складу молекул входять як позитивні так і негативні електричні заряди, то між молекулами діють одночасно сили притягання та сили відштовхування.
Міжмолекулярні сили діють на невеликих відстанях (не можна склеїти розбиту чашку притиснувши частинки одна до одної). Сили взаємодії виникають при наближенні двох молекул будь якого виду, але величина взаємодії залежить від природи молекул.
Для опису сили взаємодії між молекулами використовують графік залежності рівнодіючої сили Fp (притягання та відштовхування) молекул від відстані r між їх центрами.
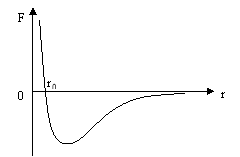 Fприт. <0 Fвідш.>0
Fприт. <0 Fвідш.>0
В т. r0 - рівноважне положення
F(r0 )=0
Радіус молекулярної дії r0 – найменша відстань між молекулами, на якій сили взаємодії такі малі, що ними можна знехтувати. (r0 ≈1 нм=1·10-9м )
Сили притягання перешкоджають розтягненню тіла, сили відштовхування стиску.
Отже, сили взаємодії визначають наявність у молекул потенціальної енергії.
Сума кінетичної і потенціальної енергій всіх частинок тіла називається внутрішньою енергією.
- Дослідні обґрунтування положень молекулярної-кінетичної теорії:
- Досліди показують, що всі гази легко стискуються. Це доводить наявність між молекулами газу проміжків. Для рідин і твердих тіл ці проміжки менші ніж у газів, тому стискування значно менше.
- Молекули газу намагаються зайняти весь доступний для нього об’єм. Це свідчить про наявність неперервного хаотичного руху.
- Утворення мономолекулярних плівок (олія, гас) на поверхні води, товщина яких не може бути меншою за діаметр молекул, підтверджує наявність молекул та їх малого, але скінченого розміру.
- Дифузія – явище проникнення молекул одного виду у проміжки між молекулами іншого виду (поширення запаху, зафарбовування рідини). Доводить наявність між молекулами газу проміжків та хаотичного руху.
- Броунівський рух – хаотичний рух малих за розміром частинок (тіл) у рідині чи газі, зумовлений нескомпенсованими взаємодіями молекул з тілами (частинки зазнають поштовхів з боку оточуючих молекул, які перебувають в тепловому русі).
- Збереження форми і об’єму твердим тілом і об’єму рідиною підтверджують наявність сил взаємодії між молекулами.
- Основні величини молекулярної фізики:
Масу атомів та молекул характеризують не абсолютними, а відносними величинами.
Атомна одиниця маси (а.о.м.) – одиниця вимірювання, що дорівнює 1/12 маси ізотопу вуглецю С12. Маса молекули виражена в атомних одиницях маси називається відносною молекулярною (атомною) масою mв (подана в таблиці Мендєлєєва).
1а.о.м.=1,66·10-27кг
m=mвідн·1,66·10-27кг
Для вирішення багатьох практичних завдань зручно користуватися такими порціями речовини, в яких міститься однакове число молекул.
Кількість речовини ν – характеристика фізичного тіла, що пропорційна кількості молекул у тілі. Одиницею кількості речовини є моль.
Моль – кількість речовини, в якій міститься стільки молекул, скільки атомів міститься у 0,012 кг ізотопу вуглецю С12.
Молярна маса - маса одного моля речовини μ.
μ= mв г/моль= mвідн·10-3кг/моль
З означення випливає, що кількість структурних елементів (молекул) в молі довільної речовини однакова.
Число Авогадро – кількість молекул в одному молі речовини NА
NА=6,022·1023 молекул/моль
Молярний об’єм - об’єм одного моля речовини.
Для будь-якого газу при нормальних умовах Vм=22,4л.
Число молекул газу в одиниці об’єму при нормальних умовах називається числом Лошмідта nЛ.
nЛ= NА/ Vм=2,7·1025 молекул/м3
Застосування вивченого матеріалу.
Задача 1 ( 2.14. [1])
Визначити число молекул, що знаходяться в 1г азоту.
|
m=1г=1·10-3кг μ(N)=14·10-3кг/моль NA=6,022·10-23мол/моль
N –?
|
Розв’язання
μ(N2)=2·μ(N)
Відповідь: N=0.215·1023молекул |
Домашнє завдання:
1. § 2.1-2.3, 3.2, 3.5-3.7 [ Л.С.Жданов, Г.Л.Жданов. Фізика]
2. Задача № 2,15 [1]: Визначити число атомів, що знаходяться в 1г гелію.
Лекція 2
Питання для повторення
- Що вивчає молекулярна фізика?
- Основні положення молекулярно-кінетичної теорії .
- Що таке молекула?
- Дослідні обґрунтування положень молекулярної-кінетичної теорії
- Основні величини молекулярної фізики.
Тема: Основні характеристики газоподібного стану речовини.
План:
- Агрегатний стан речовини.
- Газоподібний стан речовини.
-
Термодинамічні параметри газу .
- Температура
- Тиск
- Агрегатний стан.
Молекули перебувають в хаотичному русі, що визначається кінетичною енергією, та взаємодіють одна з одною, що характеризується потенціальною енергією. Сумісна дія двох факторів визначає агрегатний стан речовини.
Одна і таж речовина може перебувати у різних агрегатних станах: газоподібному, рідкому та твердому (пара, вода, лід). В залежному від того який фактор переважає маємо той чи інший агрегатний стан:
1. Газоподібний - хаотичний рух переважає сили взаємодії ( Ек >Еп )
2. Рідина - хаотичний рух і його характеристика кінетична енергія близькі до значення потенціальної енергії взаємодії ( Ек ≈ Еп )
3. Тверде тіло - кінетична енергія хаотичного руху мала порівняно з потенціальною енергією взаємодії ( Ек < Еп )
Виходячи з цих означень маємо такі здійснення теплового руху у різних агрегатних станах:
- В газах - значне стискування і розширення
- В рідинах - коливання молекул навколо положень рівноваги, але наявність перескоків, що є причиною текучості рідини.
- В твердому тілі - коливання відносно положень рівноваги у вузлах кристалічної решітки.
При підвищенні температури речовини зростає кінетична енергія молекул і співвідношення енергій порушується: тверді тіла переходять в рідкий стан, рідкі – в газоподібний. (При нагріванні лід тане і випаровується)
- Газоподібний стан характеризується перевищенням кінетичної енергії хаотичного руху над потенціальною енергією взаємодії між молекулами. Сили взаємодії не можуть втримати молекули разом і вони розлітаються по всьому простору, відведеному газу, внаслідок постійних зіткнень молекул між собою в процесі теплового хаотичного руху. Підрахунки показують, що середня відстань між молекулами в газі
3 нм, радіус молекулярної дії 1нм, тому сили притягання мізерні (якщо газ не стиснутий).
Характерна особливість газового стану: в кожен момент часу взаємодіючі молекули становлять незначну частину загального числа молекул і взаємним притяганням можна знехтувати.
- Термодинамічні параметри газу .
При опису властивостей газу можна використовувати величини, які характеризують молекулярний світ: енергія молекул, рух швидкість руху, маса, тощо. Такі величини є мікроскопічними. Проте можна використовувати також величини, числові значення яких знаходять простим вимірюванням за допомогою приладів: тиск, об’єм, температура і т. д. Такі величини є макроскопічними.
Термодинамічні параметри газу - макроскопічні величини, які однозначно характеризують стан газу.
Основними термодинамічними параметрами є тиск р, об’єм V і температура Т.
- Об’єм – величина простору, який займає дана речовина. Основною одиницею об’єму є кубічний метр [V]=1м3, 1літр=1·10-3м3
- Тиск
Молекули газу, вдаряючись об поверхню тіла (стінки посудини), створюють на неї тиск. Тиск вимірюється силою, що діє на одиницю площі поверхні 
Одиницею тиску в системі СІ є Паскаль : [р]=1Н/1м=1Па.
На практиці користуються також і іншими одиницями тиску:
- Технічна атмосфера (ат) 1ат=9,81·104Па
- Міліметр ртутного стовпчика (мм.рт.ст.) 1мм рт.ст.=133 Па
- Фізична атмосфера (атм) 1атм=1,013·105 Па
Величина тиску тим більша, чим більша середня кінетична енергія руху молекул газу і їх кількість в одиниці об’єму. Цю залежність виражає формула:
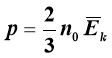 – Основне рівняння М.К.Т.
– Основне рівняння М.К.Т.
Оскільки кінетична енергія молекул газу значною мірою залежить від температури, то і тиск залежить від температури: рt=p0 (1+γt)
де 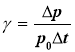 - температурний коефіцієнт тиску – це величина, що характеризує залежність зміни тиску газу від його типу в процесі зміни температури при сталих масі і об’єму газу. [γ]= 1ºС-1
- температурний коефіцієнт тиску – це величина, що характеризує залежність зміни тиску газу від його типу в процесі зміни температури при сталих масі і об’єму газу. [γ]= 1ºС-1
Для ідеальних газів різного типу температурний коефіцієнт тиску не залежить від типу газу і становить 1/273 ºС-1, для реальних газів залежність від типу газу значна.
- Температура.
Початкове уявлення про температуру людина отримує за допомогою органів чуттів. Доторкаючись до предметів ми можемо визначити, який предмет тепліший, який холодніший.
Температура – це величина, що характеризує ступінь нагрітості тіла.
Для об’єктивності вимірювання температури було створено прилад – термометр – дія якого основана на розширенні тіл під час нагрівання. На практиці за 0 умовно приймається температура танення льоду при нормальному тиску, а за 100 – температура кипіння води при нормальному тиску. Одна сота цього інтервалу є одиницею температури – градусом Цельсія, а таку шкалу температур називають шкалою Цельсія. Внаслідок нерівномірного розширення речовин, що використовуються в термометрах (спирт, ртуть), при нагріванні, отримати єдину температурну шкалу таким чином не можна.
Оскільки температурний коефіцієнт тиску для ідеальних газів не залежить від типу газу, то тиск розрідженого водню, що найбільше по властивостям наближається до ідеального газу, може бути використаний для створення єдиної температурної шкали.
Якщо при певній температурі тиск газу, який визначається ударами молекул при їх хаотичному русі, стане нульовим, то і кінетична енергія хаотичного руху молекул теж буде нульовою, тобто молекули зупиняться.
Абсолютний нуль – це температура, при якій має припинитися поступальний рух молекул.
![]() t = –273ºС
t = –273ºС
З означення абсолютного нуля зрозуміло, що неможливо охолодити тіло до температури абсолютного нуля, оскільки рух молекул припиняється і речовина в сенсі, який ми означили трьома основними положеннями М.К.Т. припиняє існувати. Отже, температури нижчої абсолютного нуля в природі не може бути!
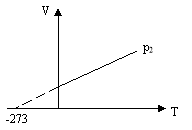
На основі цих міркувань Кельвіном була введена нова термодинамічна шкала температур – шкала Кельвіна. За нуль цієї шкали приймається температура абсолютного нуля, а розмір градуса Кельвіна співпадає з розміром градуса Цельсія. Температура, виражена за термодинамічною шкалою, називається абсолютною температурою Т, одиницею якої є Кельвін ( К ).
Зв’язок між абсолютною температурою і температурою за Цельсієм
Т=273+ t
Отже, ми визначили, що тиску газу з одного боку прямо пропорційний температурі, а з іншого – прямо пропорційний середній кінетичній енергії руху молекул. Це означає, що кінетична енергія прямо пропорційна абсолютній температурі: ![]()
підставивши цю формулу у вираз для тиску отримаємо
![]() де k=1,38·10-23 Дж/К – стала Больцмана
де k=1,38·10-23 Дж/К – стала Больцмана
 На практиці часто користуються поняттям Нормальні умови – це стан речовини при певних термодинамічних параметрах:
На практиці часто користуються поняттям Нормальні умови – це стан речовини при певних термодинамічних параметрах:
Домашнє завдання:
1. §2.5-2.6, 3.3, 3.8, 4.4, 4.5 [ Л.С.Жданов, Г.Л.Жданов. Фізика]
2. Перевести в основні одиниці:
|
завдання |
відповідь |
завдання |
відповідь |
завдання |
відповідь |
|
5л= |
|
75кПа= |
|
0ºС= |
|
|
2мл= |
|
760мм.рт.ст.= |
|
-273ºС= |
|
|
4дм3= |
|
748мм.рт.ст.= |
|
27ºС= |
|
Лекція 3
Питання для повторення
- Агрегатний стан речовини.
- Основні характеристики теплового руху.
- Термодинамічні параметри газу.
- Нормальні умови.
Тема: Ідеальний газ. Рівняння Мендєлєєва-Клапейрона. Ізопроцеси та їх графіки. Розв’язування задач.
План:
- Ідеальний газ.
- Об’єднаний газовий закон.
- Процеси в газах.
- Робота газу.
- Ідеальний газ.
При вивченні явищ природи неможливо врахувати всі фактори, які впливають на хід явища. Проте завжди можна виділити найголовніші з них, іншими (другорядними), які не здійснюють значного впливу на хід явища, можна знехтувати. На цій основі створюється певне ідеалізоване уявлення про явища.
Виходячи з характеристик газового стану речовини можна ввести поняття ідеального газу.
Ідеальний газ - це такий газ, в якому можна знехтувати взаємодію між молекулами, а молекули прийняти за матеріальну точку.
Така модель відповідає реальному газу при невисоких тисках і не дуже низьких температурах. При високих тисках молекули реального газу наближаються одна до одної настільки, що сили притягання стають суттєвими, (як і власний об’єм молекул). Так само і при низьких температурах. Тому властивості реальних газів в таких умовах суттєво відрізняються від властивостей ідеального газу.
Ідеальний газ характеризується трьома основними термодинамічними параметрами - тиск, об’єм і температура.
Якщо вибрати певну масу газу m , то при сталих тиску, температурі і об’єму газ буде знаходитися в рівноважному стані. Якщо основні термодинамічні параметри змінюються, то в газі протікає процес, який переводить газ в інший рівноважний стан з іншими значеннями термодинамічних параметрів.
Газовий закон – співвідношення між значеннями певних термодинамічних параметрів газу на початку і в кінці процесу.
2. Об’єднаний газовий закон – газовий закон, що виражає зв’язок між всіма трьома параметрами газу.
Зв’язок між тиском, об’ємом і температурою певної масу газу встановлюється за допомогою співвідношення ![]() , де n0 - число молекул в одиниці об’єму (концентрація)
, де n0 - число молекул в одиниці об’єму (концентрація)
![]()
![]()
![]()
оскільки при постійній масі загальна кількість молекул N залишається сталою, а k – стала величина, їх добуток теж є сталою величиною.
|
|
- Об’єднаний газовий закон: при постійній масі газу відношення добутку об’єму на тиск до температури газу є сталою величиною для всіх станів цієї маси газу. |
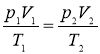
Застосуємо об’єднаний газовий закон для одного моля газу
![]()
![]() - універсальна газова стала R=8,31Дж/(моль·К)
- універсальна газова стала R=8,31Дж/(моль·К)
Розглянемо формулу зв’язку термодинамічних параметрів для загального випадку ![]() ,
, ![]() ,
, ![]()
![]()
![]()
|
|
- рівняння Мендєлєєва-Клапейрона (рівняння стану ідеального газу) |
Якщо 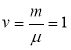 => pV=RT - рівняння стану для одного моля ідеального газу.
=> pV=RT - рівняння стану для одного моля ідеального газу.
Застосування вивченого матеріалу.
Задача 1 ( 2.14. [1])
Визначити тиск , при якому 1м3 газу містить 2,4 ·1026 молекул; температура газу становить 60ºС.
|
V=1м3 N=2,4·1026 мол t=60ºС=333К NA=6,022·10-23мол/моль
P –?
|
Розв’язання
Відповідь: P=1,1МПа |
Задача 2 ( 492. [2])
Повітря об’ємом 1,45м3, яке знаходиться при температурі 20ºС і тиску 100кПа, перевели в рідкий стан. Який об’єм займе рідке повітря, якщо його густина 861кг/м3?
(μповітря 26·10-3кг/моль)
|
Vг=1,45м3 р=100кПа=100·103Па t=20ºС=293К ρ=861кг/м3 μповітря 26·10-3кг/моль
Vр –?
|
Розв’язання
Відповідь: Vр =0,0018м3 |
Домашнє завдання:
1.§ 2.1-2.3, 3.2, 3.5-3.7 [ Л.С.Жданов, Г.Л.Жданов. Фізика]
2. Задача № 2,42[1]: При якій температурі 1 см3 газу містить 1·1019 молекул, якщо тиск становить 10кПа.
3. Задача № 497[2]: Визначити густину ρ газу при тиску p і абсолютній температурі T.
|
Газ |
Величина |
Відповідь |
|
|
р·103, Па |
Т, К |
ρ, кг/м3 |
|
|
Азот (N2) |
102 |
297 |
|
|
Кисень (O2) |
310 |
510 |
|
|
Водень (H2) |
41 |
243 |
|
|
Аргон (Ar) |
32 |
600 |
|
Лекція 4
Питання для повторення
- Ідеальний газ.
- Газовий закон.
- Об’єднаний газовий закон.
- Рівняння Мендєлєєва-Клапейрона..
- Рівняння стану для одного моля ідеального газу.
Тема: Процеси в газах. Робота газу при зміні об’єму.
План:
- Ізопроцеси та їх графіки.
- Робота газу при зміні об’єму.
Якщо основні термодинамічні параметри змінюються, то в газі протікає процес, який переводить газ в інший рівноважний стан. Розглянемо основні процеси в газах:
Процеси, при яких маса газу і один з його параметрів залишаються сталими, називають ізопроцесами.
1. Ізохорний процес - процес, що відбувається при сталій масі і незмінному об’ємі.
V=Const. V1=V2
Газовий закон при таких умовах має вигляд: 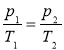
Ізохорний процес підкоряється закону Шарля: при постійній масі газу і незмінному об’ємі тиск газу прямо пропорційний його абсолютній температурі.
З рівняння Менделєєва - Клапейрона:
![]() V=Const, m=Const, R=Const, μ=Const,
V=Const, m=Const, R=Const, μ=Const, ![]() р~Т
р~Т
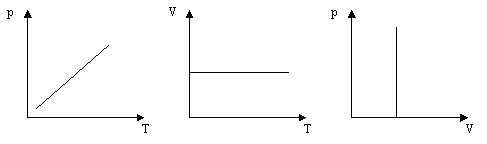
Графік цього процесу називається ізохора :
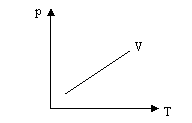
2. Ізобарний процес - процес, що відбувається при постійній масі і незмінному тиску:
p=Const, р1=р2
Газовий закон: ![]()
Підкоряється закону Гей-Лосака: при постійній масі і незмінному тиску об’єм газу прямо пропорційний його абсолютній температурі.
З рівняння М-К:
![]() р=Const, m=Const, R=Const, μ=Const,
р=Const, m=Const, R=Const, μ=Const, ![]() V~Т
V~Т
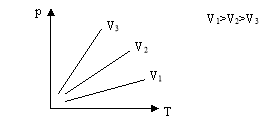
Графік цього процесу - ізобара
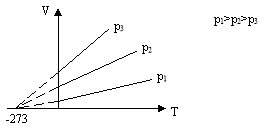
3. Ізотермічний процес - процес, що відбувається при постійній масі і сталій температурі.
T=Const, T1=T2
Газовий закон: ![]()
Підкоряється закону Бойля-Маріотта: при постійній масі газу і незмінній температурі тиск газу обернено пропорційний його об’єму
З рівняння М-К:
![]() T=Const, m=Const, R=Const, μ=Const,
T=Const, m=Const, R=Const, μ=Const, ![]() p~1/V
p~1/V
Графік цього процесу - ізотерма
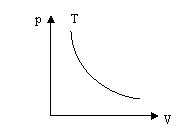
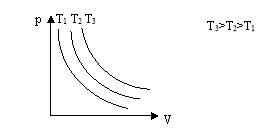
Виходячи з означення ідеального газу в ньому відсутні сили міжмолекулярної взаємодії і тому молекули не мають потенціальної енергії. Внутрішня енергія ідеального газу являє собою лише суму кінетичної енергії хаотичного руху всіх його молекул.
Для кожної окремої молекули ![]()
Для одного моля газу ![]()
Внутрішня енергія довільної маси ідеального газу – 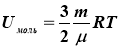
- Робота газу при зміні об’єму.
Стиснутий газ при розширенні виконує роботу.
Розглянемо циліндр з рухомим поршнем, заповнений газом (мал.). Поршень нерухомий поки тик газу врівноважений з навколишнім тиском. Якщо поступово збільшувати температуру газ почне ізобарно розширюватися, оскільки зовнішній тиск залишається сталим. При цьому поршень переміститься з положення 1 в положення 2 на відстань Δl.
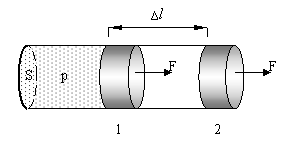
При цьому газ виконає роботу проти зовнішньої сили: A=FΔl оскільки F=pS то A=pSΔl.
S – площа поперечного перерізу циліндра, Δl – довжини,
SΔl=ΔV – приріст об’єму при нагріванні
тоді
A=pΔV – робота газу при зміні об’єму
A=p(V1-V2)
При V1 = V2 А=0 отже газ виконує роботу лише в процесі зміни свого об’єму.
Застосовуючи цю формулу до одного моля ідеального газу використавши рівняння Мендєлєєва-Клапейрона отримаємо
Aмоль=pΔVмоль pVмоль1=RT1 pVмоль2=RT2
p(Vмоль2 - Vмоль1) = R(T2-T1)
pΔVмоль=RΔT
![]()
молярна газова стала чисельно дорівнює роботі, виконаній одним молем ідеального газу при його ізобаричному нагріванні на один Кельвін.
Застосування вивченого матеріалу.
Задача 1 ( 3.9 [1])
Зобразити графік ізохорного процесу в координатах: а)р,Т; б)V,Т; в)р,V.
Ізохорний процес - процес, що відбувається при сталій масі і незмінному об’ємі.
m=Const, V=Const.
Задача 2 ( 3.18 [1])
Газ, що займав об’єм 12,32л, охолодили при постійному тиску на 45К, після чого об’єм став рівен 10,52л. Визначити початкову температуру газу.
|
V1=12,32л =12,32·10-3м3 р=Const Т2=Т1-45К V2=10,52л =10,52·10-3м3
Т1 –?
|
p=Const, р1=р2 – ізобарний процес
Відповідь: Т1=308К |
Задача 3 ( 525 [2])
Температура повітря в циліндрі 7ºС. На скільки переміститься поршень при нагріванні повітря на 20К, якщо висота стовпчика повітря під поршнем становить14см?
|
Т1=7С =280К Т2= Т1+20К =300К р=Const l1=14см =0,14м
l2 –?, ∆l-?
|
Розв’язання
p=Const, р1=р2 – ізобарний процес
Відповідь: l2 =0,15м, ∆l=0,01м (на 1 см) |
Домашнє завдання:
1. §4.1-4.3, 4.6, 5.1-5.10 [ Л.С.Жданов, Г.Л.Жданов. Фізика]
2. Задача 1 ( 3.56 [1])
Зобразити графік ізотермічного процесу в координатах: а)р,Т; б)V,Т; в)р,V.
3. Задача 2 ( 3.8 [1])
Газ в закритому балоні нагріли від 300К до 360К, при цьому тиск зріс на 0,81МПа. Визначити початковий тиск. (Процес вважати ізохорним)
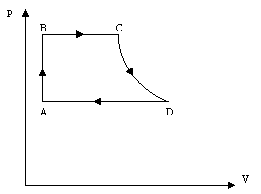 4. Задача* № 538[2]: На малюнку зображено замкнутий цикл. Ділянка СD відповідає ізотермі. Накреслити цю діаграму в координатах р,Т і V Т.
4. Задача* № 538[2]: На малюнку зображено замкнутий цикл. Ділянка СD відповідає ізотермі. Накреслити цю діаграму в координатах р,Т і V Т.
Матеріал для самостійного опрацювання:
Основні характеристики теплового руху.
- Швидкість хаотичного руху:
Одним з найпростіших і наочних дослідів для визначення швидкості хаотичного руху є дослід, проведений Штерном у 1920році.
На горизонтальному столику, який може обертатися навколо осі 0, закріплено дві циліндричні поверхні А і В, одна з яких (А) має вузьку щілину паралельну осі О. Вздовж осі 0 розміщено платинову дротину, поверхня якої покрита сріблом, яка підключається до електричної мережі. При пропусканні струму дротина нагрівається і починається випаровування атомів срібла з її поверхні. Частинки срібла летять в різні сторони і вилітають через щілину на поверхню В, в точку М. Вся установка знаходиться під ковпаком (у вакуумі) для уникнення розсіяння молекул срібла на молекулах повітря.
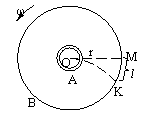 Визначення швидкості відбувається так:
Визначення швидкості відбувається так:
Установку обертають навколо осі 0 з постійною кутовою швидкістю ω. За час t молекула, що вилетіла з щілини попадає на поверхню B в точці K. Час польоту молекули вздовж радіуса r поверхні B і час зміщення точки M в точку K на відстань KM=l однакові, тому: ![]() rA - радіус поверхні А.
rA - радіус поверхні А.
З іншого боку лінійна швидкість точок поверхні В становить ωr, тому час можна виразити так ![]()
Прирівнявши дві останні формули отримаємо формулу для швидкості руху молекул
![]()
За дослідом Штерна швидкість молекул срібла становить близько 500м/с,
водню – 1840 м/с, азоту – 493 м/с.
- Число зіткнень, довжина вільного пробігу.
При хаотичному русі відбуваються численні зіткнення молекул газу між собою.
Довжина вільного пробігу λ - відстань, яку пролітає молекула між двома послідовними зіткненнями.
Використовується середнє значення довжини вільного пробігу
![]()
![]()
![]() - середнє число зіткнень молекул за одну секунду.
- середнє число зіткнень молекул за одну секунду.
При нормальних умовах λ для молекул повітря становить близько 10-7м. В таких умовах на об’єм молекули припадає 0,04% всього об’єму, який займає газ.
Основні визначення і формули теми
|
Означення |
Формула |
Одиниці |
|
Відносна молекулярна (атомна) маса - маса молекули виражена в атомних одиницях маси |
mв |
[mв]= а.о.м. 1а.о.м.=1,66·10-27кг
|
|
Кількість речовини – характеристика фізичного тіла, що пропорційна кількості молекул у тілі. |
|
[ν]= моль. |
|
Сталі величини |
||
|
Число Авогадро – кількість молекул в одному молі речовини NА NА=6,022·1023 молекул/моль |
||
|
Молярний об’єм - об’єм одного моля речовини. Для будь-якого газу при нормальних умовах Vм=22,4л. |
||
|
Число Лошмідта nЛ – число молекул газу в одиниці об’єму при нормальних умовах nЛ= NА/ Vм=2,7·1025 молекул/м3 |
||
Завдання для тематичного контролю
Фізичний диктант.
- Основні положення молекулярно-кінетичної теорії.
- Внутрішня енергія.
- Кількість речовини.
- Чим визначається агрегатний стан.
- Характеристики газоподібного стану речовини.
- Термодинамічні параметри газу.
- Основне рівняння М.К.Т.
- Абсолютний нуль.
- Зв’язок між абсолютною температурою і температурою за Цельсієм.
- Нормальні умови.
- Ідеальний га.з
- Об’єднаний газовий закон.
- Рівняння Мендєлєєва-Клапейрона.
- Ізохорний процес.
- Ізобарний процес.
- Ізотермічний процес.
- Робота газу при зміні об’єму.
Відповіді
До лекції 1
Задача № 2,15 [1]: Визначити число атомів, що знаходяться в 1г гелію.
(В-дь: 1,5·1023атомів)
До лекції 2
Перевести в основні одиниці:
|
завдання |
відповідь |
завдання |
відповідь |
завдання |
відповідь |
|
5л= |
5·10-3м3 |
75кПа= |
75000 Па |
0ºС= |
273 К |
|
2мл= |
2·10-6м3 |
760мм.рт.ст.= |
101080 Па |
-273ºС= |
0 К |
|
4дм3= |
4·10-3м3 |
748мм.рт.ст.= |
99484 Па |
27ºС= |
300 К |
До лекції 3
Задача № 2,42[1]: При якій температурі 1 см3 газу містить 1·1019 молекул, якщо тиск становить 10кПа. (В-дь: 73К)
Задача № 497[2]: Визначити густину ρ газу при тиску p і абсолютній температурі T.
|
Газ |
Величина |
Відповідь |
|
|
р·103, Па |
Т, К |
ρ, кг/м3 |
|
|
Азот (N2) |
102 |
297 |
1,16 |
|
Кисень (O2) |
310 |
510 |
2,34 |
|
Водень (H2) |
41 |
243 |
0,041 |
|
Аргон (Ar) |
32 |
600 |
0,257 |
До лекції 4.
Задача 2 ( 3.8 [1])
Газ в закритому балоні нагріли від 300К до 360К, при цьому тиск зріс на 0,81МПа. Визначити початковий тиск. (Процес вважати ізохорним) В-дь: 4,1МПа
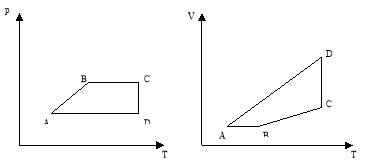
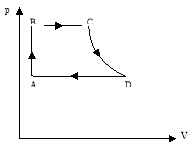 Задача* № 538[2]: На малюнку зображено замкнутий цикл. Ділянка СD відповідає ізотермі. Накреслити цю діаграму в координатах р,Т і V Т.
Задача* № 538[2]: На малюнку зображено замкнутий цикл. Ділянка СD відповідає ізотермі. Накреслити цю діаграму в координатах р,Т і V Т.


про публікацію авторської розробки
Додати розробку

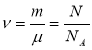
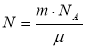 1молекула N містить 2 атома, тому
1молекула N містить 2 атома, тому