Методичні рекомендації до виконання лабораторних робіт з дисципліни «Хімія» для студентів ІІ курсу спеціальності 186 «Видавництво та поліграфія».

Рецензенти: завідувач кафедри методики викладання природничо-математичних дисциплін ІППОЧО, кандидат хімічних наук Поліна ЧУХНЕНКО; викладач вищої категорії, методист, викладач хімії Чернівецького фахового коледжу технологій та дизайну Божена БУРКУТ; викладач вищої категорії, викладач біології і екології Чернівецького індустріального фахового коледжу Надія ДУДІЙ.
Розглянуто на засіданні циклової комісії загальноосвітніх дисциплін Чернівецького індустріального фахового коледжу
Протокол №12 від 10.05.23р.
Голова циклової комісії: Світлана МАЦЕЙКО
Рекомендовано методичним об’єднанням викладачів хімії, біології і екології закладів фахової передвищої освіти Чернівецької області, протокол №2 від 25.05.23р. Керівник методичного об’єднання: Світлана МАЦЕЙКО.
Схвалено Методичною радою
Чернівецького індустріального фахового коледжу Протокол №7 від 31.05.23р.
Голова Методичної ради: Анастасія ВАСКАН
Методичні рекомендації до виконання лабораторних робіт з дисципліни «Хімія» для студентів ІІ курсу спеціальності 186 «Видавництво та поліграфія». Друге видання, доповнене і доопрацьоване. / Уклад. Світлана МАЦЕЙКО. - Чернівці, 2023 - 46с.
Зміст
1. Пояснювальна записка………………………………………………..….4 2. Правила техніки безпеки………………………………………………....5
3. Лабораторна робота № 1.
Будова атома і хімічний зв’язок……………………………………........7
4. Лабораторна робота № 2.
Тема: Швидкість хімічних реакцій....………………………….............11
5. Лабораторна робота №3.
Тема: Хімічна рівновага……………………………….…………..........16
6. Лабораторна робота №4.
Тема: Окисно – відновні процеси………………………….…...............21
7. Лабораторна робота №5.
Тема: Реакції обміну між електролітами……….……….……..............25
8. Лабораторна робота № 6.
Тема: Визначення рН розчинів………………………...…….…............27
9. Лабораторна робота № 7.
Тема: Гідроліз солей………………………………………………….…30
10.Лабораторна робота №8.
Тема: Комплексні сполук.…………………………...………………….34
11.Лабораторна робота №9.
Тема: Вивчення властивостей полімерів………………..…………….37 12. Лабораторна робота №10.
Тема: Одержання та властивості колоїдних розчинів………………..39 13. Лабораторна робота №11.
Тема: Розв’язування експериментальних задач……………. ………..42
14. Література……………………………………………………………….45
Пояснювальна записка
"Задоволення – пролетить, воно для себе; праця залишить слід довгої радості – вона для інших. Навчання – собі, плід навчання – іншим. Іншого сенсу немає в навчанні, інакше воно було б непотрібне”.
Д.І. Менделєєв
Методичні вказівки та завдання для лабораторних робіт є частиною методичного забезпечення дисципліни «Хімія» для студентів ІІ курсу. Тематика лабораторних робіт відповідає навчальній програмі з дисципліни «Хімія». Методичні вказівки призначені для покращення організації виконання робіт студентами. Лабораторні роботи сприяють глибшому засвоєнню хімічних понять і законопроектів, розвивають уміння застосовувати набуті практичні навички і знання в конкретних дослідженнях та розрахункових завданнях, розвивають інтерес до вивчення дисципліни і є передумовою самостійного творчого підходу до виконання поставленого перед студентами завдання. Створений на допомогу студентам.
Проведення лабораторних занять відбувається в навчальній лабораторії. Студенти знайомляться з лабораторними дослідами, які характеризують хімічні властивості речовин, а пізніше самостійно виконують індивідуальне завдання.
Проведення лабораторних робіт носить демонстраційний характер. Студенти знайомляться із змістом лабораторної роботи, беруть участь у її проведенні, спостерігають за ходом хімічних процесів те реакцій. Свої спостереження, узагальнення та висновки оформляють за такою схемою:
Тема:
Мета:
Порядок виконання роботи:
Обладнання та матеріали:
Допуск до проведення лабораторної роботи:
1. Яких правил техніки безпеки потрібно дотримуватися під час виконання лабораторної роботи?
2. Опишіть своїми словами послідовність дії при виконанні роботи.
3. Опишіть свої спостереження за ходом хімічної реакції.
4. Напишіть рівняння реакцій, що відображають перебіг досліду.
Хід роботи:
1. Провести досліди згідно інструкції.
2. Дати відповідь на запитання до дослідів.
3. Записати рівняння реакції та спостереження.
Зробіть висновки.
Виконайте завдання для самостійної роботи.
Правильність виконання та оформлення звіту до лабораторної роботи викладач оцінює за п’ятибальною системою. Рівень засвоєння студентами теоретичних та практичних знань виявляється під час усного захисту роботи. В кінці кожної роботи приведеної теоретичні запитання та завдання для захисту роботи.
I. Основні правила техніки безпеки під час роботи в кабінеті - лабораторії хімії:
1. Виконуйте тільки ті досліди, що узгоджені з викладачем.
2. Забороняється брати речовини руками і пробувати її на смак.
3. Для визначення запаху речовини треба долонею зробити рух під отвору посудини до носа.
4. Відкривши склянку з реактивом, ставте пробку догори.
5. Посудину, з якої взято реактив, відразу закривайте пробкою і ставте на місце. 6. Надлишок узятого не зливайте (не зсипайте) у ту ж саму посудину, а лише у спеціальну посудину.
7. Під час нагрівання пробірок і колб з реактивами користуйтесь тримачем. Отвір посудини спрямовуйте в бік від тих, що працюють поруч.
8. Нагрівайте посудину з реактивом рівномірно, увесь об’єм рідини, не вище її рівня.
9. Не зазирайте в посудину, яку нагріваєте або в яку наливаєте раеактив.
10. Якщо кислота або луг потрапили на руки або одяг, негайно змийте їх великою кількістю води і повідомте про це викладача.
11. Кислоту слід наливати у воду повільно, тонким струменем, перемішуючи: категорично забороняється наливати воду в кислоту.
12 Будьте максимально обережними при виконанні практичних робіт, чітко дотримуйтесь інструкції.
13. Уважно читайте етикетку на посудині з речовиною, яку берете для досліду.
14. Відпрацьовані реактиви після їх нейтралізації злийте у раковину, а цінні реактиви – у спеціальні посудини.
15. Після закінчення роботи приберіть своє робоче місце, виключіть воду, електронагрівальні прилади і обов’язково ретельно вимийте руки!
II. У кабінеті - лабораторії хімії забороняється:
- Класти свої сніданки на лабораторні столи і споживати їжу в хімічному кабінеті. - Пробувати хімічні реактиви на смак.
- Брати речовини руками.
- Виливати чи висипати їдкі реактиви в каналізацію без спеціальної обробки.
- Залишати відкритими склянки та банки з реактивами.
- Заглядати в посуд, в якому нагріваються реактиви, нахилятися над посудиною, в яку наливається будь-яка рідина (особливо їжа), бо непомітні краплини можуть потрапити в очі.
- Виливати та висипати залишки реактивів в склянки та банки, я яких їх взяли.
- Міняти корки та піпетки від різних банок та склянок, самостійно зливати та змішувати реактиви.
- Залишати не прибраними розсипані або розлиті реактиви.
III. Правила пожежної безпеки:
1. Посуд, в якому спалахнула рідина (бензин, гас, ацетон, скипидар, ефір, спирт, бензол), накривають скляною, фарфоровою посудиною більшою розміру або дерев’яними дошками тощо. Категорично забороняється задмухувати полум’я. 2. Розлиту на столі чи підлозі рідину, що зайнялася, засипають піском або накривають ковдрою. Не намагайтеся гасити полум’я водою. У разі великих пожеж застосовують вогнегасник.
3. Якщо на працівникові зайнявся одяг, його швидко аогортають ковдрою, залишаючи голову відкритою. Можна також зірвати палаючий одяг або направити на нього струмінь води. Однак найліпше качатися по підлозі чи землі. Не можна допускати, щоб потерпілий бігав, збивав полум’я руками, бо рух роздмухує полум’я.
Лабораторна робота № 1 Тема: Будова атома і хімічний зв’язок
Мета: Навчитися характеризувати найважливіші складові частини атома. Навчитися оперувати квантовими числами, зображати електронні конфігурації атомів, квантовими комірками, електронними формулами. Навчитися визначати тип хімічного зв’язку.
Теоретичні відомості
Атом - мікрочастинка, яка складається з ядра, що вміщує протони і нейтрони, і електронів, які утворюють зовнішню оболонку.
Хімічний елемент - вид атомів з однаковим зарядом ядра.
Ізотоп - вид атомів з однаковим масовим числом.
Масове число - загальна кількість протонів і нейтронів, що входять до ядра.
Квантові числа - параметри, що визначають електронну структуру і властивості електронів атома n - головне квантове число; визначає енергетичний рівень і енергію електрона.
n = 1, 2, ... [1] ... ∞;
l - орбітальне квантове число; визначає енергетичний підрівень, форму орбіталі і енергію електрона. l = 0, 1, ... [1] ... n-1;
ml - магнітне квантове число; визначає просторову орієнтацію атомних орбіталей
ml = -1... [1] ...+1;
ms - спінове квантове число; визначає власний механічний і магнітний момент електрона ms = -1/2 або +1/2
Кількість енергетичних підрівнів на енергетичному рівні дорівнює n
Електронна ємність енергетичного рівня дорівнює 2n2
Кількість орбіталей на енергетичному підрівні дорівнює 2l + 1 Електронна ємність енергетичного підрівня дорівнює 2 · ( 2l + 1 )
Принцип Паулі - в атомі не може бути двох або більше електронів з однаковим набором всіх чотирьох квантових чисел
Правило Гунда - сумарне спінове число електронів на даному підрівні повинне бути максимальним.
Правило Клечковського - енергетичні підрівні заповнюються в порядку зростання величини n+l, а при рівних значеннях - у порядку зростання величини n.
Типи хімічного зв’язку
Ковалентний - узагальнена електронна пара локалізована між ядрами з двох атомів, що утворюють хімічний зв’язок. Характеризується направленістю і насиченістю. Іонний - узагальнена електронна пара локалізована на одному з двох атомів, що утворюють хімічний зв’язок. Характеризується ненаправленістю і ненасиченістю. Металічний - зовнішні електрони делокалізовані в межах кристалу і об’єднують позитивно заряджені іони атомів металу.
Порядок виконання роботи
1. Ознайомити студентів з розв’язуванням типових завдань для цієї теми.
2. Проаналізувати один з варіантів тест – контролю « Будова атома».
3. Виконання завдання тест – контролю « Будова атома» відповідно до варіанту.
4. Виконати завдання для самоконтролю опрацювати відповідно до варіанту.
Завдання тест – контролю до теми « Будова атома»
1. Складіть електрону формулу атома або йона і вкажіть розподіл електронів по орбіталях.
2. Скільки електронів перебувають на кожному енергетичному рівні атома?
3. Яке значення головного, орбітального, магнітного, та спінового квантових чисел характерне для останнього електрона даного атома в основному стані?
4. Покажіть розподіл електронів на наведених в таблиці орбіталях йона в Вашому варіанті.
Приклад виконання тест – контролю
1) Атом: 17Cl заряд: 1- орбіталях: 3S3p
Відповідь: 1) 17Cl0 1s22s22p63s23p5
2) s p
|
↑↓ |
↑↓ |
↑↓ |
↓ |
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
|
|
n = 3 7 n = 2 8
n = 1 2
3) Для останнього неспареного електрона атома хлору: головне квантове число n = 3, орбітальне число L = 1, магнітне число m = 1, спінове число s = +1/2.
4) 17Cl0 + 1e→ 17Cl-; 17Cl- 1s22s22p63s23p6;
Розподіл електронів по вказаним орбіталях - 1s22s22p63 s23p6
Варіанти завдань до тест – контролю « Будова атома»
|
№ вар. |
Атом |
|
Йон |
№ вар. |
Атом |
Йон |
||
|
заряд |
орбіталі |
заряд |
орбіталі |
|||||
|
1 |
50Sn |
2+ |
5s5р |
3 |
43Te |
6+ |
5s4d |
|
|
2 |
74W |
5+ |
5s5р |
4 |
34Se |
2- |
4s4р |
|
Завдання для самостійної роботи
1. Вкажіть, якому хімічному елементу відповідає така електрона формула:
І Варіант – 1s22s22p63s23p6 ІІ Варіант –1s22s22p63s23p63d54s1
ІIІ Варіант – 1s22s22p63s23p63d104s2
ІV Варіант – 1s22s22p63s1
V Варіант – 5s25p4 2. Вкажіть тип хімічного зв’язку в молекулах :
І Варіант – H2, Cl2, HCl.
ІІ Варіант – HBr, SO2, Cl2.
ІIІ Варіант – NaCl, O2, H2S.
ІV Варіант – H2, KCl, SO3.
V Варіант – N2, NH3, HCl3.
3. Який із наведених хімічних елементів має найменшу електро - негативність: І Варіант –O, N, F, Cl.
ІІ Варіант – S, C, I, Fe.
ІIІ Варіант – H, N, O, Cl.
ІV Варіант – B, S, As, Cr, Hg.
V Варіант – Na, Mg, Al, P.
4. Визначить головне квантове число та орбітальне число для атомів:
І Варіант – Cl,
ІІ Варіант – Na,
ІIІ Варіант – Mg,
ІV Варіант – Ba,
V Варіант – Zn
Запитання до захисту лабораторної роботи:
1. Фізичний зміст періодичного закону.
2. Назвіть чотири квантових числа і пояснити їх фізичний зміст.
3. Яка будова електронних оболонок атомів?
4. Які основні правила запису електронних формул атомів?
Завдання:
1) Накресліть графічну будову і запишіть електронні формули для атомів: Mg, Al, P.
2) Що називають хімічним зв’язком? Які типи хімічних зв’язків ви знаєте?
Техніка безпеки:
Фізіологічна дія реактивів, що використовуються:
1.Кислоти і луги викликають опіки шкіри, руйнують тканини одежі;
2.Перманганат калію KMn04 в твердому стані (в виді пилу) подразнює органи дихання. В вигляді концентрованого розчину дає опіки шкіри. При попаданні розчину KMn04 на одежу утворюють плями, які потім неможливо вивести; 3. Солі натрію, заліза, калію можуть отруювати організм; Заходи безпеки:
1. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
2. Не пробувати реактиви на смак.
3. Працювати в халатах.
4. Після роботи обов’язково помити руки.
Література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
3. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Лабораторна робота № 2
Тема: Швидкість хімічних реакцій
Мета: Експериментально дослідити вплив концентрації реагуючих речовин на швидкість хімічної реакції і навчитись самостійно робити висновки. Уміти розв’язувати задачі на хімічну кінетику. Навчитися записувати рівняння швидкості реакції, характеризувати фактори, від яких залежить швидкість хімічних реакцій, обчислювати швидкість хімічних реакцій, використовувати принцип Ле - Шательє для визначення умов зміщення рівноваги хімічних реакцій.
Теоретичні відомості
Хімічна кінетика – це розділ хімії, що вивчає швидкість хімічних реакцій.
Швидкість гомологічних реакцій звичайно вимірюється кількістю речовини, що вступила в реакцію або утворилася в результаті реакції за одиницю часу в одиниці об’єму.
Δυ
Математично це можна записати так: υ (гомол) = ----------
V Δt
де υ (гомол) - швидкість реакції в гомогенній системі; υ - кількість речовини однієї з вигідних речовин або продуктів реакції; V – об’єм; t – час; Δυ = υ2 - υ1 ; Δt = t2 - t1.
Швидкість хімічної реакції виражають: моль/(л · с).
Розглянемо в загальному вигляді швидкість реакції, що відбувається за рівнянням : A+ B = C + D
В міру витрачення речовини А швидкість реакції зменшується (як це показано на рисунку). Звідси випливає що швидкість реакції можна визначити лише для деякого проміжку часу. Оскільки концентрація речовини А в момент часу t1 вимірюється величиною с1, а в момент t2 – величиною с2, то за проміжок часу
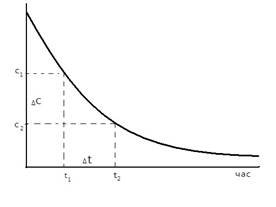 Δt =t2-t1 зміна концентрації речовин становитиме Δс = с2 – с1, звідки можна визначити середню швидкість реакції (υ):
Δt =t2-t1 зміна концентрації речовин становитиме Δс = с2 – с1, звідки можна визначити середню швидкість реакції (υ):
c2 – c1 Δc υ = - -------- = --------.
t2 – t1 Δt
Зміна концентрації реагуючої речовини з часом
Знак «мінус» тому, що, незважаючи на зменшення концентрації речовини А і, отже, на від’ємне значення різниці с2 – с1, швидкість реакції може бути тільки додатною величиною. Можна також стежити за зміною концентрації одного з продуктів реакції – речовини С або D; вона підчас реакції збільшуватиметься, і тому в правій частині рівняння треба ставити знак «плюс»
Фактори що впливають на швидкість реакції
Швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин. Для реакції (І) цей закон виразиться рівнянням:
υ = kсА сВ,
де сА і сВ – концентрації речовин А і В, моль/л; k – коефіцієнт пропорційності, що що називається константою швидкості реакції. Основний закон хімічної кінетики часто називають законом діючих мас.
Вплив температури. Залежність швидкості реакції від температури визначається правилом Вант-Гофа: З підвищенням температури на кожні 100С швидкість більшості реакцій зростає в 2 - 4 рази.
Математично ця залежність виражається співвідношенням : t2 - t1
υt2= υt1· γ --------,
10
де υt1 , υt2 – швидкості реакції відповідно при початковій (t1) і кінцевій (t2) температурах; γ – температурний коефіцієнт швидкості реакції, який показує, у скільки разів збільшується швидкість реакції з підвищенням температури реагуючих речовин на 100С.
Розв’язування типових задач
Задача1: Реакція за температури 500 відбувається за 2 хв. 15с. За який час закінчиться ця реакція за температури 700С, якщо в даному температурному інтервалі температурний коефіцієнт швидкості дорівнює 3?
Розв’язування.
Із збільшенням температури від 50υ до 700С швидкість реакції відповідно до правил Вант-Гоффа збільшується:
υ(t2) t2 – t1
------ = γ ·-------- , υ (t1) 10
де t2 = 700С, t1 = 500С, υ (t2) і υ (t1) – швидкості реакції за даних температур t1 маємо:
υ (t2) 70 - 50
------ = 3 -------------- = 32 = 9,
υ (t1) 10 тобто швидкість збільшується в 9 разів.
Відповідно до означення швидкість реакції обернено пропорційна часу перебігу реакції, отже:
υ(t2) τ(t1)
------- = ------- , υ(t1) τ(t2)
де τ(t1) і τ(t2) час перебігу реакції за температур t1 і t2.
Звідси маємо:
υ(t1)
τ(t2) = τ(t1) --------- ; υ(t2)
Враховуючи, що τ(t1) = 135 с (2 хв. 15 с), визначаємо час перебігу реакції за температури t2:
1
τ(t2) = 135 --- = 15 (c).
9
Порядок виконання роботи
1. Дослідити вплив концентрації реагуючих речовин на швидкість хімічної реакції.
2. Ознайомити студентів з розв’язуванням типових задач на хімічну кінетику.
3. Виконувати завдання тест-контролю «Хімічна кінетика і рівновага» відповідно до варіанту.
4. Виконувати завдання для самостійного опрацювання відповідно до варіанту. Обладнання та матеріали: Три пробірки, розчин Натрій тіосульфату - Na2S2O3, дистильована вода - H₂O, розчин сульфатної кислоти - Н₂SO₄, секундомір.
Дослід. Вплив концентрації реагуючих речовин на швидкість хімічної реакції. Налити у три пробірки розчин Натрій тіосульфату: у першу пробірку - 1 мл, другу – 2мл, у третю -3 мл. До першої пробірки долити 2 мл води, до другої 1-мл води, третю пробірку залишити без змін. Таким чином, у кожній пробірці буде по 3 мл розчину, а концентрації Натрій тіосульфату будуть відноситись між собою відповідно як 1 : 2 : 3. Долити до кожної пробірки по 1 краплі розчину Н₂SO₄ - розведеної сульфатної кислоти і спостерігати утворення вільного Сульфуру у вигляді каламуті (поява опалесценції).
За показом секундоміра відмітити, через скільки секунд з’явилася опалесценція. Порівняти час для кожної пробірки.
Результати занести у таблицю:
|
№ пробірки |
Вміст пробіро |
к |
H₂SO₄ |
Час протікання реакції, t, хв. |
Відносна швидкість V = 1 ⁄ t |
|
|
Розчин Na₂S₂O₃ , мл |
H₂O, мл |
Відносна конц., с |
||||
|
1 2 3 |
|
|
|
|
|
|
У звіті розкрийте такі пункти: 1.При взаємодії Натрій тіосульфату і сульфатної кислоти відбувається реакція: Na2S2O3 + H2SO4 = SO2↑ + S↓ + Na2SO4 + H2O
2. Побудуйте графік залежності швидкості реакції від концентрації реагуючих речовин.
3. Проаналізуйте графік, зробіть висновок про вплив концентрації реагуючої речовини на швидкість реакції.
Завдання для самостійного опрацювання: Варіант 1
1. У скільки разів зміниться швидкість реакції 2A + B → A2B, якщо концентрація А збільшити у 2 рази, а концентрацію B зменшити у 2 рази?
2. Вкажіть системи, в яких при підвищенні t0 рівновага зміщується в право:
а) 2H2 + O2 = 2H2O + Q, б) CO + H2O = CO2 + H2 + 42 кДж,
Задача: Реакція за температури 300 відбувається за 3хв. 10 с. За який час закінчиться ця реакція за температури 600 С, якщо в даному температурному інтервалі температурний коефіцієнт швидкості дорівнює 3? Варіант 2
1. Як зміниться швидкість прямої реакції: 2NO + O2 = 2NO2, якщо збільшити концентрацію газової суміші в 2 рази:
а) збільшиться у 4 рази, б) збільшиться у 8 раз,
в) зменшиться у 2 рази, г) зменшиться у 4 рази?
2. Вкажіть системи, в яких при підвищенні t0 рівновага зміщується в право:
а) 2CO + O2= 2CO2 + 570 кДж б) PCI5 = PCI3 + CI2 -130 кДж.
Задача: Реакція за температури 260 відбувається за 2 хв. 10 с. За який час закінчиться ця реакція за температури 400С, якщо в даному температурному інтервалі температурний коефіцієнт швидкості дорівнює 4?
Запитання до захисту лабораторної роботи
1. Які фактори впливають на швидкість хімічної реакції?
2. Яка залежність описується правилом Вант-Гоффа?
3. Наведіть приклади застосування каталізаторів та інгібіторів у поліграфії.
4. Дайте визначення хімічної рівноваги.
5. Чому рівна константа рівноваги хімічної реакції?
6. Принцип Ле-Шательє.
Техніка безпеки:
Фізіологічна дія реактивів, що використовуються:
1. Кислоти і луги викликають опіки шкіри, руйнують тканини одежі; 2. Тіосульфату Натрію може викликати отруєння організму ; Заходи безпеки:
1. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
2. Не пробувати нічого на смак. Працювати в халатах.
3. Після роботи обов'язково помити руки.
Правила першої допомоги:
Уражене місце кислотою помити великою кількістю води; При опіках лугом – помити 1% розчином оцтової кислоти;
При опіках кислотами – помити 2% розчином питної води.
Література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
3. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Лабораторна робота №3 Тема: Хімічна рівновага.
Мета роботи: Вивчити залежність зсуву хімічної рівноваги від концентрації речовин та температури, закріпити знання про хімічну рівновагу, сформувати навички застосування принципу Ле Шательє, формування навичок спостерігати і робити висновки.
Речовини і обладнання: Дистильована вода, розчин Ферум (ІІІ) хлорид, розчин йоду, амоній роданід (NH4SCN), розчин крохмалю, штатив з пробірками, сірники, піпетка.
Теоретичні відомості
Хімічну рівновагу можна визначити як такий стан системи реагуючих речовин, за якого швидкості прямої і зворотної реакцій дорівнюють одна одній.
На стан хімічної рівноваги впливають концентрації реагуючих речовин, температура, а для газуватих речовин - і тиск. При зміні одного з цих параметрів стан рівноваги порушується, і концентрації всіх реагуючих речовин змінюються доти, доки не встановлюється новий стан рівноваги, але вже з іншими значеннями рівноважних концентрацій. Подібний перехід реакційної системи з одного стану рівноваги в інший називається зміщенням хімічної рівноваги. Якщо при зміні умов концентрація кінцевих речовин збільшується, то говорять про збільшення рівноваги в бік продуктів реакції. Якщо ж збільшується концентрація вихідних речовин, то рівновага зміщується в бік їх утворення.
Напрямок зміщення хімічної рівноваги при зміні концентрації реагуючих речовин, температури і тиску(для газуватих реакцій) визначається загальним положенням, що відоме під назвою принципу рухомої рівновага, або принципу Ле Шательє: якщо на систему, що перебуває в стані рівноваги, чиниться який-небудь зовнішній вплив (змінюється концентрація, температура, тиск), то він сприяє перебігу тієї з двох протилежних реакцій, яка послаблює цей вплив.
Приклад: 3/2 Н2 + 1/2 N2 = N Н3 , Δ Н = - 46.2 кДж/моль
2 обєми 1 обєм
1) Збільшення концентрації Нітрогену зміщує рівновагу в бік вихідних речовин.
2) Пряма реакція відбувається з виділенням теплоти. Підвищення температури суміші сприяє перебігу реакцій з поглинанням теплоти, і рівновага зміщується в бік вихідних речовин, зниження температури спричинить зміщення рівноваги в бік продукту реакції.
3) Підрахуємо число молекул у лівій і правій частинах рівняння ( у лівій частині рівняння – 2 молекули, а в правій - одна). Оскільки підвищення тиску повинно сприяти процесу, що викликає зменшення числа молекул, то в цьому випадку рівновага зміститься в бік продукту реакції. Зниження тиску змістить рівновагу в бік вихідних речовин.
Розв’язування типових задач:
Задача 1: У системі: А + В ↔ С, ΔН0 < 0, де А, В і С – гази, встановилася рівновага. Як впливатимуть на рівноважну концентрацію речовини С: а) підвищення тиску;
б) збільшення концентрації речовини А;
в) підвищення температури?
Розв’язання:
а) під час перебігу реакції загальне число молів газуватих речовин зменшується з 2 до 1, відповідно до принципу Ле-Шательє підвищення тиску призведе до зміщення рівноваги в бік меншого числа молів газуватих речовин (тобто в бік утворення речовини С), отже [C] збільшиться.
б)збільшення концентрації речовини А призведе зміщення рівноваги в бік утворення продуту С, тобто [C] збільшиться.
в) оскільки ΔН0 < 0, теплота виділяється, реакція – екзотермічна. Зворотна реакція обов’язково буде ендотермічною. Підвищення температури завжди сприяє перебігу реакції з поглинанням теплоти, тобто рівновага зміститься в бік речовин А та В і [C] зменшиться.
Задача 2. Як впливатиме підвищення тиску на хімічну рівновагу в оборотній системі:
Fe3O4 (т) + CO (г) ↔ 3FeO (т) + СО2 ?
Розв’язання.
Запишемо вирази для швидкостей прямої (υпр) і зворотної (υзвор) реакцій: υпр = kпр [CO]; υзвор = kзвор [CO2]
Швидкості прямої і зворотної реакцій не залежать від концентрацій твердих речовин. За підвищення тиску в два рази в таке саме число разів збільшуються концентрації СО і СО2. Отже швидкості прямої і зворотної реакцій збільшаться в однакове число разів, і рівновага в системі не зміститься.
Тест-контроль до теми «Хімічна кінетика та рівновага»
Проаналізуйте кінетику наведеної у Вашому варіанті оборотної хімічної реакції згідно з завданням тест-контролю:
1. У скільки разів зміниться швидкість прямої реакції при зміні концентрації вихідних речовин?
2. У скільки разів зміниться швидкість прямої реакції при зміні об’єму системи згідно з даними Вашого варіанту?
3. У скільки разів зміниться швидкість прямої реакції при зміні тиску в системі згідно з даними Вашого варіанту?
4. У скільки разів зміниться швидкість прямої реакції при зміні температури системи згідно з даними Вашого варіанту?
5. На скільки градусів треба змінити температуру, щоб швидкість прямої реакції залишалася сталою, якщо тиск в системі змінився, як це наведено у Вашому варіанті?
6. Як зміниться стан рівноваги в системі, якщо змінити концентрацію вихідних речовин, як це зазначено у Вашому варіанті?
7. Як змінити стан рівноваги, якщо в системі змінити тиск, як це зазначено у Вашому варіанті?
8. Як зміниться стан рівноваги в системі, якщо змінити об’єм системи, як це зазначено у Вашому варіанті?
9. Як зміниться стан рівноваги, якщо в системі змінити температуру, як це передбачено у Вашому варіанті?
10.Як змінити температуру і тиск, щоб максимально підвищити вихід продуктів реакції?
Приклад виконання тест-контролю «Хімічна кінетика та рівновага»
|
Хімічна система |
Темп. коеф., γ |
Зміни в системі |
|||
|
△C, разів |
△V, разів |
△p, разів |
△t, разів |
||
|
H2(r) + J2(r) ↔ 2HJ(r) + Q |
2 |
+8 |
-4 |
+2 |
-40 |
1. V = K [H2] [J2]
V1 = K 8 [H2] 8[J2] = 64 K [H2] [J2],
Згідно до закону дії мас швидкості прямої реакції збільшиться у 64 рази при збільшенні концентрації вихідних речовин у 8 разів.
2. V2 = K 4[H2] 4[J2] = 16K [H2] [J2],
Швидкість прямої реакції збільшиться у 16 разів, при зменшенні об’єму системи у 4 рази.
3. V3 = K 2[H2]2 [J2] = 4K [H2] [J2]
Швидкість прямої реакції збільшиться у 4 разів, при зменшенні об’єму системи у 2 рази.
4. Згідно з правилом Вант – Гора
Vt2 = Vt1 γ ![]() Vt2 /V t1 = 24 = 16
Vt2 /V t1 = 24 = 16
Швидкість прямої реакції зменшилася у 16 разів, при зменшенні температури на 40∘ С. 5. При збільшенні тисків системі у 2 рази швидкість прямої реакції збільшиться у 4 рази.
Щоб швидкість прямої реакції залишалася сталою, необхідно температуру зменшити на 200С.
![]()
6. Згідно з принципом Ле-Шательє, при збільшенні концентрації вихідних речовин рівновага в системі зміститься вправо, тобто в бік продуктів реакції.
7. Якщо в системі збільшиться тиск, то рівновага зміститься в бік меншого об’єму. У нашому випадку об’єми рівні, то рівновага не зміститься.
8. Якщо в системі зменшити об’эм, то збільшиться концентрація вихідних речовин і рівновага в системі зміститься вправо.
9. При зменшенні температури рівновага зміститься в бік екзотермічних реакцій, до < + >, тобто вправо.
10.Щоб максимально підвищити вихід продуктів реакції, тобто рівновагу в системі змістити вправо, необхідно зменшити температур. Зміна тиску на рівновагу не вплине.
|
№В
|
Хімічна система |
Темп. коеф., γ |
Зміни в системі |
|||
|
△C, разів |
△V, разів |
△p, разів |
△t, разів |
|||
|
1-В |
H2 (г) + J2 (г) ↔ 2HJ (г) + Q |
2 |
+8 |
-4 |
+2 |
-40 |
|
2-В |
NH3 (г) + HCl (г) ↔ NH4Cl (к) + Q |
2 |
+16 |
+4 |
-4 |
-60 |
Хід виконання роботи:
Дослід 1: В пробірку налийте 15-20 мл води, в кожну пробірку долийте по 3-4 краплі розчинів Ферум (ІІІ) хлориду і амоній роданіду. Отриманий розчин розділіть на 3 пробірки. Першу пробірку використовуйте для порівняння забарвлення розчинів. До другої пробірки додайте 4-5 крапель Ферум (ІІІ) хлориду. До третьої пробірки додайте 4-5 крапель амоній роданіду. Завдання:
1) Порівняйте забарвлення розчинів в другій і третій пробірках з етолонною пробіркою і зробіть висновки про зміщення хімічної рівноваги.
2) Поясніть спостереження, ґрунтуючись на принципі Ле Шательє.
Дослід 2: Йод з крохмалем утворює сполуку інтенсивно-синього забарвлення. Дослідіть вплив температури на цю рівновагу. Для цього в дві пробірки налийте по 3-4 мл розчину крохмалю і додайте по 3-4 краплі розведеного розчину йоду. Одну з пробірок нагрійте в полум’ї спиртівки, а потім остудіть в склянці з водою.
Завдання: Опишіть свої спостереження. Який вплив температури на рівновагу даної реакції?
Запитання до захисту лабораторної роботи 1) Як змінюється забарвлення розчину?
2) Як зміщується рівновага при нагріванні та охолодженні?
3) Якою реакцією – ендотермічною чи екзотермічною – є реакція утворення сполуки йоду з крохмалем?
4) Поясніть спостереження та висновки, ґрунтуючись на принципі Ле Шательє. Варіант 1
В яких системах для зміщення рівноваги вправо слід знизити температуру: а) 2H2 + O2 = 2H2O + Q, б) CaCO3 = CaO + CO2 - Q,
в) SO3 + H2O = H2SO4 + Q, г) N2 + O2 = 2NO - Q?
Варіант 2
Впливом яких факторів можна змістити рівновагу вправо в системі:
CaCO3 = Ca + CO2 - Q
а) збільшення тиску, б) зниження температури,
в) підвищення температури, г) зниження тиску?
Техніка безпеки:
Фізіологічна дія реактивів, що використовуються:
1.Кислоти і луги викликають опіки шкіри, руйнують тканини одежі;
2.Розчин солі Ферум (ІІІ) хлорид, розчин йоду, амоній роданід можуть викликати отруєння організму; Заходи безпеки:
1. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
2. Не пробувати нічого на смак.
3. Працювати в халатах.
4. Після роботи обов’язково помити руки.
Правила першої допомоги:
Уражене місце кислотою помити великою кількістю води; При опіках лугом – помити 1% розчином оцтової кислоти;
При опіках кислотами – помити 2% розчином питної води.
Література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
3. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Лабораторна робота №4 Тема: Окисно – відновні процеси
Мета: Навчити студентів визначати ступінь окиснення елемента у сполуці, підбирати коефіцієнти у рівнянні ОВР, складати рівняння ОВР методом електронного балансу, визначати окисник і відновник у реакції.
Реактиви і обладнання: Натрій сульфіт, Ферум (II) сульфат, Калій перманганат, штатив з пробірками, сульфатна кислота, Натрій гідроксиду.
Теоретичні відомості:
Окисно-відновні реакції - це реакції, що відбуваються зі зміною ступеня окислення атомів, які входять до складу реагуючих речовин або реакції між окисником і відновником.
Кількість відданих електронів дорівнює кількості приєднаних електронів дорівнює кількості приєднаних електронів. Це називають електронним балансом.
Окислення – процес віддавання електронів атомом, молекулою або іоном. Відновлення - процес приєднання електронів атомом, молекулою або іоном. Атоми, молекули або іони, що віддають електрони, називаються відновниками, самі ж вони окисляються. Атоми, молекули або іони, що приєднують електрони, називаються окисниками, самі ж вони відновлюються.
Порядок виконання роботи:
Дослід 1: В пробірку наливаємо 1 мл. Ферум ( II) сульфат, добавляємо 0,5 мл. сульфатної кислоти. В цю ж пробірку добавляємо поступово Калій перманганату.
Завдання: Запишіть свої спостереження і рівняння реакції.
Дослід 2: В пробірку наливаємо 1 мл Натрій сульфіту, додаємо 0,5 мл. Натрій гідроксиду і Калій перманганат.
Завдання:Запишіть свої спостереження за ходом реакції і рівняння реакції.
Визначаємо елементи, що міняють ступені окиснення. Це Mn+7 і S+4 . Складаємо електронні рівняння. Вони дають змогу встановити коефіцієнти перед окисником, відновником і продуктами їх взаємодії.
Коефіцієнти для інших сполук підбирають шляхом підрахунку кількості атомів у сполуках у лівій і правій частині рівняння:
2KMn+7O4 + Na2S+4O3 + 2NaOH = 2NaKMn+6O4 + Na2SO4 + H2O
Mn+7 + 1e → Mn+6 2 – відновлення,
S+4 – 2e → S+6 1 – окиснення,
2 MnO4- + SO32- + 2OH- →2MnO42- + H2O + SO42-
![]()
![]()
![]()
окисник відновник середовище
Це реакція міжмолекулярного (міжатомного) окиснення – відновлення, в якій обмін електронами відбувається між атомами, що входять до складу різних молекул.
Завдання для самостійної роботи Варіант 1
1. Визначте ступінь окиснення елементів у сполуках: Cl2O3, CO, NH3, Al2O3, HClO4, KMnO4. 2. Які з наведених процесів є процесами окиснення, а які – відновлення: Al0 → Al+3, Sn+2 + 2e- →?, Cr+6 → Cr0?
3. Розставте коефіцієнти в рівняннях окисно – відновних реакцій, визначте окисник і відновник, зазначте процеси окиснення та відновлення й тип реакцій: а) PbO2 + NaNO2 + H2SO4→ PbSO4 + NaNO3 + H2O,
б) Mg + HNO3→ Mg (NO3)2 + N2 + H2O. Варіант 2
1. Визначте ступінь окиснення елементів у сполуках: NaCrO2, K2Cr2O7, Na2CrO4, CO2. 2. Які з наведених процесів є процесами окиснення, а які – відновлення: Cl0 → Cl-, Sn+2 → Sn+4, S-2 → S0, S+6 → S+?
3. Розставте коефіцієнти в рівняннях окисно-відновних реакціях, визначте окисник і відновник, зазначте процеси окиснення та відновлення й тип реакцій: а) Al + NNO3 → Al (NO3)3 + N2 + H2O,
б) K2Cr2O7 + KNO2 + H2SO4 → Cr2(SO4)3 + KNO3 + K2SO4 + H2O.
Варіант 3
1. Визначте ступінь окиснення елементів у сполуках: CCl4, NH3, Na2CrO4, NH4Cl, HF. 2. Які з наведених процесів є процесами окиснення, а які – відновлення: Cl20 → 2Cl-, Cu+2 → Cu0, S-2 → S+2, C0 → C+2?
3. Розставте коефіцієнти в рівняннях окисно-відновних реакціях, визначте окисник і відновник, зазначте процеси окиснення та відновлення й тип реакцій: а) MnO2 + KOH + KNO3 → K2MnO4+KNO2+H2O,
б) K2Cr2O7 + HCl → Cl2 + CrCl3 + KCL + H2O? Варіант 4
1. Визначте ступінь окиснення елементів у сполуках: Cr2O3, CO, NH3, HClO4, KMnO4. 2. Які з наведених процесів є процесами окиснення, а які – відновлення:
Al0 → Al+3, Sn+2 → Sn+4, Cr+6 → Cr0, S+2 → S+6?
3. Розставте коефіцієнти в рівняннях окисно-відновних реакціях, визначте окисник і відновник, зазначте процеси окиснення та відновлення й тип реакцій: а) KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O,
б) CuS + HNO3 → Cu(NO3)2 + NO + SO2+ H2O? Запитання до захисту лабораторної роботи
1. Які реакції називають окисно-відновними? Наведіть приклади. 2. Знайдіть ступінь окиснення елементів у сполуках: K2Cr2O7, KMnO4, Ag2SO4, NH4NO3
3. Наведіть приклади застосування ОВР у поліграфії. 4. Підберіть коефіцієнти, визначте окисник у реакції: Mg + HNO3 → Mg(NO3)2 + N2 + H2O
5. Наприклад застосування даної реакції у поліграфії. Техніка безпеки:
Фізіологічна дія реактивів, що використовуються:
1. Кислоти і луги викликають опіки шкіри, руйнують тканини одежі.
2. Перманганат калію KMn04 в твердому стані (в виді пилу) подразнює органи дихання. В виді концентрованого розчину дає опіки шкіри.
3. При попаданні розчину KMn04 на одежу утворюють плями, які потім неможливо вивести.
4. Солі Натрію, Феруму можуть отруювати організм.
Заходи безпеки:
1. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
2. Не пробувати нічого на смак. Працювати в халатах.
3. Після роботи обов’язково помити руки.
Правила першої допомоги:
Уражене місце кислотою помити великою кількістю води;
При опіках лугом – помити 1% розчином оцтової кислоти;
При опіках кислотами – помити 2% розчином питної води.
Література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
3. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Лабораторна робота №5
Тема: Реакції обміну між електролітами.
Мета роботи: Навчитися проводити реакції обміну між розчинами електролітів. Речовини і обладнання: Ферум (III) хлорид (FeCl3), Натрій гідроксид (NaOH), Барій хлорид (BaCl2), сульфатна кислота (H2SO4), Натрій карбонат (Na2CO3), хлоридна кислота (HCl), карбонатна кислота (H2CO3), штатив з пробіркам.
Теоретичні відомості
Реакції обміну між електролітами у розчинах відбуваються за участю йонів - частинок, які реально існують у розчинахсолей, лугів і кислот. Такі реакції називають йонними, а рівняння цих реакцій - йонними рівняннями. Скласти рівняння реакції обміну між електролітами у йонній формі, слід зважити на те, що електроліти у розчині дисоціюють на йони. За таблицею «Розчинність кислот, основ і солей у воді» визначмо, які з-поміж реагентів є сильними електролітами. Реакції обміну в розчинах електролітів з випаданням осаду.
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + 2Cl‾ + 2Na+ + SO42‾ = BaSO4↓ + 2N+ + 2Cl‾
Ba2+ + SO42‾ = BaSO4↓ Реакції обміну в розчинах електролітів з виділенням газу.
СаСО3 + 2НCl = СаСl2 + CO2↑ + H2O
СаСО3 + 2Н+ + 2Cl‾ = Са2+ + 2Сl‾ + CO2↑ + H2O
СаСО3 + 2Н+ = Са2+ + CO2↑ + H2O
Реакції обміну в розчинах електролітів з утворенням води.
NaOH + HCl = NaCl + H2O
Na+ + OH‾ + H+ + Cl‾ = Na+ + Cl‾ + H2O
OH‾ + H+ = H2O
Порядок виконання роботи
Дослід 1: Реакції, що відбуваються з утворенням осаду.
В одну пробірку налийте 1-2 мл розчину Ферум (III) хлориду (FeCl3), і додайте трохи розчину лугу.
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓
Fe3+ + 3Cl- + 3Na+ + 3OH- → 3Na+ + 3Cl- + Fe(OH)3↓ Fe3+ + 3OH- → Fe(OH)3↓
Завдання: Що спостерігаєте? Який осад утворюється в результаті реакції?
У другу пробірку налийте 1-2 мл розчину Барій хлориду (BaCl2), і додайте розчин сульфатної кислоти.
BaCl2 + H2SO4 → 2HCl + BaSO4↓
Ba2+ + 2Cl- + 2H + SO42- → 2H+ + 2Cl- + BaSO4↓ Ba2+ + SO42- → BaSO4↓
Завдання: Що спостерігаєте? Який осад утворюється в результаті реакції?
Дослід 2: Добування речовини з реактивів, що є навашому столі.
В пробірку налийте 1-2 мл розчину хлоридної кислоти (HCl) і додайте трохи Натрій карбонату (Na2CO3).
Завдання: Напишіть рівняння. Що спостерігаєте?
Запитання до захисту лабораторної роботи:
1. Які речовини називають електролітами? Речовини яких класів належать до електролітів?
2. Слабкі та сильні електроліти?
3. Сформулюйте визначення електролітичної дисоціації. Яка роль води в цьому процесі?
4. Напишіть рівняння реакції дисоціації електролітів:
а) нітратної та сульфатної кислоти; б) гідроксидів калію та барію;
в) солей – нітрату магнію; фосфату натрію; сульфату алюмінію.
5.Приведіть приклади реакцій обміну між електролітами, що відбуваються з виділенням газу, утворенням осаду та утворенням води.
Техніка безпеки:
Фізіологічна дія реактивів, що використовуються:
1.Кислоти і луги викликають опіки шкіри, руйнують тканини одежі;
2.Перманганат калію KMn04 в твердому стані (в виді пилу) подразнює органи дихання. В виді концентрованого розчину дає опіки шкіри; При попаданні розчину KMn04 на одежу утворюють плями, які потім неможливо вивести;
3.Солі Ферум (III) хлорид (FeCl3), Барій хлорид (BaCl2), сульфатна кислота (H2SO4), Натрій карбонат (Na2CO3) та Натрій гідроксид (NaOH) можуть отруювати організм; Заходи безпеки:
1. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
2. Не пробувати нічого на смак.
3. Працювати в халатах.
4. Після роботи обов’язково помити руки.
Правила першої допомоги:
Уражене місце кислотою помити великою кількістю води;
При опіках лугом – помити 1% розчином оцтової кислоти;
При опіках кислотами – помити 2% розчином питної води.
Література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
3. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Лабораторна робота №6 Тема: Визначення рН розчинів.
Мета: Експериментально дослідити зміну забарвлення індикаторів у кислому і лужному середовищах. Навчитися визначати рН розчинів за допомогою універсального індикатора і самостійного робити висновки. Вміти складати йонні рівняння реакцій. Обчислювати константу дисоціації, концепцію йоннів [H+] і [ОH-] за значенням рН і навпаки.
Обладнання та матеріали: Штатив з пробірками; розчини індикаторів: метиловий оранжевий, фенолфталеїн, лакмус; універсальний індикатор; розчин натрій гідроксиду NaOH.
Теоретичні відомості
Кислотність середовища найчастіше виражають не концентрацією іонів Гідрогену, а водневим показником рН - від’ємним логарифмом концентрації водневих іонів:
рН = - lg[Н+] [Н+] = 10-рН, де [Н+] – концентрація іонів Гідрогену.
За допомогою рН реакція розчинів характеризується так: нейтральна – рН =7, Кисла - рН ‹ 7, лужна – рН › 7.
Наведемо значення рН деяких найвідоміших розчинів і зазначимо відповідну їм реакцію середовища: шлунковий сік – рН=1,7 (сильнокисла реакція); дощова вода – рН = 6 (слабкокисла); водопровідна вода – рН = 7,5 (слабколужна); кров – рН = 7,4 (слабколужна); слина – рН = 6,9 (слабкокисла); сльози – рН=7 (нейтральна).
Винятково значна роль рН в найрізноманітніших явищах і процесах – в природі, в техніці, в поліграфії. Багато виробничих процесів у хімічній, харчовій, текстильній та інших галузях промисловості відбувається лише за певної реакції середовища.
Для практичного визначення рН розчинів найчастіше користуються індикаторами.
Індикаторний метод визначення рН ґрунтується на тому, що різні індикатори при різних значеннях рН неоднаково змінюють своє забарвлення: метиловий оранжевий змінює забарвлення при рН=4, лакмус – при рН=7, фенолфталеїн – при рН=9 тощо. Існують індикатори, які моють властивості змінювати свій колір при послідовній зміні рН. Це такі індикатори, як м-нітрофенол, н-нітрофенол тощо, які можна використовувати для кількісного визначення рН.
pH, Водневий показник - величина, що показує міру активності іонів водню (Н+) в розчині, тобто ступінь кислотності або лужності цього розчину. Для розведених розчинів можна користуватись терміном «концентрація» замість «активність» у цьому визначенні.
Показник кислотності (рН) зволожувального розчину може коливатись в інтервалі 4,8–5,5. При використанні зволожувального розчину з рН нижче 4,8:
- руйнується гідрофільна плівка проміжних елементів друкарської форми та виникає тінення;
- уповільнюється процес закріплення фарби на відбитках через порушення окислювальної полімеризації друкарської фарби, що може викликати відбиття фарбового шару на зворотній бік відбитка;
- зменшується стійкість фарбового шару до стирання;
- оголюються металеві розкочувальні циліндри фарбового апарату, що призводить до нерівномірного подавання фарби на друкарську форму та можливі до непродруковування дрібних друкарських елементів зображення. При рН більше за 5,5:
- виникає «омилення» друкарської фарби (у вигляді сіруватого відтінку);
- друкарська фарба емульгує та нашаровується на фарбових валиках, що призводить до тінення друкарської форми і бруду на відбитках;
- руйнуються друкувальні елементи, що знижує тиражестійкість друкарських форм.
У деяких випадках, у залежності від характеристики задруковуваного матеріалу та друкарської форми, значення рН зволожувального розчину може становити від 6,0 до 6,6. У процесі тиражного друку рН зволожувального розчину змінюється внаслідок руйнування основи проміжних елементів, корозії металевих деталей зволожувального апарату, впливу задруковуваних матеріалів (рН паперу) та кислотності фарб. Для запобігання корозії до складу зволожувального розчину вводять спеціальні добавки.
Порядок виконання роботи
1. Провести досліди по визначенню рН.
2. Ознайомити студентів з розв’язуванням типових задач по визначенню рН.
3. Виконати завдання для самостійного опрацювання відповідно до варіанту.
Дослід 1. Зміна забарвлення індикаторів у кислому і лужному середовищах. Взяти 3 пробірки, пронумерувати їх і в кожну налити по 20 крапель 0,1 М розчину лугу. В кожну пару пробірок внести по 1 краплі одного з досліджуваних індикаторів.
Наприклад, в обидві пробірки №1 – метилоранжевого, №2 – фенолфталеїну, №3 – лакмусу.
Який колір досліджуваних індикаторів у даних середовищах?
Свої спостереження порівняйте з даними таблиці:
|
№ |
Індикатор |
Забарвлення індикатора при значенні рН |
Інтервал переходу індикатора |
|||||||||||||
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
|
1 |
|
Червоний |
… |
Жовтий |
3,1-4,4 |
|||||||||||
|
2 |
|
Безколірний |
… |
Червоний |
9,4-10,6 |
|||||||||||
|
3 |
Лакмус |
червоний |
… |
синій |
5,0-8,0 |
|||||||||||
Дослід 2. Визначення рН розчину за допомогою універсального індикаторного паперу. Взяти досліджуваний розчин і занурити в нього смужку індикаторного паперу на декілька секунд. Вийняти смужку і порівняти забарвлення мокрої смужки паперу кольоровою шкалою. Шкала містить 10 різнокольорових прямокутників, які відображаються зміну кольору універсального індикатора від 1 до 10.
Зробити висновок про величину рН досліджуваного розчину. Вказати реакцію середовища.
Запитання для захисту лабораторної роботи:
1. Що називають водневим показником?
2. Чому рівний рН в кислих, нейтральних та лужних розчинах?
3. В яких поліграфічних процесах необхідно контролювати значення рН?
4. Які ви знаєте способи визначення рН? Техніка безпеки:
Фізіологічна дія реактивів, що використовуються:
1.Кислоти і луги викликають опіки шкіри, руйнують тканини одежі;
2.Перманганат калію KMn04 в твердому стані (в виді пилу) подразнює органи дихання. В виді концентрованого розчину дає опіки шкіри; При попаданні розчину KMn04 на одежу утворюють плями, які потім неможливо вивести; 3. Солі натрію, заліза, калію можуть отруювати організм; Заходи безпеки:
1. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
2. Не пробувати нічого на смак. Працювати в халатах.
3. Після роботи обов’язково помити руки.
Правила першої допомоги:
Уражене місце кислотою помити великою кількістю води;
При опіках лугом – помити 1% розчином оцтової кислоти;
При опіках кислотами – помити 2% розчином питної води.
Література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
3. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
.
Лабораторна робота № 7
Тема: Гідроліз солей.
Мета: Навчити студентів оцінювати здатність солей до гідролізу, записувати рівняння гідролізу солей в молекулярній та йонній формах і самостійно робити висновки про зміну рН середовища.
Теоретичні відомості
У водному розчині відбувається взаємодія молекул розчиненої речовини з молекулами води. У результаті молекули розчиненої речовини зазнають хімічних перетворень. Зі складних речовин такі перетворення є характерними для солей. Взаємодія іонів солі, що утворюються в результаті електролітичної дисоціації, з молекулами води називається гідролізом солі.
За відношенням до води всі солі поділяються на чотири групи залежно від природи катіона та аніона солі.
1. Солі, утворені сильною основою і сильною кислотою, гідролізу не піддаються, рН середовища не змінюється.
2. Солі утворені слабкою основою і сильною кислотою (NH4CI, CuCI2, Zn(NO3)2 тощо), мають кисле середовище (рН<7) внаслідок накопичення в розчині катіонів Гідрогену як продукту гідролізу. Сіль, утворена слабкою основою і сильною кислотою: NН4Cl + НОН → NH4OH + Н ++ Cl-
NН4 ++ НОН → NH4OH+ Н + Середовище кисле, рН < 7.
3. Солі утворені слабкою кислотою і сильною основою мають лужне середовище
(рН>7). Сіль утворена сильною основою і слабкою кислотою: СНСООNa + Н+ + ОН- → СН3СОOH + Na+ + OH-
СНСОО- + Н+ + ОН- → СН3СОOH + OH- Середовище лужне, рН > 7. 4.Соль утворена слабкою кислотою і слабкою основою має лужне середовище (рН=7) – повний гідроліз.
Приклад 1. Гідроліз хлориду амонію:
NH4CI + HOH ⥂ NH4OH + HCI, у повному іонно-молекулярному вигляді:
NH4 + + CI- + HOH ⥂ NH4OH + H+ + CI-,у скороченому іонно-молекулярному вигляді: NH4 + + HOH ⥂ NH4OH + H+.
Якщо катіон солі багатозарядний, гідроліз проходить ступінчасто. Однак другий і наступні можливі ступені гідролізу практично не виявляються (у силу електростатичних причин заряджених частинок, що послабляють дисоціацію).
Приклад 2. Гідроліз Купрум хлориду: CuCI2 + HOH ⥂ CuOHCI + HCI,
в іонному вигляді: Cu2+ +2CI- + HOH ⥂ CuOH+ + 2CI- + H+, у скороченому іонно-молекулярному вигляді: Cu2+ + HOH ⥂ CuOH+ + H+.
Гідроліз за аніоном є характерним для солей, утворених сильною основою і слабкою кислотою (KCN, Na2CO3, CH3COOK тощо). Що слабкіше кислота, то інтенсивніше відбувається процес гідролізу. Водні розчини солей, утворених сильною основою і слабкою кислотою, мають лужне середовище (pH>7) унаслідок накопичення в розчині іонів ОН-.
Пиклад 3. Гідроліз Калій ціаніду: KCN + HOH ⥂ KOH + HCN, у повному іонно-малекулярному вигляді: K+ + CN- + HOH ⥂ K+OH- + HCN, у скороченому іонно-молекулярному вигляді: CN- + HOH ⥂ OH- + HCN.
Якщо сіль утворена багато основною кислотою, гідроліз проходить ступінчасто. Однак другий і наступні можливі ступені гідролізу практично не виявляються (через електростатичний вплив заряджених частинок, що послабляють дисоціацію). Приклад 4. Гідроліз Натрій карбонату: Na2CO3 + HOH ⥂ NaHCO3 + NaOH, у повному іонно-молекулярному вигляді: 2Na+ + CO32- + HOH ⥂ 2Na+ + HCO3- + OH-.
Гідроліз за катіоном і аніоном характерний для солей, утворених слабкою основою і слабкою кислотою. Іони таких солей одночасно зв’язують іони H+ і ОН-, утворюючи слабкі електроліти-кислоту і основу. Залежно від значень констант дисоціації кислоти і основи (сили кислоти і основи) середовище може бути нейтральним, слабко кислим або слабколужним.
Порядок виконання роботи
Обладнання та матеріали: Амоній гідроксид, хлоридна кислота, сульфатна кислота, Натрій гідроксид, Натрій хлорид, штатив з пробірками, універсальний індикаторний папір, вода.
Дослід 1. Помістіть в пробірку 1 мл Амоній гідроксид та добавте декілька краплин сульфатної кислоти. Яке середовище утворюється в результаті гідролізу (кисле, нейтральне, лужне)? Для визначення середовища опустіть універсальний індикаторний папір змочений водою в отриманий розчин.
Завдання: Напишіть відповідні рівняння в молекулярному та йонному вигляді. Дослід 2. Налийте в пробірку 1 мл Натрій гідроксиду та декілька краплин хлоридної кислоти. Яке середовище утворюється в результаті гідролізу (кисле, нейтральне, лужне)? Для визначення середовища опустіть універсальний індикаторний папір змочений водою в отриманий розчин. Завдання: Напишіть відповідні рівняння в молекулярному та йонному вигляді.
Запитання до захисту лабораторної роботи 1. Що називають гідролізом солей?
2. Назвіть три випадки гідролізу солей. Наведіть приклади.
3. Що називають ступенем гідролізу ті константою гідролізу?
4. Які фактори впливають на гідроліз?
5. Як змістити рівновагу гідролізу?
6. Наведіть приклади застосування гідролізу солей у поліграфії?
7. Напишіть рівняння гідролізу солі Na2CO3. Вкажіть характер середовища.
Техніка безпеки:
Фізіологічна дія реактивів, що використовуються:
1. Кислоти і луги викликають опіки шкіри, руйнують тканини одежі; 2. Солі натрію, калію можуть отруювати організм;
3. Амоній гідроксид подразнює органи дихання.
Заходи безпеки:
1. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
2. Не пробувати нічого на смак.
3. Працювати в халатах.
4. Після роботи обов’язково помити руки.
Правила першої допомоги:
Уражене місце кислотою помити великою кількістю води; При опіках лугом – помити 1% розчином оцтової кислоти;
При опіках кислотами – помити 2% розчином питної води.
Література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
3. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Лабораторна робота №8 Тема: Комплексні сполуки
Мета: Вміти пояснити теорію будови комплексних сполук. Вміти дати повний аналіз комплексної сполуки, написати рівняння дисоціації і константу нестійкої комплексної сполуки.
Порядок виконання роботи
1. Провести досліди по одержання комплексних сполук.
2. Виконати завдання для самостійного опрацювання відповідно до варіанту.
Обладнання та матеріали: Розчин Арґентум нітрату AgNO3, розчин Натрій хлориду NaCl, розчин амоній гідроксиду NH4OH, розчин Купруму (ІІ) хлориду CuCl2, розчин Натрію броміду NaBr, розчин Натрію тіосульфату Na2S2O3, три пробірки.
Дослід 1. Одержання комплексного амоніакату срібла. До 1-2 мл розчину AgNO3 долити стільки ж розчину NaCl. Записати рівняння реакції. Далі до одержаного осаду долити надлишок NH4OH. Що утворилось? Записати рівняння реакції. AgNO3 + NaCl → AgCl↓ + NaNO3
AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O
Дослід 2. Одержання комплексного Купрум амоніакату. До 1-2 мл розчину CuCl2 додати по крапках розчин NH4OH. Записати всі спостереження та відповіді рівняння утворення осаду та розчинення його. CuCl2 + NH4OH → Cu(OH)Cl↓ + NH4Cl зелений
Cu(OH)Cl + NH4OH → Cu(OH)2↓ + NH4Cl голубий
Cu(OH)2 + NH4OH → [Cu(NH3)4](OH)2↓+ H2O Фіолетовий
Дослід 3. Одержання комплексного тіосульфату срібла. До розчину AgNO3 (1-2 мл) додати по краплях розчин NaBr. Записати спостереження та відповідне рівняння реакції. На утворений осад подіяти розчином Na2S2O3 до розчинення. Записати рівняння реакції. Де використовують ці реакції в поліграфії? AgNO3 + NaBr → AgBr↓ + NaNO3
AgBr + 2Na2S2O3 → Na3[Ag(S2O3)] + NaBr Приклад виконання завдання для самостійного опрацювання:
1. Дати повний аналіз комплексної сполуки K4[Fe(CN)6].
2. Написати рівняння дисоціації і константу нестійкості комплексної сполуки K4[Fe(CN)6].
Зовнішня сфера внутрітшня сфера
K4 [Fe(CN)6]
↑ ↑ ↑
Комплексоутворювач координаційне число
Аденти
3. Дисоціація за другим ступенем відбувається по зовнішній сфері, як у сильних електронів:
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-.
Дисоціація за другим ступенем відбувається дуже повільно, як дисоціація слабких електронів:
[Fe(CN)6]4- → Fe2+ + 6CN-
Константу рівноваги у випадку дисоціації комплексних йонів називається константою нестійкості комплексного йона (Кн):
[Fe2+] [CN-] 6
![]() = -----------
= -----------
[ [Fe (CN)6] 4-] 6
|
№ Варіанта |
1. Дати повний аналіз комплексної сполуки |
2. Написати рівняння дисоціації і константу нестійкості йону. |
|
1 |
K3[Fe(CN)6] |
K[Ag(CN)2] |
|
2 |
Na3[Co(CN)6] |
K2[Pt(OH)5Cl] |
|
3 |
K4[Co(CN)6] |
Ba[Pt(CN)4] |
|
4 |
[Cu(NH3)4]SO4 |
K2[Ni(CN)4] |
|
5 |
K[Al(OH)4] |
[Cd(NH3)4]Cl2 |
Запитання до захисту лабораторії роботи
1. Дайте визначення і поясніть утворення донорно-акценторного зв’язку.
2. Поясніть теорію будови комплексних сполук.
3. Як визначають заряд комплексного йона і комплексного утворювача?
4. Як записують константу нестійкості комплексного йона? 5. Де комплексні сполуки застосовують у поліграфічних процесах?
Техніка безпеки:
Фізіологічна дія реактивів, що використовуються:
1.Кислоти і луги викликають опіки шкіри, руйнують тканини одежі;
2.Перманганат калію KMn04 в твердому стані (в виді пилу) подразнює органи дихання. В виді концентрованого розчину дає опіки шкіри; При попаданні розчину KMn04 на одежу утворюють плями, які потім неможливо вивести; 3. Солі Натрію, Феруму, Калію можуть отруювати організм; Заходи безпеки:
1. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
2. Не пробувати нічого на смак.
3. Працювати в халатах.
4. Після роботи обов’язково помити руки.
Правила першої допомоги:
Уражене місце кислотою помити великою кількістю води;
При опіках лугом – помити 1% розчином оцтової кислоти;
При опіках кислотами – помити 2% розчином питної води.
Література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Підгорний, А. В. Хімія [Електронний ресурс]: підручник для здобувачів ступеня бакалавра за спеціальностями галузі знань 10 «Природничі науки» / А. В. Підгорний, Т. М. Назарова, Т. І. Дуда; КПІ ім. Ігоря Сікорського. – Електронні текстові дані: (1 файл: 2,82 Мбайт). – Київ: КПІ ім. Ігоря Сікорського, 2020. – 351 с.
3. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
4. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Лабораторна робота №9 Тема: Вивчення властивостей полімерів.
Мета: Закріпити знання про високомолекулярні сполуки, їх властивості і способи застосування, формування навичок експериментально вивчити фізичні властивості речовин, спостерігати і робити висновки.
Реактиви і обладнання: Зразки полімерів, пластмас , поліетилен гранульований або листовий, розведені розчини сульфатної кислоти, Натрій гідроксиду, хімічних і натуральних волокон, спиртівка, пробіркотримач, сірники, тигельні щипці.
Теоретичні відомості
Полімеризація – це послідовне сполучення однакових молекул у більші. Реакції полімеризації особливо характерні для ненасичених сполук. Так, наприклад, з етилену утворюється високомолекулярна сполука – поліетилен. Продукт реалізації полімеризації називається полімером, а вихідна речовина, що вступає в реакцію полімеризації, називається мономером.
Полімер – речовина з дуже високою молекулярною масою, молекула якої складається з великої повторюваних угруповань, що мають однакову будову. Вони називаються елементарними ланками, або структурними одиницями. Число елементарних ланок, що повторюються в макромолекулі, називається ступенем полімеризації.
За допомогою реакцій полімеризації добувають високомолекулярні синтетичні речовини, наприклад поліетилен, політетрафторетилен, полістирол. Вони мають велике народногосподарське значення.
Порядок виконання роботи
Дослід 1. Розпізнавання пластмас. Розгляньте видані вам вироби з пластмас. Випробуйте їх на дотик. Опишіть їх пластичність та міцність. Користуючись таблицею, визначаємо вид пластмаси. Для дослідження пластмасу вносимо у полум’я спиртівки. Якщо пластмаса горить, то зверніть увагу на характер горіння.
Завдання: Опишіть властивості пластмаси. Що відбувається з ним при нагріванні (плавлення або розм’якшення) ?
Дослід 2. Невеликі шматочки поліетилену опустіть в пробірки з розчинами: кислоти, лугу.
Завдання: Що відбувається? Про що це свідчить? Зробити висновки про хімічну активність поліетилену.
Запитання до захисту лабораторної роботи:
Тести:
1. Дивініловий каучук – це:
а) ізопреновий каучук ; б) натуральний каучук;
в) бутадієновий каучук; г) бутадієн – стирольний каучук; 2. Високомолекулярні органічні сполуки одержують за допомогою реакції:
а) Поліконденсації; б) Полімеризації; в) Дегідрадації;
г) Полімеризації та Поліконденсації.
3. Низькомолекулярні речовини, з яких синтезують високомолекулярні речовини, називають:
а) Полімери; б) Димерами; в) мономерами; г) тримерами; 4. Яка з наведених високомолекулярних сполук належить до термопластичних?
а) Полімерами; б) Фенол формальдегідна смола;
в) Епоксидна смола; г) Поліефірна смола.
5. Капрон добувається з:
а) капронової кислоти б) е- аміноетанової кислоти;
в)е- амінокапронової кислоти; г) терефталевої кислоти.
6. До поліамідних волокон належать:
а) ацетатне; б) віскозне; в) найлон; г) бавовняне.
7. При поліконденсації як побічні продукти виділяються:
а) вода; б) водень в) галоген; г) амоніак Усне опитування:
1. Дайте характеристику високомолекулярним сполукам. Наведіть приклади.
2. Вплив на синтетичні волокна лугу та кислот.
3. Наведіть приклади пластмас.
4. Дайте характеристику поліетилену та полістиролу.
Техніка безпеки:
Фізіологічні дії реактивів, що використовуються:
1.Кислоти і луги викликають опіки шкіри, подразнюють органи дихання, руйнують тканину одежі. Заходи безпеки:
1. Зразки пластмас нагріваємо обережно над полум’ям спиртівки, використовуючи тигельні щипці.
2. Спиртівку гасимо за допомогою ковпачка.
3. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
4. Працювати в халатах.
5. Не пробувати реактиви на смак.
6. Виконувати роботу, відповідно до інструкції.
7. Брати реактиви в невеликій кількості.
Правила першої допомоги:
Уражене місце кислотою помити великою кількістю води;
При опіках лугом – помити 1% розчином оцтової кислоти;
При опіках кислотами – помити 2% розчином питної води.
Література:
1. Басов В.П. Теоретичні розділи загальної хімії: підручник – К.: Каравелла, 2008. – 304 с.
2. Романова Н. В. Загальна та неорганічна хімія. Київ, «Перун», 2002. 458 с.
3. Хомченко І. Г. Загально хімія. К.: Вища школа, 1993. – 424 с.
4. Гомонай В.І. Фізична та колоїдна хімія: Підручник для студентів ВНЗ. Вінниця, Нова книга, 2007.
5. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Лабораторна робота №10
Тема: Одержання та властивості колоїдних розчинів
Мета: Навчити студентів одержувати колоїдні розчини арґентум (I) йодиду AgJз різноманітними зарядами частинок. Вміти накреслити схематично будову колоїдних частинок золю AgJ, одержаних у першому випадку з надлишком AgNO3, а у другому – з надлишком KJ. Одержати золь ферум (ІІІ) гідроксиду Fe(OH)3 і здійснити його коагуляцію.
Теоретична частина
Системи з розміром частинок, меншим за 1 нм, являють собою істинні розчини, що складаються з молекул або іонів розчиненої речовини, їх слід розглядати як однофазну систему. Системи з розмірами частинок понад 100 нм – це грубо дисперсні системи: суспензії та емульсії.
Суспензії – це дисперсні системи, в яких дисперсною фазою є тверда речовина практично нерозчинна у рідині. Щоб приготувати суспензію, треба речовину подрібнити до тонкого порошку, висипати у рідину, в якій речовина не розчиняється, і добре збовтати. Через деякий час частинки випадуть на дно посудини.
Емульсії – це дисперсні системи, в яких і дисперсна фаза, і дисперсне середовище є рідинами, що не змішуються між собою. З води і олії можна приготувати емульсію, довго збовтуючи суміш. Прикладом емульсії є молоко, в якому дрібні кульки жиру плавають у рідині.
Колоїдні розчини – це високодисперсні двофазні системи, що складаються з дисперсійного середовища і дисперсної фази, причому лінійні розміри частинок останньої перебувають в межах від 1 до 100 нм. Як бачимо, колоїдні розчини за розмірами частинок є проміжними між істинними. Розчинами та суспензіями і емульсіями. Колоїдні частинки звичайно складаються з великої кількості молекул або іонів.
Колоїдні розчини інакше називають золями. Їх добавляють дисперсними та конденсаційними методами. Золі мають ряд специфічних властивостей, які детально вивчає колоїдна хімія.
Однією з важливих властивостей золів є те, що частинки даного золю мають електричні заряди одного знака. Завдяки цьому вони не об’єднуються в більші частинки і не осаджуються. Для осадження золю необхідно, щоб його частинки об’єдналися і більші агрегати. Об’єдналися частинок в більші агрегати називається коагуляцією, а осадження їх під дією сили гравітації – седиментацією.
Значення золів винятково велике, оскільки вони поширеніші ніж істинні розчини. Складні золі – кров, соки рослин. Із золями пов’язано виробництво штучних волокон, фарбування, виготовлення клеїв, лаків, плівок, чорнила.
Порядок виконання роботи
Обладнання та матеріали: 4 пробірки, розчин Калій йодиду KJ, Арґентум (І) нітрату AgNO3, Ферум (ІІІ) хлориду FeCl3 Натрій сульфату Na2SO4, вода, піпетка.
Дослід 1. Одержання золю Арґентум (І) йодиду AgJ різнойменними зарядами частинок. Налити в пробірку 2-3мл 0,05 М розчину KJ і з піпетки повільно додати 410 крапель 0,05 М розчину AgNO3. Записати в зошит колір золю AgJ і рівняння реакції в молекулярній та йонній формах. Повторити дослід, наливши і пробірку 1мл розчину AgNO3 і повільно додати при струшувані 5-10 крапель KJ.
Накреслити схематично будову колоїдних частинок золю AgJ, одержаних у першому випадку з надлишком AgNO3, а у другому – KJ.
AgNO3 + KJ = AgJ + KNO3
Золь
Заряд йонної оболонки AgJ залежить від того, яку з солей було взято в надлишку:
а) при надлишку AgNO3 частинки AgJ вибірково адсорбують йони Ag+ і заряджаються «+»;
б) при надлишку KJ частинки AgJ адсорбують J-і заряджаються «-».
Дослід 2. Одержання золю ферум (ІІІ) гідроксиду Fe(OH)3 і його коагуляція. У пробірку налити 3мл 0,05 М розчину Ферум (ІІІ) хлориду FeCl3 і поставити його перед білим екраном в якості розчину для порівняння. В іншу пробірку налити стільки ж гарячої води і додати 1-2 краплі розчину Ферум (ІІІ) хлориду FeCl3. Порівняти забарвлення розчинів у двох пробірках. Запишіть свої спостереження. Накреслити схематично будову колоїдних частинок золю Ферум (ІІІ) гідроксиду Fe(OH)3.
В одержаний колоїдний розчин Ферум (ІІІ) гідроксиду Fe(OH)3 додайте по краплях розчин Натрій сульфату Na2SO4.
Що спостерігаєте ? Чому відбулась коагуляція колоїдного розчину ? Які йони є коагулянтами ?
Запитання для захисту лабораторної роботи
1. Що називають поверхневим натягом ? Від чого він залежить ?
2. Що є мірою змочування поверхнв ?
3. Як речовини називають гідрофільними; гідрофобними ?
4. Що називають адсорбцією ?
5. Наведіть приклади застосування ПАР в поліграфії.
6. Наведіть приклади використання дисперсних систем поліграфії.
7. Як класифікують дисперсні системи ?
8. Які Ви знаєте особливі властивості колоїдних систем ?
Техніка безпеки:
Фізіологічна дія реактивів, що використовуються:
1. Кислоти і луги викликають опіки шкіри, руйнують тканини одежі;
2. Перманганат калію KMn04 в твердому стані (в виді пилу) подразнює органи дихання. В виді концентрованого розчину дає опіки шкіри; При попаданні розчину KMn04 на одежу утворюють плями, які потім неможливо вивести; 3. Солі натрію, заліза, калію можуть отруювати організм; Заходи безпеки:
1. Не допускати попадання кислот, лугів, солей на шкіру або одежу.
2. Не пробувати нічого на смак.
3. Працювати в халатах.
4. Після роботи обов’язково помити руки.
Література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Підгорний, А. В. Хімія [Електронний ресурс]: підручник для здобувачів ступеня бакалавра за спеціальностями галузі знань 10 «Природничі науки» / А. В. Підгорний, Т. М. Назарова, Т. І. Дуда; КПІ ім. Ігоря Сікорського. – Електронні текстові дані: (1 файл: 2,82 Мбайт). – Київ: КПІ ім. Ігоря Сікорського, 2020. – 351 с.
3. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
4. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Лабораторна робота №11 Тема: Розв’язування експериментальних задач.
Мета: Навчитися розв’язувати експериментальні задачі. Закріпити знання по темі «Метали».
Теоретичні відомості
Хімічні й фізичні властивості металів визначаються будовою їхніх атомів і особливостями хімічного зв’язку. Загальною хімічною властивістю металів є здатність атомів під час хімічних реакцій віддавати валентні електрони, тобто окислюватись і перетворюватись на позитивно заряджені йони. Отже, метали в реакціях є добрими відновниками. Чим легше атоми металів віддають електрони, тим вони хімічно активніші. Для якісної характеристики хімічної активності металів скористайтеся реакціями витіснення. Хімічний характер будь-якого металу значною мірою зумовлюється тим, наслідки легко його атоми віддавати електрони і перетворюватись на позитивно заряджені йони, тобто наскільки легко метал окислюється. Для металів характерні такі хімічні властивості:
1. Взаємодія з солями. Активні метали відновлюють менш активні метали з розчинів їхніх солей:
Cu + CuCl2 = ZnCl2 + Cu ;
Cu + 2AgNO3 = Cu(NO3)2 + Ag
Цинк і Купрум окислюються йонами Купруму й Аргунтуму, тобто катіонами менш активних металів. Отже, Цинк і Купрум-відновники.
2. Взаємодія з неметалами. Метали окислюються багатьма неметалами. Найбільш енергійно вони реагують з галогенами, Оксигеном і Сульфуром, утворюючи відповідно галогеніди, оксиди, сульфіди:
2Al + 3Br2 = 2AlBr3
2Mg + O2 = 2MgO
2Na + S = Na2S
У цих реакціях метали Алюміній, Магній, Натрій- відновники, а тнеметали Бром, Оксиген, Сульфур- Окисники.
3. Взаємодія з водою. Найактивніші метали (Калій, Натрій, Барій, Кальцій) реагують з водою за звичайних умов звиділенням водню та утворенням лугів:
2Na + 2H2O = 2NaOH + H2↑ Ba + 2H2O = Ba(OH)2 + H2↑ Досить активні метали (Магній, Цинк) реагують з розбавленими розчинами кислот, відновлюючи Гідроген:
Mg + 2HCl = MgCl2 + H2↑
Fe + H2SO4 = FeSO2 + H2↑
У пробірку долийте трохи хлоридної кислоти, у другу – надлишок розчину Натрій гідроксиду. Що спостерігається ?
Розв’язування експериментальних задач з теми «Метали» Завдання 1. Виконвайте такі перетворення:
CuCl2 → Cu(OH)2 → CuO → Cu(NO3)2 → CuSO4
Завдання 2.
Виходячи з Магнію, добудьте Магній сульфат.
Запитання длязахисту лабораторної роботи:
1. Хімічні властивості металів.
2. Алюміній та його амфотерність.
Техніка безпеки
Фізіологічні дії реактивів, що використовуються:
Кислоти і луги викликають опіки шкіри, подразнюють органи дихання, руйнують тканину одежі;
Алюміній хлорид при попаданні в шлунок викликає отруєння Заходи безпеки:
Не допускати попадання кислот, лугів, солей на шкіру або одежу.
Працювати в халатах.
Не пробувати реактиви на смак.
Використовувати роботу, відповідно до інструкції. Брати реактиви в невеликій кількості.
Правила першої допомоги :
Уражене місце кислотою помити великою кількістю води; При опіках лугом – помити 1% розчином оцтової кислоти; При опіках кислотами – помити 2% розчином питної води.
Література:
1. Басов В.П. Теоретичні розділи загальної хімії:К.: Каравелла, 2018. – 304 с.
2. Романова Н. В. Загальна та неорганічна хімія. Київ, «Перун», 2012. 458 с.
3. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / Укладачі: Назарко І.С., Вічко О.І. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
Література
Основна література:
1. Назарко І.С. Загальна хімія: навчальний посібник для студентів технічних спеціальностей / І.С. Назарко, О.І Вічко. – Тернопіль: Тернопільський національний технічний університет імені Івана Пулюя, 2019. – 192 с.
2. Підгорний, А. В. Хімія [Електронний ресурс]: підручник для здобувачів ступеня бакалавра за спеціальностями галузі знань 10 «Природничі науки» / А. В. Підгорний, Т. М. Назарова, Т. І. Дуда; КПІ ім. Ігоря Сікорського. – Електронні текстові дані: (1 файл: 2,82 Мбайт). – Київ: КПІ ім. Ігоря Сікорського, 2020. – 351 с.
3. Загальна та неорганічна хімія: підручник / Гомонай В. І., Мільович С. С. – Вінниця: Нова Книга, 2016. – 448 с.
4. Фізична хімія. Хімічна термодинаміка [Електронний ресурс]: навч. посіб. для студ. спеціальності 161 «Хімічні технології та інженерія» / уклад.: Т.А. Каменська, Г.А. Рудницька, М.Є. Пономарьов; КПІ ім. Ігоря Сікорського. – Електронні текстові данні (1 файл: 2,594 Мбайт). – Київ: КПІ ім. Ігоря Сікорського, 2021. – 257 с. 5.Гомонай В.І. Фізична та колоїдна хімія: Підручник для студентів вищ. навч. заклад. – Вид. – 3-е. – Вінниця: Нова Книга, 2014. – 496с.
6. Хімія. Підручник. Частина І. Загальна хімія. За ред. акад. УАН Голубєва А.В. – К.: Кондор-Видавництво., 2016. – 264 с.
Додаткова література:
1. Мельник Л.І. Хімія і фізика полімерів: Навч. посібник – Київ: НТУУ «КПІ» 2016.– 161 с.
2. Хімія полімерів: конспект лекцій / упоряд.: Л. П. Марушко. Луцьк: П «Зоря-плюс» BOO ВОІ СОІУ, 2021. 133 с.
4. Шульженко О.О. Хімія: підручник [Електронний ресурс] / О.О. Шульженко, А.Є. Шпак, Р.А. Хохлова – Київ: КПІ ім. Ігоря Сікорського, 2019. – 179 с.
5. Шульженко О.О. Неорганічна та органічна хімія: Основні поняття. Будова атома. Хімічний зв’язок [Електронний ресурс]: навчальний посібник для студентів спеціальності 186 «Видавництво та поліграфія», спеціалізації «Поліграфічні медіатехнології» / О. О. Шульженко, А. Є. Шпак. – Київ: КПІ ім. Ігоря Сікорського, 2018. – 177 с.
7. Булавін В.І. Загальна хімія: навчальний посібник для студентів хіміко-технологічних та нехімічних спеціальностей денної та заочної форми навчання. – Харків: ХПІ, 2019, 373 с.
8. Величко О. М. Матеріали зі спеціальними властивостями / О. М. Величко, С. Ф. Гавенко, К. І Золотухіна [Електронний ресурс]: навч. посіб. з грифом УАД, 2016. –
155 с.
9. Целуйко Ф. В. Сучасна поліграфія та екологія в контексті розвитку графічного дизайну / Ф. В. Целуйко // Теорія та історія дизайну. — 2014. — № 2. — С. 42–46.
Інформаційні ресурси
1. Періодична система хімічних елементів / Вікіпедія: вільна енциклопедія. URL: https://uk.wikipedia.org/wiki
2. Центр електронних навчальних матеріалів, режим доступу: http://193.108.240.69/moodle/
3. Журнал неорганічної хімії, режим доступу: http://www.geokhi.ru/~zhakh
4. Електронна бібліотека літератури із загальної хімії: веб-сайт. URL: https://techemy.com
5. Центр електронних навчальних матеріалів: веб-сайт. URL: http://193.108.240.69/moodle/
6. Наукова бібліотека: веб-сайт. URL: http://biopro.ucoz.ua/load/zagalna_ta_neorganichna_khimija/1-1-0-15


про публікацію авторської розробки
Додати розробку