Поняття про гідроліз солей
Про матеріал
Презентація до уроку хімії в 11 класі за темою "Гідроліз солей". Містить теоретичні відомості і вправи на закріплення нового матеріалу. Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


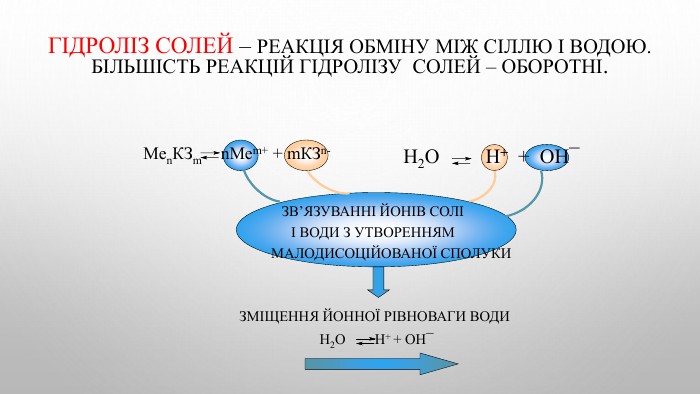
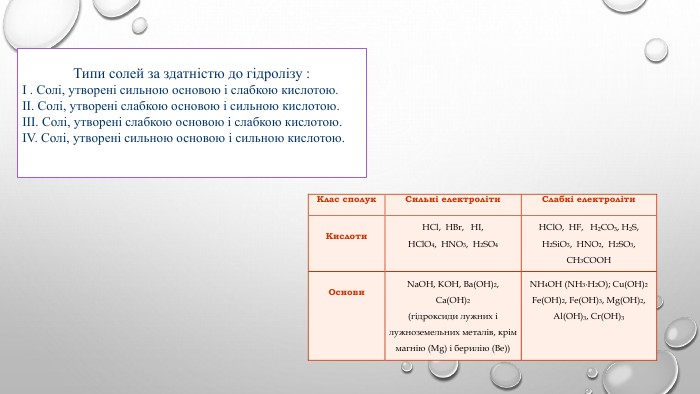
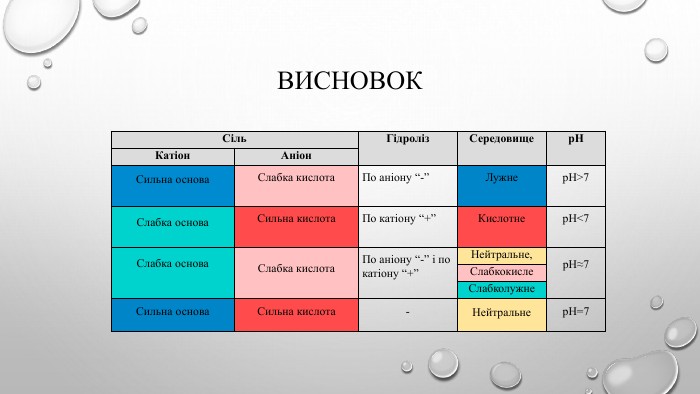
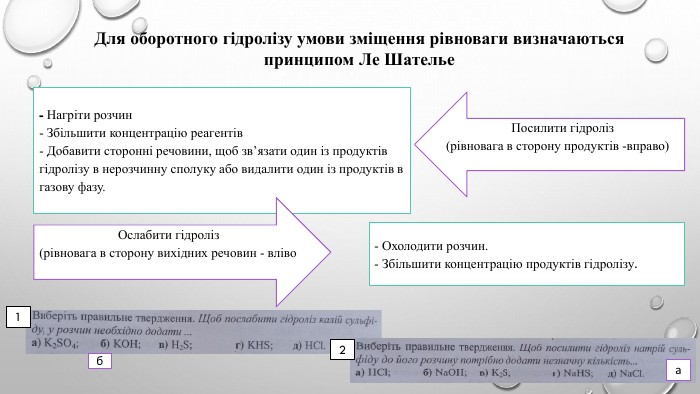
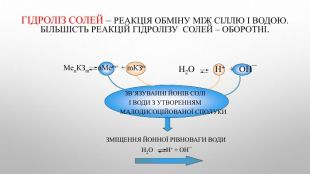
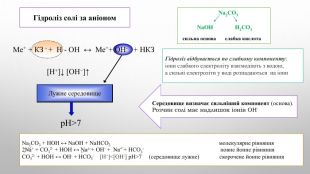
![Ме+ + КЗ - + Н - ОН ↔ Ме++ OH- + НКЗ Гідроліз солі за аніоном[H+]↓ [ОН−]↑Середовище визначає сильніший компонент (основа). Розчин солі має надлишок іонів ОН-Na2 CO3 Na. ОН Н2 CO3cильна основа слабка кислота. Лужне середовищеp. H>7 Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони. Na2 CO3 + НОН ↔ Na. ОН + Na. НCO3 молекулярне рівняння 2 Na+ + CО32- + НОН ↔ Na+ + ОН- + Na+ + НCO3- повне йонне рівняння. CО32- + НОН ↔ ОН- + НCO3- [Н+]<[ОН-] p. H>7 (середовище лужне) скорочене йонне рівняння Ме+ + КЗ - + Н - ОН ↔ Ме++ OH- + НКЗ Гідроліз солі за аніоном[H+]↓ [ОН−]↑Середовище визначає сильніший компонент (основа). Розчин солі має надлишок іонів ОН-Na2 CO3 Na. ОН Н2 CO3cильна основа слабка кислота. Лужне середовищеp. H>7 Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони. Na2 CO3 + НОН ↔ Na. ОН + Na. НCO3 молекулярне рівняння 2 Na+ + CО32- + НОН ↔ Na+ + ОН- + Na+ + НCO3- повне йонне рівняння. CО32- + НОН ↔ ОН- + НCO3- [Н+]<[ОН-] p. H>7 (середовище лужне) скорочене йонне рівняння](/uploads/files/4592833/359749/413457_images/4.jpg)
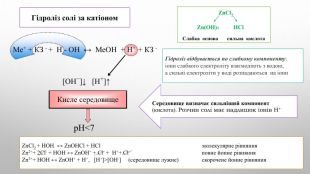
![Гідроліз солі за катіоном. Середовище визначає сильніший компонент (кислота). Розчин солі має надлишок іонів Н+Zn. Cl2 Zn(ОН)2 НCl Cлабка основа сильна кислота. Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони. Zn. Cl2 + НОН ↔ Zn. ОНCl + НCl молекулярне рівняння Zn2++ 2 Cl- + НОН ↔ Zn. ОН+ + Cl- + Н++ Cl- повне йонне рівняння. Zn2++ НОН ↔ Zn. ОН+ + Н+, [Н+]>[ОН-] (середовище лужне) скорочене йонне рівняння Ме+ + КЗ - + Н - ОН ↔ Ме. OH + H+ + КЗ - [ОН−]↓ [H+]↑ Кисле середовищеp. H<7 Гідроліз солі за катіоном. Середовище визначає сильніший компонент (кислота). Розчин солі має надлишок іонів Н+Zn. Cl2 Zn(ОН)2 НCl Cлабка основа сильна кислота. Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони. Zn. Cl2 + НОН ↔ Zn. ОНCl + НCl молекулярне рівняння Zn2++ 2 Cl- + НОН ↔ Zn. ОН+ + Cl- + Н++ Cl- повне йонне рівняння. Zn2++ НОН ↔ Zn. ОН+ + Н+, [Н+]>[ОН-] (середовище лужне) скорочене йонне рівняння Ме+ + КЗ - + Н - ОН ↔ Ме. OH + H+ + КЗ - [ОН−]↓ [H+]↑ Кисле середовищеp. H<7](/uploads/files/4592833/359749/413457_images/5.jpg)
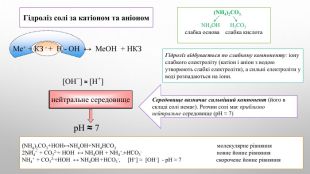
![NH4 ОН Н2 CO3слабка основа слабка кислота. Гідроліз солі за катіоном та аніоном. Середовище визначає сильніший компонент (його в складі солі немає). Розчин солі має приблизно нейтральне середовище (р. Н ≈ 7)(NH4)2 CO3. Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (катіон і аніон з водою утворюють слабкі електроліти), а сильні електроліти у воді розпадаються на іони.(NH4)2 CO3+НОН↔NH4 ОН+NH4 НCO3 молекулярне рівняння 2 NH4+ + CO32-+ НОН ↔ NH4 ОН + NH4+ +НCO3- повне йонне рівняння. NH4+ + CO32-+НОН ↔ NH4 ОН +НCO3-, [Н+] ≈ [ОН-] - р. Н ≈ 7 скорочене йонне рівняння[ОН−] ≈ [H+] нейтральне середовищеp. H ≈ 7 Ме+ + КЗ - + Н - ОН ↔ Ме. OH + HКЗ NH4 ОН Н2 CO3слабка основа слабка кислота. Гідроліз солі за катіоном та аніоном. Середовище визначає сильніший компонент (його в складі солі немає). Розчин солі має приблизно нейтральне середовище (р. Н ≈ 7)(NH4)2 CO3. Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (катіон і аніон з водою утворюють слабкі електроліти), а сильні електроліти у воді розпадаються на іони.(NH4)2 CO3+НОН↔NH4 ОН+NH4 НCO3 молекулярне рівняння 2 NH4+ + CO32-+ НОН ↔ NH4 ОН + NH4+ +НCO3- повне йонне рівняння. NH4+ + CO32-+НОН ↔ NH4 ОН +НCO3-, [Н+] ≈ [ОН-] - р. Н ≈ 7 скорочене йонне рівняння[ОН−] ≈ [H+] нейтральне середовищеp. H ≈ 7 Ме+ + КЗ - + Н - ОН ↔ Ме. OH + HКЗ](/uploads/files/4592833/359749/413457_images/6.jpg)
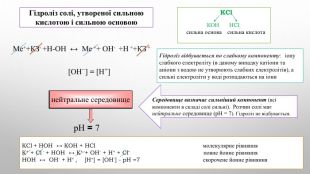
![КОН НCl. сильна основа сильна кислота. Гідроліз солі, утвореної сильною кислотою і сильною основою. Середовище визначає сильніший компонент (всі компоненти в складі солі сильні). Розчин солі має нейтральне середовище (р. Н = 7). Гідроліз не відбувається. KCl. Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (в даному випадку катіони та аніони з водою не утворюють слабких електролітів), а сильні електроліти у воді розпадаються на іони. КСl + НОН ↔ КОН + НCl молекулярне рівняння К+ + Сl - + НОН ↔ К+ + ОН- + Н+ + Cl- повне йонне рівняння. НОН ↔ ОН- + Н+ , [Н+] = [ОН-] - р. Н =7 скорочене йонне рівняння[ОН−] = [H+] нейтральне середовищеp. H = 7 Ме++КЗ- +Н-ОН ↔ Ме ++ ОH- +Н ++КЗ + КОН НCl. сильна основа сильна кислота. Гідроліз солі, утвореної сильною кислотою і сильною основою. Середовище визначає сильніший компонент (всі компоненти в складі солі сильні). Розчин солі має нейтральне середовище (р. Н = 7). Гідроліз не відбувається. KCl. Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (в даному випадку катіони та аніони з водою не утворюють слабких електролітів), а сильні електроліти у воді розпадаються на іони. КСl + НОН ↔ КОН + НCl молекулярне рівняння К+ + Сl - + НОН ↔ К+ + ОН- + Н+ + Cl- повне йонне рівняння. НОН ↔ ОН- + Н+ , [Н+] = [ОН-] - р. Н =7 скорочене йонне рівняння[ОН−] = [H+] нейтральне середовищеp. H = 7 Ме++КЗ- +Н-ОН ↔ Ме ++ ОH- +Н ++КЗ +](/uploads/files/4592833/359749/413457_images/7.jpg)