Методичні рекомендації "Задачі як шлях до розвитку розумових та творчих здібностей учнів"
До Вашої уваги пропоную розроблені методичні рекомендації "Задачі як шлях до розвитку розумових та творчих здібностей учнів" для учителів хімії.
Відділ освіти Новгород-Сіверської районної ради
Чернігівської області
Задачі як шлях до розвитку розумових та творчих здібностей учнів
2016
Вступ.
Хімія – одна з найважливіших природничих наук, яка відіграла значну роль у створенні сучасної наукової картини світу. Ми на кожному кроці бачимо необхідні в нашому житті предмети, виробництво яких неможливе без застосування хімічних знань. Цікаві і разом з тим складні хімічні процеси у величезній кількості відбуваються в живих організмах. Звідси зрозуміло, що людям, які мріють присвятити своє життя медицині чи фармакології, металургії чи нафтохімії, парфумерному чи сільськогосподарському виробництвам вкрай потрібні глибокі знання хімії.
Проте майбутньому вченому-хіміку мало знати і вміти пояснювати ті чи інші хімічні явища з якісної сторони, їх потрібно характеризувати ще й кількісно. Це вміння формується у процесі систематичного розв’язування розрахункових задач. Тому, пам’ятаючи, що хімія належить до точних наук, потрібно дуже відповідально ставитись до математичних розрахунків.
Розв’язування задач за алгоритмами дає змогу учням засвоїти специфіку предмета, розвинути мобільність і фундаментальність інтегрованого стилю мислення, відкриває можливості виходу на творчий рівень хімічної освіти.
Слово «алгоритм» походить від латинської форми написання ім’я східного математика ІХ століття Мухаммеда ібн Муси аль-Хорезмі (що означає «з Хорезма») – Algorithmi, який сформулював правила виконання чотирьох математичних дій над числами в десятинній системі обчислення.
Систему правил виконання математичних дій в Європі називали терміном «алгоризм», який надалі перетворився на «алгоритм», що визначає правила розв’язку задач певного типу.
Не може обійтись без алгоритмів і хімія. Алгоритми в шкільному курсі хімії – це:
- правила складання хімічних формул і рівнянь;
- послідовність описування хімічних елементів, властивостей речовин, протікання хімічних реакцій;
- раціональний спосіб розв’язування розрахункових, експериментальних і розрахунково-експериментальних задач;
- оптимальний план проведення хімічного аналізу неорганічних і органічних речовин;
- певний порядок приготування розчинів заданої концентрації.
Одна з основних властивостей алгоритму – масовість. Вона характеризує можливість розв’язувати задачі певного типу.
Наступною властивістю є детермінованість – орієнтація на певного виконавця. Ця властивість потребує, щоб кожна вказівка алгоритму була зрозуміла виконавцю. Одна з найважливіших властивостей алгоритму – результативність. Послідовне виконання всіх дій повинно привести до розв’язку задачі за кінцеву кількість кроків, оскільки алгоритм завжди має за мету отримання пошукового результату.
Алгоритм – кінцева послідовність точно сформульованих правил розв’язання деяких типів задач.
Хімічна задача на відміну від математичної має свою специфіку, яка зумовлена тим, що хімічні знаки, формули та рівняння містять у закритому вигляді певні числові дані. Для розв’язку задачі необхідно з’ясувати відношення між даними задачі й пошуковою величиною, встановити відповідні їм закономірності.
Застосування алгоритмів для розв’язування задач розвиває вміння логічно мислити, виділяти головне у матеріалі, що вивчається, знаходити оптимальні шляхи розв’язання задач, послідовно розділяти свої дії на «кроки», які призводять до знаходження шуканої величини.
Програмою з хімії для середньої школи передбачається розв’язок таких типів розрахункових задач:
- розрахунок відносних молекулярних мас речовин за хімічними формулами;
- розрахунок за хімічними рівняннями маси або кількістю речовин за відомою масою або кількістю речовини одного з реагентів чи продуктів реакції;
- розрахунки за термохімічними рівняннями;
- визначення масової частки і маси речовини в розчині;
- визначення за хімічним рівнянням об’єму газів, якщо відома кількість речовини одного з реагентів або продуктів реакції;
- розрахунок об’ємних відношень газів за хімічними рівняннями;
- визначення відносної густини газів;
- розрахунки за хімічними рівняннями, якщо одна з речовин узята в надлишку;
- визначення масової або об’ємної частки виходу продукту реакції порівняно з теоретично можливим;
- визначення маси або об’єму продукту реакції за відомою масою або об’ємом вихідної речовини, яка містить домішки;
- знаходження молекулярної формули речовини ;
- обчислення числа атомів або молекул за відомою кількістю речовини;
-
знаходження молярного об’єму газів з використанням закону Авогадро та його наслідків.
Далі розглянемо алгоритми розв’язування задач з хімії та наведемо приклади розв’язання хімічних задач за наведеними алгоритмами.
Алгоритм обчислення відносних молекулярних мас Мr
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
- Запишіть хімічну формулу речовини.
- Користуючись довідковою таблицею, випишіть відносні атомні маси елементів, що входять до складу речовини.
-
Складіть формулу розрахунку відносної молекулярної маси, розглядаючи Мr як суму добутків Аr (Е) на число атомів кожного з них
Мr = Аr (Е1)· п1 + Аr (Е2)· п2 +… - Розрахуйте Мr речовини за складеною формулою.
-
Запишіть відповідь.
Приклади розв’язання задач за алгоритмом
Задача. Визначити відносну молекулярну масу сульфатної кислоти, якщо її формула H2SO4 .
Дано: Мr(H2SO4)=2 Аr (Н)+ Аr (S)+4Аr (О);
H2SO4 Мr(H2SO4)=2·1+32+4·16+98.
Знайти:
Мr - ?
Відповідь: Мr(H2SO4)=98.
Алгоритм обчислення масових часток елементів у речовині
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
-
Запишіть розрахункову формулу для знаходження масової частки елемента
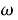
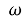
- Знайдіть відносну молекулярну масу речовини.
- Підставте у формулу (див. крок 3.) значення відносної молекулярної маси речовини (Мr), кількості атомів елемента (п), та значення відносної атомної маси елемента (Аr ) та отримайте відповідь.
-
Запишіть відповідь.
Приклад розв’язання задачі за алгоритмом
Задача. Природний газ складається в основному з газу метану, формула якого СН4. Обчисліть масову частку Карбону в метані.
Дано: ![]()
СН4 ![]()
Знайти: Аr (С)=12;
![]()
![]()
Відповідь: масова частка Карбону в метані становить 75%.
Алгоритм обчислення маси продукту реакції за відомою кількістю вихідної речовини.
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
- Складіть рівняння реакції.
- Підкресліть формули речовин, про які йдеться в умові задачі.
- Надпишіть над підкресленими формулами вихідні дані, під формулами – дані, що закономірно витікають з рівняння реакції, і відповідні коефіцієнти.
- Обчисліть кількість речовин.
- Обчисліть М шуканої речовини, знаючи, що [М]= Мr
- Використовуючи формулу розрахунку кількості речовини п=т/М, обчисліть його масу т=М · п.
- Запишіть відповідь.
Приклади розв’язання задачі за алгоритмом
Задача. Обчисліть масу води, яка утворюється в результаті взаємодії алюміній оксиду кількістю речовини 0,5 моль із сульфатною кислотою.
Дано: 0,5 моль х моль
п(Al2O3)=0,5 моль (Al2O3)+ 3H2SO4 = Al2(SO4)3 +3Н2О
Знайти: 1 моль 3 моль
т(Н2О) - ?
![]() =0,5·3=1,5(моль)
=0,5·3=1,5(моль)
[М]= Мr(Н2О)=1·2+16=18 М=18 г/моль
т(Н2О)= М(Н2О) · п(Н2О)=18г/моль· 1,5моль=27 г Відповідь: т(Н2О)=27 г.
Алгоритм обчислення кількості теплоти за термохімічним рівнянням реакції
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
- Запишіть термохімічне рівняння.
- Підкресліть формулу речовини з відомими вихідними даними і числове значення теплового ефекту.
- Над підкресленою формулою речовини вкажіть вихідні дані, під формулою – числові дані, закономірні для цього рівняння, над числовим значенням теплового ефекту – умовне позначення Q.
- Обчисліть шукану кількість теплоти в кДж.
7) Запишіть відповідь.
Приклади розв’язання задач за алгоритмом Задача. Обчисліть кількість теплоти, що виділиться внаслідок спалювання фосфору масою 6,2 г. Термохімічне рівняння реакції горіння фосфору:
4Р+5О2=2Р2О3+3010 кДж
Дано: 6,2 г х Q
т(Р)=6,2 г 4Р+5О2=2Р2О3+3010 кДж
Q1=3010 кДж 4·31 г
Знайти: ![]()
Q2 - ?
![]()
![]() =150,5 кДж
=150,5 кДж
Відповідь: Q2=150,5 кДж
Алгоритм обчислення маси розчиненої речовини, якщо відома масова частка розчиненої речовини й маса розчину
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
- Складіть формулу для обчислення маси розчиненої речовини.
- Підставте в отриманий у кроці 3 вираз чисельні дані з умови задачі та здійсніть розрахунки.
- Запишіть відповідь.
Приклади розв’язання задач за алгоритмом
Обчисліть масу натрій хлориду, необхідну для приготування розчину масою 200 г з масовою часткою солі 0,5.
Дано:
т(розч.)=200 г т (NaCl) =![]()
![]()
Знайти:
т (NaCl) - ?
Відповідь: т (NaCl)=100 (г)
Алгоритм обчислення об’єму газу за відомою кількістю речовини
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
- Напишіть формулу зв’язку між кількістю речовини, молярним об’ємом і об’ємом газу: п=V/Vm
- Знайдіть математичний вираз для об’єму V=n·Vm
5)Запишіть відповідь.
Приклади розв’язання задач за алгоритмом
Задача. Який об’єм займе 2500 моль аміаку?
Дано:
п(NH3)=2500 моль V= п· Vм
Знайти: V(NH3) - ? Vм=0,0224 м3/моль
V (NH3)=0,0224 м3/моль·2500 моль=56 м3
Відповідь: 2500 моль аміаку займе об’єм 56 м3
Алгоритм обчислення об’ємних відношень газів за рівнянням хімічної реакції
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
- Складіть рівняння реакції.
- Підкресліть формули речовин, про які йдеться в умові задачі.
- Надпишіть над підкресленими формулами числові значення відомого об’єму, під формулами – числові значення об’ємів, які випливають з даного рівняння реакції та відповідають коефіцієнтам.
- Обчисліть об’єм газу в літрах.
- Запишіть відповідь.
Приклад розв’язання задачі за алгоритмом
Задача:Який об’єм кисню витратиться на згоряння 5 м3 етану?
Дано:
V(С2Н6)=5 м3 5 м3 ![]()
Знайти: 2С2Н6+7О2![]()
V(О2) - ? 2 7
![]() =
=![]()
 =
= ![]()
V(О2)=![]() =17,5 м3
=17,5 м3
Відповідь: На згоряння 5 м3 етану витратиться 17,5 м3 кисню.
Алгоритм обчислення відносної густини газу
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
-
Запишіть розрахункову формулу відносної густини за воднем (або повітрям) DH2 =
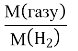 , М(Н2)=2г/моль;
, М(Н2)=2г/моль;
Dповітря =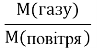 , Dповітря =29 г/моль
, Dповітря =29 г/моль
- Обчисліть відносну молекулярну масу за хімічною формулою.
- Підставте у формулу (див. крок 3) значення М і отримайте відповідь.
-
Запишіть відповідь.
Приклади розв’язання задач за алгоритмом
Задача. Обчисліть відносну густину сульфур (IV) оксиду за воднем.
Дано:
SO2 D![]() =
=![]()
Знайти: М(SO2)=32+16·2=64
D![]() -? [М]=Мr ; М(SO2)=64 г/моль
-? [М]=Мr ; М(SO2)=64 г/моль
D![]() =
=![]() =
=![]()
Відповідь: D![]() = 32
= 32
Алгоритм обчислення молекулярної формули речовини за її відносною густиною і масою продуктів горіння
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
-
Обчисліть молярну масу речовини за формулою
Dгазу =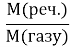 ; М(повітря)=29 г/мол
; М(повітря)=29 г/мол
- Знайдіть індекси, розрахувавши молярні маси СО2 та H2О
- Знайдіть, чи входить до складу речовини Оксиген.
-
Знайдіть індекс для Оксигену за формулою п=
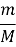
- Знайдіть найпростішу й істинну формулу речовини.
- Запишіть відповідь.
Приклад розв’язання задачі за алгоритмом
Задача. При згорянні 1,76 г органічної речовини утворилось 3,25 г Карбон (IV) оксиду і 1,44 мл води. Густина парів цієї речовини за повітрям (в однакових умовах) дорівнює 1,52. Виведіть молекулярну формулу органічної речовини.
Дано:
т(А) = 1,76 г Емпірична формула речовини CxHyOz звідси
т(СО2)=3,52 г x : y : z = п(С):п(Н):п(О)
V(H2O)=1,4 мл CxHyOz +О2 ![]()
![]() Н2О
Н2О
D(пов)=1,52 п(С) = п(СО2); п(Н) = 2п(Н2О);
Знайти: п=![]() ; М(СO2)=44 г/моль;
; М(СO2)=44 г/моль;
Формула - ? п(С)=п(СО2)=![]() =0,08 моль.
=0,08 моль.
т=ρ·V; т(Н2О)=1,44 мл·1г/мл=1,44 г.
М(Н2О)=18 г/моль;
п(Н) = 2п(Н2О) =2![]() =0,16 моль.
=0,16 моль.
т(А)=т(С)+т(Н)+т(О);
т(О)=т(А)-(т(Н)+т(С)).
т=п·М
М(Н)=1 г/моль;
М(С)=12 г/моль;
т(Н)=1г/моль·0,16моль=0,16 г;
т(С)=12 г/моль·0,08 моль=0,96 г.
т(О)=1,76 г-(0,96г+0,16 г)=1,76 г-1,12 г=0,64 г.
М(О)=16 г/моль; п(О)=![]() = 0,04 моль.
= 0,04 моль.
x : y : z=0,08:0,16:0,04=2:4:1;
А – С2Н4О.
(С2Н4О)п п=![]() ;
;
М(С2Н4О)=44 г/моль; D(пов.)=![]() ;
;
М(А)= D(пов.)·М(пов);
М(А)=1,52·29 г/моль=44,1 г/моль;
п=![]() =1.
=1.
Відповідь: молекулярна формула органічної речовини - С2Н4О.
Алгоритм обчислення за рівнянням хімічної реакції, якщо одна з вихідних речовин узята в надлишку
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
- Запишіть рівняння реакції.
- Підкресліть формули речовин, про які йдеться в умові задачі.
- Обчисліть молярні маси цих речовин.
-
Обчисліть кількості реагентів за формулою п=
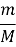
-
Знайдіть, яка з вихідних речовин узята в надлишку за формулою: aA+bB=AaBb
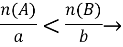 B у надлишку
B у надлишку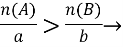 А у надлишку.
А у надлишку.
- Розрахунок здійснюйте за речовиною, яка повністю використовується у реакції.
9) Запишіть відповідь.
Приклад розв’язання задачі за алгоритмом
Задача. Обчисліть масу осаду, який утвориться внаслідок взаємодії розчинів, які містять купрум (ІІ) сульфат масою 8 г та натрій гідроксид масою 10 г.
Дано:
т(CuSO4)=8 г CuSO4 + 2 NaOH = Cu(OH)2 ![]()
m(NaOH)=10г М (CuSO4)=64+32+16·4=160 (г/моль);
Знайти: М(NaOH)=23+16+1=40 (г/моль);
тCu((OH)2) -? М(Cu((OH)2)=64+17·2=98 (г/моль).
п (CuSO4)=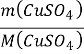 =
=![]() 0,05 (моль) ;
0,05 (моль) ;
п (NaOH)=![]() =
=![]() =0,12 (моль).
=0,12 (моль).
п![]() =п Cu((OH)2)=0,05 моль;
=п Cu((OH)2)=0,05 моль;
т( Cu((OH)2)=п( Cu((OH)2)![]()
М(Cu((OH)2)=0,05·98=4,9 (г).
Відповідь: т( Cu((OH)2)= 0,05·98=4,9 (г).
Алгоритм обчислення маси продукту реакції за відомою масою вихідної речовини, яка містить домішки
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
- Обчисліть масу речовини за формулою
т(чист. реч.) =![]()
![]()
![]()
![]()
- Складіть рівняння реакції.
- Підкресліть формули речовин, про які йдеться в умові задачі.
- Обчисліть молярні маси цих речовин.
-
Обчисліть кількості цих речовин а формулою п=
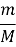
- Надпишіть над підкресленими формулами вихідні дані задачі, під формулами – дані, закономірні для рівняння реакцій
-
Обчисліть масу продукту реакції за формулою т=М

- Запишіть відповідь.
Приклад розв’язання задачі за алгоритмом
Задача. Яку масу кальцій оксиду можна одержати з вапняку масою 400 г з масовою часткою домішок 0,2?
Дано:
т(вапняку)=400 г ![]()
![]()
Знайти: СаСО3![]()
т(СаО) - ? М (СаСО3 )=40+12+16·3=100 (г/моль);
М( СаО )= 40+16=56 (г/моль).
т (СаСО3 )=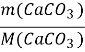 =
=![]() =3,2(моль)
=3,2(моль)
3,2 х
СаСО3 ![]()
1 1
т(СаО)=п(СаО)·М(СаО)= 3,2·56=179,2 г
Відповідь: т(СаО)= 179,2 г.
Алгоритм обчислення виходу продукту реакції порівняно з теоретично можливим
- Прочитайте текст задачі.
- Запишіть скорочено умову і вимоги задачі з допомогою загальноприйнятих значень.
- Запишіть рівняння реакції.
- Підкресліть формули речовин, про які йдеться в умові задачі.
- Обчисліть молярні маси цих речовин.
-
Обчисліть кількості цих речовин а формулою п=
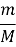
- Укажіть над підкресленими формулами вихідні кількості речовин, під формулами – дані, закономірні для рівняння реакції.
- Обчисліть теоретичну кількість речовини продукту реакції.
-
Обчисліть вихід продукту від теоретично можливого за формулою η=
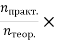 100%
100%
- Запишіть відповідь.
Приклад розв’язання задачі за алгоритмом
Задача. З натрій нітрату масою 86,7 г, що містить 2% домішок, отримали нітратну кислоту масою 56,7 г. яка масова частка (%) виходу нітратної кислоти?
Дано:
т(NaNO3) =86,7 г η=![]() ·100%
·100% ![]()
![]()
т(пр.Н NO3)=56,7 г п(NaNO3):п(НNO3)=1:1;
Знайти: п(NaNO3)=п(НNO3);![]()
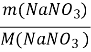
M(NaNO3 )=85 г/моль;
т(NaNO3 )=![]()
![]()
![]()
![]()
т(NaNO3 )=0,98·86,7 г=85 г;
п(NaNO3 )=![]() =1 моль;
=1 моль;
п(НNO3 )=1 моль;
т(НNO3 )=п(НNO3 )·М(НNO3 );
М(НNO3 )=63 г/моль;
т(НNO3 )=1 моль ·63 г/моль=63 г.
![]()
![]() ·100%=90%.
·100%=90%.
Відповідь:масова частка виходу нітратної кислоти становить 90 %.
1. Обчислення за хімічними формулами
Приклад1
Обчислити відносну молекулярну масу кальцій карбонату СаСО3.
Mr(СаСО3)= 1·Ar(Са)+1·Ar(С)+3·Ar(О)= 40+12+3 ·16=100
Приклад2
Визначити масову частку Оксигену в кальцій карбонаті СаСО3.
|
Дано: СаСО3 ω%(О)-?
|
Розв’язання:
1.ω% (E) = |
|
|
2.Mr(СаСО3)= 1·Ar(Са)+1·Ar(С)+3·Ar(О)= 40+12+3 ·16 =100
3. ω% (О)= |
|
|
|
|
Відповідь: ω% (О)= 48%
|
|
Приклад3
Скільки атомів містить залізо масою 1,12 г?
|
Дано: |
Розв’язання:
|
|
m(Fe)=1,12 г |
2. ν (Fe) = 1,12г : 56г/моль = 0,02 моль 3. N (Fe) =0,02моль· 6,02· 1023 атомів/моль=1,2·1022атомів |
|
N (Fe) -? |
|
|
Відповідь: 1,2·1022атомів
|
|
Приклад 4
Обчислити співвідношення мас Феруму й Оксигену в ферум (ІІІ) оксиді.
|
Дано: |
Розв’язання: |
|
Fe2O3 m(Fe):m(O) - ? |
ν (А) : ν (В): ν (С) = х : у : z ν (Fe) : ν (О) = 2 : 3 m (Fe) : m (O) = 2М(Fe) : 3М(O); m (Fe) : m (O) = (2·56) : (3·16) = 112 : 48 = 7 : 3
|
|
Відповідь: співвідношення мас елементів Феруму й Оксигену в ферум (ІІІ) оксиді становить 7 : 3. |
|
Приклад 5
Обчислити відносну густину етану за повітрям.
|
Дано: |
Розв’язання: |
|
С2Н6 Dпов(С2Н6)-?
|
Dпов.= Dпов=30/29=1,034 |
|
Відповідь: відносна густина С2Н6 за повітрям дорівнює 1,034. |
|
Приклад 6
Обчислити густину за воднем газової суміші, що містить 0,4 об’ємних частки вуглекислого газу, 0,4 об’ємних частки нітроген (ІV) оксиду і 0,2 об’ємних частки азоту.
|
Дано: |
Розв’язання: |
|
φ (СО2)= 0,4 φ (NO2)= 0,4 φ (N2) = 0,2 Dн2 (суміші)-? |
Dн2 (сум.)= 1. Яка середня молярна маса газової суміші? Мсер.(сум.)=М(СО2) φ (СО2)+М(NO2) φ (NO2)+M(N2)φ(N2) Mсер.(сум.)=44·0,4+46·0,4+28·0,2= 41,6(г/моль) 2. Яка відносна густина суміші за воднем? Dн2 (газ. сум.) =41,6/2=20,8 |
|
|
|
|
Відповідь: відносна густина газової суміші за воднем дорівнює 20,8, |
|
2. Обчислення з використанням газових законів
Приклад1
Обчисліть об’єм азоту і водню, необхідних для синтезу амоніаку (NH3) об’ємом 6 м3.
|
Дано: |
Розв´язання: |
|
V(NH3)=6м3 V(N2) - ? V(H2) - ? |
N2 + 3H2 2NH3 ν (N2) : ν (H2) : ν (NH3) = 1 : 3 : 2 V(N2) : V(H2) : V(NH3) = 1 : 3 : 2 x : y : 6 = 1 : 3 : 2 x : 6 = 1 : 2; x = 3 (м3) y : 6 = 3 : 2; y = 9 (м3) |
|
Відповідь: об´єм азоту 3 м3, об´єм водню 9 м3.
|
|
Приклад2
За нормальних умов 1 г повітря займає об’єм 773 мл. Який об’єм займе та ж маса повітря при100С та тиску, рівному 85,2 кПа?
|
Дано: |
Розв´язання: |
|
m (пов) = 1 г V0 (пов) = 0,773 л t = 100C р = 85,2 кПа |
V = |
|
V (пов) - ? |
|
|
Відповідь: об´єм повітря 950млл |
|
3. Обчислення масової частки і маси речовини в розчині
Приклад1
Обчислити масову частку кухонної солі в розчині, приготовленому при розчиненні 40 г солі в 360 г води.
|
Дано: |
Розв’язання: |
|
m (р.р.)=40 г m(Н2О)=360г г ω (р.р.) - ? |
1. ω (р.р.)=
2. ω (р.р.)= |
|
|
|
|
Відповідь: масова частка солі 10% |
|
Приклад2
Визначити об’єм води, в якій потрібно розчинити 60 г кухонної солі, щоб утворився 30% розчин кухонної солі.
|
Дано: |
Розв’язання: |
|
m (NaCL)=60 г ω (%) (NaCL) = 30 30% V (Н2О) - ? |
1. Записуємо формулу для обчислення масової частки
ω (р.р.)= m (роз)= m (р.р.) + m (Н2О) 2. Підставляємо значення:
30% = 0,3(60 + х) = 60 18 + 0,3х = 60 0,3х = 42 х =140 – це маса води. 3. Знаходимо об’єм води: ρ (Н2О) = 1 г/см3, отже V = 140 (см3) |
|
|
|
|
Відповідь: об’єм води– 140 см3. |
|
Приклад3
Визначити масову частку солі(натрій карбонату) в розчині, утвореному при додаванні 400 мл води до 600 г 40% її розчину
|
V(H2O) = 400 мл m1(розч)=600 г ω % (HCl)=25% |
1. Яку масу води додали до розчину? m = ρ∙V; ρ (H2O) = 1 г/мл m (H2O) = 400 (г) 2. Яка маса утвореного розчину? m2(розч)= m1(розч)+ m(H2O) m2(розч)=600 +400 = 1000 (г) 3. Яка маса хлоридної кислоти у вихідному розчині?
m(HCl) = 4. Записуємо формулу для обчислення масової частки
ω (р.р.)=
ω2 (р.р.)=
|
|
ω2(HCl) - ? |
|
|
Відповідь: масова частка хлоридної кислоти в утвореному розчині становить 15%
|
|
Приклад4
Визначити масову частку кухонної солі в розчині, одержаному при додаванні 60 г натрій хлориду до 200 г розчину з масовою часткою солі 0,25.
|
Дано: |
Розв’язання: |
|
m (NaCl)=60 г m1(poзч)=200г ω1 (NaCl) = 0,25
ω2(NaCl) - ? |
1. Яка маса солі містилась у вихідному розчині? m1(NaCl)р.р.=200г∙0,25 = 50 (г) 2. Яка маса розчиненої речовини в утвореному розчині? m2(NaCl)р.р.= m1(NaCl)р.р.+ m (NaCl)= 50г+60г = 110 г (г) 3. Яка маса утвореного розчину? m2(poзч)= m1(poзч) + m (NaCl)= 200г + 60г = 260 г 4. Якою буде масова частка утвореного розчину?
ω2 (р.р.)=
ω2 (NaCl)= |
|
|
|
|
Відповідь: масова частка отриманого розчину 42,3% |
|
Приклад5
Визначити масову частку калій гідроксиду в розчині, одержаному при розчиненні 7,8 г калію в 200 мл води.
|
Дано: |
Розв’язання: |
|
m (К)=7,8 г V (Н2О)=200мл мл |
1. m = ρ∙V; ρ (H2O) = 1 г/мл m (H2O) =200 (г) 2. 2К + 2Н2О = 2КОН + Н2↑ 2 моль 2 моль 1 моль М=39 г/моль М=56г/моль М=2 г/моль m = 78 г m = 112 г m= 2 г 7,8 г х г у г х = 11,2 (г) у = 0,2 (г) 3. m (розч) = m (К)+ m (H2O) – m (H2) = (7,8 + 200) – 0,2 = = 207,6 (г)
4. ω% (р.р.)= |
|
ω%(КОН) - ? |
|
|
Відповідь: масова частка калій гідроксиду 5,4 % |
|
4.Обчислення молярної концентрації розчинів
Приклад
Визначити молярну концентрацію натрій гідроксиду в його розчині об’ємом 100мл, якщо там міститься 56 г лугу.
|
Дано: |
Розв’язання: |
|
m (NaCl)=56 г V(розч)=100 мл С (NaОН) - ? |
1. С (речовини) = 2. 100млл=0,1л
3. С (NaОН)= |
|
|
|
|
Відповідь: молярна концентрація лугу становить 1,4моль/л. |
|
5. Розрахунки концентрації розчину утвореного з кристалогідратів
Приклад1
У воді масою 150 г розчинили мідний купорос масою150 г. Визначити масову частку купрум (ІІ) сульфату в одержаному розчині.
|
Дано: |
Розв’язання: |
|
m (Н2О)р=150 г m (СuSO4∙5H2O) = = 150 г ω (СuSO4)-? |
1. Яка маса розчиненої речовини – безводного СuSO4? СuSO4∙5H2O CuSO4 1 моль 1 моль М=250 г/моль М=160 г/моль m = 250 г m = 160 г 150 г х г х = 96 (г)( СuSO4) 2. Яка масова частка солі в утвореному розчині?
ω ( СuSO4) =
ω (СuSO4)= |
|
|
|
|
Відповідь: масова частка купрум (ІІ) сульфату становить 0,48 |
|
Приклад2
Обчислити масу мідного купоросу та води, необхідних для приготування розчину купрум (ІІ) сульфату масою 200 г з масовою часткою солі 16%.
|
Дано: |
Розв’язання: |
|
|
ω (СuSO4)=0, 16 m(розчину)= 200 г
m (Н2О) – ? m (СuSO4∙5H2O) – ? |
1. m (р.р.)= m (СuSO4) = 0,16∙ 200= 32 (г)
солі? СuSO4 CuSO4∙5H2O 1 моль 1 моль М=160 г/моль М=250 г/моль 160 г міститься в 250 г 32 г міститься в х г х = 50 (г) - це m (СuSO4∙5H2O) 3. Яка маса води потрібна? m (Н2О) = m (СuSO4)розчину - m (СuSO4∙5H2O) = = 200 – 50 = 250 (г) |
|
|
Відповідь: маса кристалогідрату 50 г, маса води 250 г. |
||
|
Відповідь: масова частка солі в утвореному розчині 21,23% |
||
6.Обчислення на змішування розчинів
Приклад1
Змішали розчини сульфатної кислоти з масовими частками 10%, 25% та 32% з відповідними масами 120 г, 200 г та 350 г. Обчислити масову частку сульфатної кислоти в одержаному розчині.
|
Дано: |
Розв’язання: |
|
ω1 = 10% ω2 = 25% ω3 = 32% m1 = 120 г m2 = 200 г m3 = 350 г |
ω зміш. =
ω4 = |
|
ω4 (Н2SO4)- ? |
|
|
Відповідь: масова частка сульфатної кислоти становить 26% |
|
Приклад2
Які маси розчинів натрій хлориду з масовими частками 10% та 90% слід взяти для приготування розчину солі масою 160 г з масовою часткою 30%?
|
Дано: |
Розв’язання: Спробуємо розв’язати задачу за правилом діагоналей: |
|
ω1 = 10% ω2 = 90% ω3 = 30% m3 = 160 г m1 - ? m2 -? |
1. 90 % 20% 1 30 % 10 % 60% 3 2. загальне число масових частин 1 + 3 = 4 3. маса яка припадає на одну частину 160г:4=40г 4.маси вихідних розчинів солі 40г ∙1=40г 90%-вого розчину; 40г∙3=120г 10%-вого розчину. |
|
Відповідь: m1 = 40 г, m2 = 120 г |
|
7. Обчислення кількості речовини, маси чи об’єму речовини за рівнянням реакції
Приклад
Яку масу Fe3O4 можна одержати при спалюванні заліза масою 67,2г?
|
Дано: |
Розв’язання: |
|
m(Fe)= 67,2 г
|
І спосіб 1. М(Fe) =56 г/моль; М(Fe3O4)=232 г/моль. 3 Fe + 2 O2 Fe3O4
2. ν (Fe) =
3. 4. m (Fe3O4) = 232 ·0,4 = 92,8 (г). ІІ спосіб 3 Fe + 2 O2 Fe3O4 3 моль 1 моль М=56 г/моль М=232 г/моль m=168г m= 232 г 67,2 г х
|
|
m (Fe3O4)-? |
|
|
Відповідь: маса окалини 46,6 г. |
|
8.Розв’язування задач на домішки
m(тex) = m (чист. реч.) + m(дом); m (чист. реч.) = m(тex) – m(дом)
ω%(дом.) = ![]() %; ω% (чист. реч.) =
%; ω% (чист. реч.) =![]() %
%
ω%(дом.) + ω% (чист. реч.) = 100%
Приклад
Який об’єм ацетилену виділиться при взаємодії води з 1кг технічного кальцій карбіду, якщо масова частка домішок 20%.
|
Дано: |
Розв’язання: |
|
m(кальцій карбіду)=1кг w (дом.)=20% V(С 2H2)-? |
СаС2 +2Н2О = Са(ОН)2 + С2Н2 п (СаС2) : п (С2Н2) = 1:1 п (СаС2) = п (С2Н2) п = т/М М(СаС2) = 64 г/моль=0,064кг/моль
W(речовини) = т(речовини) = w(речовини)·т(суміші) w(СаС2) = 100% -20%.=80%.=0,8 т(СаС2) = 0,8·1кг = 0,8кг
п (СаС2) = п (С2Н2) = V(С 2H2)= 22,4л/моль·12,5моль=280 л |
|
|
|
|
Відповідь: V(С 2H2)= 280л |
|
9.Розв’язування задач на вихід продукту від теоретично можливого
η (Х) =![]() ; φ(Х) =
; φ(Х) = ![]()
Приклад
При випалюванні залізного колчедану масою 96 г одержали ферум (ІІІ) оксид масою 60 г. Обчислити вихід продукту реакції за відношенням до теоретичного.
|
Дано: |
Розв’язання: |
|
m (FeS2)=96г m(Fe2O3)=60г |
М (FeS2 ) =120 г/моль; М (Fe2O3) = 160 г/моль 1. п (FeS2 ) = 96:120 =0,8 моль 2. 4 FeS2 + 11 О2 2 Fe2O3 + 8 SO2
п (Fe2O3) = 3. m(Fe2O3)=64 г
4. η (Fe2O3) = |
|
η (Fe2O3)-? |
|
|
Відповідь: 93,75% |
|
10. Розв’язування задач на надлишок однієї з реагуючих речовин
Приклад
Який об’єм водню виділиться при взаємодії алюмінію масою 2,16 г з розчином, що містить 9,9 г хлоридної кислоти?
|
Дано: |
Розв’язання: |
|
m (Al) = 2,16 г m(HCl) = 9,9 г V(H2) - ? |
п (HCl) = 2. 2Al + 6HCl 2AlCl3 + 3Н2↑ 3.Позначимо необхідну кількість соляної кислоти, що прореагує з 0,08моль алюмінію за х , тоді згідно рівняння реакції
4.У нас за умовою кислоти 0,27 моль, а потрібно 0,24 моль. Отже в надлишку саме HCl. Тоді алюміній у недостачі. Подальші розрахунки проводимо за тією речовиною, яка в недостачі, тобто – за алюмінієм. 5. 2 : 3 = 0,08 : у; у = 0,12 моль 6. V(H2) = 0,12 ∙ 22,4 = 2,688 л. |
|
Відповідь: об’єм утвореного водню становить 2,688 л |
|
11.Розв’язування задач на надлишок за участю солей багатоосновних кислот
Особливість цих задач полягає у тому, що в залежності від кількісних співвідношень кислот з лугами можуть утворюватись різні типи солей.
Для ортофосфатної кислоти:
Н3РО4 + КOH КH2PO4 + H2O (співвідношення 1 : 1)
Н3РО4 + 2КOH К2HPO4 + 2H2O (співвідношення 1 : 2)
Н3РО4 + 3КOH К3PO4 + 3H2O (співвідношення 1 : 3)
Для двохосновних кислот (наприклад, Н2 СО3)
Н2СО3 + KOH KНСО3 + H2O (співвідношення 1 : 1)
Н2СО3 + 2KOH K2СО3 + H2O (співвідношення 1 : 2)
Приклад1
До розчину, що містить 16 г натрій гідроксиду, додали розчин, що містить 19,6 г ортофосфатної кислоти. Розчин випарили. Обчислити маси утворених солей.
|
Дано: |
Розв’язання: |
|
m (NaOH)= г m(Н3РО4)=19,6г m (солей) - ? |
п (NaOH) =
п (Н3РО4) = п (NaOH) : п (Н3РО4) = 0,4 : 0,2 = 2 : 1 Н3РО4 + 2NaOH Na2HPO4 + 2H2O кількість речовини утвореної солі 1 : 1 = 0,2 : х х = п (Na2HPO4)= 0,2 моль маса утвореної солі т (Na2HPO4) = 0,2моль ∙ 142г/моль = 28,4 г |
|
|
|
|
Відповідь: маса утвореного натрій гідрогенфосфату 28,4 г. |
|
Приклад2
До розчину, що містить 44 г натрій гідроксиду, додали розчин, що містить 39,2 г ортофосфатної кислоти. Розчин випарили. Обчислити маси утворених солей.
|
Дано: |
Розв’язання: |
|
m(NaOH)= 44г m(Н3РО4)= = 39,2г m (солей) - ? |
п (NaOH) =
п (Н3РО4) = п(NaOH) : п(Н3РО4) = 1,1 : 0,4 = 2,75 : 1 Утворюється двозаміщена сіль і трохи гідрогенфосфату. Н3РО4 + 2NaOH Na2HPO4 + 2H2O Na2HPO4+ NaOH Na3PO4 + H2O кількість речовини лугу яка прореагувала з кислотою 1 : 2 = 0,4 : х; х = 0,8 моль кількість речовини лугу в надлишку п(NaOH) = 1,1 – 0,8 = 0,3 моль кількість речовини утвореної солі Na2HPO4 1 : 1 = 0,4 : у; у= 0,4 моль кількість речовини гідрогенфосфату натрію яка прореагувала з надлишком лугу 1 : 1 = 0,3 : у2; у2= 0,3 моль кількість речовини гідрогенфосфату натрію яка залишилась п (Na2HPO4) = 0,4 – 0,3 = 0,1 моль кількість речовини ортофосфату натрію яка утворилась 1 : 1 = 0,3 : у3; у3= 0,3 (моль) маса утворених солей M (Na2HPO4) = 0,1 ∙ 142 = 14,2 г m (Na3PO4) = 0,3 ∙ 164 = 49,2 г |
|
|
|
|
Відповідь: маса утвореного натрій гідрофосфату 14,2 г, а натрій ортофосфату 49,2 г. |
|
12. Обчислення за термохімічними рівняннями.
∆Н0 = ∑ ∆Н0 кін – ∑ ∆Н0вих
Приклад 1
Скільки теплоти виділиться при згоранні водню об’ємом 33,6 л, якщо тепловий ефект реакції становить 571,6 кДж?
|
Дано: |
Розв’язання: |
|
V (Н2) = 33,6 л ∆Н0=-571,6кДж G - ? |
2 H2 + O2 2 H2O + 571,6 кДж 2 моль Vm=22,4л/моль V=44,8 л 571,6 кДж 33,6 л х
х = |
|
|
|
|
Відповідь: 428,7 кДж |
|
Приклад 2
Скласти термохімічне рівняння, якщо відомо, що при згорянні алюмінію масою 9г виділяється 274,44 кДж теплоти.
|
Дано: |
Розв’язання: |
|
m (АІ) = 9 г G = 274,44 кДж ∆Н0 - ? |
4АІ + 3O2 2АІ2 O3 + x кДж 4моль M=27 г/моль m=108 г х кДж 9г 274,44 кДж
х = |
|
∆Н0 - ? |
|
|
Відповідь: ∆Н0 = - 3293,28 кДж |
|
Приклад 3
Обчислити тепловий ефект реакції, що описується рівнянням С2Н6О (г) + 3О2 (г) 2СО2 (г) + 3Н2О, якщо теплоти утворення С2Н6О, СО2 та Н2О відповідно становлять -277 кДж/моль; -393,3 кДж/моль та -286,2 кДж/моль.
|
Дано: |
Розв’язання: |
|
∆Н0(С2Н6О) = -277 кДж/моль ∆Н0(СО 2) = -393,3 кДж/моль ∆Н0(Н2О) = -286,2 кДж/моль |
С2Н6О (г) + 3О2 (г) 2СО2 (г) + 3Н2О ∆Н0 = ∑ ∆Н0 кін – ∑ ∆Н0вих ∆Н0=(2∙(-393,3)+3∙(-286,2))-(1∙(-277)+ (3∙0)= (-786,6 – 858,6) + 277 = -1368,2 кДж |
|
∆Н0 - ? |
|
|
Відповідь: ∆Н0 = - 1368,2 кДж |
|
13. Розв'язування задач на суміші
Приклад
При розчиненні у хлоридній кислоті сплаву алюмінію з цинком масою 6,66 г виділилось 3,024 л водню. Визначити масу кожного металу у суміші.
|
Дано: |
Розв’язання: |
|
m (Al + Zn) = 6,66 г V (H2) = 3,024 л |
І спосіб 1.Нехай m (Al) = х г, тоді m (Zn) = 6,66 – х г 2. кількості реагуючих речовин
п (Al) = 3. кількість речовин водню яка виділяється
п(H2) = 4. 2 Al + 6 HCl 2 AlCl3 + 3H2↑ Zn + 2 HCl ZnCl2 + H2↑ 5. кількість моль водню який виділиться при взаємодії хлоридної кислоти з алюмінієм
2 : 3 = 6. кількість моль водню який виділиться при взаємодії хлоридної кислоти з цинком
1 : 1 = 7. маса алюмінію в суміші
65х + 119,88 – 18х = 157,95 х = 0,81 г 8. маса цинку в суміші m (Zn) = 6,66 – 0,81 = 5,85 г ІІ спосіб 1.Нехай m (Al) = х (г), тоді m (Zn) = у (г) 2. кількості реагуючих речовин
п (Al) = 3. кількість речовини водню який виділяється
п (H2) = 4. 2 Al + 6 HCl 2 AlCl3 + 3H2↑ Zn + 2 HCl ZnCl2 + H2↑ 5. кількість моль водню який виділиться при взаємодії хлоридної кислоти з алюмінієм
2 : 3 = 6. кількість моль водню який виділиться при взаємодії хлоридної кислоти з цинком
1 : 1 = 7. маса речовин у суміш
х = 0,81 г, у = 5,85 г |
|
m (Al) - ? m (Zn) - ? |
|
|
Відповідь: m (Al) = 0,81 г; m (Zn) = 5,85 г. |
|
14. Розв'язування задач на встановлення формул органічних сполук
Виведення молекулярної форми відомого класу органічних сполук за відносною густиною
Приклад
Відносна густина пари деякого алкану за воднем дорівнює 57 . Визначте формулу цього алкану і назвіть його.
Дано: Розв’язування:
СnH2n+2 M(CnH2n+2)= (14n +2) г/моль
D(н2)=57 1. Обчислимо молярну масу алкану:
СnH2n+2 - ? M(CnH2n+2) = D(н2) ![]() M(н2)
M(н2)
M( н2 )=2 г/моль
M(CnH2n+2) = 57 ![]() 2 г/моль = 114 г/моль
2 г/моль = 114 г/моль
2. Обчислимо число атомів Карбону в алкані:
12n + 2 = 114;
14n = 112;
п = 112:14
п=8
С8Н18
Відповідь: Формула сполуки С8Н18. Це октан.
Виведення молекулярної формули за відомими масовими частками елементів
Приклад
Виведіть молекулярну формулу вуглеводню, масова частка Карбону в якому становить 85, 71%, а Гідрогену 14,29%. Відносна густина пари цього вуглеводню за повітрям дорівнює 2,896.
Дано: Розв’язування:
ω(С) = 85,71% 1. Обчислюємо молярну масу вуглеводню:
ω(Н) = 14,29% ![]()
D(CxHy)пов = 2,896 2. Виводимо алгоритм для встановлення кількості
атомів Карбону та Гідрогену:
CxHy - ? ![]()
![]()
3. Обчислюємо число атомів Карбону і Гідрогену у вуглеводні (для розрахунків відсотки переводимо в частки):
![]()
![]()
Формула вуглеводню С6Н12
4. Робимо перевірку виведеної формули вуглеводню за молярною масою:
М(С6Н12)=84г/моль
Відповідь: формула вуглеводню С6Н12 (гексен)
Виведення молекулярної формули за відомими масою, об’ємами або кількістю речовини продуктів згорання
Приклад
Внаслідок спалювання вуглеводню масою 1,5 г утворився оксид карбону (ІV) об’ємом 2,24 л (н.у.) та вода масою 2,7 г. Виведіть молекулярну формулу вуглеводню, якщо відносна густина його за повітрям становить 1,0345.
Дано: Розв’язування:
m(CxHy)=1,5г 1. Обчислимо молярну масу вуглеводню:
V(C xHy)=2,24 л ![]()
m(H2O)=2,7г Mпов = 29 г/моль
D(CxHy)пов=1,0345 ![]()
CxHy - ? 2.Обчислимо кількість речовини вуглеводню масою 1,5г
![]()
3. Обчислимо кількість речовини оксиду карбону (ІV) об’ємом 2,24 л:
![]()
4. Обчислимо кількість речовини води масою 2,7 г:
![]()
5. Обчислимо співвідношення кількостей речовин вуглеводню, оксиду карбону (ІV) та води:
п(CxHy) : п(СО2) : п (Н2О) = 0,05 : 0,1 : 0,15
![]()
6. Обчислимо число атомів Карбону і Гідрогену у вуглеводні:
СхНу +3,5 О2 → 2 СО2 + 3Н2О
х=2; у=6; С2Н6;
7. Перевіряємо М(С2Н6) = 30 г/моль
Відповідь: Формула вуглеводню С2Н6 (етан)
Виведення молекулярної формули за об’ємними відношеннями газів
Приклад
При дегідратації первинного насиченого спирту утворився газоподібний алкен, об’єм якого виявився в 4 рази меншим, ніж об’єм карбон(VI)оксиду, що утворився при спалювані такої ж кількості спирту. Одержаний алкен може повністю знебарвити розчин бромної води, де міститься 16г брому. Який спирт піддали дегідратації?
Дано: Розв’язування:
![]() Складаємо рівняння відповідних реакцій:
Складаємо рівняння відповідних реакцій:
m(Br2) = 16г 1) Дегідратація первинного насиченого спирту:
СnH2n+1OH - ? СnH2n+1OH = СnH2n + H2O
2) Горіння первинного насиченого спирту:
СnH2n+1OH + О2 = СО2 + Н2О
3) Приєднання брому алкеном:
СnH2n + Br2 = СnH2n Br2
Складаємо співвідношення реагуючих речовин та продуктів реакції:
V(СnH2n) : V (CO2) = 1:4
4) Знаходимо кількість речовини Брому:
![]() , за рівнянням п(СnH2n) = 0,1 моль
, за рівнянням п(СnH2n) = 0,1 моль
5) За умовою задачі:
1V СnH2n = 4V CO2
п(СnH2n) = 0,1 моль
п(CO2) = 0,4 моль
п(СnH2n): п(CO2) = 0,1 : 0,4 = 1:4
6) Формула алкену містить 4 атоми Карбону:
С4Н8
При гідратації алкену добудемо одноатомний насичений спирт С4Н9ОН
Відповідь: С4Н9ОН – бутанол
Використана література
- Данильченко В. С. Як розв’язувати задачі з хімії. – Харків: країна мрій, 2008. – 89 с.
- Даскалу Ю. К. Алгоритми та методичні рекомендації по розв’язуванню розрахункових задач з хімії. – Герца, 2013. – 34 с.
- Загоруй М. Й. Хімія: Як розв’язувати задачі. – К.: Логос, 1999. –
127 с.
- Кукса С. П. 600 задач з хімії: Розв’язування задач за алгоритмами. – Тернопіль: Мандрівець, 2000. – 140 с.
- Лазник Р. П. Навчальна програма факультативного курсу: Розв’язування розрахункових задач з хімії // Основа. – Лютий 2008 - №3. – с 2-12.
- Магнутіна В. А. Алгоритми у вивченні хімії // Хімія. – Січень 2008. - №2. – с. 11-14.
- Середа І. П. конкурсні задачі з хімії: Приклади розв’язування задач. – К. : Вища школа, 1972. – 271 с.


про публікацію авторської розробки
Додати розробку
