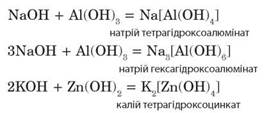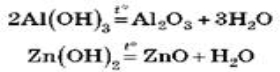Міні-довідник "амфотерні сполуки"
«ШПАРГАЛКА»
Амфотерні сполуки: оксиди та гідроксиди(основи).
Амфотерні сполуки мають особливість: вони проявляють властивості як кислот, так і основ залежно від того, з якою речовиною вони реагують.
Так, реагуючи із сильною кислотою, вони проявляють основні властивості, а під час реакції із сильною основою — кислотні.
Здатність сполуки виявляти основні та кислотні властивості називають амфотерністю, а саму сполуку — амфотерною.
Наводимо формули найважливіших амфотерних сполук:

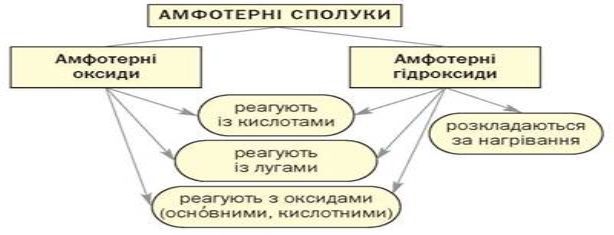
Хімічні властивості амфотерних сполук
|
Амфотерні оксиди |
Амфотерні гідроксиди |
|
Амфотерні оксиди у реакціях із кислотами і кислотними оксидами поводять себе, як основні оксиди; у реакціях із лугами і основними оксидами — як кислотні оксиди. |
Амфотерні гідроксиди —це сполуки які залежно від другого реагенту можуть поводитися і як кислоти, і як основи й утворювати солі різного складу.
|
|
BeO, Al2O3, ZnO, MnO2, Fe2O3, Cr2O3, PbO, PbO2, SnO, SnO2 та деякі інші |
Be(OH)2, Al(OH)3, Zn(OH)2, Mn(OH)3, Fe(OH)3, Cr(OH)3, Sn(OH)2, Pb(OH)2 та деякі інші. |
|
Взаємодія з кислотами |
|
|
ZnO + 2HNO3 = Zn(NO3)2 + H2O Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O |
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O |
|
Взаємодія з основами (лугами) |
|
|
ZnO + 2KOH = K2ZnO2 + H2O калій цинкат Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O
|
Взаємодія в розплаві
Взаємодія в розчині
|
|
Взаємодія з кислотними оксидами.
|
|
|
Al2O3 + 3SO3 = Al2(SO4)3 |
|
|
Взаємодія з основними оксидами.
|
|
|
Аl2О3 + СаО = Са(АlО2)2. кальцій алюмінат:
ZnO + K2O = K2ZnO2 калій цинкат |
|
|
Розклад під час нагрівання
|
|
|
|
|
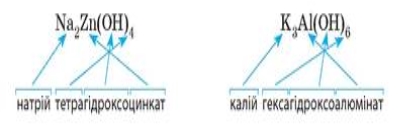 Як для звичайних солей, назва комплексної солі складається з двох слів. Але слід указати число груп ОН у складі солі: префікс тетра- означає, що гідроксильних груп чотири, а префіксом гекса- позначають шість груп ОН.
Як для звичайних солей, назва комплексної солі складається з двох слів. Але слід указати число груп ОН у складі солі: префікс тетра- означає, що гідроксильних груп чотири, а префіксом гекса- позначають шість груп ОН.
Амфотерні гідроксиди
|
Амфотерний гідроксид |
Кислотний залишок і його валентність |
|
|
основна форма |
кислотна форма |
|
|
Zn(OH)2 |
H2ZnO2 |
ZnO2 (II) |
|
Аl(OН)3 |
HAlO2 (Н3АlО3 - H2O = НАlO2) |
АlО2 (I) |
|
Ве(ОН)2 |
Н2ВеО2 |
ВеО2 (II) |
|
Sn(OH)2 |
H2SnO2 |
SnO2 (II) |
|
Рb(ОН)2 |
H2РbО2 |
РbО2 (II) |
|
Fe(OH)3 |
HFeO2 (H3FeO3 - Н2O = HFeO2) |
FeO2 (І) |
|
Сr(ОН)3 |
HCrO2 (H3CrO3 - H2O = HCrO2) |
CrO2 (І) |
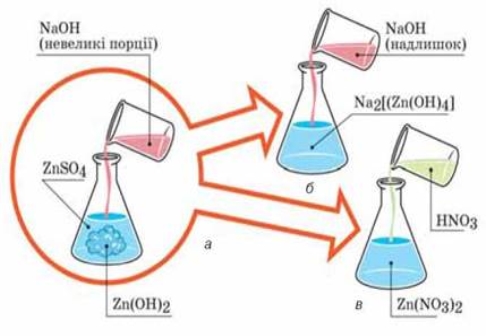
Мал. Послідовність проведення досліду з виявлення амфотерності цинк гідроксиду: а — добування цинк гідроксиду; б, в — розчинення осаду Zn(OH)2
Стисло про основне
• За характерними хімічними властивостями виокремлено групу оксидів — амфотерні оксиди й групу гідратів оксидів — амфотерні гідроксиди.
• Представниками неорганічних амфотерних сполук є оксиди й гідроксиди Цинку, Берилію, Алюмінію, Плюмбуму(ІІ), Стануму(ІІ), Хрому(ІІІ) та деякі інші.
• Амфотерні сполуки, залежно від умов, взаємодіють як із кислотами, так і з лугами, утворюючи солі. Тобто вони проявляють і основні, і кислотні властивості.
• Усі амфотерні оксиди й амфотерні гідроксиди нерозчинні у воді.
• У формулах солей, утворених взаємодією амфотерної сполуки з кислотою, їх металічний елемент — це елемент амфотерного гідроксиду (ZnSO4, ZnCl2 тощо).
• У формулах солей, утворених взаємодією амфотерної сполуки з лугом, її металічний елемент входить до складу кислотного залишку (Na2[Zn(OH)4], K[Al(OH)4] або NaAlO2, KZnO2).
• Амфотерні гідроксиди, як і нерозчинні основи, розкладаються під час нагрівання на амфотерний оксид і воду, наприклад, Zn(OH)2 =t °C ZnO + H2O.

про публікацію авторської розробки
Додати розробку