Міні-довідник "Термохімічні реакції"
«ШПАРГАЛКА»
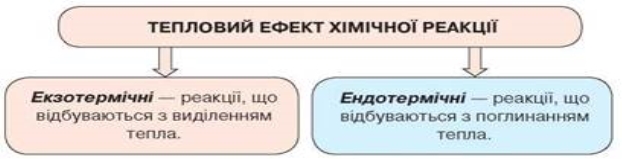
Екзотермічні та ендотермічні реакції. Тепловий ефект хімічних реакцій.
Тепловий ефект хімічної реакції - один із численних зовнішніх ефектів, що супроводжують перетворення одних речовин на інші.
Тепловим ефектом реакції називають кількість тепла, що виділяється або поглинається під час хімічної реакції.
|
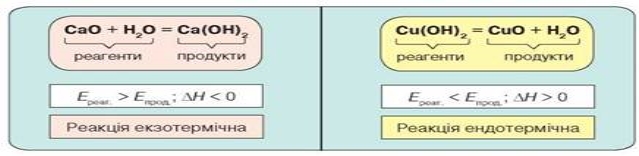
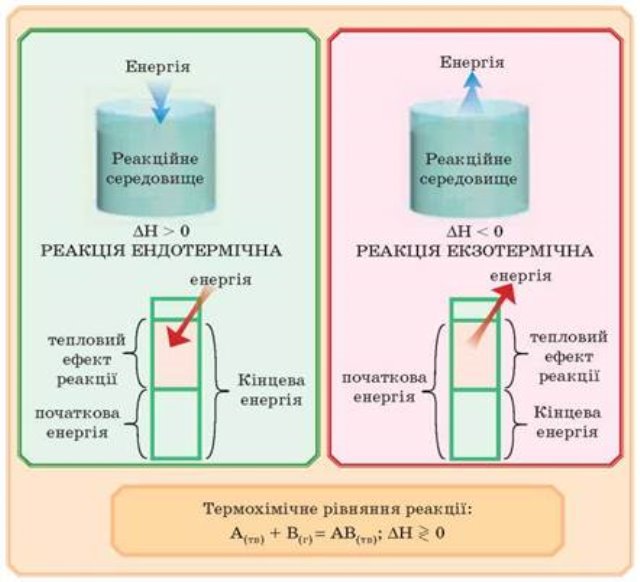
Екзотермічна реакція: реагенти → продукти + теплота |
Ендотермічна реакція: реагенти + теплота → продукти. |
|
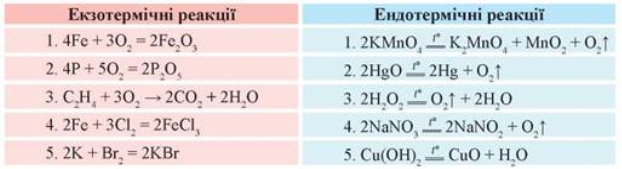
Екзотермічні реакції:
|
Ендотермічні реакції:
|
Термохімічні рівняння реакції
Термохімічне рівняння - рівняння хімічної реакції, у якому зазначають агрегатні стани речовин і для якого наводять числове значення теплового ефекту.
Наприклад, термохімічне рівняння реакції горіння метану - головного складника природного газу - таке:
СН4(г) + 2О2(г) = О2(г) + 2Н2О (р), ΔΗ = -890 кДж,
де (г) - газ, (р) - рідина. Тверду речовину позначають (т).
Хімічні рівняння, в яких зазначається кількість теплоти, що виділяється або вбирається, називаються термохімічними рівняннями.
S + O2 = SO2; ΔΗ = -297 кДж; енергія виділяється;
СаСО3 = СаО + СО2; ΔΗ = +157 кДж; енергія поглинається.
Для теплового ефекту реакції використовують позначення ΔΗ (читається «дельта-аш»). У разі екзотермічної реакції ΔΗ < 0, а ендотермічної реакції — ΔΗ > 0. За необхідності тепловий ефект указують разом із хімічним рівнянням:
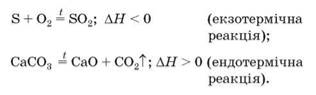
Тепловий ефект позначається:
а) Q – показує скільки теплоти (кДж) виділилося або поглинулося під час реакції;
б) ∆ Н – показує різницю між вмістом енергії у вихідних речовинах і кінцевих продуктах (ентальпія)
∆ Н = - Q
Тепловий ефект вимірюється в Дж або кДж
|
Екзотермічні Відбуваються з виділенням тепла Способи запису термохімічного рівняння 2Mg + O2 → 2MgO + Q 2Mg + O2 → 2MgO + 1205 кДж 2Mg + O2 → 2MgO; ∆ Н ‹ 0 2Mg + O2 → 2MgO; ∆Н = -1205кДж
|
Ендотермічні Відбуваються з поглинанням теплоти Способи запису термохімічного рівняння СаСО3 → СаО +СО2- Q СаСО3 → СаО +СО2-180кДж СаСО3 → СаО +СО2; ∆ Н › 0 СаСО3 → СаО +СО2; ∆ Н =180 кДж
|
ПІДСУМОВУЄМО ВИВЧЕНЕ
• За тепловим ефектом реакції поділяють на екзо- й ендотермічні.
• Екзотермічні — реакції, під час яких виділяється тепло.
• Ендотермічні — реакції, під час яких поглинається тепло.
• Екзотермічна реакція відбувається, якщо енергія реагентів є більшою за енергію утворення продуктів реакції.
• Ендотермічна реакція відбувається, якщо енергія реагентів є меншою від енергії утворення продуктів реакції.
• Хімічне рівняння, у якому зазначено тепловий ефект реакції, називають термохімічним.


про публікацію авторської розробки
Додати розробку
