Науково-дослідницька робота "Фактори, що впливають на протікання електричного струму в електролітах"
Фактори, що впливають на протікання електричного струму в електролітах
Науково-дослідницька робота
учня 9 – Б класу КЗШ №117
Серьогіна Костянтина
Науковий керівник
Серьогіна Лілія Володимирівна
учитель фізики
1. ВСТУП
У дитинстві мені мама показувала багато цікавих дослідів. Ось один з них. Візьмемо лимон, оцинковану і мідну пластинки, мідний провідник. У лимоні зробимо два маленьких розрізи і вставимо в них оцинковану і мідну пластинки. Пластинки з’єднаємо мідним провідником. Якщо лизнути провідник, відчуємо удар струмом. Ми одержали лимон – батарейку.
Зараз на уроках фізики ми достатньо детально проходимо закони, що описують протікання електричного струму в металах. Описуються експерименти, за допомогою яких ці закони були відкриті. Згадується так само про те, що електричний струм проводять не тільки метали, але і інші речовини, зокрема, - електроліти. У нашому досліді електролітом є лимонний сік. Якщо з'єднати сполучними провідниками пластинки з амперметром, то він покаже струм в колі. Лимон став джерелом живлення. Ще я помітив, що чим далі розташувати пластинки одну від одної, тим менша сила струму.


Мені стало цікаво:
1) Що є електричним струмом в електролітах?
2) Які фактори, і яким чином ці фактори впливають на протікання електричного струму?
2. ПОПЕРЕДНІ ВІДОМОСТІ
1. В електролітичну ванну з дистильованою водою занурюю два вугільні електроди, які з’єдную з електричною лампою і джерелом постійного струму. Замикаю коло, тобто подаю напругу до електродів, створюючи таким чином електричне поле між електродами. Але струму в колі немає, лампочка не засвічується. Чому? Тому що в дистильованій воді немає вільних заряджених частинок. У воду кидаю кухонну сіль. При цьому у колі з'являється струм, лампочка засвічується. Якщо насипати більше солі – розжарення нитки лампочки збільшується. Молекули солі NaCl під час взаємодії з молекулами води розпалися на позитивні і негативні іони. Під дією електричного поля іони приходять в спрямований рух: позитивні іони переміщаються до негативно зарядженого електроду (катоду), а негативні – до позитивно зарядженого електроду (аноду). Під час розчинення речовини у воді, молекули якої є полярними, молекули речовини розпадаються на іони – відбувається електролітична дисоціація.
Причина дисоціації електролітів у воді полягає в тому, що молекули води є полярними молекулами з великим дипольним моментом. Внаслідок цього навколо молекули води виникає сильне електричне поле. Під час розчинення речовини, наприклад, солі NaCl, навколо кожного з іонів (Na+ і Cl-) орієнтуються полярні молекули води. До позитивного іона молекули розчиненої речовини притягуються негативні полюси молекул води, при цьому вони відштовхують інші іони цієї молекули. Цей процес ослабляє зв'язок між іонами молекули розчиненої речовини. Внаслідок теплового руху молекул відбувається розрив іонів молекули розчиненої речовини на окремі іони. Іони, що утворилися, починають мандрувати по розчину. Якщо іони розчиненої речовини зближуватимуться на достатню відстань, то відбувається їх об'єднання в нейтральну молекулу – такий процес називається рекомбінацією іонів. У розчині одночасно йдуть два процеси – дисоціація і рекомбінація. В стані рівноваги швидкості протікання дисоціації і рекомбінації однакові: кількість іонів, що утворилися, рівна числу об’єднаних іонів в нейтральну молекулу за однаковий час.
Приклади електролізу:
1) Електроліз водного розчину соляної кислоти. Дисоціація молекули HCL:
HCL ‹=› H+ + CL-
Переходячи до анода іони хлору, віддають надмірні електрони та перетворюються на нейтральні атоми хлору і тут же об'єднуються в молекулу хлору CL.
2CL- – 2e- → CL2
Атоми водню, на катоді нейтралізуються і об'єднуються попарно в молекули водню Н:
2Н+ + 2е- → Н2
В цьому випадку вторинних реакцій немає.
Електроліт – це розчин солі, кислоти або лугу, що проводить електричний струм. Таким чином, на відміну від металів, що володіють електронною провідністю, електроліти – це провідники, електропровідність яких виникає за рахунок руху іонів.
Можна зробити висновок: електричний струм в електроліті – це спрямований рух позитивних та негативних іонів в електричному полі. Значить, провідність електролітів є іонною, а сприяє цьому явище електролітичної дисоціації.
2. Якщо говорити про фактори, що впливають на протікання електричного струму в металах, то, як відомо, цими факторами є напруга на кінцях металевого провідника, що нам показує закон Ома
![]()
тобто опір постійний і сила струму прямо пропорційна напрузі, і геометричні характеристики провідника, що показує наступна формула
![]()
де ρ – питомий електричний опір, величина постійна для даної речовини за даних умов, l – довжина провідника, S – площа поперечного перерізу провідника. Якщо цю формулу підставити в закон Ома, то виходить, що
![]()
тобто сила струму прямо пропорційна площі поперечного перерізу провідника і обернено пропорційна довжині провідника.
Температура провідника також впливає на його опір: чим більша температура, тим більший опір, а значить, чим більша температура провідника, тим менша сила струму.
Я припускаю, що для електролітів вірні ті ж закономірності, що і для металів (за винятком температури), проте не зовсім очевидно, що таке у разі електролітів довжина і площа поперечного перерізу провідника.
Забігаючи вперед, розглянемо основну частину моєї експериментальної установки: електролітичну ванну з електродами. Електроди підключені до джерела струму. Для дослідження закономірностей нам необхідно вимірювати силу струму і напругу в електроліті, тому в електричне коло підключені амперметр і вольтметр. Я припускаю, що в електроліті струм тече прямо від електроду до електроду, тоді довжина провідника в моєму випадку буде відстань між електродами, а площа поперечного перерізу провідника – площа пластин електродів, опущених в електроліт.
Що стосується температурної залежності сили струму від температури електроліту, то тут ситуація повинна кардинально відрізнятися від того, що відбувається в металі і ось чому, в електроліті струм створюється рухом іонів, іони утворюються в результаті розпаду молекули і руйнування деяких її зв'язків. Для руйнування зв'язків необхідна енергія, коли ми нагріваємо електроліт, ми надаємо йому енергію, і в результаті цього утворюється більше іонів. Відповідно більша температура, більша сила струму.
Для підтвердження або спростування своєї гіпотези я виконав ряд експериментів з електролітом – розчином мідного купоросу (CuSO4).
Дисоціація: CuSO4 ‹=› Cu2++ SO42-
Атоми міді, що нейтралізувалися, відкладаються у вигляді твердого осаду на катоді.
Катод: Cu2++2e- → Cu0 - виділяється на катоді.
Анод: 4ОН- - 4e- → 2Н2О+О2 - кисень виділяється на аноді.
Анод розчиняється, а мідь виділяється на катоді.
3. ЕКСПЕРИМЕНТИ ТА ЇХ РЕЗУЛЬТАТИ
Перш ніж проводити експеримент, необхідно скласти схему електричного кола.
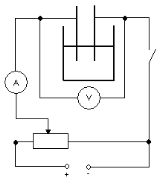
Мал. 3.1.
Так само необхідно вибрати обладнання і скласти схему установки для експериментів.
Обладнання: джерело струму, електролітична ванна, реостат, амперметр, вольтметр, вимикач, посудина з розчином мідного купоросу, 2 мідних електроди, електроплитка, з’єднувальні проводи.
3.1 Чи справедливий для електролітів закон Ома?
Для того, щоб перевірити справедливість закону Ома для електролітів, я зібрав електричне коло, як показано на мал. 3.1., і змінював тільки напругу рівномірно на 0,2 вольт, орієнтуючись на показання вольтметра. Записував показання амперметра для кожної напруги.
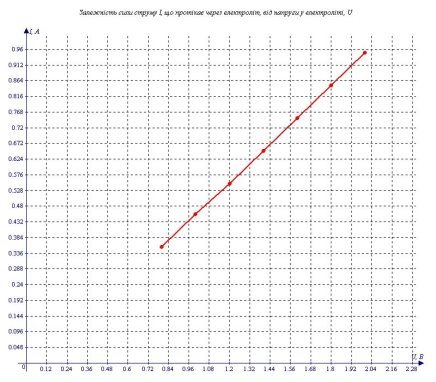
В результаті експерименту я одержав наступні дані.
Таблиця 1.
"Залежність сили струму, I, що протікає через електроліт від напруги в електроліті, U."
|
U (В) |
I (А) |
R |
|
0,8 |
0,355 |
2,25 |
|
1 |
0,455 |
2,2 |
|
1,2 |
0,55 |
2,18 |
|
1,4 |
0,65 |
2,15 |
|
1,6 |
0,75 |
2,13 |
|
1,8 |
0,85 |
2,12 |
|
2 |
0,95 |
2,11 |
Я побудував графік залежності I від U, який схожий на пряму пропорційність (див. графік 1). Графік прямої пропорційності – пряма. Графік, який я одержав, звичайно не пряма, але якщо врахувати погрішності через дані точки можна провести пряму. Хай не всі точки будуть на ній лежати, але всі точки знаходяться біля цієї прямої. Опір слабо залежить від напруги. З цього можна зробити висновок, що для розчину мідного купоросу закон Ома вірний, принаймні, при напрузі 0 - 2 В.
3.2. Як залежить сила струму від відстані між електродами?
Мета другого експерименту – з'ясувати чи є залежність сили струму від відстані між електродами оберненою пропорційністю.
Для того, щоб дослідити залежність сили струму від відстані я зібрав електричне коло, як показано на мал. 3.1. і поставив електроди на максимальній відстані один від одного. Включив джерело струму і рівномірно зменшував відстань між електродами на 1см, записуючи показання амперметра для кожної відстані. Мінімальна відстань, яку мені дозволила моя установка 2см, максимальна – 9 см. Напруга підтримувалася постійною.
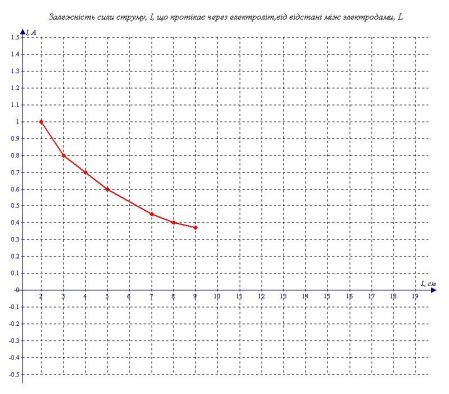
В результаті експерименту я одержав наступні дані.
Таблиця 2.
"Залежність сили струму, I, що протікає через електроліт, від відстані між електродами, L"
|
L(см) |
I(А) |
|
2 |
1 |
|
3 |
0,8 |
|
4 |
0,7 |
|
5 |
0,6 |
|
7 |
0,45 |
|
8 |
0,4 |
|
9 |
0,37 |
Графік, який я побудував за цими даними (див. графік 2) схожий на гіперболу, але для того, щоб точно визначити чи є досліджувана залежність оберненою пропорційністю, необхідно визначити чи є залежність I від 1/L прямою пропорційністю.
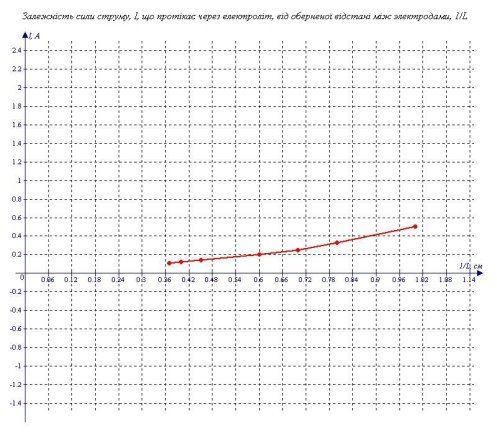
Таблиця 3.
|
L(см) |
I(А) |
1/L(1/см) |
|
2 |
1 |
0,5 |
|
3 |
0,8 |
0,33 |
|
4 |
0,7 |
0,25 |
|
5 |
0,6 |
0,2 |
|
7 |
0,45 |
0,142 |
|
8 |
0,4 |
0,125 |
|
9 |
0,37 |
0,111 |
Я побудував графік залежності I - 1/L (див. графік 3), він схожий на пряму, тобто ця залежність є прямою пропорційністю. Таким чином, видно, що залежність сили струму, що протікає через електроліт, від відстані між електродами є оберненою при відстані від 2см до 9см.
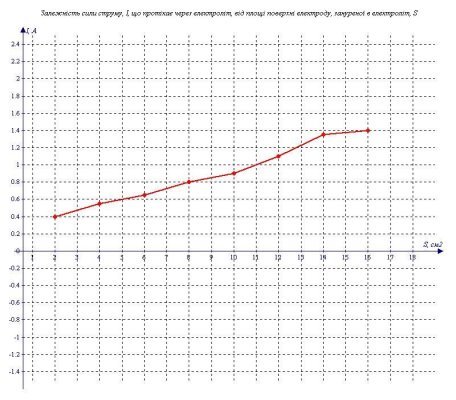
3.3. Як сила струму залежить від площі електродів, зануреної в електроліт?
Для того, щоб дослідити залежність струму від площі електродів, занурених в електроліт, я зібрав електричне коло (мал. 3.1) і налив електроліту стільки, щоб електрод був опущений у воду на 1см. Потім я доливав електроліт так, щоб рівень води піднімався на 1см, і записував дані для кожного рівня води. Щоб обчислити площу пластини електроду, зануреної в електроліт, я зміряв його ширину (2см). Напруга підтримувалася постійною. В ході експерименту отримав наступні результати.
Таблиця 4
"Залежність сили струму, I, що протікає через електроліт, від площі поверхні електроду,
зануреної в електроліт, S"
|
S(см2) |
I(А) |
|
2 |
0,4 |
|
4 |
0,55 |
|
6 |
0,65 |
|
8 |
0,8 |
|
10 |
0,9 |
|
12 |
1,1 |
|
14 |
1,35 |
|
16 |
1,4 |
Я побудував графік залежності I від S, який схожий на пряму пропорційність (див. графік 4). З цього можна зробити висновок, що сила струму прямо пропорційна площі поверхні електроду, зануреної в електроліт.
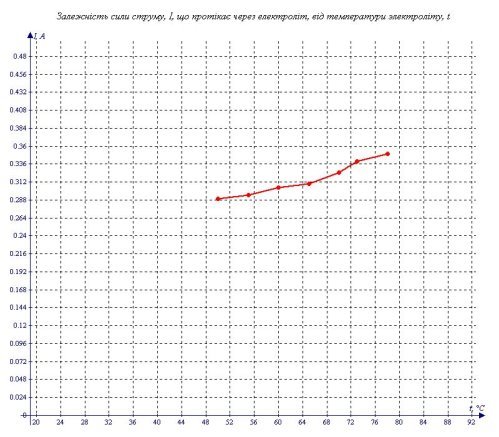
3.4. Як залежить сила струму в електроліті від температури?
Для того, щоб відповісти на це питання, мені потрібно вимірювати силу струму, що протікає через розчини електроліту з різною температурою. Для цього я приготував електроліт при температурі 78ºС і став вимірювати його температуру і силу струму, що протікає через електроліт. Одержаний розчин електроліту остигав і по мірі охолодження, я записував температуру електроліту і силу струму, що протікає через нього.
Протягом експерименту напруга підтримувалася постійною.

Я отримав наступні дані.
Таблиця 5
" Залежність сили струму, I, що протікає через електроліт, від температури електроліту, t."
|
t (°C) |
I (А) |
|
78 |
0,350 |
|
73 |
0,340 |
|
70 |
0,325 |
|
65 |
0,310 |
|
60 |
0,305 |
|
55 |
0,295 |
|
50 |
0,290 |
Я побудував графік залежності I від t, який схожий на пряму пропорційність (див. графік 5). З цього можна зробити висновок, що сила струму прямо пропорційна температурі електроліту.
4. ВИСНОВКИ.
У висновках я хотів би узагальнити отримані результати в ході експериментів.
Метали і електроліти схожі тим, що для них вірний закон Ома. Так само вони схожі залежністю від своїх геометричних характеристик, тобто в металі: чим більша довжина провідника, тим менша сила струму, аналогічно в електроліті, чим більша відстань між електродами, тим менша сила струму.
В металі сила струму прямо пропорційна площі перерізу провідника, так само і в електроліті сила струму прямо пропорційна площі поверхні електроду, зануреної в електроліт.
Так само як і передбачалося, в електроліті сила струму прямо пропорційна температурі електроліту, на відміну від металів.
5. ЛІТЕРАТУРА
- Касаткина И. Л. – Репетитор по физике. изд-во «Феникс», 2005.
- Кирик Л. А. Физика - 8. Методические материалы. – М.: Илекса,2003.
- Коршак Е. В., Ляшенко А, И. – Учебник физики 10 класс. К., ВТФ «Перун», 2004.
- Ландсберг Г. С. – Елементарный учебник физики. М.: изд-во «Наука»,1975.
- Старощук В. А. – Інші 70 дослідів з фізики. Х.: Вид. група. «Основа», 2005.
- Демонстрационный эксперимент по физике в средней школе/ Под ред. А. А. Покровского. – М.: Просвещение, 1978.
- Перышкин А. В. Курс физики. Ч. 2. – М.: Просвещение, 1969.
Додатки
Графік 1
Графік 2
Графік 3
Графік 4
Графік 5


про публікацію авторської розробки
Додати розробку
