Неметали V групи. Нітроген і Фосфор. Будова атомів, їх місце в періодичній системі. Оксиди Нітрогену. Амоніак, будова, властивості, способи добування.
Міністерство освіти і науки України
Вінницький технічний коледж
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
до проведення відкритого заняття з хімії
на тему : « Неметали V групи. Нітроген і Фосфор. Будова атомів, їх місце в періодичній системі. Оксиди Нітрогену. Амоніак, будова, властивості, способи добування, застосування »
Розглянуто і схвалено на засіданні циклової комісії природничо-математичних дисциплін та інформатики
Протокол №___ від ________
Голова циклової комісії
________ Овчар І.М.
Укладач: Вітюк О.І.
Вінниця – 2018 р
Методика проведення заняття
Дисципліна: Хімія
Викладач: Вітюк О.І., викладач першої категорії
Група: 1ЕА1
Тема: Неметали V групи. Нітроген і Фосфор. Будова атомів, їх місце в періодичній
системі. Оксиди Нітрогену. Амоніак, будова, властивості, способи добування,
застосування
Мета:
навчальна: розглянути загальну характеристику неметалів V групи; будову атома та місце розташування нітрогену та фосфору в періодичній системі хімічних елементів Д.І. Менделєєва; властивості оксидів нітрогену; ознайомити студентів зі складом, будовою, властивостями, способами добування та застосування амоніаку
розвиваюча: розвивати у студентів уміння самостійно працювати, порівнювати, робити відповідні висновки, конкретизувати
виховна: виховувати інтерес до дослідницької роботи, бережливе ставлення до природних багатств, до свого здоров'я
Обладнання та матеріали: періодична таблиця хімічних елементів, презентація, амоній дихромат, комп’ютер, амоній хлорид, кальцій гідроксид, стакан з водою, пробірки, лакмусовий папірець, пробірочний штатив
Тип заняття: лекція
Методи навчання: робота в групах, розповідь, «мозковий штурм», лабораторний і демонстраційний експерименти, робота з опорною схемою, фронтальна бесіда, проблемні питання, робота з підручником, складання опорних схем.
Форми роботи: індивідуальна, групова, фронтальна
Прийоми самостійної роботи студентів: спостереження, робота з підручником та опорним конспектом
Міжпредметні зв’язки: фізіологія людини, фізика, безпека життєдіяльності, біологія, історія.
Нові поняття і терміни: « алотропні модифікації », « білий червоний та чорний фосфор »
« амоніак », « фосфорити », « апатити »

Хід заняття
І. Організаційний момент(перевірка присутніх)
ІІ. Актуалізація опорних знань
Перевірка домашнього завдання
Робота біля дошки
1) Розв'яжіть задачу. Згоріла Сірка масою 9,6 г. Газ, що утворився при цьому, пропустили через розчин натрій гідроксиду до утворення середньої солі. Обчисліть її масу.
2) Здійсніть перетворення:
S → SO2 → SO3 → H2SO4 → Na2SO4 → Na3PO4
Мозковий штурм
1.Охарактеризуйте місце розташування Оксигену та Сульфуру в періодичній системі хімічних елементів Д.І. Менделєєва.
2. Які алотропні форми утворює оксиген. Охарактеризуйте їх.
3. Які способи добування Оксигену ви знаєте?
4. Які фізичні властивості має Сульфур?
5. Назвіть алотропні форми Сульфуру.
6. Які оксиди утворює Сульфур? Чим вони відрізняються?
7. Назвіть хімічні властивості Оксигену?
8. Назвіть фізичні властивості Сульфатної кислоти?
9. Що таке явище алотропії ?
10. Які хімічні властивості сульфатної кислоти?
11. Які способи добування сульфатної кислоти ви знаєте?
ІІІ. Мотивація навчальної діяльності
Батько історії – Геродот – стверджував, що жерці Вавілона під страхом смертної казні забороняли простим людям вживати волоські горіхи, вважаючи, що це «божественна їжа», що посилює розумові здатності. Який елемент називають елементом життя і мислення ми з'ясуємо на сьогоднішньому занятті, а також розглянемо елемент, без якого неможливе життя і носить назву «безжиттєвий».
А ще ми вивчимо одну з найпоширеніших та найбільш цінних сполук Нітрогену – амоніак. Це провідна речовина неорганічного синтезу, на основі якої виготовляють цінну народногосподарську продукцію.
Із цим газом людина знайома з давніх часів, він утворюється у великих кількостях під час гниття, розкладання та сухої перегонки нітрогеновмісних сполук, сечовини та білків. На ранніх стадіях еволюції Землі в атмосфері було багато цього газу. Його завжди можна знайти в повітрі, в дощовій воді (він весь час утворюється при розкладанні тваринних і рослинних білків).
Водний розчин цього газу допомагає лікарям виводити людину зі стану запаморочення.
Отже, запишіть у зошиті тему заняття.
ІV. Вивчення нового матеріалу
План
1.Загальна характеристика хімічних елементів V групи, головної підгрупи періодичної системи, будова атома Нітрогену і Фосфору
2. Поширення та історія відкриття Нітрогену та Фосфору
3. Фізичні та хімічні властивості Нітрогену та Фосфору. Алотропні модифікації Фосфору
4. Способи добування та застосування Нітрогену та Фосфору
5. Властивості Оксидів Нітрогену
6. Будова молекули, способи добування амоніаку
7. Фізичні та хімічні властивості амоніаку, застосування
1. Загальна характеристика хімічних елементів V групи, головної підгрупи періодичної системи, будова атома Нітрогену і Фосфору
Нітроген і Фосфор – елементи V групи, головної підгрупи періодичної системи.

На зовнішньому енергетичному рівні їх атоми мають по п'ять електронів - ![]()
тому вищий ступінь окиснення цих елементів дорівнює +5, нижчий -3, характерний також +3.
Метод - робота в групах.
Кожна група отримує завдання на картці, колективно розв’язує його, вибирає одного представника для захисту виконаної роботи. Завдання виконують на виданому великому аркуші паперу у вигляді опорного конспекту.
1. Дайте характеристику Нітрогену і Фосфору за положенням в періодичній системі. Запишіть електронну і графічну формули цих елементів.
2. Чому вони знаходяться в одній групі?
3. Що спільного і відмінного є в будові атомів цих елементів?
4. Яка валентність і ступінь окиснення в Нітрогену і Фосфору?
5.Чи може у них бути збуджений стан і як це вплине на валентність і ступінь окиснення цих елементів?
А тепер поговоримо про прості речовини, утворені Нітрогеном і Фосфором.
Будова молекули Нітрогену.
Молекули нітрогену складаються з двох атомів Нітрогену, з'єднаних за допомогою трьох електронних пар.
Молекулярна формула азоту N2
Електронна формула молекули азоту ![]()
Структурна формула ![]()
Електронна будова зовнішнього енергетичного рівня (електронного шару) атома Нітрогена слідуюча:
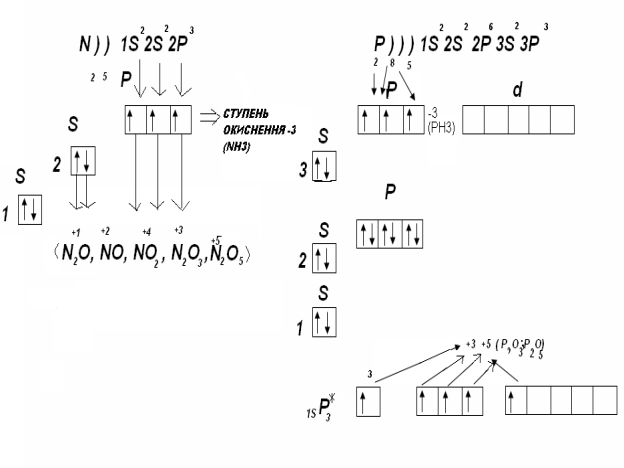
Коли атом Нітрогену з'єднується з атомами більш електронегативних елементів і його 1,2,3,; або всі 5 валентних електронів відтягуються до цих атомів, ступінь окиснення Нітрогену буде відповідно +1,+2,+3,+4 або +5.
Отже нітроген проявляє такі ступені окиснення : -3,0,+1,+2,+3,+4,+5.
Будова молекули фосфору.
Електронна будова зовнішнього енергетичного рівня (електронного шару) атома Фосфору слідуюча:
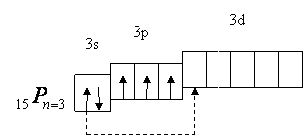
Фосфор — з гр. світлоносний., аналог нітрогену, оскільки електронна конфігурація його валентних електронів, як і у нітрогену, s2p3. Однак порівняно з атомом нітрогену атом фосфору має меншу енергію іонізації і більший радіус. Це означає, що неметалічні ознаки у фосфору виражені слабкіше, ніж у нітрогену. Тому для фосфору рідше буває ступінь окиснення – 3 і частіше +5. Мало характерні й інші ступені окиснення. Прості речовини Фосфору зазвичай є твердими.
Студенти заповнюють таблицю в опорному конспекті .
Заповніть таблицю з використанням ПСХЄ:
|
Властивості хімічних елементів |
Нітроген |
Фосфор |
|
Місце в періодичній системі |
|
|
|
Число електронів на зовнішньому рівні |
|
|
|
Електронна формула |
|
|
|
Число енергетичних рівнів |
|
|
|
Характерні ступені окиснення |
|
|
|
Електронегативність |
|
|
|
Радіус атома |
|
|
|
Формула вищого оксиду |
|
|
|
Сполука з гідрогеном |
|
|
Нітроген і Фосфор елементи головної підгрупи V групи періодичної системи. Мають на останньому енергетичному рівні однакове число електронів, тому проявляють однакові ступені окиснення: вища ступінь окиснення у фосфора та нітрогену дорівнює + 5, нища – 3. В атомі фосфора 3 енергетичних рівня, в атомі нітрогену 2 енергетичних рівня, тому порівнюючи з нітрогеном атом фосфору має більший радіус, менше значення електронегативності, вираженні відновні властивості , а окисні властивості у фосфора послаблюються.
2. Поширення та історія відкриття Нітрогену та Фосфору
(Два студенти виступають з презентацією про поширення та історію відкриття Нітрогену і Фосфору.
- Нітроген :
• Азот N2 - єдина проста речовина Нітрогену;
- є головною складовою частиною повітря (78,09 %);
- міститься в нітратах та солях амонію;
- входить до складу вугілля, нафти ;
- є одним з основних компонентів всіх клітин (білкових сполук, нуклеїнових кислот, алкалоїдів).
- Фосфор:
- загальний вміст фосфору в земній корі становить 0,08 % ;
- постійною складовою частиною живих організмів (рослин і тварин);
• міститься в кістках тварин і людини у вигляді фосфату кальцію
Са3(PO4)2 ;
- входить до складу нуклеїнових кислот та білків;
- вміст фосфору у тканинах мозку становить 0,38 %, у м’язах — 0,27 %.
- найбільше Фосфору міститься в таких продуктах харчування, як м'ясо,
риба, квасоля, яйця.
фосфорит Са3(РО4)2 апатит 3Са3(РО4)2 – СаХ2 (X - F, Сl, ОН).
Історія відкриття Нітрогену
Своєю назвою азот зобов’язаний видатному французькому вченому Лавуазьє. Така назва («безжиттєвий») на думку Лавуазьє, підкреслювала властивість газоподібного азоту не підтримувати горіння та дихання.
Відкрив азот англійський профессор ботаніки і лікар Даніель Резерфорд у 1772 році. Він досліджував повітря ізольованого від атмосфери дзвона, в якому згоряла свічка, або, проживши трохи, гинула миша.
Шведський хімік Карл Шеєле отримав азот з атмосферного повітря тим же шляхом, що і Кавендіш. Він назвав новий газ «зіпсованим повітрям». Шеєле (1775) назвав азот «флогістованим повітрям» (Air phlogisticated). У своїй праці «Хімічний трактат про повітря і вогонь» К. Шеєле описав отримання та властивості повітря і зазначив, що атмосферне повітря складається з двох «видів повітря»: «вогняного» — кисню і «флогістованого» — азоту.
Жульєн Шапталь у своєму підручнику з хімії «Елементи хімії» 1790 року запропонував замінити слово азот — наразі іншою сучасною назвою — гібридним латинським словом nitrogene (нітроген) (від пізньолатинського nitrum — селітра та грецького gennao — народжую, виробляю), посилаючись на те що в 1784 році Генрі Кавендіш показав, що азот входить до складу селітри. Свою пропозицію Шапталь детально мотивував.
Історія відкриття Фосфору
Фосфор відкритий гамбурзьким алхіміком Геннігом Брандом у 1669 році. Подібно до інших алхіміків, Бранд намагався відшукати еліксир життя або філософський камінь, а отримав речовину, яка світиться. Цим відкриттям Бранд не збагатився і продав спосіб отримання Даніелю Крафту (Johann Daniel Kraft), який заробив на цьому маєток.
Трохи згодом фосфор отримав інший німецький хімік - Йоганн Кункель.
Незалежно від Бранда і Кункеля фосфор отримав Роберт Бойль, який описав його в статті «Спосіб приготування фосфору з людської сечі», датованій 14 жовтня 1680 р. та опублікованій 1693р.
Те, що фосфор - проста речовина, довів Антуан Лавуазьє.
Удосконалений спосіб отримання фосфору був опублікований 1743 Андреасом Маргграфом. Існують дані, що фосфор вміли отримувати арабські алхіміки у XII столітті.
3. Фізичні та хімічні властивості Нітрогену та Фосфору. Алотропні модифікації Фосфору
Фізичні властивості Нітрогегу
Нітроген – це газ, що не підтримує ні дихання ні горіння.
- безбарвний
- без запаху
- без смаку
- нерозчинний у воді
- легший за повітря
- t°кип= - 196°С
- t°пл = - 210°С
- У рідкому стані він являє собою безбарвну рідину (схожу на воду) з питомим об'ємом 1,239 дм³/кг (при 195,8 °C за тиску 101,3 кПа) — рідкий азот.

Алотропні модифікації фосфору (Відео).
Заповнити таблицю в опорному конспекті.
Зменшення неметалічності елемента фосфору порівняно з нітрогеном позначається на властивостях його простих речовин. Так, фосфор на відміну від азоту має кілька алотропічних модифікацій: білий, червоний, чорний тощо.
Білий фосфор – це м'яка, схожа на віск речовина, має запах часнику. У чистому вигляді вона безбарвна і прозора.
Білий фосфор є леткою, легкоплавкою (tпл.=44°С) речовиною. Він легко окиснюється на повітрі, що може призвести до самозаймання, тому його потрібно зберігати під водою. При окисненні білий фосфор світиться в темряві – відбувається безпосереднє перетворення хімічної енергії на світлову.
Добувають конденсацією пари фосфору. Не розчиняється у воді, але добре розчиняється у сірковуглеці. За тривалого слабкого нагрівання білий фосфор переходить у червоний. Білий Фосфор має молекулярні кристалічні гратки, побудовані з молекул Р4.
Червоний фосфор – порошок від темно-коричневого до червонного і фіолетового кольору, не отруйний, на повітрі окиснюється повільно, у темряві не світиться, загоряється лише за 260°С. Встановлено, що червоний фосфор представляє собою суміш кількох алотропних модифікацій (видозмін), які різняться одна від одної кольором(від алого до фіолетового) і деякими іншими властивостями. Властивості його великою мірою залежить від способу добування. Під час нагрівання червонного фосфору без доступу повітря він випаровується, а при охолодженні його пара перетворюється на білий фосфор. 
Червоний фосфор застосовують для виготовлення сірників. З нього, сульфіду стибію (ІІІ)![]() , залізного сурику (природного оксиду феруму (ІІІ)
, залізного сурику (природного оксиду феруму (ІІІ) ![]() з домішкою кварцу
з домішкою кварцу ![]() ) і клею виготовляють суміш, яку наносять на бокову поверхню сірникової коробки. Головки сірників складаються з хлорату калію
) і клею виготовляють суміш, яку наносять на бокову поверхню сірникової коробки. Головки сірників складаються з хлорату калію ![]() , молотого скла, сірки та клею. Під час тертя головки по боковій поверхні сірникової коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево.
, молотого скла, сірки та клею. Під час тертя головки по боковій поверхні сірникової коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево.
Одна з реакцій, що відбувається при цьому за участю фосфору, описується схемою:
![]()
Чорний фосфор – найбільш стійка модифікація, утворюється з білого за нагрівання до 220 оС та за дуже високого тиску (1200 атм.). За зовнішнім виглядом він нагадує графіт та є напівпровідником.
Хімічні властивості Нітрогену
Молекула Нітрогену має міцний потрійний зв'язок, для розриву такого зв’язку потрібна значна енергія, тому молекулярний азот виявляє хімічну пасивність і вступає в хімічні реакції за нагрівання у присутності каталізатора й за підвищеного тиску.
1. Взаємодія з металами.
6Li + N2 = 2Li3N (за кімнатної температури)
З іншими металами реагує за нагрівання:
3Mg + N2 = Mg3N2 , утворюючи нітриди.
2. Взаємодія з неметалами.
З воднем азот сполучається за наявності каталізатора, високих температур і тиску, утворюючи аміак:
N2 + 3H2 = 2NH3
N2 + O2 = 2NO
Хімічні властивості фосфору
1.Взаємодія з неметалами.
З киснем фосфор сполучається досить енергійно, особливо білий, виділяючи значну кількість тепла і утворюючи пентаоксид фосфору P2O5:
4P + 5O2 → 2P2O5
під час повільного окиснення утворюється фосфор (ІІІ) оксид
4P + 3O2 = 2P2O3
Взаємодія з хлором, з яким він навіть при невеликому нагріванні енергійно утворює безбарвні кристали пентахлориду фосфору PCl5:
2P + 5Cl2 → 2PCl5
Взаємодія з воднем.
2P + 3H2 → 2PH3
PH3 – отруйний газ, безбарвний, погано розчинний у воді, нестійкий.
2.Взаємодія з металами, утворюючи фосфіди:
2P + 3Ca → Ca3P2
4. Способи добування та застосування Нітрогену та Фосфору
Нітроген одержують у промисловості з рідкого повітря: оскільки азот має найнижчу температуру кипіння з усіх атмосферних газів, із рідкого повітря він випаровується першим.
У лабораторії азот одержують при термічному розкладанні амоній нітриту: NH4NO2 → N2↑ + 2H2O.
Рідше використовують метод розкладу амоній дихромату та окиснення амоніаку: (NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O;
2NH3 + 3CuO → N2 + 3Cu + 3H2O.
Демонстрація досліду: «Хімічний вулкан »
Фосфор у промисловості одержують прожарюванням суміші подрібненого фосфориту або апатиту з піском та вугіллям у електричних печах за температури 15000С без доступу повітря:
Сa3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO↑.
Застосування Нітрогену та Фосфору.
Застосування Нітрогену
Нітроген застосовують у виробництві добрив, вибухових речовин, нашатирного спирту, який використовують у медицині. Азотні добрива є найбільш цінними. До таких добрив відноситься аміачна селітра, сечовина, аміак, натрієва селітра. Азот є невідємною частиною білкових молекул, тому він і необхідний рослинам для нормального росту та розвитку.
Рідкий азот використовується для створення низьких температур, ним охолоджують різні ємкості і обладнання.
Застосування Фосфору
Основну частину видобутого фосфору витрачають на одержання термічної фосфорної кислоти, яка використовується при виробництві добрив і фосфатів. Білий фосфор застосовують як димоутворювальною і запальне засіб, в тому числі і для трасуючих боєприпасів.
Червоний використовують для виготовлення запальною поверхні сірникової коробки, а у виробництві ламп розжарювання він виступає як газопоглинач.
Фосфор знайшов своє застосування і в металургії. Його використовують як добавки для отримання легованих сплавів, припоїв, магнитомягких і антифрикційних сплавів. В суміші з товченим склом і клеєм червоний фосфор наносять на бічні поверхні сірникових коробок. До складу головок сірників фосфор не входить. Вони виготовляються з суміші хлорату калію KClO3, діоксиду мангану MnO2, сірки, товченого скла і клею.
5. Властивості Оксидів Нітрогену
Індивідуальна самостійна робота з підручником з наступною колективною перевіркою. Прочитайте текст підручника і охарактеризуйте фізичні властивості оксидів нітрогену заповнюючи таблицю №3 в опорному конспекті.
Нітроген здатний утворювати п'ять оксидів . N2O, NO, N2O3, NO2 і N2O5
Із вищенаведених оксидів тільки N2O і NO є несолетворними, всі інші – солетворні (кислотні).
Усі нітроген оксиди отруйні.
Оксид N2O має наркотичні властивості, які на початковій стадії позначаються ейфорією, звідси й назва — «звеселяючий газ» використовується в медицині для наркозу.
Оксид NO2 ,бурий газ з різким запахом, отруйний подразнює дихальні шляхи і слизові оболонки очей. Шкідливий наслідок хімічного виробництва, він потрапляє в атмосферу у вигляді «лисячого хвоста» — червоно-брунатного забарвлення.
Оксид NO – газ без кольору і запаху погано розчиняється у воді.
Оксид N2O3 – темно-синя рідина.
N2O5 - за звичайних умов є білою кристалічною речовиною, що повільно розкладається та сублімує за 33 °C. Сполука проявляє сильні окисні властивості.
Оксиди NO і NO2 є одними з найважливіших сполук Нітрогену.
Нітроген (ІІ) оксид - безбарвний газ, який слабко розчиняється у воді.
NO - несолетворний оксид, хімічно інертний щодо води, кислот і лугів.
За звичайних умов він реагує з киснем, перетворюючись на нітроген (ІV) оксид: 2NO + O2 = 2NO2
Нітроген (IV) оксид - газ бурого кольору, з неприємним, задушливим запахом.
Він належить до солетворних, кислотних оксидів і має хімічні властивості, характерні для цього класу речовин.
NO2 реагує з водою з утворенням двох кислот - нітритної і нітратної:
2NO2 + H2O → HNO2+HNO3
З лугами NO2 утворює солі названих кислот - нітрити і нітрати.
Наприклад: 2NO2 + 2NaOH→NaNO2 + NaNO3 + H2O
При розчиненні NO2 у воді в надлишку кисню утворюється тільки нітратна кислота:
4NO2 + O2 + 2H2O → 4HNO3
NO2 розкладається на азот і кисень на каталізаторі - паладованому оксиді алюмінію: ![]()
NO і NO2 є проміжними продуктами в промисловому синтезі нітратної кислоти з аміаку, яка у великих кількостях добувається і використовується хімічною промисловістю.
6. Будова молекули та способи добування амоніаку.
Молекула NH3 має структуру трикутної піраміди з атомом Нітрогену у вершині. Хімічний зв’язок утворюється шляхом перекривання s-орбіталей трьох атомів Гідрогену і трьох р-орбіталей Нітрогену. р-хмари перпендикулярні, але кут між зв’язками перевищує 90°, тому що електронні хмари атомів Гідрогену відштовхуються й утворюють кут зв’язку 107°. Довжина зв’язку N - H становить 1,01 А.
Способи добування амоніаку.
Демонстрація досліду. Одержання амоніаку й розчинення його у воді.
1.У лабораторії амоніак одержують за схемою: Дія лугів на солі амонію:
Сa(OH)2 + 2NH4CI → CaCI2 + 2NH3 ↑+ 2H2O
Як зібрати амоніак ? (Газ легший за повітря, отже, його можна зібрати, витісняючи повітря з перевернутої пробірки).
Пробірку з амоніаком занурюємо у воду дном догори.
Чому рівень води піднімається у пробірці? (Амоніак розчиняється у воді)
Якого забарвлення набуває у водному розчині амоніаку лакмус? Чому?
Запишіть рівняння дисоціації амоній гідроксиду:
NH3 + HOH ![]() NH4OH
NH4OH ![]() NH4+ + OH-
NH4+ + OH-
Викладач. Отже, ви бачете, що амоніак добре розчинний у воді й має лужну реакцію середовища.
Проблемне питання.
Як пояснити, що реакція середовища лужна?
(Очікувана відповідь: під час розчинення амоніаку у воді відбувається хімічна реакція. У результаті цієї хімічної реакції утворюється речовина амоній гідроксид, яка належить до слабких і нестійких основ. Гідроксид- іони обумовлюють лужне середовище, лакмус набуває синього забарвлення).
2. У промисловості амоніак одержують прямим синтезом з нітрогену та гідрогену за схемою: N2 + 3H2 → 2NH3 + 92,4 кДж (t° = 450 °C, Р = 800 атм, kat)
7. Фізичні та хімічні властивості амоніаку.
Фізичні властивості: безбарвний газ із різким задушливим запахом, добре розчинний у воді внаслідок утворення між NH3 і H2O водневих звязків (до 700 л амоніаку в 1 л води). Температура плавлення дорівнює —77,7 °С, температура кипіння - 33,4 °С, при температурі нижче за 33,40С переходить у рідкий стан. Вражає слизові оболонки очей і дихадльних шляхів.
Хімічні властивості амоніаку
Як відновник амоніак
1.Взаємодіє з киснем (повне окиснення)
4NH3 + 3О2 → 6H2О + 2N2
Зверніть увагу на те, що суміш амоніаку й кисню внаслідок нагрівання може вибухати!
Неповне окиснення в присутності каталізатора (kat — Pt, Fe2О3, Cr2О3):
4NH3 + 5О2 → 4NО + 6H2О
2.Взаємодія з водою утворюючи аміачну воду (амоній гідроксид):
NH3 + HOH → NH4OH
Лужна реакція середовища, але в розчині лише невеликка частина молекул NH3 перетворюється на іони амонію NH4+. Тому аміачна вода пахне амоніаком. Формула амоніачної води: NH3×H2O. Її називають амоній гідроксидом або нашатирним спиртом (10% розчин амоніаку).
Утворюється ковалентний зв’язок за донорно-акцепторним механізмом:
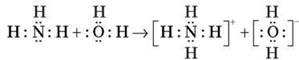
У розчині амоніаку індикатори змінюють колір: лакмус — на синій, фенолфталеїн — на малиновий, що вказує на лужне середовище розчину амоніаку.
3.Для амоніаку характерні реакції приєднання з утворенням іона амонію.
Демонстрація досліду «Дим без вогню». Взаємодія амоніаку з кислотами:
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4
Робота біля дошки
Розв'яжіть задачу.
Під час пропускання амоніаку через концентровану хлоридну кислоту, утворилась сіль масою 21,4 г. Обчісліть об’єм амоніаку (н.у.), який прореагував. (Відповідь: V(NH3 = 6,8 л.)).
V. Узагальнення і систематизація знань
Бліц-опитування (червоні картки - Фосфор, зелені картки – Нітроген, жовті картки - Амоніак)
1. Елемент V групи, складова білків (Нітроген).
2. Газ – безбарвний, легший за повітря із різким задушливим запахом (Амоніак).
3. Має алотропні модифікації (Фосфор).
4. Газ, що взаємодіє з кислотами утворюючи солі амонію (Амоніак).
5. Утворює оксиди, які мають ступінь окиснення від + 1 до + 5 (Нітроген).
6. Елемент, який при взаємодії з металами утворює фосфіди (Фосфор).
7. Який елемент має потрійний зв'язок? (Нітроген).
8. Елемент V групи, що входить до складу зубів (Фосфор).
9. Сполука, яка добре розчинна у воді і має назву нашатирний спирт (Амоніак).
10. Який елемент називають елементом життя і мислення? (Фосфор).
11. Речовина, що входить до складу сірників (Червоний фосфор).
12. Речовина, що утворює солі амонію (Амоніак).
VІ. Підбиття підсумків
Викладач. Ви всі дуже добре сьогодні працювали, особливо хочу відмітити роботу…(називає прізвища студентів), які активно працювали на занятті.
Оцінювання студентів.
VІІ. Домашнє завдання
1) Розв'яжіть задачу. Газ, що утворився під час повного згоряння амоніаку об’ємом 17, 92 л (н.у.), прореагував з магнієм за нагрівання з утворенням магній нітриду. Обчисліть масу та кількість речовини утвореного продукту.
2) Напишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
N2 → NH3→ NO → NO2 →HNO3 → NH4NO3→ (NH4)3PO4
- Творче завдання за бажанням (для студентів з високим рівнем знань).
Від взаємодії газу А з одним з компонентів повітря С (в присутності каталізатора і при високій температурі) утворюється безбарвний газ Б з різким запахом. У результаті його каталітичного окиснення утворюється газ В, що швидко окислюється до газу Г бурого кольору. Під час розчинення газу Г у воді в присутності кисню утворюється рідина Д, яка реагує з міддю, утворюючи газ Г. При реакції Д з Б утворюється речовина Е, яка застосовується у сільському господарстві. Напишіть рівняння реакцій.
Відповідь: (Речовина А –водень; С – нітроген; Б – амоніак; В – моно оксид нітрогену; Г – діоксид нітрогену; Д –нітратна кислота; Е – нітрат амонію).
Література
1. Хімія 10 клас: Розробки уроків / Т. М. Гранкіна, О.В. Григорович. – Вид.2-ге, випр..- Х.:
“Ранок”, 2007. – 320 с.
2. Хімія 9 клас: Плани-конспекти уроків / О.В. Григорович, А.В. Віценцик, О.М. Гостиннікова. - Х.: “Ранок”, 2009. – 320 с.
3. Хімія: Задачі, вправи, тести / Я.М. Каличак, В.В. Кінжибало, Б.Я. Котур та ін.– Л.: Світ, 2001.– 175 с.
4. Хомченко Г.П. Збірник задач з хімії для вступників до вищих навчальних закладів. – К.: Арій, 2008. – 320 с.
5. Цветкова Л.Б. Загальна хімія: Теорія і задачі: Навч. посібник. Ч. I. – Л.: “Магнолія – 2006”, 2007. – 398 с.
6. Хімія: Довідник для абітурієнтів та школярів загальноосвітніх навчальних закладів; навчально-методичний посібник. – К. : Літера ЛТД, 2009. – 464 с.
Опорний конспект з хімії
Тема: Неметали V групи. Нітроген і Фосфор. Будова атомів, їх місце в періодичній системі. Оксиди Нітрогену. Амоніак, будова, властивості, способи добування, застосування
Завдання № 1. Заповніть таблицю з використанням ПСХЄ:
|
Властивості хімічних елементів |
Нітроген |
Фосфор |
|
Місце в періодичній системі |
|
|
|
Число електронів на зовнішньому рівні |
|
|
|
Електронна формула |
|
|
|
Число енергетичних рівнів |
|
|
|
Характерні ступені окиснення |
|
|
|
Електронегативність |
|
|
|
Формула вищого оксиду |
|
|
|
Сполука з гідрогеном |
|
|
Завдання № 2. Алотропні модифікації Фосфору
|
Алотропні модифікації фосфору |
||
|
Білий фосфор |
Червоний фосфор |
Чорний фосфор |
|
|
|
|
Завдання № 3. Фізичні властивості Оксидів Нітрогену
|
Ступінь окиснення |
Формула |
Фізичні властивості |
|
|
N2O |
|
|
|
NO |
|
|
|
NO2 |
|
|
|
N2O3 |
|
|
|
N2O5 |
|
Зразок опорного конспекту:
![]()
 Вища вал. III + 7 N 1s22s22p3 Вища вал.V. +15Р 1S22S22p63S23p33d0
Вища вал. III + 7 N 1s22s22p3 Вища вал.V. +15Р 1S22S22p63S23p33d0


 N P
N P
![]()
![]()
![]()
![]() Ст. окиснення Проста реч. Ст. окиснення Алотропні модифікації
Ст. окиснення Проста реч. Ст. окиснення Алотропні модифікації
![]()
![]()
![]() -3 до +5 N2
-3 до +5 N2
Білий Червоний Чорний
P4 P P


про публікацію авторської розробки
Додати розробку


