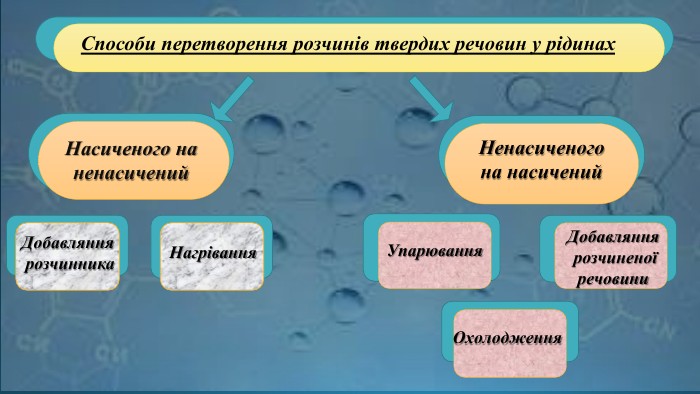
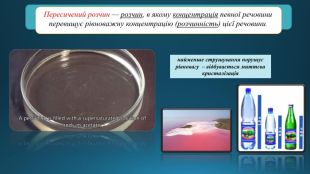
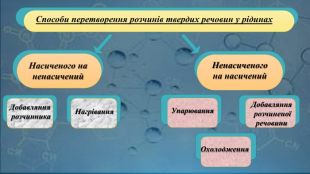
Ненасичені й насичені, концентровані й розведені розчини
Про матеріал
Мета: продовжити збагачувати свої знання з теми «Розчини», ознайомити учнів з класифікацією розчинів, навчити відрізняти концентровані й розведені розчини від насичених і ненасичених; розвивати вміння порівнювати, аналізувати, робити висновки; виховувати працелюбність, повагу до вчителя, інтерес до предмету. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку