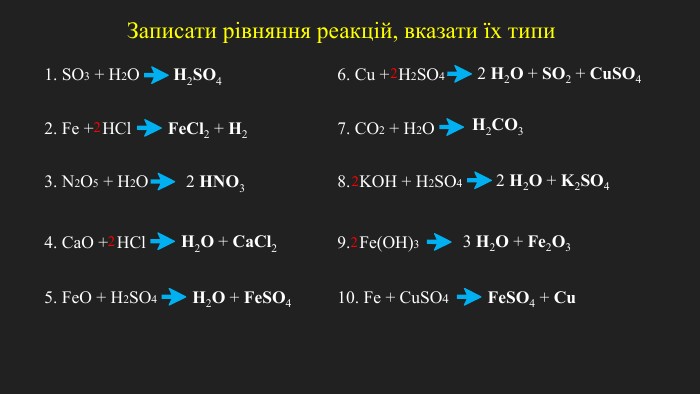
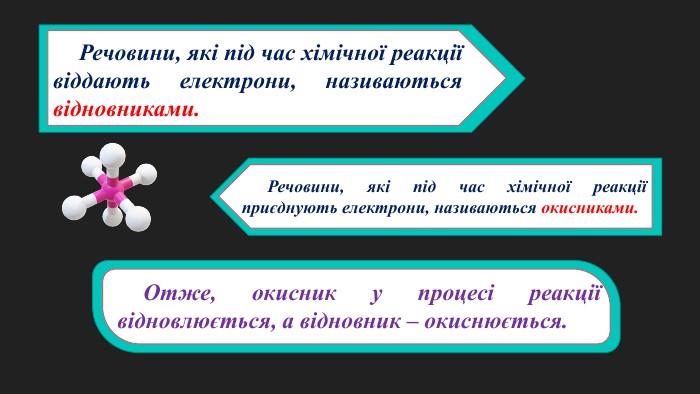
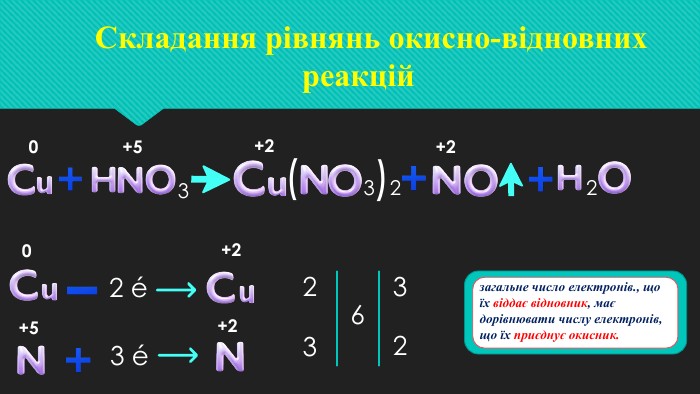
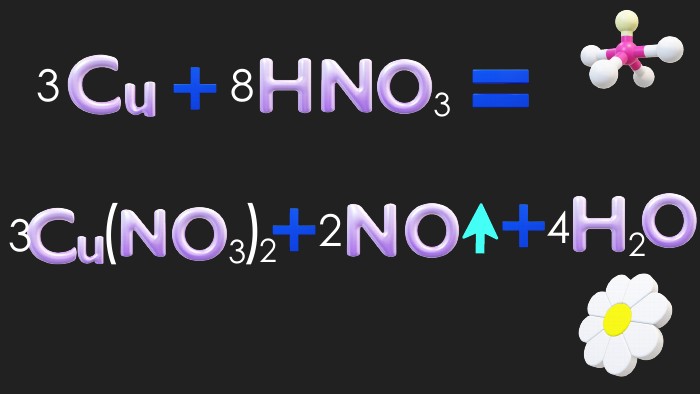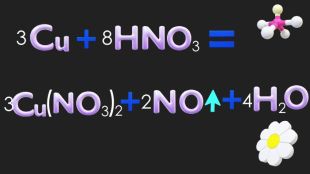Окисно-відновні реакції. Процеси окиснення, відновлення, окисники, відновники
Про матеріал
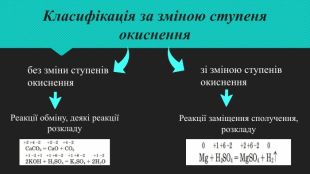
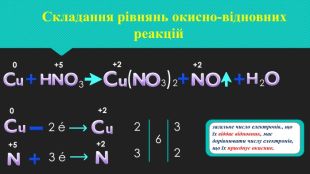
Мета: навчити учнів самостійно систематизувати знання про класифікацію хімічних реакцій за ознакою зміни ступеня окиснення елемента; ознайомитися з поняттям «окисник», «відновник», «окисно-відновна реакція»; розвивати вміння розрізняти процеси окиснення; виховувати цікавість до окисно-відновних процесів в природі, промисловості, побуті. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку