Неорганічні речовини
Про матеріал
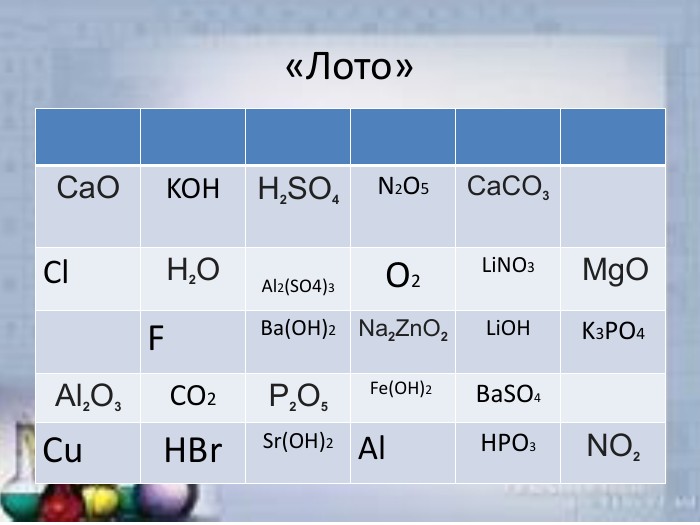
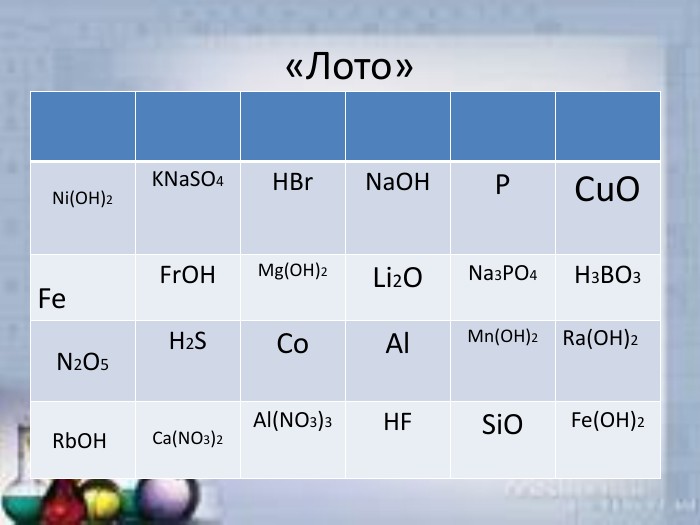
Презентація "Неорганічні речовини" (гра) допоможе урізноманітнити урок. презентацію можна використати як елемент уроку, щоб перевірити знання учнів про оксиди, кислоти, солі та основи. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку