Нітрогеновмісні сполуки: аміни, амінокислоти, білки.
Навчально-методична картка
Заняття 56-57
Предмет: хімія
Тема: Нітрогеновмісні сполуки: аміни, амінокислоти, білки.
Мета:
а) навчальна: ознайомити студентів з класифікацією нітрогеновмісних органічних сполук, розглянути особливості будови, ізомерії, номенклатури, властивостей та застосування нітрогеновмісних органічних сполук; вміти пояснювати зв’язок між будовою речовини та її властивостями, вміти розрізняти органічні речовини за наявністю функціональної групи та характерними реакціями; уміти користуватися органічними сполуками з урахуванням їх токсичності .
б) виховна: сприяти виникненню зацікавленності до предмету і через нього розбудити найкращі людські якості: працьовитість, наполегливість, допитливість, творчість, вихрвувати екологічну культуру.
Тип заняття : вивчення нового матеріалу..
Методи навчання: роповідь, бесіда(евристична)
Оснащення: таблиця амінокислот, мультимедійна схема структури білкової молекули.
Структура заняття
1 Організаційний момент - 2 хв.
2. Перевірка домашнього завдання -10 хв.
3. Актуалізація опорних знань - 5 хв.
4. Вивчення нового матеріалу - 50 хв.
5. Засвоєння знань - 10 хв.
6. Підведення підсумків - 2 хв.
7. Домашнє завдання - 1 хв.
Хід заняття
1 Організаційний момент.
2. Перевірка домашнього завдання.
3. Актуалізація опорних знань.
Бесіда :
1.Мономерами яких органічних полімерів є амінокислоти ?
2.Які елементи входять до складу амінокислот ?
3. Яким шляхом організм людини одержує амінокислоти ?
4. У яких біологічних процесах беруть участь амінокислоти .
4. Вивчення нового матеріалу.
В органічних сполуках Нітроген міститься:
• у структурі карбонового ланцюга;
• у складі функціональних груп (наприклад, нітрогрупи, аміногрупи).
Відомо безліч природних і синтетичних органічних сполук, що містять у своєму складі атоми Нітрогену.
У цій темі ми розглянемо важливі нітрогеновмісні сполуки — аміни (R – NH2). Щоб краще зрозуміти будову і властивості цих сполук, необхідно згадати електронну будову атома Нітрогену й дати характеристики його хімічним зв’язкам з іншими атомами (Гідрогеном, Карбоном, Оксигеном).
АМІНИ
Аміни — похідні амоніаку, що утворюються в результаті заміщення атомів Гідрогену на вуглеводневі радикали.
Залежно від числа радикалів розрізняють аміни:
• первинні (R - NH2);
• вторинні (R - NH - R');
• третинні (R – NR – R).
Атом Нітрогену в NH3 і амінах перебуває в стані sp3-гібридизації. Три такі орбіталі перекриваються з 1s-орбіталями атомів Гідрогену або sp3-орбіталями атома Карбону радикала й утворюють три σ-зв’язки, а четверта sp3-орбіталь виявляється зайнятою вільною електронною парою атома Нітрогену.
Номенклатура
Складаючи назву, перелічують радикали з додаванням закінчення -амін:
CH3 – CH – NH2
│
CH3
ізопропіламін
Ізомерія
1) Ізомерія карбонового скелета (починаючи з бутиламіну).
2) Ізомерія положення аміногрупи (починаючи з пропіламіну).
Фізичні властивості:
За звичайної температури лише нижчі аліфатичні аміни CH3NH2, (CH3)2NH і (CH3)3N — гази (із запахом амоніаку), середні гомологи — рідини (з різким рибним запахом), вищі — тверді речовини без запаху. Ароматичні аміни — безбарвні рідини з високою температурою кипіння або тверді речовини. Нижчі аміни добре розчинні у воді й мають різкий запах. Зі збільшенням молекулярної маси збільшуються температури кипіння і плавлення, зменшується розчинність у воді.
Зв’язок N - H є полярним, тому первинні та вторинні аміни утворюють міжмолекулярні водневі зв’язки (трохи більш слабкі, ніж Н-зв’язки за участі групи O – H).
Третинні аміни не утворюють водневих зв’язків, що створюють асоціації (відсутня група N - H). Тому їхні температури кипіння нижчі, ніж в ізомерних первинних і вторинних амінів (триетиламін кипить за температури 89 °С, а н-гексиламін — за 133 °С).
Порівняно зі спиртами аліфатичні аміни мають нижчі температури кипіння (t°кип метиламіну - -6 °С, t°кип метанолу - +64,5 °С). Це свідчить про те, що аміни асоційовані меншою мірою, ніж спирти, оскільки міцність водневих зв’язків з атомом Нітрогену менша, ніж за участі більш електронегативного Оксигену.
Хімічні властивості амінів
1) Горіння
Аміни згоряють у кисні, утворюючи азот, вуглекислий газ і воду.
4C2H5NH2 + 15O2 →8 CO2 + 14 H2O + 2N2
2) Властивості амінів як основ (акцепторів протонів)
Водні розчини аліфатичних амінів дають лужну реакцію, тому що внаслідок їх взаємодії з водою утворюються гідроксиди алкіламонію, аналогічні амоній гідроксиду:
Н H
│ │
Н — N : + Н — О — Н ↔ [ H – N+ – H ]OH-
│ │
H H
амоній гідроксид
Зв’язок протона з аміном, як і з амоніаком, утворюється за донорно-акцепторним механізмом за рахунок неподіленої електронної пари атома Нітрогену.
Аліфатичні аміни — сильніші основи, ніж амоніак, оскільки алкільні радикали збільшують електронну густину на атомі Нітрогену. З цієї причини електронна пара атома Нітрогену утримується менш міцно й легше взаємодіє з протоном.
3) Взаємодія з кислотами
Взаємодіючи з кислотами, аміни утворюють солі:
Н H
│ │
Н3С — N : + Н — Cl ↔ [ H3С – N+ – H ]Сl
│ │
H H
метиламоній хлорид
Солі амінів — тверді речовини, добре розчинні у воді. Унаслідок нагрівання лугу витісняють із них аміни:
[CH3NH3]Cl + NaOH → CH3 NH2 +NaCl + H2O
Отже, головні властивості змінюються в ряду:
NH3< RNH2 < R2NH < R3N (у газовій фазі)
4) Окиснення амінів
Аміни, особливо ароматичні, легко окислюються на повітрі. На відміну від амоніаку, вони здатні запалюватися від відкритого полум’я.
4 CH3NH2 + 9 O2 → 4 CO2 + 10H2O + 2N2
Застосування амінів
Аміни використовують для одержання лікарських речовин, барвників і вихідних продуктів для органічного синтезу. Гексаметилендіамін у процесі поліконденсації з адипіновою кислотою дає поліамідні волокна.
АМІНОКИСЛОТИ
Амінокислоти — це органічні речовини, які містить вуглеводевий радикал сполучний з двома функціональними групами — карбоксидною та аміно групою.
R – COOH
│
NH2
CH2 – COOH
│
NH2
амінооцтова(гліцин)
Фізичні властивості: безбарвні, кристалічні речовини, що плавляться і розкладаються при високих температурах (більше 2500), легкорозчинні у воді, нерозчинні у ефірі, багато з них солодкуватого смаку.
Поширення в природі: входять до складу білкових молекул, найчастіше 22 амінокислоти, які мають, в положені α — амінокислоти.
Номенклатура та ізомерія амінокислот:
залежно від взаємного розрашування карбоксильної і аміногрупи розрізняють α,β,γ,δ,ε амінокарбонові кислоти.
Хімічні властивості:
І. Подібні до карбонових кислот
1. 2СН2 — СООН + Na → 2СН2 — СООNa +H2
│ │
NH2 NH2
2. СН2 — СООН + NaOH → СН2 — СООNa +H2O
│ │
NH2 NH2
3. 2СН2 — СООН + Na2O → 2СН2 — СООNa +H2O
│ │
NH2 NH2
4. 2СН2 — СООН + Na2CO3 → 2СН2 — СООNa +H2O + CO2
│ │
NH2 NH2
5. СН2 — СООН + C2H5OH → СН2 — СООC2H5 +H2O
│ │
NH2 NH2
ІІ. Як основа реагує з кислотами
СН2 — СООН + НCl → [СН2 — СООH]Cl
│ │
NH2 NH3
HCl∙NH2 – CH2 – COOH
ІІІ. Проявляють амфотерні властивості, реагуючи між собою з утворенням пептидних або аміних зв'язків.
СН2 — СООН +СН2 — СООН +СН2 — СООН →
│ │ │
NH2 NH2 NH2
Значення:
- Для побудови білків організму.
- В медицині, як лікувальний засіб.
- В с/г, для відгодівлі тварин.
- Для виробництва синтетичних волокон, капрону та енанту.
Добування амінокислот:
- Гідролізом білкових молекул.
- Синтетичний з карбонових кислот через їх галогенопохідні
СН3 — СООН →СН2Сl – COOH → CH2NH2 – COOH
БІЛКИ
Чому білки? Назва «білки» походить від відомого з давніх-давен яєчного білка (лат. albumen), який унаслідок нагрівання перетворюється, на білу нерозчинну масу. Згідно з описами Плінія Старшого, уже в Стародавньому Римі яєчний білок застосовували як лікувальний засіб. Однак справжня історія білкових речовин розпочалася тоді, коли з’явилися відомості про хімічні властивості білків. Найважливіша з-поміж них - здатність до гідролізу.
Гідроліз білків - реакція, за допомогою якої з них було добуто амінокислоти. Ви звичайно, пам'ятаєте, що саме в такий спосіб відкрито й найпростішу з них - амінооцтову. Унаслідок гідролізу руйнуються пептидні зв'язки між амінокислотними залишками. Тобто реакція гіддролізу білків обернена до реакції їхнього утворення з амінокислот. Виявлення амінокислот у продуктах гідролізу білків мало вирішальне значення для розуміння хімічної природи білкових полімерів.
Склад і будову білків науковці намагалися означити чи не з XVII ст. Крок за кроком просувалися вони до мети - створення теорії будови білка. Зокрема, думку про амінокислотний склад білків висловлював
І. Я. Горбачевський (мал.1). Він одним з перших виділив у чистому вигляді амінокислоти і попалав, що вони є «будівельними цеглинками» білків.

Малюнок 1. Горбачевський І.Я.
Зрештою в 1902 р. Е. Фішер (мал.2) сформулював пептидну гіпотезу, згідно з якою білки побудовані з амінокислотних залишків, з'єднаних пептидними зв'язками.

Малюнок 2. Фішер Е.Г.
Він висловив припущення, що амінокислоти, які утворюються внаслідок гідролізу білків, є для них найпростішим «будівельним матеріалом». Науковець експериментально довів, що амінокислоти сполучаються між собою в результаті взаємодії карбоксильних і аміногруп з виділенням води та утворенням поліпептидів. Він започаткував синтез поліпептидів і одержав білкову речовину з відносною молекулярною масою 1213 - першу синтетичну сполуку, подібну до найпростіших білків. Отже, пептидну гіпотезу було повністю підтверджено аналізом білків і синтезом їх з амінокислот. Таким чином, подальше вивчення будови білків дістало міцне теоретичне підґрунтя.
Значення білкових речовин для організму:
- Будівельна.
- Захисна.
- Сигнальна.
- Рухова.
- Запасаюча.
- Поживна.
- Транспортна.
- Енергентична.
- Регуляторна.
- Фермантативна.
Склад білка: Карбон (51-55%), Оксиген(від 22-24%), Нітроген(15-18%), Гідроген(6-7%), Сульфур(0,5-3%).
Білки мають великі молекулярні маси: білок інсулін — 6000 одиниць, альбомін — 45000 одиниць, глобін гемоглобіну — 60-70 тисяч, вірус тютюнової мазайки — 41 мільйон.
Первинна структура — визначається послідовністю α-амінокислотних залишків у поліпептидному ланцюгу. послідовність амінокислотних залишків поліпептидному ланцюзі. Виявлено, що певна комбінація амінокислот зумовлює специфічні функції білка в організмі. Тож за первинною структурою можна передбачити функції невідомого білка. Або, навпаки синтезувати білкову речовину з потрібними функціями. Первинні структура білка виникає внаслідок утворення пептидних зв'язків мін: амінокислотними залишками.
Вторинна структура — це конфермація поліпептидного ланцюга закріплена множиною водневих зв'язків між групами у спіраль. Місцеве впорядкування фрагмента поліпептидного ланцюга внаслідок утворення водневих зв'язків (мал.3). Яке полярні групи фрагментів первинної структури віддалені одна від одно: утворюються складчасті шари з кількох зигзагуватих поліпептидних ланцюгів. Якщо ж полярні групи фрагментів первинної структури розташовані близько, утворюється так звана а-спіраль один виток якої містить чотири амінокислотні залишки.
Уперше таку структуру виявив Лайнус Лолінг під час вивчення методом рентгеноструктурного аналізу головного білка волосся й вовни - α-кератину, її назвали α-структурою, або α-спіраллю. Також можливе утворення клубка біополімеру іншої форми.
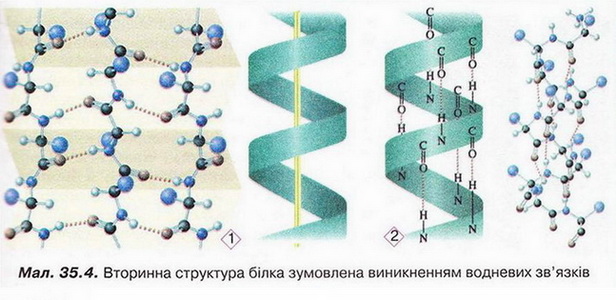
Малюнок 3. Вторинна структура білка
Третина структура — це форма закрученої спіралі у просторі у клубок конфігурація якого підтримується за рахунок дисульфідних зв'язків, водневих зв'язків, гідрофобних та йонних взаємодій. просторова будова поліпептидного ланцюга, зумовлена взаємним розташуванням елементів вторинної структури. Третинна структура стабілізована насамперед ковалентними зв'язками, які виникають унаслідок взаємодії між функціональними групами різної хімічної природи. Неабияку роль у виникненні й підтриманні третинної структури відіграють електростатичні сили притягання й відштовхування та водневі зв'язки.
Четвертина структура — це агрегати кількох білкових макромолекул утворених за рахунок взаємодії різних поліпептидних ланцюгів. Гемоглобін - перший білок, в якого було виявлено четвертинну структуру. Четвертинна структура гемоглобіну складається з чотирьох макромолекул. Вони утворюють надмолекулярну структуру сферичної форми. її функція - транспортування кисню в живих організмах.
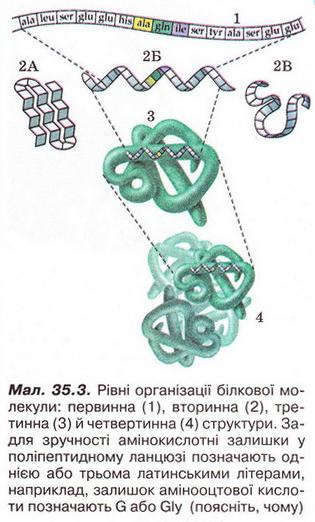
Малюнок 34 Структурні рівні організації білка
Властивості білків:
1. Залежно від значення відносної молекулярної маси білки мають різну розчиність.
2. Здатність до гідролізу.
3. Денатурація — це повне руйнування просторової структури білка, яке призводить до втрати біологічної активності. Денатурація відбувається під дією солей важких металів, дії високої температури радіоактивного випромінювання, дії кислот, лугів, навіть сильно механічног острушування.
4. Кольорові реакції білків:
а) Біуретова — це утворення фіолетового забарвлення при дії на білок лугу і декількох крапель купрум сульфату.
б) Ксантопротеїнова — це поява жовтого забарвлення при дії на білок з ароматичним ядром, концентрованої нітратної кислоти, а при додавані лугу жовтий колір переходить в оранжевий.
в) Цистеїнова — це утворення чорного осаду плюмбум сульфіду при кип'ятінні білка, що містить сульфур з лцгом і додавані плюмбум ацетату.
г) Мілонова — це утворення червоного забарвлення при кип'ятіні білка з реактивом мілона (меркурій(ІІ) нітрату та нітратної кислоти).
5. Засвоєння знань.
1. Який об'єм амоніаку потрібно пропустити крізь розчин хлороцтової кислоти масою 600 г з масовою часткою кислоти 20% для її повного перетворення на амінооцтову. (зошит 11 клас)
2. Як можна добути феніламін виходячи з метану?(зошит 11 клас)
3. Який об'єм розчину лугу, що містить 15% калій гідроксиду з густиною 1,14г/мл необхідний для нейтралізації амінокислоти, добутої з кальцій карбіду масою 12,8 г.(зошит 11 клас)
6. Підведення підсумків.
7. Домашнє завдання.
§13-15 ст.59 №111,
1. здійснити ланцюжок перетворення
метан → ацетилен → бензен → хлоробензен → анілін →2,4,6 — три бромоанілін
2. Визначте в якій із речовин — амоніаку, метиламіні, аніліні чи амінооцтовій кислоті — масова частка Нітрогену більша. Відповідь підтвердіть необхідними розрахунками.(гога ст.316 №12.2.1)


про публікацію авторської розробки
Додати розробку
