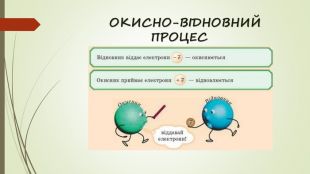
Окисно-відновні реакції. Гальванічні елементи
Можна використовувати для вивчення теми "Окисно-відновні реакції', "Гальванічні елементи", під час уроків повторення та для підготовки до ЗНО. Містить тести ЗНО попередніх років з цієї теми.


















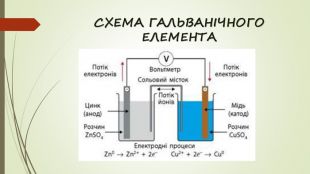
![ЕЛЕМЕНТ ЯКОБІ ДАНІЕЛЯЦинк більш активний відновник і легше віддає електрони, ніж мідь. Відбувається спрямований рух електронів від цинкової пластинки (аноду) до мідної (катоду) [Під час процесу електролізу заряд електродів - протилежний] Одночасно на цинковому електроді виникає нестача електронів, завдяки чому рівновага, що встановилася на ньому, зміщується в бік утворення йонів Zn2+: Zn0 → Zn2+ + 2e-А на мідному електроді виникає надлишок електронів, і рівновага зміщується в бік осадження йонів Cu2+ на пластинці: Cu2+ + 2e- → Cu0 Сумарний процес, що відбувається на двох електродах, можна зобразити рівнянням: Zn0 + Cu2+ → Cu0 + Zn2+Схема гальванічного елемента(Анод -) Zn | Zn2+ || Cu2+ | Cu (Катод+) ЕЛЕМЕНТ ЯКОБІ ДАНІЕЛЯЦинк більш активний відновник і легше віддає електрони, ніж мідь. Відбувається спрямований рух електронів від цинкової пластинки (аноду) до мідної (катоду) [Під час процесу електролізу заряд електродів - протилежний] Одночасно на цинковому електроді виникає нестача електронів, завдяки чому рівновага, що встановилася на ньому, зміщується в бік утворення йонів Zn2+: Zn0 → Zn2+ + 2e-А на мідному електроді виникає надлишок електронів, і рівновага зміщується в бік осадження йонів Cu2+ на пластинці: Cu2+ + 2e- → Cu0 Сумарний процес, що відбувається на двох електродах, можна зобразити рівнянням: Zn0 + Cu2+ → Cu0 + Zn2+Схема гальванічного елемента(Анод -) Zn | Zn2+ || Cu2+ | Cu (Катод+)](/uploads/files/258605/182063/194697_images/23.jpg)









ПРАВИЛА ВИЗНАЧЕННЯ СТУПЕНЯ ОКИСНЕННЯМеталічні елементи мають у сполуках лише позитивні ступені окиснення. Гідроген у сполуках з неметалічними елементами становить +1; з менталами становить –1 Ступінь окиснення Оксигену –2 (пероксидні сполуки -1; ОF2 +2)Cтупінь окиснення Флуору –1 Ступінь окиснення елемента в простій речовині дорівнює нулю
Максимальний (позитивний) ступінь окиснення елемента збігається з номером групи, у якій він розміщений (виняток— О, F, інертні елементи)Мінімальний (негативний) ступінь окиснення неметалічного елемента дорівнює різниці між номером групи і числом 8 Правило електронейтральності: сума ступенів окиснення елементів у сполуці дорівнює нулю
ОСНОВНІ ВІДНОВНИКИПрості речовини неметали: S, Si, C, P, H2 Прості речовини метали та їх йони, що здатні підвищувати свій ступінь окиснення: Zn, Al, Mg, Fe2+, Cu+, Cr3+, Sn2+, Hg+, Mn2+Бінарні сполуки неметалічних елементів з металічними елементами та Гідрогеном: галогеніди, гідриди, карбіди, силіциди, фосфіди, нітриди, сульфіди, селеніди та ін. Складні молекули та йони металічних і неметалічних елементів, у яких вони мають проміжний ступінь окиснення: нітроген(ІІ) оксид, карбон(ІІ) оксид, ферум(ІІ) оксид, сульфур(ІV) оксид, манган(ІV) оксид, сульфітна кислота та її солі, нітритна кислота та її солі, гідроген пероксид та ін.
ОСНОВНІ ОКИСНИКИАтоми неметалічних елементів. Найлегше приєднують електрони або утворюють спільні електронні пари елементи сьомої групи головної підгрупи, найважче – елементи IV групи. Елементи п’ятої та шостої груп головних підгруп займають проміжне положення. Катіони металічних елементів можуть приєднувати електрони і відновлюватись до простих речовин або до катіонів із меншими зарядами, крім катіонів лужних і лужноземельних елементів наприклад: Ag+ + ē = Ag; Fe3+ + ē = Fe2+; Чим менш активний метал, тим легше його катіон приєднує електрони. Складні йони або молекули, у яких неметалічні елементи знаходяться у найвищих можливих ступенях окиснення: нітратна кислота та її солі; сульфатна кислота та її солі, аніони оксигеновмісних кислот галогенів, KMn. O4
ВОЛЬТІВ СТОВПЦе був немов товстий «бутерброд» iз металічних пластин (міді і цинку) i тканини, яка заздалегідь була просочена розчином сульфатної кислоти. До першої та останньої пластинок припаювали дротинки. Якщо ix занурювали у воду, то на поверхні кожної дротинки починалося виділення газу. Це відбувався електроліз води. Отже, крізь воду проходив електричний струм. Винайдене джерело струму було названо гальванічним елементом
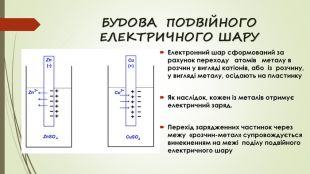
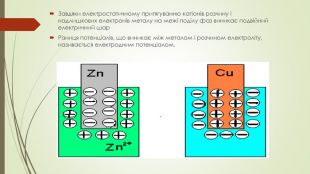
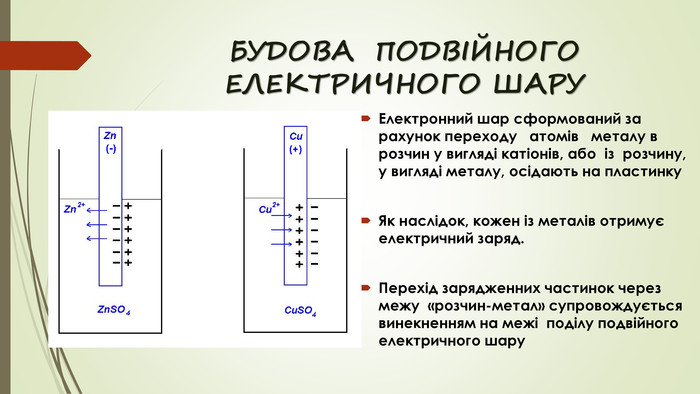
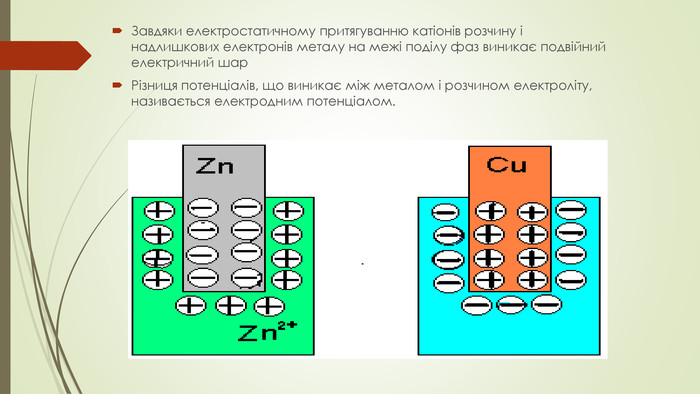
БУДОВА ПОДВІЙНОГО ЕЛЕКТРИЧНОГО ШАРУЕлектронний шар сформований за рахунок переходу атомів металу в розчин у вигляді катіонів, або із розчину, у вигляді металу, осідають на пластинку Як наслідок, кожен із металів отримує електричний заряд. Перехід зарядженних частинок через межу «розчин-метал» супровождується винекненням на межі поділу подвійного електричного шару
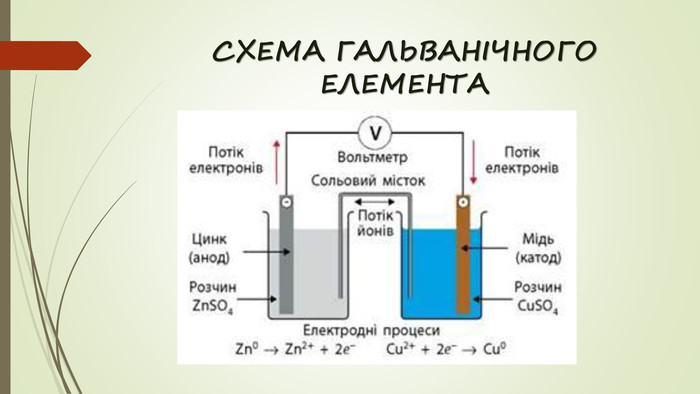
ЕЛЕМЕНТ ЯКОБІ ДАНІЕЛЯЦинк більш активний відновник і легше віддає електрони, ніж мідь. Відбувається спрямований рух електронів від цинкової пластинки (аноду) до мідної (катоду) [Під час процесу електролізу заряд електродів - протилежний] Одночасно на цинковому електроді виникає нестача електронів, завдяки чому рівновага, що встановилася на ньому, зміщується в бік утворення йонів Zn2+: Zn0 → Zn2+ + 2e-А на мідному електроді виникає надлишок електронів, і рівновага зміщується в бік осадження йонів Cu2+ на пластинці: Cu2+ + 2e- → Cu0 Сумарний процес, що відбувається на двох електродах, можна зобразити рівнянням: Zn0 + Cu2+ → Cu0 + Zn2+Схема гальванічного елемента(Анод -) Zn | Zn2+ || Cu2+ | Cu (Катод+)
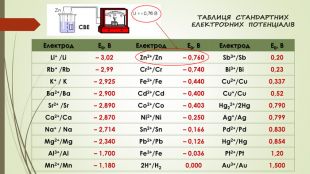
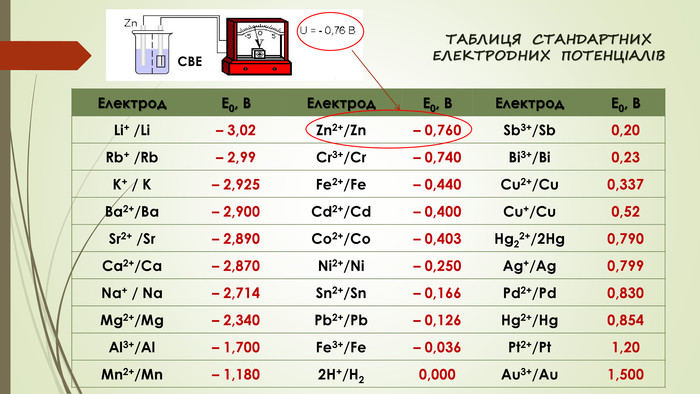
{17292 A2 E-F333-43 FB-9621-5 CBBE7 FDCDCB}Електрод. Е0, ВЕлектрод. Е0, ВЕлектрод. Е0, ВLi+ /Li– 3,02 Zn2+/Zn– 0,760 Sb3+/Sb0,20 Rb+ /Rb– 2,99 Cr3+/Cr– 0,740 Bi3+/Bi0,23 K+ / K– 2,925 Fe2+/Fe– 0,440 Cu2+/Cu0,337 Ba2+/Ba– 2,900 Cd2+/Cd– 0,400 Cu+/Cu0,52 Sr2+ /Sr– 2,890 Co2+/Co– 0,403 Hg22+/2 Hg0,790 Ca2+/Ca– 2,870 Ni2+/Ni– 0,250 Ag+/Ag0,799 Na+ / Na– 2,714 Sn2+/Sn– 0,166 Pd2+/Pd0,830 Mg2+/Mg– 2,340 Pb2+/Pb– 0,126 Hg2+/Hg0,854 Al3+/Al– 1,700 Fe3+/Fe– 0,036 Pt2+/Pt1,20 Mn2+/Mn– 1,1802 H+/H20,000 Au3+/Au1,500 СВЕСВЕТАБЛИЦЯ СТАНДАРТНИХ ЕЛЕКТРОДНИХ ПОТЕНЦІАЛІВ
ВИСНОВКИЧим більший негативний електродний потенціал металу, тим більша його відновна здатність. Кожен метал здатний відновлювати з розчинів ті метали, які стоять у ряді напруг праворуч від нього. Всі метали, що мають негативний потенціал, тобто що знаходяться в ряді напруг лівіше водню, здатні витісняти його з розчинів кислот. Чим більше різниця електродного потенціалу металів, тим більшою буде ЕРС гальванічного елемента, який з них побудований. Робота гальванічного елемента характеризується його електрорушійною силою (ЕРС)
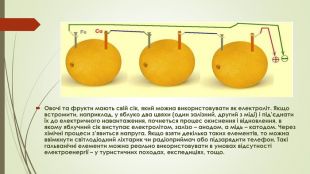
Овочі та фрукти мають свій сік, який можна використовувати як електроліт. Якщо встромити, наприклад, у яблуко два цвяхи (один залізний, другий з міді) і під’єднати їх до електричного навантаження, почнеться процес окиснення і відновлення, в якому яблучний сік виступає електролітом, залізо – анодом, а мідь – катодом. Через хімічні процеси з’явиться напруга. Якщо взяти декілька таких елементів, то можна ввімкнути світлодіодний ліхтарик чи радіоприймач або підзарядити телефон. Такі гальванічні елементи можна реально використовувати в умовах відсутності електроенергії – у туристичних походах, експедиціях, тощо.
ТЕСТИ1. Катодом у гальванічному елементі з нікелевим анодом може бути… А алюміній Б калій В магній Г олово 2. Укажіть гальванічний елемент, який характеризується найбільшою електрорушійною силою А Cu|Cu2+||Ag+|Ag Б Pb|Pb2+||Cu2+|Cu В Sn|Sn2+|| Ag+|Ag Г Sn|Sn2+||Pb2+|Pb3. Виберіть схему реакції, яка відбувається в гальванічному елементі, складеному з залізної пластини і мідної пластин, занурених у розчини своїх солей. А Fе0+ Cu2+→ Fе2++ Cu0 Б Сu2 ++ SО42− → Cu. SО4 В Fе2 ++ SО42−→ Fе. SО4 Г Сu0+ Fе2 +→ Cu2 ++ Fе0
4. Який метал утворить гальванічний елемент з максимальною ЕРС у парі з міддю: Bi Zn Pb Cr5. Анодом у гальванічному елементі з мідним катодом може бути: золото срібло платина залізо6. Розташуйте схеми гальванічних елементів у порядку збільшення їх електрорушійної сили. Zn |Zn2+ || Fe2+| Fe. Zn |Zn2+ || Pb2+|Pb. Mn|Mn2+||Cu2+|Cu. Mn|Mn2+||Hg2+|Hg
7. Установіть відповідність між складовими гальванічного елемента, напрямом руху заряджених частинок і цифрами на рисунку8. Укажіть усі метали, що можна використати в гальванічному елементі у якості катода, якщо анодом буде нікель. А цинк. Б залізо. В мідь. Г марганець. Д свинець9. Гальванічний елемент складається з пластин міді та магнію, які занурені у розчини своїх солей. Маса катоду збільшилась на 24 г, на скільки грамів зменшилась маса аноду. А сольовий місток Б анод В рух катіонів Г катод Д рух аніонів. Е рух електронів 123456 А Б В Г Д Е


про публікацію авторської розробки
Додати розробку