Окисно-відновні реакції, їх значення
Мета уроку:
Освітня: поглибити знання учнів про окисно-відновні реакції, навчивши учнів складати рівняння окисно-відновних реакцій методом електронного балансу.
Розвивальна: розвивати вміння і навички роботи в команді, вчити самостійно здобувати знання з різних джерел інформації та оформлювати їх у вигляді презентації, формувати вміння виступати перед аудиторією, використовуючи можливості мультимедійної техніки.
Виховна: виховувати пізнавальний інтерес учнів до вивчення хімії, товариськість і взаємодопомогу.
1
Тема уроку: "Окисно-відновні реакції, їхнє значення.
Мета уроку:
Освітня: поглибити знання учнів про окисно-відновні реакції, навчивши учнів складати рівняння окисно-відновних реакцій методом електронного балансу.
Розвивальна: розвивати вміння і навички роботи в команді, вчити самостійно здобувати знання з різних джерел інформації та оформлювати їх у вигляді презентації, формувати вміння виступати перед аудиторією, використовуючи можливості мультимедійної техніки.
Виховна: виховувати пізнавальний інтерес учнів до вивчення хімії, товариськість і взаємодопомогу.
Програмне забезпечення: програмно-методичний комплекс «Хімія. 9 клас», Microsoft PowerPoint, Word, Paint, Internet Explorer.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, пам’ятки з алгоритмом складання рівнянь окисно-відновних реакцій методом електронного балансу, правила визначення ступенів окиснення елементів в речовинах.
Базові поняття та терміни: окисно-відновні реакції, окисники, відновники, окиснення, відновлення, метод електронного балансу
Хід уроку:
І. Організаційний момент.
Привітання, перевірка готовності учнів до уроку, налаштування на робочий настрій та побажання успіху в роботі.

 Добрий день! Я рада бачити вас всіх в гуморі. Сподіваюсь, ми з вами добре попрацюємо. Сьогодні на уроці ми продовжуємо говорить про окисно-відновні реакції, зокрема розглянемо їх значення. Отже цілі, які ми ставимо: повторити теоретичний матеріал про окисно-відновні реакції, удосконалити навики складання електронного балансу; розкрити значення окисно-відновних реакцій. Ще раз згадаємо ім’я відомого українського ученого, який зробив вагомий внесок у розробку теорії окисно-відновних реакцій Льва Володимировича Писаржевського.
Добрий день! Я рада бачити вас всіх в гуморі. Сподіваюсь, ми з вами добре попрацюємо. Сьогодні на уроці ми продовжуємо говорить про окисно-відновні реакції, зокрема розглянемо їх значення. Отже цілі, які ми ставимо: повторити теоретичний матеріал про окисно-відновні реакції, удосконалити навики складання електронного балансу; розкрити значення окисно-відновних реакцій. Ще раз згадаємо ім’я відомого українського ученого, який зробив вагомий внесок у розробку теорії окисно-відновних реакцій Льва Володимировича Писаржевського.
II. Актуалізація опорних знань.
Зараз ми ще раз повторимо основні поняття, котрі були розглянути в цієї темі, проглянувши відеосюжет «Окисно-відновні реакції».

І щоб закріпити все вище сказане зробимо тестовий контроль.
 Експрес – контроль
Експрес – контроль
1. Метали мають такі ступені окиснення:
А. нульовий; Б. позитивний; В. Негативний
2. Окисно-відновні реакції, це реакції в яких:
А. не змінюється ступень окиснення елементів;
Б. змінюється ступень окиснення елементів;
В. належність до окисно-відновних реакцій визначається іншими методами;
3. Відновники – це атоми, молекули або іони , що:
А. приєднують електрони; Б. віддають електрони;
В. Здатні і віддавати і приєднувати електрони.
4. Окисники – це атоми, молекули або іони, що:
А. приєднують електрони; Б. віддають електрони;
В. Здатні віддавати та приєднувати електрони.
5. Відновлення – це процес:
А. приєднування електронів; Б. віддавання електронів;
В. Не пов'язаний з переходом електронів;
6. Який процес відбувається в зазначеній схемі 2Н+1+2е→Н20
А. відновлення; Б. окиснення
7. при відновленні ступень окиснення:
А. зменшується; Б. збільшується; В. не змінюється.
8. Елемент з мінімальним ступенем окиснення може бути:
А. тільки відновником; Б. тільки окисником;
В. і відновником і окисником.
9. Елемент з максимальним ступенем окиснення може бути:
А. тільки відновником; Б. тільки окисником;
В. і відновником і окисником.
10. Елемент з проміжним ступенем окиснення може бути:
А. тільки відновником; Б. тільки окисником;
В. і відновником і окисником.
11. Укажіть схему, що відповідає перетворенню N0→N-3:
А. 1s22s22p3-3e → 1s22s2
Б. 1s22s22p3+3e → 1s22s22р6
В. 1s22s22p5+1e → 1s22s22р6
Г. 1s22s22p3-3e → 1s22s22р6
12. Вкажіть кількість електронів , відданих або приєднаних атомом в схемі S-2 → S+6:
А. 2е ; Б. 6е; В. 8е.
Далі, обмінюється своїми роботами і відбувається взаємоперевірка. Кількість правильних балів – відповідна оцінка за виконану роботу. Дивимось на екран.

Відповіді: 1. А,Б; 2. Б, 3. Б, 4. А, 5.А. 6.А. 7.А. 8.А. 9.Б. 10.В, 11.Б, 12.В.
Роботи передали.
ІІІ. Мотивація навчальної діяльності.
 Учитель. В III в. до н.е. на острові Родос був побудований пам'ятник у вигляді величезної статуї Геліоса. Геліос був не просто особливо шановним божеством на острові – він був його творцем. Вважалося, що не маючи місця йому присвяченого сонячний бог виніс острів на своїх руках із морської глибини. Грандіозний задум і досконалість виконання Колоса Родоського – одного із чудес Античного світу – вражали всіх, хто його бачив. Ми не знаємо точно, як виглядала статуя, але відомо, що вона була зроблена із бронзи й досягала у висоту близько 31,5 м. За час існування була найбільшою статуєю світу. Статуя була створена скульптором Харетом. Бронзова оболонка кріпилася до залізного каркаса. Порожню статую почали будувати знизу й, у міру того як вона росла, заповнювали каміннями, щоб зробити її стійкіше.
Учитель. В III в. до н.е. на острові Родос був побудований пам'ятник у вигляді величезної статуї Геліоса. Геліос був не просто особливо шановним божеством на острові – він був його творцем. Вважалося, що не маючи місця йому присвяченого сонячний бог виніс острів на своїх руках із морської глибини. Грандіозний задум і досконалість виконання Колоса Родоського – одного із чудес Античного світу – вражали всіх, хто його бачив. Ми не знаємо точно, як виглядала статуя, але відомо, що вона була зроблена із бронзи й досягала у висоту близько 31,5 м. За час існування була найбільшою статуєю світу. Статуя була створена скульптором Харетом. Бронзова оболонка кріпилася до залізного каркаса. Порожню статую почали будувати знизу й, у міру того як вона росла, заповнювали каміннями, щоб зробити її стійкіше.
 Через 12 років перед жителями острова постала велична картина: біля входу в гавань на біломармуровому пагорбі підносилася гігантська бронзова фігура бога Сонця. Приблизно через 50 років після завершення будівництва Колос звалився. Під час землетрусу він переломився на рівні колін. Учені вважають, що дійсною причиною недовговічності цього чуда стала корозія металу. А в основі процесу корозії лежать окисно-відновні реакції.
Через 12 років перед жителями острова постала велична картина: біля входу в гавань на біломармуровому пагорбі підносилася гігантська бронзова фігура бога Сонця. Приблизно через 50 років після завершення будівництва Колос звалився. Під час землетрусу він переломився на рівні колін. Учені вважають, що дійсною причиною недовговічності цього чуда стала корозія металу. А в основі процесу корозії лежать окисно-відновні реакції.
Навколо нас в природі відбувається велика кількість хімічних реакцій: виверження вулкану, фотосинтез, дихання, травлення… Ми, люди, також широко використовуємо хімічні процеси. Наприклад, горіння сірника, добування металів з руд, приготування їжі та інше. Серед цих процесів велика кількість належить до окисно-відновних реакцій.
Окисно-відновні реакції надзвичайно поширені і важливі. Найважливіші процеси на планеті пов'язані із цим типом хімічних реакцій. В усі часи ці реакції привертали до себе увагу. Вони були оспівані і в літературі, і в музиці, і в образотворчому мистецтві. Де саме вони зустрічаються, яка їх роль в природі і житті людини ми з’ясуємо на сьогоднішньому уроці. А ще я хочу, щоб ви наприкінці уроку дали мені обґрунтовану відповідь на питання: Окисно-відновні реакції – «Добро чи зло»?
ІV.Викладення нового матеріалу.
Презентація з обговоренням.«ОВР НАВКОЛО НАС».
Учні отримали картки з завданням заздалегідь з наступними завданнями:
Перша група : значення окисно-відновних процесів в природі.
Друга група: значення окисно-відновних реакцій в житті людини.
Третя група: значення окисно-відновних реакцій в техніці.
Четверта група: руйнівна роль ОВР.
Заслуховуються повідомлення груп.
Прогнозовані результати:
 Перша група.
Перша група.

 Окисно-відновні реакції найбільш поширені і відіграють значну роль у природі. Завдяки окисно-відновним процесам на ранніх стадіях існування нашої планети утворились гірські породи і мінерали. Вони є основою життєдіяльності, адже з ними пов’язані найважливіші функції живої системи – це дихання, обмін речовин, фотосинтез у рослин. Під час дихання органічні речовини окиснюються до кінцевих продуктів - вуглекислого газу і води, використовуючи для цього кисень. А під час фотосинтезу вуглекислий газ відновлюється в органічних сполуках, а кисень вивільняється у повітря. Під дією сонячного світла в зелених рослинах відбувається процес фотосинтезу. Він включає десятки хімічних реакцій, однак сумарне рівняння одне:
Окисно-відновні реакції найбільш поширені і відіграють значну роль у природі. Завдяки окисно-відновним процесам на ранніх стадіях існування нашої планети утворились гірські породи і мінерали. Вони є основою життєдіяльності, адже з ними пов’язані найважливіші функції живої системи – це дихання, обмін речовин, фотосинтез у рослин. Під час дихання органічні речовини окиснюються до кінцевих продуктів - вуглекислого газу і води, використовуючи для цього кисень. А під час фотосинтезу вуглекислий газ відновлюється в органічних сполуках, а кисень вивільняється у повітря. Під дією сонячного світла в зелених рослинах відбувається процес фотосинтезу. Він включає десятки хімічних реакцій, однак сумарне рівняння одне:


Процеси гниття, бродіння, тління, утворення перегною; утворення мінеральних солей з перегною в ґрунті - це все окисно-відновні реакції. У живій природі окисно-відновні процеси є основою всіх процесів обміну речовин, які є джерелом енергії.
 Такі процеси, як виверження вулканів, згоряння метеоритних тіл, грозові розряди в атмосфері завжди супроводжуються окисно-відновними процесами.
Такі процеси, як виверження вулканів, згоряння метеоритних тіл, грозові розряди в атмосфері завжди супроводжуються окисно-відновними процесами.
У 79р. н.е. «загорів» вулкан Везувій. До цього часу він був мальовничою горою, яка на 1300 метрів підносилась над Неаполітанською затокою. Але 24 серпня над Везувієм здійнялась хмара незвичайної форми, яка згодом ставала все темнішою. Посипався попіл, важкі камені, в повітрі відчувався запах спаленої сірки. Виверження вулкану повністю знищило Помпей. Місто зникло під шаром попелу, який досягав 3 метрів. Ці окисно-відновні процеси знайшли своє відображення в мистецтві: живопису.
 Видатний російський художник Карл Павлович Брюлов, побувавши у 1830році на місці розкопок давньоримського місця Помпеї, зруйнованого виверженням вулкану Везувію, розпочинає роботу над картиною» «Останній день Помпеї», що вразила сучасників художника своєю романтичною щирістю та величчю і справила сенсацію і в Росії і закордоном.
Видатний російський художник Карл Павлович Брюлов, побувавши у 1830році на місці розкопок давньоримського місця Помпеї, зруйнованого виверженням вулкану Везувію, розпочинає роботу над картиною» «Останній день Помпеї», що вразила сучасників художника своєю романтичною щирістю та величчю і справила сенсацію і в Росії і закордоном.
 З точки зору хімії у районах вулканів і на дні кратерних озер утворюються поклади самородної сірки. Це відбувається внаслідок таких окисно-відновних реакцій:
З точки зору хімії у районах вулканів і на дні кратерних озер утворюються поклади самородної сірки. Це відбувається внаслідок таких окисно-відновних реакцій:
2H2S + O2 = 2S +2H2O
H2S + 2SO2 = H2SO4+ 2S
 Іван Франко оспівував грозу у своєму вірші «Гримить». Послухайте його під музику Антоніо Вівальді, якого також надихали окисно - відновні процеси, що проходять під час грози.
Іван Франко оспівував грозу у своєму вірші «Гримить». Послухайте його під музику Антоніо Вівальді, якого також надихали окисно - відновні процеси, що проходять під час грози.
Гримить! Благодатна пора наступає,
Природу розкішная дрож пронимає,
Жде спрагла земля плодотворної зливи,
І вітер над нею гуляє бурхливий,
І з заходу темная хмара летить —
Гримить!
Гримить! Тайна дрож пронимає народи,-
Мабуть, благодатная хвиля надходить...
Мільйони чекають щасливої зміни,
Ті хмари — плідної будущини тіни,
Що людськість, мов красна весна, обновить...
Гримить!
 Під час грози азот сполучається з киснем і утворюється нітроген (ІІ) оксид, який далі перетворюється в нітроген (ІV ) оксид, який сполучається з водою і киснем і на землю ллються кислотні дощі. Завдяки цим процесам на кожний гектар землі щорічно потрапляє від 4 до 15 кг нітрогеновмісних сполук:
Під час грози азот сполучається з киснем і утворюється нітроген (ІІ) оксид, який далі перетворюється в нітроген (ІV ) оксид, який сполучається з водою і киснем і на землю ллються кислотні дощі. Завдяки цим процесам на кожний гектар землі щорічно потрапляє від 4 до 15 кг нітрогеновмісних сполук:
N2+ O2 = 2NO
2NO + O2 = 2NO2
 4NO2 + O2 +2H2O = 4HNO3
4NO2 + O2 +2H2O = 4HNO3
 Друга група. Окисно-відновні реакції мають велике значення і в житті людини – це отримання тепла в наших домівках при спалювання вугілля, дров, газу, добування багатьох органічних речовин; виробництво цілого ряду будівельних матеріалів, лікарських препаратів, вітамінів, гормонів, ферментів; виробництво кисломолочних продуктів, сирів, спирту тощо.
Друга група. Окисно-відновні реакції мають велике значення і в житті людини – це отримання тепла в наших домівках при спалювання вугілля, дров, газу, добування багатьох органічних речовин; виробництво цілого ряду будівельних матеріалів, лікарських препаратів, вітамінів, гормонів, ферментів; виробництво кисломолочних продуктів, сирів, спирту тощо.
Природоохоронні заходи, які застосовують для очищення навколишнього середовища, а саме стічних вод і ґрунту від побутового і промислового забруднення ґрунтуються на процесах окиснення і відновлення. Певні види бактерій здатні розкладати, мінералізувати органічні сполуки, які потрапляють у воду та ґрунт.

 Життя організму неможливе без поповнення його тканин енергією, будівельним матеріалом, вітамінами, мінеральними речовинами і водою. Воно здійснюється за рахунок їжі. Щоб з харчових продуктів вивільнилась енергія і вони стали придатними для включення в обмін речовин. Іжа в травному апараті піддається механічній і хімічній обробці, ця обробка відбувається під впливом ферментів до складових частин, які придатні до всмоктування в кишках і подальшого засвоєння в тканинах.
Життя організму неможливе без поповнення його тканин енергією, будівельним матеріалом, вітамінами, мінеральними речовинами і водою. Воно здійснюється за рахунок їжі. Щоб з харчових продуктів вивільнилась енергія і вони стали придатними для включення в обмін речовин. Іжа в травному апараті піддається механічній і хімічній обробці, ця обробка відбувається під впливом ферментів до складових частин, які придатні до всмоктування в кишках і подальшого засвоєння в тканинах.
За висловлюванням В.І.Вернадського «живі організми в цілому є найпотужнішою хімічною силою на земній поверхні».
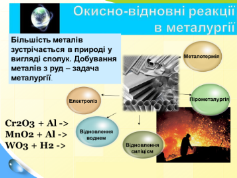 Третя група. Значення окисно-відновних реакцій в техніці дуже велике. Більшість рідкісних, важливих в техніці металів ( нікель, вольфрам, молібден, хром, алюміній) та інші) отримують за допомогою окисно-відновних реакцій. Найактивніші метали – це лужні та лужноземельні – шляхом електролізу із їх солей. В основі електролізу також лежать окисно-відновні процеси.
Третя група. Значення окисно-відновних реакцій в техніці дуже велике. Більшість рідкісних, важливих в техніці металів ( нікель, вольфрам, молібден, хром, алюміній) та інші) отримують за допомогою окисно-відновних реакцій. Найактивніші метали – це лужні та лужноземельні – шляхом електролізу із їх солей. В основі електролізу також лежать окисно-відновні процеси.
Окисно-відновні процеси використовуються в металургії під час виплавки чавуна та сталі, одержання та очищення кольорових металів, рідкісних металів:


Виробництво чавуну, сталі, деяких неметалів: фосфору, хлору, йоду; добування амоніаку, нітратної і сульфатної кислот ґрунтуються на окисно-відновних процесах.
 Четверта група: корозія металів, потемніння срібла. Нажаль, продукти харчування мають властивість псуватися. Це також окисно-відновна реакція.
Четверта група: корозія металів, потемніння срібла. Нажаль, продукти харчування мають властивість псуватися. Це також окисно-відновна реакція.
Пожежа неконтрольований процес горіння, що заподіює матеріальну шкоду життю і здоров’ю людей, інтересам суспільства і держави.

На пам'ятниках Тарасу Шевченку, Богдану Хмельницькому в Києві, Петру І в Санкт-Петербурзі (названому «Мідним вершником»), зроблених із бронзи (сплаву міді з оловом) утворюється зелений наліт, який періодично зчищають. Хімічних змін зазнає навіть срібло. Всі знають, що із часом срібні предмети темніють. Але найбільшого впливу кисню на відкритому повітрі за підвищеної вологості зазнає залізо. Іржа «з'їдає» не менш ніж 20 % від усієї його кількості, що виробляється, а це — мільйони тонн. Явище руйнування металів унаслідок хімічних реакцій з речовинами навколишнього середовища називають корозією.
 Залізо, перебуваючи за звичайних умов на повітрі, повільно реагує водночас із киснем і водою (водяною парою). Таке перетворення можна описати схемами:
Залізо, перебуваючи за звичайних умов на повітрі, повільно реагує водночас із киснем і водою (водяною парою). Таке перетворення можна описати схемами:
Fе + О2 + Н2О → Fе(ОН)2
Fе(ОН)2 + О2 + Н2О → Fе(ОН)3
Мідь реагує відразу з трьома речовинами: киснем, водою (водяною парою) і вуглекислим газом, що є у повітрі:
Сu + О2 + H2O + CO2→ (СuОН)2СО3
 Чи замислювались ви, чому картини стародавніх майстрів, наприклад Рафаеля, Леонардо да Вінчі, Фрагонара, мають таку темну палітру?
Чи замислювались ви, чому картини стародавніх майстрів, наприклад Рафаеля, Леонардо да Вінчі, Фрагонара, мають таку темну палітру?
У старовину багато картин писали масляними фарбами, до складу яких входили деякі сполуки Плюмбуму, наприклад, основний карбонат Рb3(ОН)2(СО3)2 - свинцеві білила. Під дією сірководню, що є в повітрі, свинцеві білила перетворювалися на чорний плюмбум(ІІ) сульфід, тому картини поступово тьмяніли:
Рb3(ОН)2(СO3)2 + H2S →PbS + Н2О + СО2.
 Для реставрації картини поверхню її слід обробити будь-яким окисником, наприклад гідроген пероксидом:
Для реставрації картини поверхню її слід обробити будь-яким окисником, наприклад гідроген пероксидом:
РbS + Н2О2 → РbSО4 + Н2О.
Зараз через свою отруйність свинцеві білила в масляних фарбах майже не застосовуються.

Ви почули багато цікавого матеріалу, який підготували ваші однокласники. Але не виникало у вас відчуття, що можна сформулювати таким чином: «Окисно-відновні реакції – «добро чи зло»?
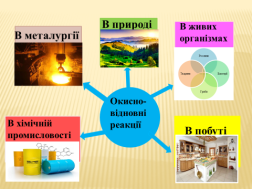 Отже, з цих повідомлень ми дізналися про значення окисно-відновних реакцій у житті людини та розвитку виробництва і можна зробити наступний висновок:
Отже, з цих повідомлень ми дізналися про значення окисно-відновних реакцій у житті людини та розвитку виробництва і можна зробити наступний висновок:
- Окисно-відновні реакції належать до найбільш поширених.
- В живій природі енергія, яка виділяється під час ОВР, забезпечує життєдіяльність організмів.
- ОВР лежать в основі процесів металургії, технічного виробництва амоніаку, нітратної та сульфатної кислот, горіння паливних матеріалів, хімічних джерел
електричного струму.
- Іноді ОВР відіграють негативну роль .
Отже, цей висновок можна вважати підсумком нашого уроку, якщо додати, що крок за кроком накопичувався досвід використання окисно-відновних реакцій. Вивчення цих процесів продовжується і в наш час. Отже, окисно-відновні реакції відіграють надзвичайно важливу роль у природі, виробництві, техніці та побуті.

 V. Дидактична гра «Чорна» скриня .
V. Дидактична гра «Чорна» скриня .
П’ять місяців на поверхні Марсу працював космічний апарат «Фенікс», який передав на Землю багато цінної інформації, зокрема, що на цій планеті є замерзла вода. Але 30 листопада 2008 року NASA оголосила про завершення його місії, так як з апаратом протягом тижня не могли встановити зв’язку. Найбільш імовірною причиною виходу з ладу Фенікса вчені називають пристрій, аналог якого знаходиться в скрині. Ви з ним добре знайомі, часто користуєтесь його послугами. Що знаходиться в скрині?
(акумулятор)
 VII. Домашнє завдання. Опрацювати матеріал § 16; Задача (додому). Конструктори перших космічних кораблів і підводних човнів зіштовхнулися із проблемою: як підтримати постійний вміст повітря на судні й космічних станціях? Позбутися надлишку вуглекислого газу й поповнити запас кисню? Рішення було знайдено.
VII. Домашнє завдання. Опрацювати матеріал § 16; Задача (додому). Конструктори перших космічних кораблів і підводних човнів зіштовхнулися із проблемою: як підтримати постійний вміст повітря на судні й космічних станціях? Позбутися надлишку вуглекислого газу й поповнити запас кисню? Рішення було знайдено.
 Надпероксид калію KO2 у результаті взаємодії з вуглекислим газом утворює кисень: КО2 + СО2 = К2СО3 + О2 Як бачите, це окисно-відновна реакція. Кисень у цій реакції є й окиснювачем, і відновником. У космічній експедиції на рахунку кожний грам вантажу. Розрахуйте запас надпероксида калію, який необхідно взяти в космічний політ, якщо поле розрахований на 10 днів і якщо екіпаж складається із двох людей. Відомо, що людей за добу видихає 1 кг вуглекислого газу. (Відповідь. 64,5 кг KO2.)
Надпероксид калію KO2 у результаті взаємодії з вуглекислим газом утворює кисень: КО2 + СО2 = К2СО3 + О2 Як бачите, це окисно-відновна реакція. Кисень у цій реакції є й окиснювачем, і відновником. У космічній експедиції на рахунку кожний грам вантажу. Розрахуйте запас надпероксида калію, який необхідно взяти в космічний політ, якщо поле розрахований на 10 днів і якщо екіпаж складається із двох людей. Відомо, що людей за добу видихає 1 кг вуглекислого газу. (Відповідь. 64,5 кг KO2.)
VIІI. Фейеверк - декоративні вогні різноманітних кольорів і форм, які одержують при спалюванні піротехнічних сумішей задля розваги. Піротехнічні суміші містять речовини – окисники.


про публікацію авторської розробки
Додати розробку
