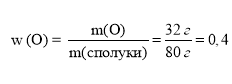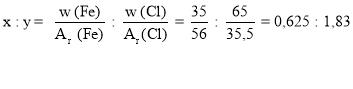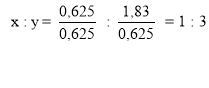Оксиген у природі. Озон. Проблема чистого повітря
Оксиген у природі. Озон. Проблема чистого повітря
Микола Глазунов, учитель хімії,
Скадовської спеціалізованої загальноосвітньої школи І-ІІІ ступенів «Академія творчості» з поглибленим вивченням предметів художньо-естетичного циклу»
Цільова група:
учні 7 класу
Тривалість:
- 45 хв.
Мета:
- забезпечити формування в учнів свідомого ставлення до екологічної проблеми чистого повітря;
- забезпечити формування в учнів критичного мислення;
- забезпечити роботу учнів із різними джерелами інформації, різними видами і типами ресурсних матеріалів;
- створити умови для діалогу між учнями, вільного вибору учнями навчальних завдань і способів поведінки;
- виховувати емоційно – ціннісне ставлення до живої природи та готовності до оцінки наслідків діяльності людини щодо природного середовища.
Операційні цілі (завдання):
Після закінчення уроку учень (учениця):
- називає якісний та кількісний склад повітря;
- описує поширеність Оксигену в природі;
- пояснює колообіг Оксигену;
- оцінює роль кисню в життєдіяльності організмів, роль озону в атмосфері, вплив діяльності людини на чистоту повітря.
Методи і техніки:
- Дискусія над пунктами у групах.
- Мозкова атака.
- Пазли – експертська головоломка.
Обладнання:
- 4 пристрої доступу до швидкісного Інтернету.
- Мультимедійний проектор.
- Екран.
Допоміжні матеріали.
Додаток 1 «Колообіг Оксигену. Озон»
Додаток 2 «Екологічний стан повітря»
Додаток 3 «Значення чистого повітря»
Додаток 4 «Охолодження повітря влітку та тепле узимку»
Додаток 5 «Охорона чистого повітря»
Вступна частина:
- Привітання школярів, перевірка готовності класу до уроку (наявність підручників, зошитів, щоденників, перевірка присутніх, настрій та увага учнів).
- Перевірка домашнього завдання, причин невиконання. Не більше 5 хвилин.
- Оголошення теми уроку. Постановка мети уроку школярами та узагальнення цілей учителем, розробка задач уроку для досягнення мети. Не більше 3 хвилин.
1.4 Демонстрація учителем відеофрагмента про будову атмосфери, унікальності життя на Землі. 2 хвилин.
Основна частина:
2.1 Виокремлення основних понять уроку, що потрібно опанувати учням: горіння, повільне окиснення, поширення Оксигену, наявність кисню, вплив людини на чистоту повітря, роль озону в атмосфері.
2.2 Опрацювання інформації усім класом щодо колообігу Оксигену в природі, про озон (Додаток 1).
Школярам необхідно з’ясувати основні напрями колообігу Оксигену в природі, взаємозв’язок кисню й озону, можливий вплив людини на екологічний стан повітря. З’ясувати якісний та кількісний склад повітря, поширення Оксигену в природі та його доступність у вигляді кисню.
2.3 Розподіл учнів на групи.
2.4 Завдання групам.
Група «Антропологів» опрацьовує матеріал про екологічний стан повітря (Додаток 2). Група «Екологів» вивчає матеріал про значення чистого повітря (Додаток 3).
Група «Підприємці» знайомиться з інформацією про заходи щодо поліпшення якості повітря (Додаток 4), а група «Юристи» - про охорону чистого повітря (Додаток 5).
2.5 Завдання учням:
Першій групі після опрацювання інформації за додатком необхідно відповісти на запитання який екологічний стан повітря?
Другій групі – ранжувати потреби людства від найнеобхіднішого до менш необхідного.
Третій групі – з’ясувати досягнення науки щодо поліпшення якості повітря на Україні? Як провести механічне, фізичне, хімічне та біологічне очищення повітря? Четвертій групі - визначити, як юридично впливати на охорону повітря від забруднення? Робота груп регламентована: не більше 8 хвилин.
2.6 Керівник групи відповідає ємно і наочно, можливо, у вигляді схеми, таблиці, на поставлене запитання групи. Іншу групи складають запитання до доповідача. Доповідь складає не більше 5 хвилин. Вироблення єдиних рекомендацій щодо охорони повітря з урахуванням поширення та колообігу Оксигену та комбінації механіко – фізико –хімічно – біологічного очищення повітря.
2.7 У групі учні працюють за розподіленими ролями.
Підсумкова частина:
3.1 Підведення підсумків уроку: Чи досягнута мета уроку? Чи усі поставлені завдання виконані?
3.2 Оцінювання керівниками групи роботи її членів, оцінювання учителем загальної роботи групи.
3.3 Повідомлення домашнього завдання: навчальний проект № 6: «Проблема забруднення повітря та шляхи її розв’язування» та навчальний проект № 7: «Дослідження зміни концентрації вуглекислого газу у класні кімнаті під час занять»
До шостого проекту підібрати економічно доцільні засоби очищення повітря з урахуванням об’єму забрудненого повітря.
До сьомго проекту розробити методику проведення «Орієнтовні розрахунки щодо поліпшення якості повітря, підвищення вмісту кисню».
Додаток 1
Колообіг Оксигену та озон.
https://uk.wikipedia.org/wiki/%D0%9F%D0%BE%D0%B2%D1%96%D1%82%D1%80%D1%8F
http://ua-referat.com/%D0%A1%D0%BA%D0%BB%D0%B0%D0%B4_%D0%BF%D0%BE%D0%B2%D1%96%D1%82%D1%80%D1%8F
http://knowledge.allbest.ru/ecology/3c0a65635a2ad68b5c43b88421206c37_0.html
http://knowledge.allbest.ru/ecology/2c0b65625a3bd78a4d43b88421316d27_0.html
У цьому кругообігу чітко виражені активна геохімічна діяльність живої речовини та її першорядна роль у цьому процесі. Біогеохімічний цикл Оксигену є планетарним процесом, що пов'язує атмосферу і гідросферу із земною корою. Він відбувається у такій послідовності:
- утворення вільного кисню у процесі фотосинтезу в зелених рослинах;
- споживання утвореного кисню для виконання дихальних функцій усіма живими організмами, а також у реакціях окиснення органічних решток і неорганічних речовин;
- інші хімічні перетворення, що приводять до утворення сполук, як вуглекислий газ та вода, та послідовного їх залучення у новий цикл фотосинтетичних перетворень.
Щорічно зелена рослинність нашої планети продукує приблизно 3∙1011 т кисню. Близько 75 % цієї кількості виділяється рослинами суші й трохи більше 25% - фотосинтезуючими організмами Світового океану. З колообігом Оксигену тісно пов'язане утворення озону. У високих шарах атмосфери під впливом ультрафіолетової частини сонячного спектра відбувається йонізація частини молекул кисню й утворюється атомарний Оксиген, котрий негайно приєднується до збуджених молекул кисню, утворюючи озон - трьохатомний Оксиген. Поглинаючи у процесі утворення значну частину жорсткого ультрафіолетового випромінювання, озон відіграє величезну захисну роль для всієї біосфери, оскільки багато з молекулярних структур живих організмів руйнуються під дією жорсткого ультрафіолету.
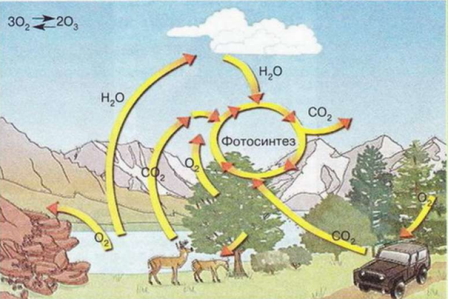
Біологічна роль кисню зумовлена його здатністю підтримувати дихання. Людина при диханні протягом однієї хвилини в середньому споживає 0,5 дм3 кисню, протягом доби – 720 дм3, а протягом року – 262,8 м3 кисню. Рослинний покрив Землі щороку виділяє в атмосферу 5•1011 т кисню. Проте цієї кількості достатньо тільки для компенсування його природної витрати.
Озоновий шар, який знаходиться в стратосфері на висоті 25 - 40 км, відіграє надзвичайно важливу роль — захист поверхні Землі від жорсткого ультрафіолетового випромінювання (190 - 320 нм). Утворення озону в стратосфері пов'язано з фотохімічною дисоціацією молекул кисню з утворенням атомарного Оксигену під впливом сонячного випромінювання. Внаслідок цих фотохімічних реакцій на висоті 25 - 40 км утворюється озоновий шар з максимальною концентрацією озону 1018 - 1019 молекул в м3. Проблема утворення "озонових дір" відома здавна, але особливої уваги до неї привернула Віденська конвенція ООН (1985р.). Під "озоновим отвором" розуміють значний простір в стратосфері Землі із значно пониженим вмістом озону, в порівнянні із багаторічною нормою його вмісту. Це явище є частиною складної екологічної проблеми - виснаження озонового шару Землі. Ця екологічна проблема являє пряму загрозу біосфері Землі, адже зростання потоку ультрафіолетового випромінювання, яке досягає земної поверхні, створює небезпеку всьому живому. За даними Всесвітньої організації охорони здоров'я, зменшення вмісту озону в стратосфері на 1%, призводить до зростання захворюваності людей на рак шкіри на 6%, катаракти очей — на 4% і це супроводжується значним послабленням імунної системи людини. Це стосується всього тваринного світу.
Зростання інтенсивності ультрафіолетового випромінювання по-iншому впливає на представників рослинного світу. Проведені наукові дослідження доводять, що при зростанні інтенсивності ультрафіолетового випромінювання буде спостерігатись порушення обміну речовин в рослинах. Це може стати причиною загибелі фітопланктону Світового океану. Наслідки цих процесів можуть бути катастрофічними. По-перше, порушення обміну речовин в рослинах, викличе зменшення врожайності сільськогосподарських культур, що загострить харчову проблему сьогодення. Крім того, можливі небажані мутації у шкідників цих рослин. По-друге, загибель фітопланктону Світового океану призведе до порушення глобального балансу діоксиду Карбону та кисню.
Систематичне вивчення озонових отворів почалось з середини 70-х років XX століття в полярних районах. У жовтні 1985 року з'явилось повідомлення, що концентрація озону в стратосфері над Антарктикою зменшилась на 40% від її мінімального значення. На континент була направлена дослідницька експедиція. Результати дослідження та моделювання процесів в стратосфері, дозволили висунути ідею про те, що крім особливостей фізико-географічних факторів, причиною зниження вмісту озону в стратосфері є потрапляння туди значних кількостей хлорфлуорвуглеводнів (фреонів). Фреонова гіпотеза одержала визнання, що стало причиною підписання у 1987 році Монреальського протоколу. Фреони Ф-12 (СС12F), Ф-115 (С2С1F5), Ф-13В1 (СВrF3), які використовувались як ефективні холодоагенти, піноутворювачі та розчинники в аерозольних упаковках у відповідності із Монреальським протоколом були заборонені для використання. Вважається, що піднімаючись у стратосферу, фреони піддаються фотохімічній дисоціації з утворення оксидів Хлору або оксидів Брому, які інтенсивно взаємодіють з озоном і руйнують його.
В останні роки встановлено, що викиди космічних літаків можуть призводити до руйнування стратосферного озону і, на долю цих джерел припадає до 10% зруйнованого озону. Тверде паливо ("гептил" — несиметричний диметилгідразин), яке використовується в космічних носіях, при згоранні утворює значні кількості оксидів Нітрогену(ІІ), які можуть легко вступати в реакцію з озоном: NO + О3 → NО2 + О2. Так, запуск одного космічного літака типу «Шаттл», призводить до руйнування до 10 млн. тонн озону. Для збереження озонового шару Землі запропоновані як пасивні методи тобто зменшення викидів фреонів, їх заміна, так і активні. До активних методів відносять хімічну та фізичну дію на стратосферу. Хімічна дія полягає у використанні етану і пропану в районах утворення «озонових дір», які при взаємодії з оксидами Хлору будуть зв'язувати його в малоактивний гідроген хлорид. Фізична дія полягає в ініціації процесів утворення озону в стратосфері шляхом дії на неї випромінювань високих енергій (лазерне, іонізуюче тощо). Така дія на стратосферу сприяє фотодисоціації молекул кисню, з утворенням атомарного Оксигену, який є передумовою утворення озону. Ці заходи дають змогу зменшити руйнування озонового шару Землі, а іноді і сприяти зростанню концентрації стратосферного озону, що дозволить, в майбутньому, зберегти озоновий екран.
Біологічні властивості озону полягають у високій оксинювальній здатності озону і утворення в багатьох реакціях з його участю вільних радикалів Оксигену, визначають його високу токсичність. Вплив озону на організм може призводити до передчасної смерті. Найбільш небезпечний вплив озон здійснює на органи дихання прямим подразненням і пошкодженням тканин; на холестерин в крові людини - з утворенням нерозчинних форм, що призводить до атеросклерозу.
Додаток 2
Екологічний стан повітря.
http://www2.epa.gov/clean-air-act-overview
http://www.clean-air-kids.org.uk/airquality.html
http://old.ecoleague.net/65490196-187.html
Якщо подивитися на Землю з висоти польоту літака, над великими промисловими містами можна побачити, що вона затягнута сірими хмарами пилу, який містить сажу, асфальтний та гумовий пил. Брак чистого повітря - проблема з проблем! У звичайному житті ми мало помічаємо його, а адже без повітря не можна жити. Повітря, як і вода, стає в XXI столітті проблемою з проблем.
Промислові підприємства винні в 65% забруднень повітря, 35% забруднень повітря припадає на транспорт.
Гранично допустимі концентрації (ГДК) забруднюючих речовин в атмосфері в нашій країні: по фенолу - 0,01 мг/м3, по нітроген діоксиду - 0,085 мг/м3, по сульфур діоксиду - 0,5 мг/м3, по свинцю - 0,0003 мг/м3, по чадному газу - 5 мг/м3.
Підраховано, що в одному кубометрі міського повітря, незважаючи на всі заходи санітарної охорони, міститься приблизно 0,1 міліграма сажі. За добу людина вдихає 12000 літрів повітря. Виходить, що за 30 років міського життя в легенях осідає приблизно від 1 до 50 грамів сажі. Захворювання: силікоз, бронхіти, антракозі - справа «її рук».
В останні десятиліття стали з'являтися так звані фотохімічні тумани, які є результатом діяльності людини: вони утворюються через вплив ультрафіолетової радіації Сонця на вихлопні гази автомашин. Ці тумани викликають різке подразнення горла, носа, очей.
Підвищений вміст сірчистого газу (сульфур діоксиду), оксидів нітрогену в повітрі негативно впливає на ряд рослин - гинуть посіви люцерни, ячменю, бавовни, цитрусові рослини, починають хворіти хвойні ліси. Надлишок в повітрі кислоти веде до корозії металів, до руйнування будівель. Чи потрібно говорити, що і людям він заподіює великої шкоди.
Ще багато років тому англійський учений К. Томсон був стурбований тим, що все живе припинить своє існування через виснаження кисню в атмосфері. Йому заперечив К. А. Тімірязєв, заявивши, що подібного роду похмурі перспективи є невіра у волю людини, яка може навіть пустелі перетворити в ліси. Пророкування великого вченого збулося: його нащадки розробили норми зелених насаджень залежно від величини міст і ступеня розвитку в них промисловості. Згідно з цими нормами в містах, де проживає 500 000 чоловік, на кожну 1000 жителів необхідно мати близько 150 гектарів лісу. Основним завданням майбутніх поколінь є відтворення біологічних ресурсів. Причому отримувати їх потрібно більше, ніж споживати. Це однаковою мірою стосується як рослинного світу, так і рибних запасів у внутрішніх водоймах, а також морях і океанах. Тільки таке розумне рішення може сприяти розвитку продуктивних сил і зростанню чисельності людства.
Земля - наш спільний маленький будинок. Людина забруднює атмосферу вже тисячоліттями, проте наслідки вживання вогню, якими вона користувалася весь цей період, були незначні. Доводилося миритися з тим, що дим заважав диханню, і що сажа лягала чорним покривом на стелі й стіни житла. Отримуване тепло було для людини важливіше, ніж чисте повітря й не закопчені стіни печери. Це початкове забруднення повітря не було проблемою, бо люди жили тоді невеликими групами, займаючи велику незайману ділянку довкілля. І навіть значне зосередження людей на порівняно невеликій території, як це було в класичній стародавності, не супроводжувалося ще серйозними наслідками. Так було аж до початку дев'ятнадцятого століття. Лише за останні сто років розвиток промисловості "обдарував" нас такими виробничими процесами, наслідки яких спочатку людина ще не могла собі уявити. Виникли міста-мільйонери, ріст яких зупинити не можна. Усе це результат великих винаходів і завоювань людини.
Найперше підтвердження того, що забруднення повітря згубно впливає на здоров'я людини, було отримано в Лондоні, Великобританія, у 1952 році. У результаті особливої метеорологічної обстановки в Лондоні загинули кілька тисяч чоловік. Холодний шар повітря був захоплений під шаром теплого повітря і не зміг піднятися вгору. Через холодну погоду населення Лондона спалювало величезна кількість вугілля, що призвело до утворення радіаційного туману по всьому місту. Відомо, що приблизно 4000 чоловік загинуло від смогу, а набагато більше число від серйозного утруднення дихання. В основному існують три основні джерела забруднення атмосфери: промисловість, побутові котельні, транспорт.
Частка кожного з цих джерел у загальному забрудненні повітря сильно різниться залежно від місця.
Автотранспорт робить негативний вплив на навколишнє середовище:
1. Шкідливі речовини у відпрацьованих газах, тверді частинки, що піднімаються пилом з коліс транспорту забруднюють повітряні маси;
2. У воду стікають брудні стоки з автомийок, стоянок, гаражів, АЕС, автодоріг. Крім того в не потрапляють хлориди, використовувані для боротьби з ожеледицею.
3. У ґрунт потрапляють відходи, забруднені нафтопродуктами, сажеві частинки, що утворилися при стиранні автомашин на дорогах.
Забруднення атмосферного повітря здійснюють звалища і несанкціоновані скупчення сміттєвих відходів, які часто просто спалюють. Кожна звалище являє собою хімічну міну, що виділяє в атмосферу небезпечні отруйні речовини. Високому забрудненню повітря сприяють несприятливі метеорологічні умови. Ситуація загострюється влітку при високій температурі повітря і відсутності потоку вітру. На стан повітряного середовища впливають підприємства комунального господарства. У холодні зими забруднення повітря від цих підприємств зростає. Однією з головних причин забруднення повітря в нашому селищі є центральні котельні.
Додаток 3
Значення чистого повітря.
http://knowledge.allbest.ru/ecology/3c0a65635a2ad68b5c43b88421206c37_0.html
Без їжі людина може прожити 5 тижнів, без води - 5 днів, без повітря - 5 хвилин. Здоров'я людини безпосередньо залежить від навколишнього середовища, і в першу чергу - від повітря, яким він дихає. Якість повітря впливає на життєдіяльність людського організму, його працездатність і загальне самопочуття. Недарма екології і, зокрема, проблемі чистого повітря приділяється так багато уваги. У наш час розвиненого технічного прогресу, все більше і більше забруднюється навколишнє середовище, знищуються ліси - найбільше джерело чистого повітря. А що можна говорити про міста ... Чим більше місто, тим брудніше в ньому повітря. І навпаки, чим далі живе людина від міських вулиць, тим здоровіше вона виглядає. Давно відомий факт, що довгожителів найбільше спостерігається в гірській місцевості, і в першу чергу це залежить від чистоти повітря. А середня тривалість життя вище в тих країнах, де ця проблема розглядається на державному рівні, і, відповідно, їй приділяється більше уваги, починаючи від фінансування і закінчуючи всілякою державною підтримкою. Згідно з даними Всесвітньої організації охорони здоров'я (ВООЗ) за 2014 рік, щорічно у світі приблизно 3700000 чоловік помирає через забруднення атмосферного повітря. Загальна кількість смертей, пов'язаних із впливом забрудненого повітря як у приміщеннях, так і в атмосфері, досягає 7000000 на рік.
Значення чистого повітря важко переоцінити, від нього залежить усе життя на планеті, починаючи від рослин і тварин і закінчуючи людством.
Зіпсоване повітря приносить велику шкоду в першу чергу дітям, оскільки дитячий організм тільки починає пристосовуватися до навколишнього середовища, формується імунна і захисна системи організму, так само великий небезпеку наражаються люди, які страждають хворобами дихальних шляхів, астмою і різними видами алергії.
Здавалося б, що в будинку або квартирі повітря повинне бути краще, ніж на міських вулицях. Але це помилкова думка. Через вентиляційні отвори в будинок проникають усі шкідливі мікроорганізми і бактерії, що знаходяться в повітрі, до яких приєднуються різні токсичні речовини, що виділяються з меблів, килимів і т.д. Окремо варто зауважити, що багато хто, не замислюючись, палять у приміщенні, а величезна кількість шкідливих речовин міститься саме в тютюновому димі. Мало того, небезпечні для людського організму віруси і бактерії можуть знаходитися в повітрі протягом двох - трьох днів, а різні дрібні порошинки, ворсинки і волоски можуть послужити причиною алергічних нападів і небезпечні набагато більше, ніж шерсть домашніх тварин.
Додаток 4
Охолодження повітря влітку та тепле – узимку.
http://allflower.in.ua/statti/kimnatni-roslyny-ochuschajut-povitria
http://studme.com.ua/1280052813846/bzhd/metody_sredstva_ochistki_vozduha.htm
http://otherreferats.allbest.ru/ecology/00142691_0.html
Якість повітря залежить від його температури, чистоти і вологості. Завжди приємно дихати свіжим повітрям, а свіжість повітрю надає відчуття прохолоди, як тільки температура вдихуваного повітря піднімається, приходить відчуття несвіжого і спёртого повітря. Величезне значення ще має вологість повітря. Велика вологість сприяє появі цвілі і створює поживний ґрунт для життєдіяльності різних бактерій. Середня температура свіжого повітря повинна бути в межах 18 - 20°C, а вологість повинна становити близько 40 - 60%, також в приміщенні повинна бути невелика вентиляція. Якщо ці параметри порушуються, то організм негайно реагує на ці зміни. Підвищується стомлюваність, сповільнюється реакція, настає сонливість. Якщо ж повітря недостатньо вологе, це призводить до почуття втоми і починає «дерти» в горлі. Так само сухе повітря згубно впливає на меблі, зроблені з дерева, і негативно позначається на музичних інструментах. Найчастіше це відбувається в зимовий період, такі як опалювальні прилади дуже сушать повітря, і багато хто, не надаючи цьому великого значення, не піклуються про збільшення вологості повітря.
Існує помилкова думка, що кондиціонер вирішує проблему з чистоти і якості повітря. Але це далеко не так. Прості кондиціонери тільки охолоджують повітря, що знаходиться в приміщенні і не здатні впливати на його вологість і чистоту. Краще з цією проблемою справляються системи кондиціонування та вентиляції, вони прекрасно виконують покладені на них завдання, контролюючи температуру, вологість і чистоту повітря. Чи є альтернатива? Так, є. Наступна схема є однією з найефективніших, вона відома як система «чиллер - фанкойли». З чого вона складається і як працює? Холодильна машина - чиллер - готує холодну воду (найчастіше з температурою близько + 7°С). Холодна вода за допомогою насоса подається в мережу трубопроводів і приходить в фанкойли. Принцип дії фанкойлів приблизно той же, що і у внутрішніх блоків спліт-систем, тільки в теплообміннику фанкойл циркулює не фреон, а всього лише холодна вода. Існує маса видів і типорозмірів фанкойлів - від настінних до канальних, тому проблеми з суміщенням агрегату і дизайну приміщення не виникають. І є переваги. По-перше, якщо в процесі будівництва або ремонту пошкодиться трубопровід з холодною водою, що циркулює по трубопроводу, проблем буде набагато менше, ніж з фреоном. По-друге, водою, підготовленою чиллером, можна постачати і секцію охолодження в припливній установці. Автоматично знімається проблема з температурою припливного повітря, притаманна системам, що використовують для охолодження «спліти». По-третє, чиллер можна встановити в підвалі або на технічному поверсі й не захаращувати фасади будівлі зовнішніми блоками спліт-систем. У результаті маємо відмінно працюючу схему «чиллер - припливна установка - фанкойли» з можливістю регулювання температури в кожному приміщенні. Але найголовніше - взимку фанкойли можуть служити для опалення! За тим же самим принципом у трубопроводах в зимові холоди теплоносій циркулює від котла і фанкойл грає роль опалювального приладу.
Більше за інших проблеми чистоти повітря хвилюють саме французьких учених, які неодноразово висували слогани типу «Дихаємо чистим повітрям». Саме вони розробили незвичайний прилад, що генерує очищене повітря. Чисте повітря вони генерують методом фотосинтезу з морських водоростей Spirulina Platensis. Ідея полягає в тому, що у велику ємність у вигляді акваріума поміщаються водорості Spirulina Platensis, а людина повинна дихати цим по-справжньому чистим повітрям. Саме таким чином досить легко і просто вирішується проблема чистого повітря. Погодьтеся, рішення було практично на поверхні. Чисте повітря, таким чином, стало об'єктом продажу, причому заробляють творці ідеї на цьому колосальні гроші. Точно таку ж ідею можна реалізувати і в нашій країні, адже проблема екології зараз стоїть дуже гостро і знайдеться чимало охочих скористатися такого роду послугами.
NASA і ALCA (Асоціація Ландшафтних підрядників Америки) провели спільне дослідження, яке довело, що кімнатні рослини допомагають уникнути симптомів синдрому шкідливого приміщення. До того ж вони виявили, що з'єднання кімнатного вентилятора і вуглецевого фільтра або інших типів повітряних очисних систем, таких як осушувачі повітря, для сканування простору, підвищили можливості рослин переробляти зіпсоване кімнатне повітря на чисте. Існує список рослин, здатних очищати повітря найбільш ефективно. Розглянемо деякі з цього списку. Філодендрон. Існує більше 900 видів в родині філодендрон, і багатьох з них досить легко знайти. Це популярні кімнатні рослини. Філодендрони ростуть відмінно з живців. Багато популярні типи філодендронів мають здатність розповзатися (є повзучими), що робить їх чудовим вибором навіть для маленьких приміщень. Сциндапсус, це ще одна дуже популярна кімнатна рослина. Сциндапсуси є ідеальними рослинами для кімнатних умов, так як вони вимагають дуже мало світла. Якщо достатньо світла для читання, то і достатньо світла для сциндапсуса. Ці рослини прекрасно ростуть у підвішених горщиках, так як вони вважають за краще чіплятися і розповзатися. Хлорофітум. За цією рослиною дуже легко доглядати і його легко розводити. Йому необхідно багато природного освітлення, але він погано росте під прямими сонячними променями. Добре росте в підвішених горщиках і може вирости дуже великим. Спатифіллум, також відомий як Peace Lilies або Spath. Ця рослина не вимагає багато світла, і його можна поливати близько одного разу на тиждень, також як і більшість інших кімнатних рослин. Спатифіллум - чудовий очисник повітря: він поглинає формальдегіди, бензен та інші шкідливі речовини. Вам не потрібно перетворювати ваш будинок в теплицю з метою насолоди перевагами чистого повітря. Вам слід використовувати 2-3 великих рослини на кожні 18-23 квадратних метри у вашому будинку.
Додаток 5
Охорона чистого повітря.
http://zakon5.rada.gov.ua/laws/show/2707-12
http://ukraine.uapravo.net/data/base55/ukr55795.htm
http://old.ecoleague.net/78705580-393.html
http://old.ecoleague.net/65490196-187.html
Існує так званий «Кіотський протокол», що передбачає велике обмеження шкідливих викидів в атмосферне повітря в масштабі всієї планети. Цей протокол підписали уже сорок країн, у тому числі і Україна. Протокол передбачає використання для потреб промисловості замість нафти і вугілля - біопаливо. За прогнозами екологів у результаті непомірного спалювання нафти, вугілля, газу років через п'ятдесят на землі не залишиться здорових людей.
Ключ до довголіття - чисте повітря, тому, щоб збільшити тривалість життя людей необхідно шукати шляхи, щоб зберегти повітря чистим. Учені гонконгського університету зібрали статистичні дані, що показують, що після посилення вимог щодо змісту оксидів сірки в автомобільних вихлопах протягом дванадцяти років середня тривалість життя збільшилася на 1-2 роки.
Велику роль у збереження повітря чистим відіграють рослини. Ліси - легені планети, вони головне джерело кисню. Необхідно захищати їх від безконтрольного вирубування і знищення. Зараз в небезпеці чисельність тропічних лісів. Щохвилини площі екваторіальних лісів знижуються на 23 гектари. Необхідно боротися з утворенням несанкціонованих звалищ, забороняти спалювання в містах побутових відходів і навіть опалого восени листя. Один з виходів - будівництво сміттєпереробних заводів. У даний час розробляються все нові моделі електро - і сонцемобілей, але вони, звичайно ж, не зможуть грати помітну роль у вирішенні проблеми як зберегти повітря чистим, тому незручні і вимагають частих підзарядок акумуляторів. Більш дієвий метод - перехід на нові стандарти використання автомобільного транспорту - Євро.
Ще одним значним кроком по збереженню чистоти атмосфери має стати модернізація виробництва. Технологічний процес на підприємствах повинен бути оптимізовано таким чином, щоб зменшити викид шкідливих речовин. Також обов'язково повинні встановлюватися спеціальні очисні пристрої, що зменшують негативний вплив промисловості на довкілля.
Також негативний вплив на атмосферу роблять різні речовини, застосовувані в побуті, зокрема аерозолі. Тому треба використовувати тільки ті засоби, на яких є маркування про те, що вони безпечні для навколишнього середовища. Збереження чистоти повітря для нашого і майбутнього поколінь є не тільки завданням всього людства в цілому, а й кожної людини окремо.
Що можна зробити для зменшення забруднення повітря:
1. Застосовувати екологічно чисте паливо;
2. Застосовувати каталізатори;
3. Встановлювати очисні фільтри;
4. Розвивати громадський транспорт;
5. Застосовувати електромобілі;
6. Посилити контроль техогляду транспорту;
7. Збільшити посадку зелених насаджень;
8. Щорічно проводити «День без автомобіля»;
9. Вести роз'яснювальну роботу з власниками автотранспорту;
10. Створити лічильники реєстрації кількості вихлопних газів.
Що можна зробити для зменшення забруднення повітря котельнями:
1. У майбутньому котельні не розташовувати поблизу житлових мікрорайонів.
2. Насаджувати дерева навколо котелень.
3. Стежити за якістю повітря і при перших ознаках забруднення повітря повідомляти органам влади.
Методика формування поняття про кислоти
Вивчення поняття про кислоти починається у 8 класі загальноосвітньої школи, разом з тим, шкільна методика формування поняття про кислоти має певні недоліки, які завадять розвивати дане поняття у вищій школі. Метою статті є узгодження дій у загальноосвітній та вищій школі з питань методики формування поняття про кислоти.
Основними постулатами, які ми обрали для підґрунтя формування поняття про кислоти є: визначення поняття «кислота» через склад, будову, властивості, використавши різні теорії.
Загальна теорія Дж. Л’юїса – Пірсона:
Кислота – при утворенні ковалентного зв’язку акцептують пару електронів на низьку за енергією вільну молекулярну орбіталь.
За даною теорією кислотами можуть бути:
- Молекули з незаповненою 8 – е- конфігурацією (BF3, SO3).
- Катіони центрального атома комплексних сполук (Co2+, Fe3+, Ag+).
- Галогеніди з ненасиченими координаційними зв’язками.
- Молекули з кратними зв’язками, у яких є додатній ступінь окиснення атома (CO2, SO2, R2C = C(CN)2).
Типи реакцій:
Перенесення Н+: HCl + NH3 → NH4Cl
Утворення комплексів: BF3 + OR2 → F3B:OR2 Cu2+ + 4NH3 → Cu(NH3)42+ SnCl4 + 2Cl- → SnCl62- Ni + 4CO → Ni(CO)4
Утворення солі: Ag+ + I- → AgI
Пірсон на основі концепції поляризуємості розподілив кислоти Л’юїса (L - кислоти) на жорсткі, м’які: жорсткі – акцепторний атом, йон: має великий додатній заряд, сильно електронегативний, справляє поляризуючу дію. Найжорсткішою кислотою є Н+; м’які кислоти – акцепторна частинка має маленький додатній заряд, або незаряджена, великий об’єм, легко деформується. Найм’якіші кислоти це – d – метали. Наприклад, жорсткі: H+, Li+, K+, Cr6+, Mg2+, Ca2+, AlCl3, BF3, SO3, CO2 та ін. М’які кислоти: Ag+, I2, Br2, Cu+, Ni. Проміжні: Zn2+, SO2, Sn2+, Pb2+, Fe2+, R3C+. Установлено постулат: жорстка кислота найкраще реагує з жорсткою основою за рахунок електростатичної взаємодії, а м’яка – з м’якою основою за рахунок більш ефективного перекривання орбіталей. З Al3+ краще взаємодіє F- ніж I-. За теорією Дж. Л’юїса - Пірсона «кислота» розглядається без впливу розчинника за визначенням, а за властивостями – розчинник та просторові ефекти впливають на силу жорсткості і м’якості кислот. За функцією – кислоти – електрофіли в органічній хімії, наприклад,
Br2 + Н2С = СН2 → C2H4Br2, HCl + Н2С = СН2 → C2H5Cl
L - кислота L – π - oснова L - кислота L – π - oснова
Жорстка кислотно – основна взаємодія підкоряється зарядовому контролю: енергія вільних орбіталей кислот висока, йрни – кислоти сильно сольватовані, а основи – мають високий потенціал йонізації, висока електронегативність, сильно сольватовані – термодинамічні характеристики процесу взаємодії жорстка кислота з основою: ∆G < 0, ∆S > 0, ∆H > 0. Таким чином, енергія орбіталей кислоти і основи сильно відрізняються. М’яка кислотно – основна взаємодія підкоряється орбітальному контролю: акцептори (кислоти) пари електронів мають низькі за енергією орбіталі, великий йонний радіус, високу спорідненість до електронів, а основи (донори електронних пар) – низький потенціал йонізації, невисоку електронегативність – термодинамічна характеристика процесу: ∆G < 0, ∆S < 0, ∆H < 0. Теорія Л’юїса – Пірсона включає протолітичну теорію Бренстенда – Лоурі, як дин з варіантів переносу Н+, а процес кислотно – основної взаємодії, як окремий випадок окисно – відновних реакцій, наприклад, F- (відновник) + BF3 (окисник) → BF4-, Н+ (окисник) + НО- (відновник) → Н2О, що узгоджується з теорією Усановича. В теорії Бренстенда - Лоурі: кислотність – це здатність атакувати НО – групу, а електрофільність, як більш загальне поняття, це атака на будь – який від’ємно заряджений атом. В органічній хімії теорія йонотропії (катіонотропії, прототропії) включає теорію кислот і основ, таким чином спостерігається очевидний зв’язок теорії в обох розділах хімії. Як приклад, поява класифікації: ОН – кислоти (оцтова, метанол, феноли), SH – кислоти (тіоли), СН – кислоти (вуглеводні) та ін. В теорії йонотропії, кислота – речовина, яка збільшує концентрацію кислотного катіону в розчиннику, наприклад, 2H2O → H3O+(кислота) + HO- (основа) 2BrF3 → BrF2+ (кислота) + BF4- (основа).
Утворення йонів під дією розчинника визначається сольватуючою дією самого розчинника, так, HCl сольватується водою → Н3О+ + Cl-
AlCl3 + (x+4)CH3OH → Al(CH3OH)43+ + 3Cl(CH3OH)x- - сольватовані обидва.
4AlCl3 + 4ТГФ → [Al(ТГФ)4]3+ + 3AlCl4- сольватований тільки катіон. Таким чином, усі хімічні процеси відбуваються у бік вирівнювання електронної густини в системі. Сольватуюча дія розчинника визначається донорними чи акцепторними числами та іонізуючою дією. Акцепторне число – модуль числа ентальпії утворення комплексу L – кислоти з речовиною (C2H5)3P = O:, отже, чим більше це число, тим сильніші акцепторні властивості (міцніше зв’язок) кислоти виявляє речовина. Тепер можна представити схему взаємозв’язку теорій (Рис.1).
Порядок формування поняття про кислоти у загальноосвітній школі на рівні стандарту можна представити послідовною схемою дій:
Склад кислот (за експериментальними даними) → будова (молекулярна, структурна, електронна; введення поняття про гідроксиди, як сполуки, що містять ОН групу) → фізичні властивості мінеральних та органічних (різний агрегатний стан, колір, поняття про леткість кислот, смак (амінокислоти), розчинність у воді та ін.) → хімічні властивості (загальні → варіативні та специфічні ознаки, які підкріплюються демонстраціями (у т.ч. з негативним результатом, наприклад, мідь з соляною (оцтовою) та нітратною кислотами у 8 класі) → поширення → застосування → добування промислове, потім вивчати лабораторне (з негативним результатом показуємо взаємодію силіцій оксиду з водою) → ідентифікація (загальні – встановлення присутності Н+ та специфічні – на кислотний залишок, наприклад, H2SO4: метилоранж – встановлення Н+ і дія барій хлориду, чи гідроксиду – встановлення сульфат - іноів ). Порядок формування поняття про кислоти на рівні ЗНЗ – ВНЗ (з доповненням до рівня стандарту та розширенням змісту програми профільного рівня хімії у 11 класі): склад → будова (H2SO4, BCl3, Mg2+, CO2) → властивості (фізичні; хімічні – утворення ZnSO4, BCl4-, Mg0, CO) – загальні властивості) → поширення → застосування → добування → ідентифікація (за фізичними, окисно – відновними та протолітичними властивостями). На кожному шляху кислотам дають визначення з подальшим уточненням. Даний підхід висуває першочерговим теорію Л’юїса – Пірсона, Усановича як більш загальну і детально знайомить школярів з протеолітичною теоріє. У темі «Хімічний зв’язок» знайомлять школярів з окисно – відновними процесами, зазначаючи, що окисно – відновна взаємодія L – кислоти і основи відбуваються зі зміною ступеня окиснення. У старшій школі, на основі знань про L - кислоти і основи вводять поняття про електрофіли і нуклеофіли для розгляду механізмів реакцій.
Вважаємо, що однобічне вивчення природи речовини призводить до догматичності знань учнів середньої школи.
Джерела інформації
- Речицький О.Н., Решнова С.Ф., Холуянов О.О. Класифікація типових недоліків з хімії, що виникають у знаннях та вміннях учнів на прикладі формування поняття «кислота». – Матеріали Міжнародної науково – методичної конференції «Сучасний стан природничо – математичної та технологічної освіти: тенденції, перспективи». – Херсон.- 2010. – с.90
Рис.1
Поняття «кислота»
Креативна освіта
Креативна освіта відходить від механічного перенесення знань, а за основу взята пошукова діяльність учнів, що ідуть шляхами наукового дослідження до встановлення фактів, формування проблем, гіпотез і аж до вирішення їх і пояснення. Креативна педагогіка прагне ненастирливо, вміло направляти розвиток талановитих дітей, надати їм можливість повною мірою розкрити та реалізувати свої здібності.
Система креативної хімічної освіти спрямована на формування творчого мислення всіх учнів, розвиток їх інтелектуальних здібностей які мають першорядне значення для оволодіння знаннями і вміннями в різних галузях науки. Креативна освіта перетворює засвоєння знань умінь на захоплюючу мандрівку, пригоду, яка пов’язана з розкриттям секретів речовини, природи світу в цілому. Практичну цінність, значущість здобутих у дослідженнях знань учні усвідомлюють, застосовуючи їх для проектування технологій виробництва.
Креативна педагогіка включає:
- Позитивний емоційний зміст навчального процесу (Творчий процес можливий лише в умовах позитивного емоційно-інтелектуального натхнення).
- Критичне ставлення до стереотипів, до установлених норм. "Творчість починається з сумніву".
- Пошук варіативних рішень будь-якої проблеми.
- Використання методу відкритого питання. (Дуже ефективно розвиває творчий потенціал учнів, пошук відповіді на запитання, навіть, якщо не буде знайдена відповідь, але розвиваючим є сам процес пошуку).
- Винахідницька діяльність (Не обов’язково чогось нового. Навіть якщо це "свій велосипед")
Учень разом з вчителем самовіддано грає – грає всерйоз у науку, в авторів винаходів, у наукових доповідачів, опонентів, рецензентів.
Технологія формування креативності досить складна. В ній можна виділити кілька етапів:
- Визначення рівня креативності кожного учня.
- Визначення перспектив розвитку креативності та врахування індивідуальних особливостей учнів.
- Розробка системи знань спрямованих на розвиток креативності.
- Організація творчої діяльності учнів
Виявляється, що навчити творчості взагалі до успіху не веде. Тому необхідна система роботи і перш за все вивчення особистості учня.
Помічено, що креативна (творча) якість проявляється в комплексі зі станом здоров’я, нервової системи, характеру, здібністю до незвичайних рішень та вчинків. Тому на початковому етапі вивчення хімії я провожу серію занять які дають змогу встановити ступінь:
- Прийомів роботи учня, розумових операцій, реальних досягнень в певній сфері знань з точки зору новизни, самостійності.
- Комплекс морально-інтелектуальних спонукань, установок інтересів, мотивів, що визначають мету здійснення тих чи інших дій, вчинків і поведінки в цілому.
- Темп, інтенсивність, рівень досягнень
- Здібності учня
Для виявлення здібностей та творчої активності учнів використовую дані психологічних анкет, повсякденні психологічні спостереження та висновки після різних форм роботи на уроках.
На початковому етапі вивчення хімії проводжу серію занять, на яких навчаю учнів: читати, працювати з підручником, допоміжною літературою та додатковою, знайомлю з хімічними реактивами, обладнанням, технікою безпеки, навчаю різним прийомам рішення задач, конспектування, складання тезисів, графіків, таблиць, схем, працювати з моделями, проводити хімічні досліди, бачити проблеми та шукати шляхи їх рішення. Так, для визначення рівня індивідуальних досягнень та встановлення кількісних і якісних індивідуальних психологічних відмінностей можна використати критеріально-орієнтовні тести і відкрити шлях діагностування і корекції особливостей. У ролі критерію у таких тестах виступають конкретні знання, вміння та навички.
Тести на обізнаність дають змогу перевірити як володіє учень такими прийомами розумової діяльності як синтез, аналіз, порівняння. Учень з кількох відповідей має вибрати правильну.
На уроці в 8 класі "Речовина, матерія, тіло. Властивості речовин" на закріплення матеріалу учні одержують тести:
- Речовина це а) олівець, б) стілець, в) дерево, г) целюлоза, д) зошит
- Матеріал з якого виготовляють олівець: а) скло, б) целюлоза, в) графіт, г) стержень, д) дерево.
- Учнівський зошит і підручник виготовлені з одного і того ж матеріалу: а) заліза, б) форми, в) паперу, г) целюлози, д) гуми
Тести на аналогію, крім аналізу, синтезу дають змогу виявити і рівень логічного мислення:
- Хімічний стакан – скло, парта...
- Цукор – цукерка, папір...
А на практичній роботі "Очищення забрудненої кухонної солі" учням пропоную виконати крім практичної запланованої частини такий розумовий експеримент: "Очистити кухонну сіль, забруднену залізними ошурками". На практичній роботі "Добування кисню та вивчення його властивостей" учням пропонуються диференційовані завдання за рівнями, щоб самим оцінити свої знання (Додаток №2).
Аналіз результатів проведених робіт дає можливість прийти до висновку, який рівень засвоєних знань – абстрактне чи конкретне домінує в того и іншого учня, дає змогу діагностувати рівень сформованості розумових дій, що лежить в основі мислення.
- Репродуктивний (копіюючий) – з стихійною стадією розвитку – це найнижчий тип де учень показує лише те, що він здатний до відтворення знань і може працювати лише при наявності алгоритмів.
- Конструктивний (напівстихійний) – показує, що учень має знання, уміння і навички користуватись при аналогії в подібних ситуаціях.
- Творчий (дослідницький) – з свідомим розвитком, показує, що учень може самостійно використовувати знання, здатний до самокорекції знань. Має інтерес до пошуків невідомого, невідповідностей. Може побачити і сформулювати проблему, шукає шляхи її вирішення. Чітко формулює результати своєї роботи. Тобто це є найвища ступінь креативності, коли учень всю роботу виконує сам, йдучи своїм шляхом.
Наведу різні підходи при розв’язуванні задач, які проявлятимуть рівні розвитку учнів.
|
|
Репродуктивний |
Конструктивний |
Творчий |
|
Тип задач |
Не розв’язує |
Розв’язує стандартні |
Розв’язує всі, перевагу надає нестандартним. |
|
Відношення до задач |
Не бачить |
Бачить стандартні задачі |
Бачить різні задачі |
|
Як розв’язує задачі |
Може знайти зноску на підручник "де все записано" |
Уміє розв’язувати задачу по стандартній методиці |
Розв’язує задачу лише оригінально |
Визначивши рівень розвитку учнів, я планую перспективи розвитку креативності з урахуванням індивідуальних властивостей учнів за допомогою підібраних завдань.
Так, при вивченні теми "Періодичний закон і періодична система" можна запропонувати при закріпленні матеріалу вправи на формування і концентрацію уваги.
Наприклад:
В наведеній таблиці вказано число протонів, нейтронів, електронів в атомах різних ізотопів. З’ясуйте, які з них являються:
- Нейтральними атомами
- Від’ємно зарядженими іонами
- Додатньо зарядженими іонами
- Ізотопами одного і того ж хімічного елементу
|
з/п |
Число протонів |
Число нейтронів |
Число електронів |
|
1 |
n |
n-2 |
n |
|
2 |
n-1 |
n-3 |
n-1 |
|
3 |
n+1 |
n+1 |
n |
|
4 |
n-1 |
n-1 |
n+1 |
|
5 |
n+2 |
n+1 |
n+1 |
Для формування просторого уявлення використовую моделювання. Наприклад, на уроці в 10 класі з теми: "Порядок з’єднання атомів в молекулах. Види вуглецевих ланцюгів, структурні формули", використовуючи лекційно-семінарську систему Н.П.Гузика, даю такі завдання на закріплення.
Програма "А"
Виготовити кульові моделі можливих молекулярних структур, які мають склад: а)C2H8, б)С4Н10, в)С4Н10О
- Написати структурні формули цих речовин і відмітити види вуглецевих ланцюгів для даного складу речовин.
- Спостерігайте, які зміни відбуваються в молекулах складу С4Н8 при перебудові вуглецевого ланцюгу з прямого в циклічний. Продемонструйте на даному матеріалі зміни речовин пов’язані: а) з складом та хімічною будовою, б) тільки з хімічною будовою
Програма "В"
Виготовити кульові моделі трьох видів вуглецевих ланцюгів молекул органічних речовин: а) прямий, б) розгалужений в) циклічний
Знаючи, що карбон в органічних сполуках завжди чотирьох валентний, приєднайте до вільних валентностей атомів карбону моделей необхідну кількість кульок, символізуючи атоми гідрогену. Напишіть молекулярну і структурну формули речовин, моделі яких ви виготовили.
Розвиток креативного мислення неможливий без оволодіння і застосування таким тонким і точним інтелектуальним інструментарієм, яким є прийоми розумової діяльності:
- виділення основного, аналіз та синтез,
- порівняння та абстрагування,
- узагальнення
- систематизація і кваліфікація
- конкретизація
- визначення та пояснення понять,
- доказ та спростовування тверджень
Дамо пояснення деяким прийомам розумової діяльності
Виділення основного, аналіз та синтез
Навчитись виділяти основне (усвідомлення інформації як частини цілого). Виділити основне можна завдяки аналізу (розчленуванню цілого на складові частини) та синтезу (взаємозв’язку його частин)
Порівняння:
Операція зіставлення полягає у визначенні подібних ознак якогось об’єкта, операція протиставлення різних ознак.
Абстрагування:
Відокремлюють якісь ознаки досліджуваних явищ, речовин, матеріалів і узагальнюють правила, поняття, закони, тощо.
Узагальнення полягає у:
- виявленні загальних істотних властивостей, особливостей явищ, та предметів,
- встановленні між ними причинно-наслідкових зв’язків,
- формуванні на їх основі висновків: загальних положень, тверджень, закономірностей, тенденцій, що подається у вигляді доказів, пояснень провідних ідей.
Систематизація:
Здатність виділити ознаку класифікації забезпечує успішність формування узагальнення і систематизації, достатньо ефективно розвиває мислення.
Класифікація
Поділяє систему, що розглядається, на частини з метою впорядкувати її і зробити придатною для огляду та розуміння
Конкретизація
Уточнюється найбільш істотне в узагальненні, формується визначення поняття, закону, правила, тощо.
Визначення і пояснення понять
Визначення або дефініція – це уточнення знань, понять на підставі відмежування вибраного предмета від усіх інших.
Пояснення – це твердження істинності понять при використанні очевидного або аксіоматичного шляхом усних та письмових виступів
Технологія креативного мислення передбачає формування цих розумових прийомів через використання різних форм роботи.
Форми роботи
- Дійові, творчі ігри та моделювання, розв’язування кросвордів.
- Семінари, диспути
- Тести-роздуми, критеріально-орієнтовані тести та інше.
- Робота з підручником.
- Розв’язування розрахункових задач
- Задачі-малюнки
- Самостійна робота (з підручником, дидактичним матеріалом)
- Дослідницька робота
- Експериментальна робота (індивідуальна, групова)
- Розумовий експеримент
- Рішення проблемних ситуацій
Наприклад: Розвиває у учнів аналітико-синтетичні здібності, вміння аналізувати, робота з підручником, з тестами:
- Типовий відновник: а)NH4NO3 б)HNO3 в)NH3 г)NaNO3
- Процесом приєднання електронів під час хімічної реакції називають: а)відновленням, б)окисленням, в)заміщенням, г)розкладом
Логічні мислення формують такі тести:
- Алмаз – графіт. Кисень – ... (до третього підібрати по аналогії).
- Cu + H2SO4 → SO2
Cu + HNO3(k) → H2, N2O, NO2, N2, NO
Тести на вміння класифікувати:
- Визначити яке з п’яти слів не відповідає спільній ознаці
а) Ag2O, K2O, CaO, MgO, Na2O
б) O2, CO2, H2SO4, BaO, NH3
Вміння конкретизувати, узагальнювати дає можливість використання тестів, де потрібно знати найсуттєвіші загальні ознаки для двох слів
- Кисень – озон (Алотропні відозміни)
- Оксиген – Сульфур (будова атома)
- Розчин H2SO4 – HCl розчин (сильні електроліти)
Тут учні показують вміння аналізувати, розкривати зміст понять, визначати значення змісту. Такими є завдання на хімічні перетворення, де причинно-наслідковий зв’язок лежить між ланками ланцюга. Кожна ланка зв’язує наступну та попередню. Знаючи властивості речовин, включених в ланцюг, можна передбачити властивості інших
- Si → x → Na2SiO3 → y → SO2 → SO3
- FeS → x → SO2 → K2SO3 → y
Задачі-малюнки також дають можливість формувати вміння порівнювати, аналізувати, конкретизувати, узагальнювати.
Наприклад, ця задача дає можливість перевірити якість засвоєння учнями практичних умінь и навичок, уміння застосовувати їх для розв’язання проблематичних ситуацій, здатність робити логічні висновки
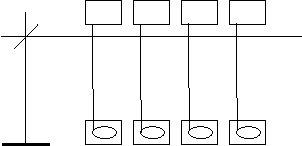
На планці закріплені ложечки з речовинами А, Б, В, Г. У стаканах міститься концентрована хлоридна кислота. При опусканні планки ложечки з речовинами занурюються в кислоту. Речовина А з шипінням "бігає по поверхні кислоти", зменшується у розмірах. Речовина А і газ, що виділяється внаслідок реакції: чисто загоряються. Речовина Б вступає в реакцію з виділенням великої кількості газу. Речовина В покривається бульбашками газу, кількість їх збільшується, але значно менше ніж у перших двох випадках. Поверхня речовини Г не змінюється. Визначте в якому періоді і якій групі періодичної системи хімічних елементів Д.І.Менделєєва розміщені елементи, з простими речовинами яких працюють у даному досліді. Відомо, що відносна атомна маса елементів зростає від А до Г, різниця за масою між елементами невелика.
Абстрагування формують задачі-розповіді:
Наприклад: Одного разу я і мої товариші вирішили відправитися на полювання на один з островів на лодці. Незабаром піднявся шторм. Лодку зносило все далі у море. Ми дуже змерзли. Раптом в імлі з’явився обрис острова. Ми швидко пристали до берега і вирішили спочатку розвести багаття, щоб зігрітися і приготувати їжу. Вітер задував вогнище і ми обклали його камінням: каміння було м’яке, біле і дуже забруднювалось. Вранці всі дуже лаяли чергового Володю. Вогнище згасло, а сірники зникли. Але я взявся і без вогнища зварити яйця на сніданок. Для цього я подрібнив білі каміння з того боку, де вони зіткнулися з вогнем, поклав у ямку вириту у землі подрібнене каміння разом з сирими яйцями, полив їх водою.
Каміння зашипіло, повалила пара і через декілька хвилин яйця гарно зварились.
- Що це за мінерал?
- Що стало з ним від жару вогню?
- Як пояснити дію води на біле каміння?
Справжня творчість починається тільки тоді, коли школярі пишуть хімічні казки самостійно, коли вони здатні створити нові образи. Ось чому особливу увагу звертаю на виконання учнями таких домашніх завдань: Скласти хімічну казку, вірш, задачу-розповідь, оповідання до теми уроку. (Додаток № )
На уроках систематично застосовую завдання для малих творчих груп, подібних до цього: "Прочитайте текст статті ... підручника, додатковий матеріал. Складіть усну відповідь, намалюйте схему, або міні-газету, поставте запитання до тексту". Учні самостійно опрацьовують текст, а потім захищають свій проект і ставлять запитання до класу. Чим більше школярі грають, тим швидше розвивається творча уява дитини, тим вище інтелектуальний рівень особистості.
Досить добре розвивають творчу активність учнів дидактичні ігри. Головним моментом, на який необхідно звертати увагу під час створення й використання навчальних ігор, є акцентування уваги учнів на змісті самої гри, а отже, і змісті навчального матеріалу.
Гра привчає учня мислити, виділяти головне, узагальнювати, розвиває його пам’ять, здібності. Для виконання цих навчально-виховних завдань в процесі навчання хімії з успіхом можуть бути використані тематичні ігри. Залежно від загальної спрямованості й типу дидактичних ігор за їх допомогою можна формувати не тільки окремі знання, а й взаємозв'язки між елементами знань, навчати учнів порівнювати та диференціювати хімічні речовини і процеси.
Засвоєння знань у ході гри часто не потребує довільної уваги, що дає змогу уникнути перевтомлення учнів.
- Ігри-вправи
Можна використовувати під час узагальнення навчального матеріалу з хімії будь-якого характеру.
"Хрестики-нулики"
а) Тема "Основні класи неорганічних сполук".
Визначити виграшні варіанти.
Вказати оксиди, які мають амфотерні властивості:
|
ZnO |
MgO |
BeO |
|
K2O |
AlO3 |
CaO |
|
SO2 |
Li2O |
Cr2O3 |
Вказати речовини, з якими взаємодіє вода:
|
K |
Cu |
Na2O |
|
SO2 |
Al2O3 |
Ca |
|
Au |
CaO |
CO2 |
Відповідь:
Na2O + H2O = 2NaOH;
Ca + 2 H2O = Ca(OH)2 + H2↑;
CO2 + H2O = H2CO3.
б) Тема "Періодична система хімічних елементів Д.І.Менделєєва".
Вказати елементи, які належать до одного періоду.
в) Тема "Нітроген та його сполуки".
Знайти сполуки, де азот має однакові значення ступеня окислення
|
HNO2 |
KNO3 |
HNO3 |
|
NF3 |
Na2O3 |
NH3 |
|
NaNO3 |
N2 |
NaNO2 |
Сполучити лінією формули тих речовин, що взаємодіють з концентрованою нітратною кислотою
|
Cu(NO3)2 |
Ca |
CuO |
|
S |
HCl |
NaOH |
|
Fe |
Ca(OH)2 |
Cu |
- Настільні ігри (гра-мозаїка, "лото Менделєєва", доміно). Їх можна використати при вивченні будови неорганічних та органічних сполук, апаратури хімічних виробництв, назви хімічних елементів.
- Сюжетно-рольові ігри – це навчальні дискусії. Різновидність групової роботи, ситуаційні задачі, захист навчальних проектів. Прикладом рішення проблемної ситуації являється урок-семінар з теми "Нітроген та його сполуки" під девізом "Науки виникли з практичних потреб людини" і "Узагальнення спостережень дозволяє сталі закономірності"
Програма А
Проблема розробки методів зв’язування азоту – одна за найважливіших проблем технології. У 1913р. Міжнародна асоціація хіміків заснувала нагороду за розробку доступного методу зв’язування азоту.
Спробуйте вирішити цю проблему, запропонувавши конструкцію апарату, в якому можливо отримати:
а)амоніак; б)нітроген(ІІ) оксид; в) амоніак з нітридів
Усі вузли апарату замалюйте і дайте обґрунтування їх доцільності.
Програма В
Поясніть, в чому складаються труднощі в добуванні:
а)амоніаку, б) нітроген(ІІ) оксид, в)нітридів.
Які умови додержуються при виробництві цих речовин
Програма С
а) Намалюйте схему електронної будови атому нітрогену і молекули азоту
б) Опишіть хімічні властивості:
а)азоту, б)поясніть, при яких умовах азот реагує з воднем
- Творчі ігри стимулюють до самостійного здобуття знань та творчому їх застосуванню. При вивчені теми "Карбон та Силіцій" я звертаю увагу на хімізм та технологію виробництва скла, цементу та цегли. Учні отримують завдання:
1.Вас призначили директором побудованого в нашій області силікатного заводу. Організуйте роботу таких відділів: а) постачання б) головного технолога, в) відділу кадрів, г)реалізації продукції, д) раціонального використання відходів виробництва.
2.Ви керуєте проектним інститутом який займається виробництвом цементу. Організуйте роботу відділів: а) раціонального використання природних ресурсів, б) технології цементу, в) інженерів-конструкторів, г) традиційного і перспективного використання цементу, д)охорони навколишнього середовища.
Учні звертаються за допомогою до вчителів історії, географії, фізики, математики, біології, креслення. Ділові ігри завжди супроводжуються великим інтересом учнів до вивченого матеріалу.
Підбираючи систему завдань і задач, я прагну, щоб кожна задача була вирішена швидко і безпомилково, а щоб рішення було творче і щоб з цього можна було взяти як найбільше користі для хімічного розвитку учнів і щоб задана задача відповідала рівневі розвитку учня.
Наприклад, звернемося до різних підходів складання завдань з теми "Кількість речовини. Моль" вчителем і використанням вивчених формул учнями.
Похідні дані для складання варіантів простих задач.
|
Речовина |
Фізичні величини, їх одиниці |
|||||||
|
Постійні |
Змінні |
|||||||
|
Ar Mr |
M (г/моль) |
NА (моль-1) |
VM (л/моль) н.у |
ν (моль) |
m (г) |
N |
V (л) |
|
|
Mg |
24 |
24 |
6,02∙1023 |
– |
х1 |
48 |
х2 |
– |
|
CO2 |
44 |
44 |
6,02∙1023 |
22,4 |
20 |
х1 |
х2 |
х3 |
Складання складних і комбінованих задач
|
Формули речовин |
Фізичні величини речовин і значення їх одиниць |
||||||
|
Їх агрегатний стан |
NА (1/моль) |
N (частинки) |
M (г/моль) |
Ar Mr |
m (г) |
VM (л/моль) н.у |
V (л) |
|
H2 O2 CO2 |
6,02∙1023 |
6,02∙1023 |
2 |
2 |
х1 |
22,4 |
х2 |
|
H2O Br2 H2SO4 |
|
|
|
|
|
|
|
|
Fe NaCl CaO |
|
|
|
|
|
|
|
Застосування формул учнями з різними рівнями розвитку
- Прості задачі (прямі)
![]()
![]()
![]()
- Задачі прості (зворотні)
![]()
![]()
![]()
![]()
- Задачі складні і комбіновані:
![]()
![]()
![]()
![]()
![]()
![]()
Розв’язування задач забезпечує систематичність, безперервність навчання, постійний зв’язок з життям. Кожна задача – це неповторна єдина у своєму роді життєва проблема, змодельована реальна ситуація. Тому для активізації навчального процесу і розвитку креативності, пропоную учням такі проблемні задачі:
- Як, виходячи з метану, одержати аміно оцтову кислоту?
- Скільки нових простих і складних речовин можна одержати, виходячи з сульфатної кислоти, цинку, води, сульфату натрію, купрум (І) оксиду?
Формування вищого ступеню креативності дають розв’язування творчих задач. Відповідно до мети, з якою використовуються творчі задачі, їх можна поділити на 2 типи: задачі на закріплення знань; задачі на формування вміння здобувати знання самостійно.
Наведу приклади задач творчого характеру.
Задача №1. Стічні води хімічного комбінату містять аміак. Запропонуйте спосіб нейтралізації аміаку, який можна застосувати в народному господарстві.
Задача №2. Ви вирушаєте в космос. Основне, що буде вам необхідно, це тепло, вода, кисень. Які речовини ви везете із собою? Чому?
Додаток
З чого складається повітря
Лавуазьє невеличкий дослід зробив,
Новий склад повітря тоді він відкрив.
Найбільшу частку займає азот
У повітрі зовсім немає кислот,
А тільки кисень, гелій, неон,
Азот, криптон та аргон.
Кисень займає лиш п’яту частину
Не можна його покласти в корзину
Кисень підтримує наше життя
Без нього немає нашого буття.
Дослід Лавуазьє з нами буде завжди
І не накличе нехай він біди
Хімічні злодії
Як ми знаємо усі,
Є хімічні злодії
Є один їдкенький луг
Шкодить який всім навкруг.
Річ у тім, що він завжди
Роз’їдає нам штани
І залізо, і халат –
Все йому в один лиш шаг.
Шкіра – теж це не проблема,
Він роз’їсть її миттєво.
Якщо трапилась біда,
Не турбуйтесь господа.
Треба воду взяти нам
І промити тільки там
Миєм довго, довго миєм
Миєм доти, доки змиєм
Отже люди, просим Вас,
Не беріть, що не для Вас!!!
Додаток
Зразки
оформлення задач з хімії
Будь-яку задачу з хімії слід оформлювати за зразком:
|
Дано:
|
Розв’язування:
Відповідь:
|
|
?
|
Задача 1. Сполука масою 80 г містить 32 г Оксигену. Обчислити масову частку Оксигену в сполуці.
|
Дано: m (сполуки) = 80 г m (О) = 32 г
|
Розв’язування:
або:
Відповідь: 0,4 або 40%.
|
|
w (О) - ? |
Задача 2. Визначити молекулярну формулу сполуки Феруму з Хлором, якщо відомо, що масова частка Феруму становить 35 %, а Хлору – 65 %.
|
Дано: w (Fe) = 35 % w (Cl) = 65 %
|
Розв’язування:
Числа x, y не є цілими, тому ділимо їх на найменше число
Відповідь: FeCl3. |
|
FexCly – ?
|
Задача 3. Обчисліть кількість речовини, що містить 3,01∙1023 молекул вуглекислого газу.
|
Дано: N(CO2)=3,01∙1023 |
Розв’язування:
Відповідь: 0,5 моль.
|
|
n (CO2) = ? |
Додаток
Фосфорная сказка
Жила-була одна нещаслива сім'я. Ріс в ній син Фосфор. Він був дуже красивим і розумним хлопчиком, тільки друзів у нього не було, тому що Фосфор був отруйним. Кожен, хто торкався до нього, ставав жабою. Коли Фосфор ходив на дискотеку, він висвітлював усі приміщення, бо в темряві світився. Одного разу його запросили на бал. Одягнув Фосфор білий костюм і пішов.
На балу Фосфор сидів у куточку і дивився на одну прекрасну дівчину, яка теж дивилася на нього. У залі горіло світло, було дуже душно, так як повітря в закрите приміщення не надходив.
Фосфор весь змучився від спеки і духоти, а коли подивився на свій костюм, то побачив, що той став темно-червоного кольору. «Як же так? Що за чудеса? »- Подумав він. Тут раптом підійшла та дівчина, яка йому сподобалася, і між ними зав'язалася розмова. Вона простягла до фосфору руку, але він скрикнув:
- Не торкайтеся до мене! Я отруйний!
- Що за нісенітницю ви говорите? Я бачу, що ви хороший жартівник! Ходімо танцювати!
Фосфор закрив очі, щоб не бачити, як дівчина перетворюється на жабу. «Але що це таке? Перетворення не сталося. Знову чудеса », - подумав він. Вони протанцювали весь вечір. Фосфор забув про своє горе. Він не знав, як усе це сталося, тому що в той час погано обізнаний з хімічною наукою.
Тепер Фосфор став найщасливішою людиною на світі, він дуже змінився: став не отруйний і навіть не світився в темряві. Батьки його їм дуже пишаються. Фосфор багато сил доклав для вивчення складної, але цікавої науки хімії і тепер став великим фахівцем в технології отримання фосфорної кислоти і в сірниковому виробництві.
Казка про соляну кислоту
Жила-була дівчинка, її звали Соляна Кислота. Вона жила далеко від бабусі Води. І ось одного разу дівчинка пішла до бабусі. А в цей день вийшов на полювання грізний Калій. І він, випередивши Соляну Кислоту, прийшов до Воді, напав на неї і перетворився на Гідроксид Калію, а від бабусі залишилося тільки хмара водню:
2К + 2Н2О → 2КОН + Н2.
Коли внучка зайшла в будиночок бабусі, на неї несподівано накинувся Гідроксид Калію. Вона не встигла втекти, і знову відбулося перетворення - Гідроксид Калію перетворився на Хлорид Калію. Тут, звідки ні візьмися, з'явилася бабуся Вода:
КОН + НСl → КСl + Н2О.
Оскільки Вода була дуже мудрою, вона знала, як можна звільнити свою внучку. Вона покликала на допомогу Сірчану (Сульфатну) Кислоту, і та з радістю допомогла - звільнила Соляну кислоту:
H2SO4 + 2KCl → K2SO4 + 2HCl
Додаток
Продукти
Наші предки-мисливці їли багато м'яса, але їх кислотна навантаження врівноважувалася вуглеводами з фруктів і овочів. Сьогодні хліб і макарони - основа західної дієти - виробляють багато кислоти, тому що в них міститься багато фосфору, який організм перетворює на фосфорну кислоту. За останні 40 років споживання нами білків, перетворюються на кислоту, збільшилася на 50%. І якщо не нейтралізувати м'ясо зеленню, що виробляє підстави, то нам не в силах допомогти білок з наших власних тканин.
Але найбільшу загрозу нашим кісткам несуть тверді сири: начинені кальцієм і тому рекомендовані для захисту кісток, вони є основним джерелом кислоти в організмі і головним винуватцем «корозії» кісток! Зауважте, що молоко поки що поза підозрою, бо що в ньому міститься приблизно однакова кількість інгредієнтів, які перетворюються в кислоти і підстави, а в процесі приготування твердих сирів разом з рідиною видаляються компоненти, які перетворюються в організмі в підстави.
Горілка. Рекомендується запивати горілку мінеральною водою типу «Боржомі» так як Ph боржомі збігається з Ph крові і, потрапляючи в кров, «Боржомі» знижує концентрацію алкоголю в крові.
Природна вода завжди має кислу реакцію (рН менше 7) через те, що в ній розчинений вуглекислий газ; при його реакції з водою утворюється кислота: СО2 + Н2О → Н + + НСО32-. Якщо наситити воду вуглекислим газом при атмосферному тиску, рН отриманою «газованої води» буде дорівнює 3,7; таку кислотність має приблизно 0,0007%-ний розчин соляної кислоти - шлунковий сік набагато кисліше! Але навіть якщо підвищити тиск CO2 над розчином до 20 атм, значення pH не опускається нижче 3,3. Це означає, що газовану воду (в помірних кількостях, звичайно) можна пити без шкоди для здоров'я, навіть якщо вона насичена вуглекислим газом.
Консервування. Різні мікроорганізми також дуже чутливі до кислотності середовища. Так, патогенні мікроби швидко розвиваються в слабій кислотному середовищі, тоді як кислу середу вони не витримують. Тому для консервування (маринування, соління) продуктів використовують, як правило, кислі розчини, додаючи в них оцет або харчові кислоти.
Вода. Звичайно рівень рН знаходиться в межах, при яких він безпосередньо не впливає на споживчі якості води. Так, в річкових водах pH зазвичай знаходиться в межах 6.5-8.5, в атмосферних опадах 4.6-6.1, у болотах 5.5-6.0, в морських водах 7.9-8.3. Тому ВООЗ не пропонує будь-якої рекомендованої за медичними показниками величини для рН.
Разом з тим відомо, що при низькому рН вода володіє високою корозійною активністю, а при високих рівнях (рН більше 11) вода набуває характерну милкості, неприємний запах, здатна викликати подразнення очей та шкіри. Саме тому для питної та господарсько-побутової води оптимальним вважається рівень рН в діапазоні від 6 до 9.
Споживання великої кількості тваринних жирів, солодкого, алкоголю, кави та нікотину, а також часті стреси призводять до порушення цієї рівноваги, а саме - "переокисняють" організм. З тканин кислі продукти обміну повністю не виводяться, а затримуються в міжклітинної рідини у вигляді солей, провокуючи розвиток багатьох хвороб. До речі, горезвісний целюліт - теж наслідок порушення кислотно-лужної рівноваги організму. Поправити баланс, а значить, і захистити себе від недуг допоможуть правильне харчування і спеціальні очисні процедури.
Ці харчові продукти відновлюють кислотно-лужний баланс, тому їх слід чаші включати в раціон харчування:
листові салати
пророслі злаки
майже всі види овочів
картопля
сухофрукти
горіхи, мигдаль
вода без газу
Картопля утворює в організмі надлишок лугу, що робить його незамінним продуктом при "переокиснення". Лужні напої (такі, як молочна сироватка, зелений чай, лужна мінеральна вода) також дуже корисні.
Ці харчова продукти не слід занадто часто включати в меню, так як вони "переокиснюють" організм:
м'ясо і рибні вироби з білої муки
каву, чорний чай
лимонад, який містить цукор
кондитерські вироби
До речі, не все, що має кислий смак, перетворюється в організмі в кислоту! Наприклад, при перетравленні кислого яблука утворюються головним чином лужні з'єднання!
Як визначити надлишок кислоти в організмі? Для цього в аптеках
продаються Спеціальні смужки, які визначають кислотно-лужний показник сечі. Цифра нижче 7 свідчить, що у вашому організмі є надлишкова кислота. Показник вище 7 свідчить про те, що у вас все в порядку. Процедура вимірювання проводиться вранці після сну і потім кілька разів протягом дня.
лужного стану вашого організму.
Виключно ефективно вплив кави на шлунково-кишковий тракт. Тут повною мірою виявляється збудливу, стимулюючу дію не тільки кофеїну, але й кислот, ароматичних і смакових речовин, утворюються в процесі обсмаження кави. Шлункова секреція, що викликається кави, рівносильна дії всіма визнаного активатора секреторної реакції - м'ясного бульйону. Через 20-30 хвилин після прийняття чорної кави кислотність у шлунку досягає максимуму. Зі збільшенням концентрації напою в шлунковому вмісті збільшується вміст вільної соляної кислоти, зростає загальна кислотність, що прискорює перетравлення та евакуацію їжі зі шлунка.
Кава, збільшуючи виділення шлункового соку, сприяє підвищенню засвоюваності їжі. Недарма у багатьох народів прийнято подавати чорну каву після сніданку та обіду.
Чорна кава як сильний збудник шлункової секреції повинен бути виключений з раціону хворих виразковою хворобою і гіперацидним гастритом. Любителям кави при цих захворюваннях можна рекомендувати вживання кави з молоком, вершками і цукром, так як при цьому збудливий вплив кави на шлункову секрецію значно зменшується.
Практично всі рослинні соки мають властивості виправляти кислотно-лужну рівновагу крові, що порушується при стомлюючої роботи. Це пов'язано з перевагою в них лужних залишків. Соки підвищують активність ферментів та обмін речовин, забезпечують знешкодження "токсинів втоми" і їх виведення з організму. В овочевих соках менше органічних кислот, саме тому вони більш прісні на смак, але зате багатша мінеральними речовинами (такими, як: калій, натрій, кальцій, залізо та ін.) Крім цього, саме овочеві соки дуже ефективно відновлюють наш організм в кризових ситуаціях. Фруктові, як правило, мають більш високу калорійність, оскільки в них більше цукру, але вони і чудово очищають наш організм.
Єдине, чим консервовані соки не поступаються свіжим сокам - це вмістом мінеральних речовин. Тому, купуючи консервований сік, ви повинні звернути увагу на назву напою. Якщо на ньому написано слово "drink", то в ньому вміст самого соку не перевищує 10-15 відсотків, решта - це вода, лимонна кислота аскорбінова, а також різні фарбники і консерванти.
В "нектарі" міститься 50 відсотків соку, а все інше – вище перелічені інгредієнти. Зустрічаються і написи на упаковці, що свідчать про "100-процентному соку". Однак і тут не слід спокушатися, тому як такий сік теж приготований з концентрованого продукту з додаванням води й цукру, що вже ніяк не говорить про його стовідсотковість.
Розрахункові задачі з урахуванням виходу продукту реакції
Вихід продукту реакції ![]() — це відношення маси (об’єму, кількості речовини) фактично отриманого продукту до максимально можливого, обчисленого за рівнянням реакції. Виражається в частках одиниці чи відсотках і обчислюється за формулою:
— це відношення маси (об’єму, кількості речовини) фактично отриманого продукту до максимально можливого, обчисленого за рівнянням реакції. Виражається в частках одиниці чи відсотках і обчислюється за формулою:![]() .
.
Задача. Яку масу сульфатної кислоти можна одержати з 40 г сульфур(VI) оксиду, якщо вихід реакції 80 % (0,8)?
Розв’язання
1) Записуємо рівняння реакції:![]() .
.
2) Знайдемо кількість речовини сульфур(VI) оксиду:![]() ;
; ![]() ;
; ![]() .
.
3) Відповідно до рівняння реакції:![]() моль.
моль.
4) Визначимо, яку масу мають 0,5 моль сульфатної кислоти:![]() ;
; ![]() ;
;![]() (г).
(г).
Масу продукту реакції, обчислену без обліку втрат за рівнянням реакції, називають теоретичним виходом ![]() . Він завжди дорівнює 100 %.
. Він завжди дорівнює 100 %.
5) Обчислимо практично отриману масу сульфатної кислоти ![]() , чи практичний вихід:
, чи практичний вихід:![]() ,
, ![]() .
.
Практично отримана маса повинна бути меншою за масу, обчислену за рівнянням реакції: 39,2 г < 49 г.
Відповідь: ![]() г.
г.
Задача. Яку масу сульфур(VI) оксиду необхідно взяти для одержання 73,5 г сульфатної кислоти, якщо вихід реакції 75 %?
Розв’язання
У задачі дано масу сульфатної кислоти, яку треба одержати фактично. Використовувати практичні дані для розрахунків за хімічними рівняннями не можна, необхідно перейти до теоретичних даних.
1) Записуємо рівняння реакції: ![]() .
.
2) За ![]() розраховуємо масу сульфатної кислоти, необхідну для теоретичних розрахунків
розраховуємо масу сульфатної кислоти, необхідну для теоретичних розрахунків ![]() :
:![]() ,
,![]() .
.
3) Визначимо кількість речовини сульфатної кислоти:![]() ;
; ![]() ;
; ![]() .
.
4) За рівнянням реакції кількості сульфатної кислоти й сульфур(VI) оксиду рівні, отже, ![]() .
.
5) Знаходимо масу витраченого сульфур(VI) оксиду:![]() ;
; ![]() ;
; ![]() .
.
Відповідь: ![]() г.
г.
Задача. Із сульфур(VI) оксиду масою 40 г було отримано 41,16 г сульфатної кислоти. Обчисліть вихід продукту реакції.
Розв’язання
1) Записуємо рівняння реакції: ![]() .
.
2) Практично отримана маса сульфатної кислоти ![]() г. Для визначення виходу продукту реакції потрібна ще й теоретично обчислена маса.
г. Для визначення виходу продукту реакції потрібна ще й теоретично обчислена маса.
3) Знайдемо кількість речовини сульфур(VI) оксиду:![]() ;
; ![]() ;
; ![]() .
.
4) За рівнянням реакції кількості сульфатної кислоти й сульфур(VI) оксиду рівні, отже, ![]() .
.
5) Обчислимо масу сульфатної кислоти за рівнянням реакції ![]() :
:![]() ;
; ![]() ;
; ![]() .
.
6) Знайдемо вихід продукту реакції:![]() ;
; ![]() .
.
Відповідь: ![]() %.
%.
Додаток
Хімічні закони.
Закон ідеальної чистоти.
Якщо в лабораторії щодня проводити прибирання, а не синтези, то в ній буде ідеальна чистота.
Закон паралельних реакцій.
В системі паралельних реакцій найбільш імовірний той процес, який найменш бажаний.
Правило неповторності.
Ніколи не намагайтеся повторити вдалий експеримент.
Принцип подібності
Гаряча колба виглядає так само, як і холодна.
Закон необхідності.
Вихід продукту реакції обернено пропорційний необхідності його синтезу.
Наслідок:
Найкраще виходять непотрібні речовини.
Принцип піраміди.
Вихід в кожній стадії багатоступінчастого синтезу обернено пропорційний числу стадій.
Слідство.
Чим більше часу займає синтез - тим більша ймовірність отримання як продукту вихідного реагенту.
Закон збереження бруду.
Не можна щось очистити, нічого не забруднивши.
Слідство.
Можна, нічого не очистивши, забруднити все.
Пірозакон.
Найчастіше пожежі в лабораторіях відбуваються, коли поруч знаходиться декан.
Висновок:
Наш декан - екстрасенс і піроман.
Додаток
Загальна характеристика розчинів. Класифікація.
Розчином називається гомогенна система (гомогенна суміш), що складається з двох і більше компонентів, одним із яких є розчинник, а інші – розчинені речовини. Розчинником є та речовина, що кількісно переважає і знаходиться в такому ж агрегатному стані, що і розчин.
Розчинністю називається здатність речовини розчинятися в даному розчиннику при даній температурі. Мірою розчинності речовини є концентрація її у насиченому розчині.
Розчини бувають: насичені, пересичені і ненасичені. Насиченим вважається розчин, що знаходиться в рівновазі з речовиною, що розчиняється. У насиченому розчині міститься гранична за даних умов кількість розчиненої речовини. Розчин є пересиченим, якщо в ньому міститься розчиненої речовини більше, ніж визначено межею розчинності. Розчин, що містить речовини менше, чим визначено межею розчинності, називається ненасиченим.
На практиці розчинність речовини часто виражають коефіцієнтом розчинності, який показує масу речовини, що розчиняється при даній температурі в 100 г розчинника з утворенням насиченого розчину.
Способи вираження концентрації розчинів.
Важливою характеристикою будь-якого розчину є відносний вміст у ньому розчиненої речовини і розчинника, що називається концентрацією. Кількісно концентрація може виражатися різними способами: відношенням мас, об’ємів, кількості молів, відношенням маси до об’єму і, навпаки, кількості молів до маси чи об’єму і т.д. На практиці найчастіше використовують такі способи вираження концентрації:
- Молярна частка - відношення кількості даного компонента до загальної кількості речовин у розчині. Для двокомпонентних розчинів
![]() ; х1 + х2 = 1.
; х1 + х2 = 1.
- Масова (об’ємна) частка – відношення маси (об’єму) розчиненої речовини до загальної маси (об’єму) розчину:
![]() ;
; ![]() ;
;
Частки виражають у частинах від одиниці або у відсотках.
3. Молярна концентрація – відношення кількості розчиненої речовини до об’єму розчину:
![]() .
.
Одиниця молярної концентрації у СІ – моль/м3, але найчастіше застосовується одиниця моль/л, яку скорочено позначають М .
4. Моляльна концентрація (моляльність) – відношення кількості розчиненої речовини до маси розчинника в кілограмах:
![]() (моль/кг, або m).
(моль/кг, або m).
Вона показує кількість молів розчиненої речовини, що припадає на 1 кг (1000 г) розчинника.
- Молярна концентрація еквівалентів (нормальна концентрація, нормальність) – відношення кількості еквівалентів розчиненої речовини до об’єму розчину:
![]() (моль/л, або н),
(моль/л, або н),
де Еm – молярна маса еквівалентів розчиненої речовини, m1(m2) – маса розчиненої речовини (розчинника), г; M – молярна маса розчиненої речовини, г/моль; V – об'єм розчину, л; n1(n2) – кількість молів розчиненої речовини (розчинника).
- Титр – відношення маси розчиненої речовини в грамах до об’єму розчину (указує на масу в грамах розчиненої речовини, що міститься в одному міллілітрі розчину):
![]() (г/мл).
(г/мл).
Методика розв'язання типових задач.
Приклад 1. При 60 С масова частка солі насиченого розчину калій нітрату становить 52,4 %. Визначте коефіцієнт розчинності солі при цій температурі.
Розв'язання. Коефіцієнт розчинності знаходимо із пропорції:
на 47,6 г Н2О припадає 52,4 г КNO3
на 100 г Н2О -//- x г КNO3
![]() г.
г.
Отже, розчинність КNO3 при 60 С становить 110 г в 100 г води.
Приклад 2. Визначте моляльну і молярну концентрації та молярну концентрацію еквівалентів розчину сульфатної кислоти з масовою часткою 15 % ( = 1,10 г/мл).
Розв'язання. 1) Для розрахунку моляльної концентрації треба визначити спочатку масу сульфатної кислоти, яка припадає на 1000 г води:
1000 : 85 = х : 15
![]()
Молярна маса H2SO4 становить 98 г/моль, отже
![]() моль/кг
моль/кг
2) Для розрахунку молярної концентрації та молярної концентрації еквівалентів потрібно визначити масу сульфатної кислоти, що міститься в 1 л (1000 мл), тобто в 1000 1,1 = 1100 г розчину.
1100 : 100 = у : 15,
![]() г.
г.
Поділивши цю масу на молярну масу сульфатної кислоти, визначаємо молярну концентрацію розчину:
СМ =![]() = 1,68 моль/л або 1,68 М;
= 1,68 моль/л або 1,68 М;
а поділивши на молярну масу еквівалентів H2SO4
![]() г/моль,
г/моль,
одержимо молярну концентрацію еквівалентів розчину:
СЕ = ![]() = 3,37 моль/л або 3,37 н.
= 3,37 моль/л або 3,37 н.
Приклад 3. Обчисліть маси розчинів сульфатної кислоти з масовими частками 15 % і 60 %, які треба змішати для приготування 100 л розчину з масовою часткою 36 % ( = 1,273 г/мл).
Розв'язання. Задачу розв’язують за правилом змішування, яке виражається формулою:
![]()
![]() С1 С-С2 (m1)
С1 С-С2 (m1)
![]()
![]() С
С
С2 С1-С (m2)
Підставляючи дані у формулу, одержимо:
![]()
![]() 60 21 (7)
60 21 (7)
![]() 36
36
![]() 15 24 (8)
15 24 (8)
Масове співвідношення вихідних речовин 7 : 8. Маса 100 л розчину H2SO4 з масовою часткою 36 % становить 100 1,273 = 127,3 кг. Для приготування 15 кг розчину з масовою часткою 36 % треба змішати 7 кг розчину з масовою часткою 60 % і 8 кг розчину з масовою часткою 15 %, а для приготування 127,3 кг розчину з масовою часткою 36 % необхідно х1 кг розчину з масовою часткою 60 % і х2 кг розчину з масовою часткою 15 %:
х1 = ![]() = 59,4 кг;
= 59,4 кг;
х2 = ![]() = 67,9 кг.
= 67,9 кг.
Приклад 4. Визначте титр розчину H2SO4 з молярною концентрацією еквівалентів 0,5 моль/л.
Розв'язання. Молярна маса еквівалентів сульфатної кислоти становить
![]() г/моль.
г/моль.
Розчин сульфатної кислоти H2SO4 з молярною концентрацію еквівалентів 0,5 моль/л буде містити 0,5 49 = 24,5 г/л, а 1 мл буде містити в 1000 раз менше, тобто
![]() г/мл;
г/мл;
Приклад 5. Визначте молярну концентрацію та молярну концентрацію еквівалентів розчину сульфатної кислоти, титр якого становить 0,00049 г/мл.
Розв'язання. 1) Молярна маса сульфатної кислоти: М(H2SO4) = 98 г/моль. Знаходимо молярну концентрацію її розчину:
![]() моль/л.
моль/л.
2) Молярна маса еквівалентів сульфатної кислоти становить
![]() г/моль
г/моль
Знаходимо молярну концентрацію еквівалентів сульфатної кислоти:
![]() моль/л.
моль/л.
Приклад 6. Скільки літрів розчину AgNO3 з молярною концентрацією еквівалентів 0,1 моль/л необхідно для обмінної реакції з 0,5 л розчину AlCl3 з молярною концентрацію еквівалентів 0,3 моль/л?
Розв'язання. У зв’язку з тим, що об’єми реагуючих одна з одною речовин обернено пропорційні їх концентраціям, які виражені через молярні концентрації еквівалентів, можна скористатися формулою :
![]() ;
;
![]() л розчину.
л розчину.
Можна міркувати і так:
В 0,5 л розчину AlCl3 з молярною концентрацією еквівалентів 0,3 моль/л міститься 0,5 0,3 = 0,15 еквівалента. Для взаємодії з даною кількістю AlCl3 потрібне таке ж число еквівалентів AgNO3, тобто 0,15. В 1 л розчину AgNO3 міститься 0,1 еквівалента, а 0,15 еквівалента буде міститися в 1,5 л розчину.
Приклад 7. При 25 С тиск насиченої пари води становить 3,168 кПа. Визначте при цій же температурі тиск насиченої пари над водним розчином карбаміду (сечовини) CO(NH2)2 з масовою часткою 5 %.
Розв'язання. Для розрахунку за формулою P1 = N1P0 (згідно 1 закону Рауля) треба обчислити молярну частку розчинника. В 100 г розчину міститься 5 г карбаміду і 95 г води. Молярні маси карбаміду і води становлять М(CO(NH2)2 = 60,05 г/моль і M(H2O) = 18,02 г/моль. Кількість води і карбаміду відповідно становить:
n1 = 95 : 18,02 = 5,272 моль;
n2 = 5 : 60,05 = 0,083 моль.
Знаходимо молярну частку води:
![]() .
.
Отже, Р1 = 0,985 3,166 = 3,119 кПа.
Приклад 8. Визначте молекулярну масу органічної речовини, якщо розчин, який містить 0,83 г цієї речовини в 20 мл води, замерзає при температурі – 0,7 С.
Розв'язання. Виходячи із 2 закону Рауля
(![]() ),
),
молекулярна маса речовини визначається за формулою:
![]() ,
,
де К – кріоскопічна стала (для води К = 1,86), m – маса розчиненої речовини (г), L – маса розчинника (г), t – зниження температури замерзання.
Підставляючи відповідні значення в рівняння, знаходимо:
![]() .
.
Приклад 9. Визначте осмотичний тиск розчину при температурі 20 С, 100 мл якого містить 20 г глюкози C6H12O6.
Розв'язання. Згідно закону Вант-Гоффа осмотичний тиск визначається рівнянням: = СMRT, де СM - молярна концентрація, яка становить:
![]() ,
,
звідси
![]() кПа.
кПа.
Приклад 10. Визначте ізотонічний коефіцієнт для 0,2 М розчину електроліту, якщо відомо, що в 1 л цього розчину міститься 2,18 1023 частинок (молекул і іонів) розчиненої речовини.
Розв'язання. Число молекул електроліту, взятих для приготування 0,2 л розчину, становить 6,02 1023 0,2 = 1,20 1023, при цьому в розчині утворилося 2,18 1023 частинок розчиненої речовини. Ізотонічний коефіцієнт показує, в скільки разів останнє число більше числа взятих молекул, тобто
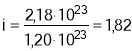 .
.
Приклад 11. Обчисліть концентрацію іонів водню в 0,1 М розчині гіпохлоритної кислоти НОСl ( К = 5 10-8).
Розв'язання. На основі закону розведення Оствальда знаходимо ступінь дисоціації НОСl
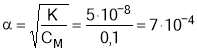 .
.
Звідси
H+ = см = 7 10-4 0,1 = 7 10-5 моль/л.
Приклад 12. Розчинність магній гідроксиду Mg(OH)2 при 18 С становить 1,7 10-4 моль/л. Визначте добуток розчинності Mg(OH)2 при цій температурі.
Розв'язання. При розчиненні кожного моля Mg(OH)2 в розчин переходить 1 моль іонів Mg2+ і вдвічі більше іонів OH-. Отже в насиченому розчині Mg(OH)2:
[Mg2+] = 1,7 10-4 моль/л, [OH-] = 3,4 10-4 моль/л.
Звідси:
ДР(Mg(OH)2) = [Mg2+] [OH -] = 1,7 10-4 (3,4 10-4 )2 =
= 1,96 10-11.
Приклад 13. Визначте розчинність барій сульфату при 25 С, якщо ДР(BaSO4) = 1,1 10-10.
Розв'язання. Невідому розчинність BaSO4 (моль/л) позначимо через х. Очевидно, що х молів BaSO4 при дисоціації створять концентрації
[Ba2+] = [SO42-] = х моль/л.
Тому:
ДР(BaSO4)= [Ba2+] [SO42-] = хх = х2 = 1,1 10 –10,
aбо х2 = 1,110 –10, х = ![]() = 1,05 10 –5 моль/л.
= 1,05 10 –5 моль/л.
Якщо виразити розчинність у грамах на 1 л (у), то множать кількість молів на молярну масу
у = 1,05 10–5 233,4 = 245 10–5 = 2,45 10–3 г/л.
Додаток
Цікаві досліди по хімії
Кров без рани.
Для проведення цього досвіду в одній скляночки готують ~ 100мл слабо-жовтого (3-процентного) розчину хлориду заліза (|||), а раптом стільки ж 3-процентного розчину роданида калію (інша назва - тіоціанід калію). В принципі можна брати будь-яку сіль, яка містить роданид, але калій роданид найбільш доступний. Також заздалегідь готують розчин фториду натрію (калію) і змочують їм невелику ганчірочку.
Для демонстрації цього досвіду зручно використовувати дитячий пластмасовий ніж, але також можна взяти тупий кухонний ніж з можливо більш широким лезом. Ваткою, змоченою розчином хлориду заліза (|||) протирають долоню, а ніж змочують розчином роданида калію. При цьому треба прагнути до того, щоб на ножі і на долоні залишилося якомога більше відповідних розчинів. Якщо тепер провести ножем по долоні, то на підлогу рясно капають краплі "крові ". Після закінчення досвіду долоню протирають ганчірочкою, змоченою розчином фториду натрію і ретельно миють руки.
В основі цього досвіду лежить взаємодія іонів Fe3 + з іонами SCN -, при цьому утворюється криваво-червоне комплексне з'єднання - роданид заліза (|||):
FeCl3 + 3KSCN =u003e 3KCl + Fe (SCN) 3
Примітка: роданид калію - дуже токсична речовина, тому будьте обережні при роботі з ним.
Примітка 2: якщо ви збираєтеся показати цей досвід батькам, то попередьте їх, будь ласка, про те, що це всього лише досвід, т. до. при правильному проведенні він дуже реалістичний.
Дим без вогню
Беруть 2 конічні колби з шийками одного діаметра , одну з них наповнюють аміаком, іншу - хлороводородом . Не забудьте, який газ важче, а який - легше повітря! Потім колби з'єднують шийками і перевертають , після чого можна спостерігати білий дим утворився хлориду амонію.
Отримання "золота ".
Готують рівні об'єми 3%- ного розчину иодида калію і 4 %- ного розчину ацетату свинцю. Перед досвідом розчини доводять до кипіння і гарячими зливають разом в колбу. При охолодженні в осад випадає йодид свинцю, який добре розчинний в гарячій воді, але досить мало в холодній (менше 0.1 %). Осад утворюється у вигляді тонких блискучих на світлі лусочок золотистого кольору. Розміри їх залежать від швидкості охолодження, чим повільніше охолоджується розчин, тим крупніше кристали.
Незгораюча хустка.
Невеликий хустинку занурюють у розчин силікату натрію (змішують силікатний клей з водою у відношенні 1:10), добре змочують і віджимають. Потім хустинку беруть за куточок пінцетом , занурюють у склянку з ацетоном (можна брати етиловий спирт, денатурат , бензин та інші легкозаймисті рідини) , виймають і тут же підпалюють над полум'ям спиртівки або за допомогою лучинки . Ацетон швидко згоряє, а хустинку залишається неушкодженим (справа в тому, що ацетон має настільки малу теплоту згоряння, що тепла ледь вистачає на те, щоб просушити хустку , тому хустинку можна просто злегка змочити водою). Після досвіду хустинку начисто відпирають в теплій воді і його знову можна використовувати за призначенням
"Золотий дощ. "
Існує безліч речовин із сильною залежністю температурної розчинності. Саме на цьому явищі і заснований даний досвід. Для проведення цього досвіду необхідно зважити рівні кількості ацетату свинцю (| |) і йодиду калію. Я раджу по 0,5 м. Далі готують два розчини. У два хімічних склянки наливають по 50 мл дистильованої води. В один додають ~ 1 мл столового оцту (або ~ 0,2 мл концентрованої оцтової кислоти) і розчиняють ацетат свинцю. Кислота додається для того, щоб придушити гідроліз іонів Pb2 +. У другому розчиняють KI. Потім обидва розчини зливають в колбу з вогнетривкого скла об'ємом 150мл. При цьому відбувається реакція подвійного обміну між ацетатом свинцю і йодидом калію:
Pb (CH3COO) 2 + 2KI =u003e 2KCH3COO + PbI2
Після змішування розчинів випадає жовтий осад йодиду свинцю (||). Суміші розчинів в колбі необхідно дати відстоятися, щоб осад осел повністю. Після цього з осаду обережно зливають рідину і замість неї доливають 100мл дистильованої води. Тепер розчин необхідно нагріти до кипіння і кип'ятити протягом 2-3хв. Осад повинен розчинитися повністю.
Якщо все було зроблено правильно, то після охолодження розчину випаде безліч золотистих кристалів, які при струшуванні колби будуть парити в товщі води. Розмір кристалів дуже сильно залежить від швидкості охолодження: чим повільніше охолоджувати, тим більшими і красивими будуть кристалики. Для більшої їх міцності перед кип'ятінням у розчин додають трохи гліцерину (~ 0,5 мл на 100 мл розчину.
Додаток
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
По вертикалі : 1. Технічна назва кристалогідрату сульфату важкого металу.
2. Вибухова суміш нітрату амонію з твердими горючими веществамі.4 . Неорганічне речовина, яку додають до руди при виплавці металів, щоб знизити температуру плавлення. 5. Мінерал, водний сульфат кальцію. 7. Російський вчений- революціонер , який передбачив існування- інертних газів. 8. Благородний метал. 12. Агрегатний стан речовини , в якому його частки не пов'язані або вельми слабо пов'язані силами взаємодії і рухаються вільно, заповнюючи весь наданий їм об'єм. 13. Позитивно чи негативно заряджений атом.15. Газ, вперше вивчений англійським ученим Г. Кавендіш. 16. Мінерал, волокниста модифікація кварцу.
По горизонталі :
3. Хімічний елемент V групи періодичної системи. 6. Існування однієї й тієї ж хімічного елемента у вигляді двох або кількох простих речовин. 9, Твердий залишок , що утворюється п u003c при нагріванні різних палив до високих температур без доступу повітря. 10. Природна мінеральна фарба , що має колір від світло - жовтого до коричневого. 11. Один з продуктів реакції нейтралізаціі.14 . Відомий французький хімік. 17. Загальна назва технічних натрієвих солей вугільної кислоти. 18. Мінерал, гідроксидкремнію . 19. Сплав заліза з нікелем , алюмінієм , міддю. 20. Прилад для вимірювання кількості теплоти. 21.Мінерал, оксид алюмінію.
Додаток
Загадки
Куди ступиш, всюди маєш, Хоч не бачиш, а вживаєш.
Взимку горою, а влітку водою.
Білий як сніг, в пошані в усіх, До рота попав, там і пропав.
Мене чекають, виглядають, а прийду – Ховатись починають.
Б’єш його молотом, А воно сміється золотом.
Раз зустрівся кисень з воднем –
Непримітним і немодним.
Побраталися тільки – раз!
Бах! Ба-бах! Супервибух,
екстраклас!
ЗАГАДКИ ПРО РЕЧОВИНИ
Я не сумую , а горю,
І воду вам я подарую.
Нехай буде дощ, і сніг, і град -
Я напоїти природу рад.
...
Я підступний підпалювач.
Ви вогню хочете - нате!
Я всесильний окислювач
(Якщо тільки дров дасте ).
...
Гуляти в грозу - який резон ?
Подихаємо повітрям , друже.
У природі ніби стало чистіше,
Всюди в повітрі ...
А ну, мерщій зніміть капелюх !
Я дочка космічного тата.
І всюдисуща і легка, -
Я лід, я піт, я - хмари.
Я іній , чай , бульйон , туман,
Річка , струмок і океан.
Коли я злюся , то закипають ;
А від морозу - застигає . ...
Класифікаційні ознаки класів сполук у шкільному курсі хімії
The Classification signs of classes of connections in the school course of chemistry
In this paper the possibility to redistribute educational material school chemistry course by teaching modern views on the subject of chemical education in secondary schools. Keywords: hydrides, hydroxides, redistribution themes feature substances, acidic and basic properties, the circuit synthesis.
Keywords: integrating, structure of course of chemistry, composition of matter, structure, basic classes of inorganic connections
У зв’язку з оновленням змісту державного стандарту та типових навчальних планів, Міністерством освіти і науки, молоді та спорту України здійснено перерозподіл годин на вивчення предмета у 7- му класі у бік збільшення до 1,5 години, але цей крок є неповним з огляду на те, що курс хімії у 8 і 9 класі потребує осучаснення та перебудови в змістовному плані.
Дидактика вчить, що першою найважливішою вимогою до змісту є його науковість. Це перший принцип дидактики, відображення в навчальному змісті реальних процесів і речовин, виявлення реальних зв'язків між ними та з іншими процесами і речовинами, а також діалектико-матеріалістичне пояснення їх сутності. Науковість змісту може бути досягнута лише тоді, коли учнів знайомлять не тільки з готовими висновками, а й з методами дослідження.
Г. М. Голіним були визначені провідні ідеї, які необхідно закладати в будь-який курс природничо-наукового напряму, а саме:
- ідея інтегративності. Вона передбачає розкриття органічно властивих будь-якій науці міжпредметних зв'язків з іншими науками, взаємопроникнення наукових понять, трактування яких у цьому випадку стає ширшою і тим самим розширює кругозір учнів, сприяє формуванню природничо-наукової картини світу;
- ідея методологізації. Мова йде про те, щоб до учнів був доведений не просто результат наукових досліджень, але і сам процес його пошуку, щоб вони освоювали і методи хімічної науки, розуміли зв'язок між науковим результатом і методами, якими він одержаний.
- ідея економізації, мабуть, - найбільш нова стосовно процесу навчання дітей у середній школі. Вона передбачає звернути увагу учнів на економічну сторону практичного використання досягнень хімічної науки, її прикладне значення і економічну оцінку наукових рішень.
- ідея гуманізації покликана розкрити перед учнями роль хімії у створенні загальнолюдських цінностей, використання її досягнень на благо людини.
Реалізація всіх цих ідей сприяє формуванню особистості учня.
Потреба у визначенні конкретного необхідного мінімуму змісту, особливо в умовах диференціації шкіл, настільки велика, що такий «Обов'язковий мінімум змісту» з хімії регулярно публікується на сторінках методичних газет і журналів з метою забезпечення єдиного рівня підготовки з хімії всіх школярів країни [7-10] .
Зміст шкільного курсу хімії отримало наукове обґрунтування в роботах найбільших вітчизняних методистів: В. Н. Верховського, П. П. Лебедєва, Ю. В. Ходакова, С. Г. Шаповаленко, Л. А. Цвєткова, І. Н. Черткова, Є. Є. Минченкова, А. Д. Смирнова, Г. І. Шелінского, Н. Є. Кузнєцової, В. П. Гаркунова. Крім того, свої методичні концепції розробки змісту шкільного курсу хімії чітко виражені в кожного з авторів шкільних підручників з хімії. Проте при різних підходах у всіх курсах можна виділити певний набір дидактичних одиниць, які складають структуру курсу. На наш погляд необхідно здійснити перерозподіли годин на вивчення курсу хімії у 8 та 9 – му класах. Недостатнє вивчення проблеми становлення і розвитку змісту шкільного курсу хімії в Україні та потреба у використанні досвіду історичного розвитку курсу хімії з метою його подальшого вдосконалення зумовили нас написати дану статтю. Метою статті є упорядкований шлях класифікації сполук та оновлений варіант програмового курсу хімії у 8 та 9 класі.
Основний матеріал. В основі класифікації лежить принцип розподіл множини на підмножини таким чином, щоб підмножини не перетиналися і об’єднання цих підмножин повинно давати вихідну множину [2]. Основою класифікації обираємо склад, будову речовин і виходячи з цього виокремлюємо наступні класи сполук: оксиди, солі, гідриди та гідроксиди. Оксиди і солі – відомі в школі сполуки, які усталено вивчаються в середньому навчальному закладі. Під гідридами будемо розуміти бінарні сполуки, до складу яких входить Гідроген зі ступенем окиснення +1 і -1 та гідроксиди – складні сполуки, що містять ОН (гідроксидну групу). Виходячи з цих міркувань, до гідридів відносимо сполуки – амоніак та хлороводень, а до гідроксидів – сульфатну кислоту та калій гідроксид, етанол, фенол, гліцерол, оцтова кислота. За такою класифікацією не виникає потреби вводити поняття «амфотерність», бо у залежності від партнера по реакції HNO3 може виявляти кислотні властивості, наприклад, HNO3 + KOH та основні з концентрованою сульфатною кислотою HNO3 + H2SO4. Так само, і натрій гідроксид, кислотні NaOH + C2H5ONa та основні властивості NaOH + HBr. Головний висновок, що випливає, що кислоти і основи – це не клас сполук, кислотність і основність – це функції речовини. Таким чином, тему 2 у 8 класі можна представити оксидами, гідридами, гідроксидами, солями. Під час вивчення гідридів та гідроксидів розглянути зміну сили кислот і основ у рядах: CH4 – NH3 – HCl; HCl – H2O – NH3; H2CO3 - оцтова - HNO3, знайомити учнів з органічними кислотами (яблучна, оцтова, лимонна, щавлева, пальмітинова) під час вивчення поширення, застосування та загальних властивостей кислотних гідроксидів (у т.ч. фізичних властивостей). Автори нинішньої програми [1] у пояснювальній записці зазначають, що завдяки більш ранньому ознайомленню з найважливішими органічними сполуками є змога краще узгодити навчальні програми хімії та біології на основі міжпредметних зв’язків і саме тому в основній школі надається мінімальна за обсягом, але функціонально цілісна система знань з основ хімії, достатня для подальшої освіти; вивчаються найважливіші органічні сполуки в напрямку ускладнення їхнього складу, будови і властивостей. Ознайомлення з основними біологічно важливими речовинами має підготувати учнів до вивчення молекулярних основ життя в курсі біології. Не зрозумілим залишається те, що заради предмета «Біологія» учнів у школі вивчатимуть хімію, заради невідомо чого, розмістили хімію Карбона (органічна хімія) і оглядово її школярі розглянуть в 9 – му класі. Щоб краще узгодити програми, необхідно залучати до їх написання широке коло спеціалістів, обговорювати, вибудовувати курс на раніш запропонованій програмі.
Тема 3 «Закон періодів та таблиця хімічних елементів Д.Менделєєва» розрахована на 15 годин і надто перевантажена фізичним предметом вивчення об’єктів. Наприклад, для прогнозування можливих валентних станів учням досить знати порядок заповнення орбіталей за квантовими комірками, щоб встановити валентність. Більше уваги приділити взаємозв’язку протонного числа і властивостями елементів та їх сполук, характеристики хімічного елемента за протонним числом. Тим паче, що проблемі дослідження прогностичної діяльності та прогностичних умінь школярів приділено багато уваги в роботах психологів та педагогів (Д.В. Вількєєва, М.Д. Касьяненка, Б.І. Коротяєва, П.І. Підкасистого, Л.О. Регуш та ін.). Їй також присвячені дисертаційні дослідження М.О. Артемової, Л.С. Недбаєвської, Н.І. Одинцової, М.С. Севастюк. Окремі питання зазначеної проблеми висвітлені у працях з методики навчання хімії: Л.П. Очирової – дослідження прогностичної функції причинно-наслідкових зв’язків під час вивчення хімії; П.І. Беспалова – роль гіпотез у процесі розв’язання пізнавальних задач на уроках хімії; В.П. Гаркунова – дослідження пояснювальної та прогностичної функцій теоретичних знань під час навчання хімії; Н.Н. Чайченко – принципи формування теоретичних понять; О.О. Макарені, Л.Н. Крючка – методика формування прогнозування властивостей хімічних елементів на підставі вчення про періодичність. Ввести задачі на встановлення хімічного елемента, якісні задачі на ідентифікацію речовин за фізико – хімічними властивостями, прогнозування характеристик елементів та властивостей речовин.
У темі 4 «Хімічний зв’язок» здійснити перерозподіл годин у бік збільшення на вивчення ступеня окиснення (його прогнозування за квантовими комірками), визначення у складних сполуках. Внести у тему вивчення хімічного зв’язка в металах, вивчення водневого зв’язка, руйнування зв’язків, перерозподіл електронної густини в сполуках. Після теми 4 пропонуємо ввести тему 5 «Узагальнення», у якій розглянути наступні алгоритми:
- характеристики класів сполук;
- характеристики окремих представників класів сполук та їх ідентифікацію.
Прикладом може слугувати наступна схема:
- Назва, визначення на рівні складу, будови; номенклатура, класифікація за складом, будовою.
- Властивості: фізичні; хімічні – відношення до простих речовин:
А). Неметали: як окисники, як відновники та без зміни ступеня окиснення
Б). Метали: як окисники, як відновники та без зміни ступеня окиснення
- Відношення до складних речовин:
А). оксиди неметалічних елементів: як окисники, як відновники та без зміни ступеня окиснення.
Б). оксиди металічних елементів: як окисники, як відновники та без зміни ступеня окиснення.
В). гідриди (кислотні, основні): як окисники, як відновники та без зміни ступеня окиснення.
Г).гідроксиди (кислотні, основні): як окисники, як відновники та без зміни ступеня окиснення.
Д). солі: як окисники, як відновники та без зміни ступеня окиснення.
- Відношення до нагрівання, електроліз.
Під час вивчення властивостей паралельно вивчають класифікацію речовин.
- Поширення.
- Застосування у промисловості, лабораторії. Екологія (небезпечність).
- Добування у промисловості, лабораторії.
- Ідентифікація (дослідження речовин).
Наводимо приклад з номенклатури:
Визначення кислотний залишок, як частини молекули без одного, декількох, усіх атомів Гідрогену. Систематична назва: гідроген + назва кислотного залишку, або номенклатура координаційних сполук: H2SeO3 – дигідроген триоксоселенат, або гідроген селенат (IV), HMnO4 – моногідроген тетраоксоманганат, або гідроген тетраоксоманганат (VII), H2Cr4O15 - дигідрогентетрахромат (VI), або гідроген тридекаоксотетрахромат. Подаємо назву, кислотний залишок, його валентність, ступінь окиснення атомів в ньому, назву солі, наприклад,
|
Назва кислоти |
Формула |
Формула кислотного залишку, валентність |
Назва солі |
|
Флуоридна |
HF |
F, I |
Флуориди |
|
Нітратна |
HNO3 |
N +5O3, I |
Нітрати |
Класифікація кислот:
За основністю:
Одноосновні: HCl, HNO3, HNO2, H3PO2, CH3COOH
Двохосновні: H2SO4, H2S, H2CO3, H3PO3 , HOOC-COOH
Трьохсновні: H3PO4
Чотирьохсновні: H4P2O7, H4SiO4
П‘ятиосновні: H5IO6
Шестиосновні: H6TeO6
За хімічним складом:
Безоксигенні: HCl, H2S, HCN
Оксигеновмісні: H2SO4, CH3 COOH, H2Mo3O10
Ізополікислоти: H2CrO7, H4P2O7, H5P3O10
Гетерополікислоти: H2S2O5, H2SiF6
За окисно - відновними властивостями:
Окисники: H2SO4, HNO3, HClO4, H2CrO4
Відновники: безоксигенні
За кислотно-основними властивостями:
Сильні: Кдис > 10-2 : HNO3, HCl
Слабкі: Кдис < 10-2 : H2СO3, H2S, амінокислоти, оцтова
Фізичні властивості:
Більшість сильних – кислі на смак
H3PO4, CH3COOH – тверді
SnCl4, HBr – різні
HCl, H2S – газуваті
H2SiO3 - не розчинні у воді
H2SO4 - розчинні у воді
Хімічні властивості:
1) Дисоціація у водних розчинах.
- оцінка сили кислоти за Дж. Річчі:
Кислота виду OmE (OH)n має рКдис ≈ 8-5m
- оцінка сили кислоти за Н.Блок – йонний потенціал P = заряд йона / радіус йона, Å. Якщо P < 4,84 – основні властивості, P > 10,24 – кислотні.
2) Відношення до простих речовин:
- неметали:
Як окисники:
S + HNO3 → H2SO4 + NO, або H2SO4 + 6NO2 + 3H2O
S + H2SO4 → 3SO2 + 2H2O
Як відновники:
H3PO3 + О2 → 2H3PO4
H2S + О2 → S + 2H2O, або 2SO2 + 2H2O
Br2 + CH2 = CH – COOH → BrCН2 – CHBr - COOH
Метали з електрохімічним потенціалом (тут можна подати за рядом – до Гідрогена, водню) < 0 В окислюються у водних розчинах кислотами до солей і водню (крім нітратної).
3) Відношення до складних речовин:
- оксиди неметалічних елементів:
Як окисники:
NO+2HNO3→3NO2+ H2O
Як відновники:
SO3 + H2S → H2SO3 + S
Без зміни ступеня окиснення
SiO2 + HF → H2SiF6+ 2H2O, або SiF4↑ + 2H2O
- оксиди металічних елементів:
Як відновники:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Без зміни ступеня окиснення
– утворюється сіль і вода
Fe2O3 + 6HCl → 2FeCl3 + 3H2O – кислотно-основна реакція обміну
- гідриди та гідроксиди:
3HCl + HNO3 → 2H2O + Cl2 + NOCl
H2S + H2SO4 → H2SO3 + H2O + S, або 3S + 3H2O
- Основні гідроксиди та L – основи:
NH3 + HCl → NH4Cl
KOН + Н3PO4 → KН2PO4 + H2O
2KOН + Н3PO4 → K2HPO4 + 2H2O
3KOН + Н3PO4 → K3PO4 + 3H2O
Реакція нейтралізації – реакція обміну складовими частинками між кислотними та основними гідридами, гідроксидами з утворенням солі.
4Co(OH)3 + 4H2SO4 → 4CoSO4 + 10H2O + O2 – окисно-відновна нейтралізація.
2NaOH + 4H3BO3 → Na2B4O7 + 7H2O – кислотно-основна нейтралізація.
NH3 + 2HF → NH4F ∙ HF→ [NH5F2]
- солі:
Як відновники:
2AgCl + H3PO3 → HPO3 + 2Ag + 2HCl
2KMnO4 + 5HNO2 + 3H2SO4 → 2MnSO4 + 5HNO3 + K2SO4 + 3H2O
Як окисники:
PbS + HNO3 → 3Pb(NO3)2 + NO + 3S + 4H2O
Без зміни ступеня окиснення:
CaCO3 + CO2 + H2O → Ca(HCO3) 2 Ca3 (PO4) 2 + 4H3PO4 → 3Ca(H2PO4) 2
Витіснення слабких або летких, не розчинних кислот:
Na2S2O3 + 2HCl → 2NaCl + SO2 + S + H2O
CaCO3 + 2CH3COOH → (CH3COO)2Ca + CO2 ↑ + H2O
- відношення до нагрівання, електроліз:
2H2SO4 → 2H2O + 2SO2 + O2, нагрівання
2H2SO4 → H2 + H2S2O8, електроліз
Методично обґрунтувати діючий курс хімії 9 класу були спроби в літературі [4,5], а після аналізу [6-8] ми дійшли висновку, що після вивчення теми «Розчини» у 9 – му класі, слід перейти до вивчення неметалічних елементів та їх сполук (14 годин із 10 класу перекласти у 9 – й клас), потім металічні елементи та їх сполуки із 10 класу перенести у 9 клас. У такому випадку замість 30 годин уявного курсу хімії Карбона, вносимо 28 годин із 10 класу, завершуючи курс 9 – го класу темами «Розчини» і «Хімічні реакції», до яких додаємо 2 години на практичне написання окисно – відновних реакцій, прогнозування продуктів окисно – відновних реакцій, бо не має змісту вивчати ступінь окиснення тільки для встановлення коефіцієнтів без прогнозування продуктів в реакції таких, як горіння вуглецю, фосфору, заліза.
Таким чином, нами була зроблена спроба переглянути діючий курс хімії у 8 та 9 класі у бік осучаснення та дидактично виваженого наповнення змісту базових основ з хімії у середній школі.
Використана література
1. Програма для загальноосвітніх навчальних закладів «Х І М І Я», 7 – 9 класи. – Київ. – Перун. - 2005р.- 31с.
2. Гузєєв В.В. Преподавание: от теории к мастерству М.: НИИ школьных технологий, 2009. 288с.
3. Шаповаленко С.Г. Методика обучения химии. - Пособие для учителей. – М.- 1963г. – с. 448, 486.
4. Попель П.П. Хімія учителю. 7-8 кл.: навч. – метод. посіб. К.: ВЦ «Академія». 2019. – с.75
5. Попель П.П. Хімія учителю. 9-10 кл.: навч. – метод. посіб. К.: ВЦ «Академія». 2010. – с.49
6. Чернобельская Г.М. Методика обучения химии в средней школе: Учеб. для студ. высш. учеб. заведений. – М.: Гуманит. изд. центр ВЛАДОС, 2000. – с. 212.
7. Зайцев О. С. Системно-структурний підхід до побудови курсу хімії. - М.: Изд-во МГУ, 1983.
8. Волова Н. Ф., Чорнобильська Г. М. Пропедевтичний курс для семикласників / / Хімія в школі, 1998, № 3. З 29-33.
9. Іванова Р. Г. Хімія. - М.: Просвещение, 1996.
10. Кузнєцова Н. Є., Титова І. М., Тара М. М., Жегін А. Ю. Хімія. - М.: Вента-на-Граф, 1997.
1


про публікацію авторської розробки
Додати розробку