Оксигеновмісні сполуки. Презентація
Про матеріал
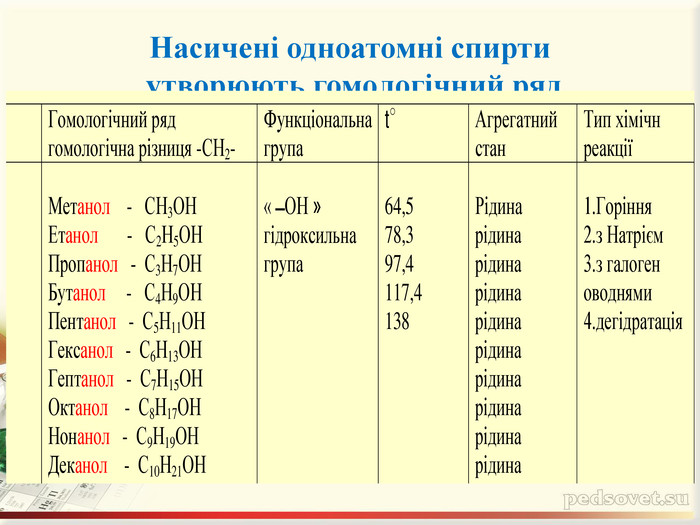
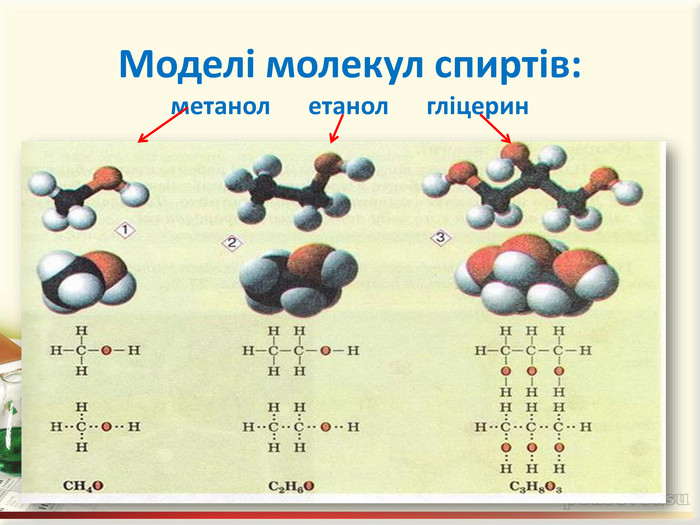
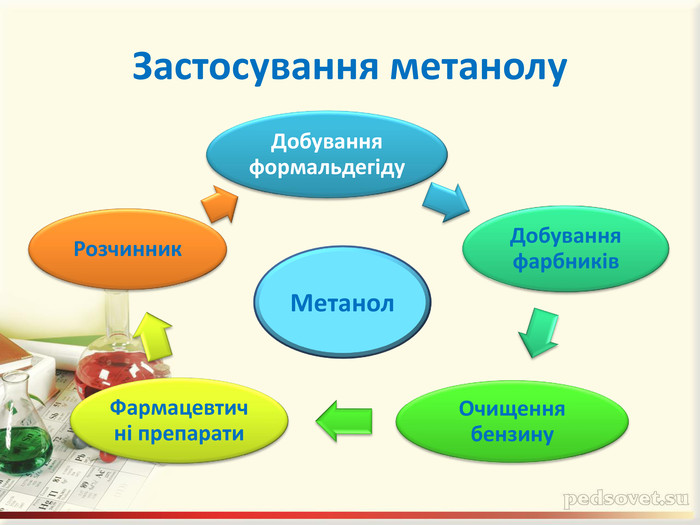
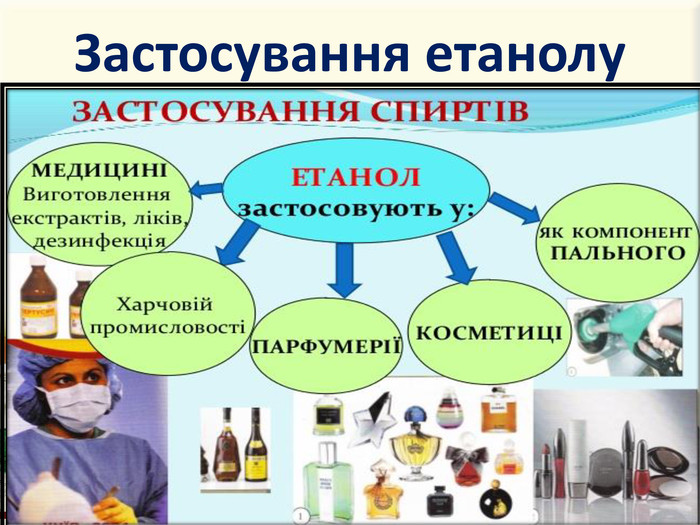
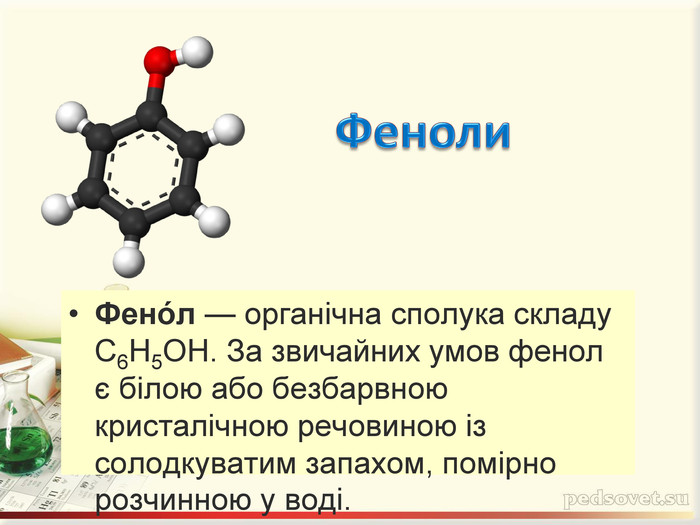
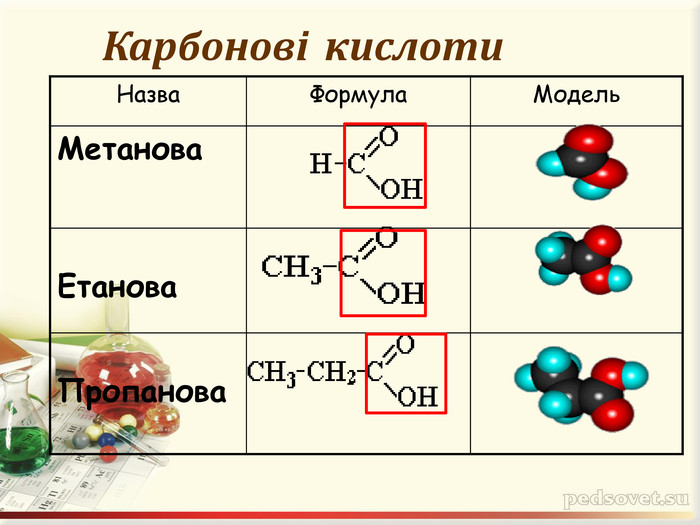
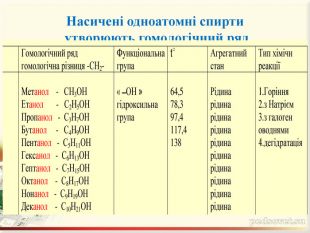
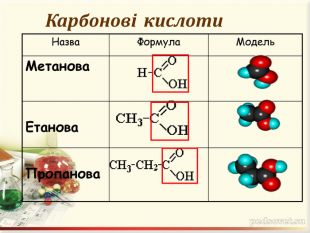
Інтерактивна презентація "Оксигеновмісні сполуки" використовується під час викладання нового матеріалу, повторенні, узагальненні та семінарських заняттях з тем "Спирти. Феноли. Альдегіди. Кислоти." курсу "Хімія" в 9-ому класі.
Перегляд файлу
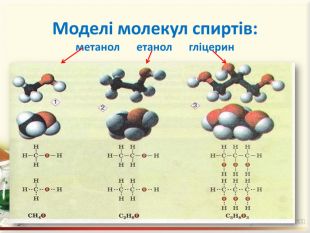
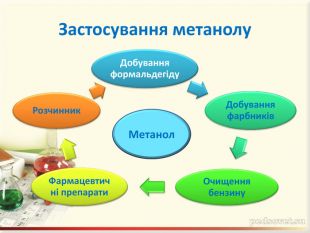
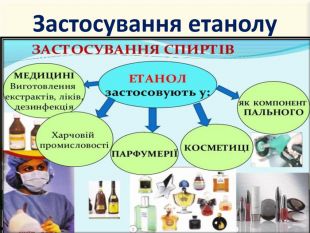
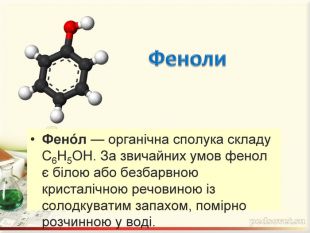
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
-
Дякую! Зручна презентація!
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку