Швидкість хімічної реакції, залежність швидкості реакції від різних чинників.
Сформувати уявлення про швидкість хімічної реакції, вплив на неї різних факторів; продовжити формувати навички складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; розвивати вміння розв'язувати задачі із використанням поняття «швидкість хімічної реакції».
Тема уроку: Швидкість хімічної реакції, залежність швидкості реакції від різних чинників.
Мета:
Формування ключових компетентностей: комунікативна, математична грамотності, технологічна, уміння вчитись упродовж життя.
Формування предметних компетентностей: сформувати уявлення про швидкість хімічної реакції, вплив на неї різних факторів; продовжити формувати навички складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; розвивати вміння розв’язувати задачі із використанням поняття «швидкість хімічної реакції».
Виховна: виховувати самостійність, критичність, різносторонність, креативність мислення, наполегливості в досягненні своєї мети, культури праці, любов до предмета.
Тип уроку: урок засвоєння нових знань
Форми роботи: бесіда, розповідь вчителя, демонстраційний експеримент, індивідуальна робота, «Продовжи речення», робота в групах.
Обладнання і матеріали: таблиця "Чинники, які впливають на швидкість хімічних реакцій", кросворд "Швидкість реакції", мультимедійний проект, реактиви.
Епіграф уроку: «Знання можуть бути купою каміння, що задавило особистість. І знання можуть бути вершиною піраміди, на якій стоїть особистість» Валентин Розов
ХІД УРОКУ
І. Організаційний етап
Привітання, виявлення відсутніх. Перевірка готовності учнів до уроку, налаштування на позитивний настрій.
ІІ. Актуалізація опорних знань. Перевірка домашнього завдання.
Бесіда:
– Дайте визначення поняттю "Хімічна реакція". (Хімічна реакція – це перетворення одних речовин на інші при незмінності ядер атомів)
- Чи буде хімічною реакцією: замерзання води; жовтіння листя на деревах; притягування заліза магнітом; пригорання їжі на сковороді; зацукровування варення; проходження електричного струму по металу.
– Які ж ознаки протікання хімічних реакцій? (Виділення або поглинання тепла, світла, електричної енергії; поява чи зникнення запаху, виділення газу, випадання осаду , поява полум’я)
– Назвіть відомі вам типи хімічних реакцій. (Розкладу, сполучення, заміщення та обміну; окисно-відновні; оборотні)
ІІІ. Мотивація навчальної діяльності
Скажіть будь-ласка, чим можна дістатись швидше до пункту призначення літаком чи поїздом? (Літаком. Різна швидкість руху)
А тепер за допомогою експерименту переконаємось, що швидкість може використовуватись і в хімії.
До експерименту вам завдання:
Спостерігаючи за експериментом зверніть увагу яка з реакцій відбувається швидше, а яка повільніше.
Демонстрація.
Дослід 1. Горіння свічки.
Запалити свічку звернути увагу на швидкість її горіння.
Дослід 2. Горіння сухого пального.
– Чи однакова швидкість горіння в обох випадках? (Ні. Швидкість згорання сухого пального більша)
Отже, тема нашого уроку "Швидкість хімічної реакції".
На сьогоднішньому уроці ми повинні:
- Розглянути поняття про швидкість хімічної реакції;
- Показати залежність швидкості хімічної реакції від природи речовини, температури, каталізатора, концентрації, площі поверхні реагуючих речовин.
- Навчитись розв'язувати задачі з використанням поняття швидкість хімічної реакції.
IV. Вивчення нового матеріалу.
1. Поняття про швидкість реакції.
Вам вже відомо із курсу фізики, що, швидкість – це величина, яка чисельно дорівнює шляху, який проходить тіло за одиницю часу.
А чи зустрічалися ви із поняттям швидкості в хімії? (Ні)
Проте поняття швидкості в хімії використовується. Але під час проходження хімічної реакції механічного переміщення не відбувається.
Проблема: То що ж характеризує швидкість в хімії?
Спробуємо розібратись в цьому. Навколо нас постійно відбуваються тисячі хімічних реакцій. Горить багаття і горить газ у конфорці газової плити, іржавіє залізо, молоко перетворюється в сир.
Відомо, що одні хімічні реакції протікають за малі частки секунди, інші ж за хвилини, години, дні. Деякі протікають так швидко, що за ними не встежиш. Ось ми запалюємо сірник. Чирк! Запалюється від тертя об коробку фосфор, що входить до складу сірникової голівки, миттєво з'являється полум'я. Хімічна реакція зайняла частки секунди. Дрова в багатті теж згорають дуже швидко. А перетворення деревини доісторичних велетенських дерев на кам'яне вугілля тривало мільйони років. Вибух суміші кисню з воднем відбувається практично миттєво, а перетворення графіту в алмаз в надрах Землі - дуже повільна реакція. З відомих на сьогоднішній день реакцій найшвидша протікає в 1040 разів швидше, ніж сама повільна. Знання швидкостей хімічних реакцій має дуже велике практичне і наукове значення. Наприклад, в хімічній промисловості від швидкості хімічної реакції залежать розміри, продуктивність апаратів, якість вироблюваного продукту і в кінцевому підсумку зарплата працівників і собівартість продукції.
– Скажіть, будь ласка, швидко чи повільно відбуваються такі процеси:
а) горіння тирси; (повільно)
б) утворення торфу; (повільно)
в) реакції обміну з утворенням осаду; (швидко)
г) вибух пороху; (швидко)
д) вигорання тканини на сонці (швидко)
е) бродіння виноградного соку (повільно)
Кожна реакція має певну швидкість. Чому одні хімічні реакції відбуваються миттєво, а інші тривають століттями?
Знання швидкості реакції, а також чинників, від яких вона залежить, уміння її передбачати та обчислювати необхідні інженерам, технологам для того, щоб регулювати перебіг реакцій, уповільнювати небажані й прискорювати ті, що потрібно здійснити.
Реакції протікають у разі зіткнення молекул реагентів. Швидкість реакції визначається кількістю зіткнень та ймовірністю того, що вони приведуть до хімічного перетворення. Число зіткнень визначається концентраціями реагентів.
Отже, швидкість хімічних реакцій, пов’язана із зміною кількості речовини реагенту чи продукту реакції в одиниці об’єму. Величина що показує вміст кількості речовини в одиниці об’єму називається концентрацією.
![]()
де c – концентрація ![]() , ν – кількість речовини [моль], V – об’єм [л].
, ν – кількість речовини [моль], V – об’єм [л].
Отже, швидкість реакції це зміна концентрації одного з реагентів чи одного з продуктів реакції за одиницю часу при незмінному об’ємі системи.
![]() ,
,
де v – швидкість хімічної реакції ![]() , c1 та c2 – початкова та кінцева концентрація (відповідно)
, c1 та c2 – початкова та кінцева концентрація (відповідно) ![]() , t1 та t2 – початковий та кінцевий час (відповідно) [с],
, t1 та t2 – початковий та кінцевий час (відповідно) [с], ![]()
![]() ,
, ![]()
Чому перед формулою ставлять ![]()
![]()
Вивченням швидкості хімічних реакції займається спеціальний розділ хімії – хімічна кінетика.(слайд 6) Серед учених, що зробили вагомий внесок у її розвиток, багато імен, зокрема: Якоб Вант-Гофф (перший лауреат нобелівської премії з хімії (1901 р.), якої удостоєний був за ряд відкриттів, одне з яких правило, що носить його ім’я), Сванте Арреніус (лауреат нобелівської премії за відкриття в області розчинів, відкрив залежність миттєвої швидкості реакції від температури), а також Петер Вааге, М. М. Семенов та інші. За свої дослідження по з’ясуванню механізму хімічних реакцій М.М. Семенов отримав Нобелівську премію з хімії. Отже, розвиток хімічної кінетики заклав нові напрями розвитку як хімії, так і фізики. Одним з них стала теорія ланцюгової реакції в розвитку якої приймали участь й вчені України. Одним з таких видатних науковців був М.В. Поляков, який працював в першій половині ХХ ст. в Дніпропетровську і запропонував механізм гетерогенно-гомогенного каталізу.
2. Фактори, що впливають на швидкість реакції.
Велосипедист для зміни швидкості має певні пристосування. Які ж "пристосування" можна використати для зміни швидкості хімічної реакції?
Швидкість хімічної реакції залежить від багатьох факторів.
Розглянемо схему. 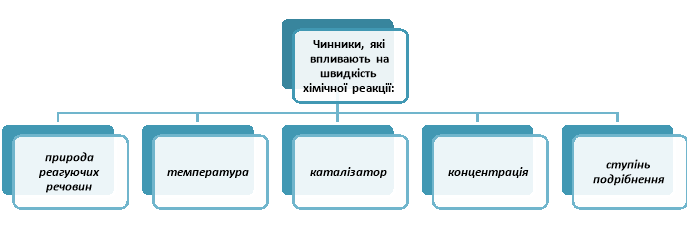
Давайте більш детально зупинимось на впливі кожного фактору.
- ШВИДКІСТЬ РЕАКЦІЇ ВИЗНАЧАЄТЬСЯ ХІМІЧНОЮ АКТИВНІСТЮ РЕЧОВИН
- ЗАГАЛЬНА ПЛОЩА ПОВЕРХНІ УСІХ ЧАСТОЧОК КРЕЙДИ ЗНАЧНО ПЕРЕВИЩУЄ ПЛОЩУ ПОВЕРХНІ ГРУДОЧКИ КРЕЙДИ. ШВИДКІСТЬ РЕАКЦІЇ ЗІ ЗБІЛЬШЕННЯМ ПЛОЩІ ПОВЕРХНІ КОНТАКТУ РЕАГЕНТІВ ЗРОСТАЄ.
Наслідок:
Чим більший ступінь подрібнення речовини, тим більша швидкість реакції. Подрібнення та розпорошення речовин зумовлює збільшення ймовірності стикання активних частинок взаємодіючих речовин. Тонкодисперсний жовтий пилок спор плауна (лікоподій) застосовують у фармації для пересипання пігулок. Купку цієї речовини не завжди вдається підпалити сірником. Натомість розподілений у повітрі лікоподій згоряє миттєво.
Так, наприклад, тріски згоряють значно швидше ніж поліно. Цукор-пісок швидше розчиняється в чаї, ніж грудка цукру.
Лабораторний дослід№10
Вплив концентрації і температури на швидкість реакції
У дві пробірки насипаємо ошурки магнію. В одну добавляємо хлоридну кислоту концентровану, а в іншу розбавнену. Здобуті результати обґрунтуйте та зробіть висновок про вплив концентрації хлоридної кислоти на швидкість хімічної реакції.
– Як залежить швидкість реакції від концентрації реагуючих речовин? ЧИМ БІЛЬША КОНЦЕНТРАЦІЯ РЕАГУЮЧИХ РЕЧОВИН, ТИМ БІЛЬША ШВИДКІСТЬ РЕАКЦІЇ. (чим більше частинок речовини, тим більше зіткнень.)
Під час пожежі не можна відкривати вікна, тому що збільшується концентрація кисню і вогонь буде сильнішим.
– Як залежить швидкість реакції від температури? Чим більша температура, тим більша швидкість реакції. Це зумовлено збільшенням умісту активних молекул (чи інших структурних частинок) у реакційній суміші. Натомість охолодження уповільнює взаємодію між реагентами. Саме тому харчові продукти довше зберігаються за низьких температур
Голландський вчений Якоб Вант-Гофф сформулювали правило, яке виражає зв’язок між швидкістю реакції та температурю.
Правило Вант-Гоффа: Із збільшенням температури на кожні 10 ˚C швидкість реакції збільшується в середньому у 2–4 рази.
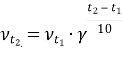 де
де ![]() та
та ![]() – швидкість хімічної реакції за температури t1 та t2 відповідно
– швидкість хімічної реакції за температури t1 та t2 відповідно ![]() , γ – температурний коефіцієнт (коефіцієнт Вант-Гоффа), t1 та t2 – кінцева та початкова температура відповідно [˚C].
, γ – температурний коефіцієнт (коефіцієнт Вант-Гоффа), t1 та t2 – кінцева та початкова температура відповідно [˚C].
Повідомлення учня про зберігання харчових продуктів
 Наявність каталізатора.
Наявність каталізатора.




![]()
Каталізатор – це речовина яка впливає на швидкість реакції але сама при цьому залишається незмінною.
Позитивні каталізатори збільшують швидкість реакції, а негативні – зменшують.
Як саме впливають каталізатори на швидкість реакції вияснимо з експерименту.
Відео дослід «Хімічна лабораторія». Розкладання гідроген пероксиду в присутності каталізатора.
![]()
Зробіть висновок про вплив каталізатора на швидкість реакції.
Механізми дії каталізаторів до кінця не з’ясовані. Існує велика кількість теорій про те яким саме чином діють каталізатори. Вчені до цих пір працюють над цим питанням.
Не для всіх реакцій використовують каталізатор. Для кожної каталітичної реакції існує свій каталізатор.
Каталізатори досить поширені в живій природі. Такі каталізатори називають ферментами, їх виробляють живі клітини. За їх участю відбуваються реакції в клітинах живих організмів. Відсутність чи нестача якогось ферменту викликає тяжкі захворювання
Каталізатори використовують майже на кожному хімічному виробництві. За участю цих речовин здійснюють майже 90% усіх хімічних перетворень. Каталізатори використовують у транспортних засобах із двигунами внутрішнього згорянню Завдяки їм чадний газ реагуючи з киснем, перетворюється на вуглекислий газ.
Фізкультхвилинка
V. Підбиття підсумків уроку
Учитель звертає увагу на те, що протягом уроку вдалося знайти на поставлене раніше запитання: Що ж характеризує швидкість в хімії? Вдалося вияснити які чинники впливають на швидкість реакції.
VІ. Закріплення знань. Рефлексія
1. Закінчити речення.
- Реакцію між газами можна прискорити за допомогою…
- Під час пожежі не можна відкривати вікна тому що…
- Причиною зростання улітку небезпека харчових отруєнь…
- Аби пришвидшити випалювання залізної руди, її…
- Приклад реакції, яка проходить швидко
- Прізвище вченого, який зробив внесок у розвиток хімічної кінетики
- Каталізатори, які збільшують швидкість реакції в живих організмах…
- Умови при яких швидкість реакції розкладання крейди буде максимальною
Розв’язати задачі.
- Швидкість реакції за температури 00 С дорівнює 1 моль/л с. Обчислити швидкість цієї реакції при температурі 300С, якщо температурний коефіцієнт швидкості реакції 3.
Дано:
![]() vt 1 = 1моль/л - с
vt 1 = 1моль/л - с
![]() t1 = 00 С
t1 = 00 С
t2 =300 С
vt2- ?
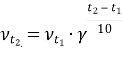
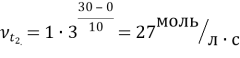
- Обчисліть швидкість реакції, якщо відомо, що концентрація вихідних речовини змінилася від 0,5 моль/л до 0,2 моль/л за 20 секунд.
Дано:
![]() t1 = 0с
t1 = 0с
t2 =20с
c1 = 0,5моль/ л - с
![]()
![]()
![]() c2 = 0,2моль/ л - с 0 - 0
c2 = 0,2моль/ л - с 0 - 0
v- ?
о
о![]()
![]()
о
о
о
о
о
о
о
о
Розв’язавши кросворд, у виділених клітинках ви прочитаєте, що хімічне явище це…..

1. Чинник, який збільшує швидкість реакції між газами
2. Каталізатори живої природи.
3. Речовина, яка змінює швидкість реакції
4. Зміна кількості речовини в одиниці об’єму за одиницю часу
5. Вміст речовини в одиниці об’єму.
6. Дія спрямована на пришвидшення гетерогенної реакції.
7. Український вчений, який запропонував механізм гомогенно–гетерогенного каталізу
VІІ. Домашнє завдання
1. Опрацювати §
2. Виконати вправи №
Розробіть пам`ятку для тих, хто збирається у похід: Як доцільніше зберігати продукти?
-
дякую, досить вдало підібраний матеріал , буду використовувати на практиці


про публікацію авторської розробки
Додати розробку
