Опорні схеми з хімії
Олег Деленко, Світлана Деленко

2023 р.
ЗМІСТ
Вступ _____________________________________________________________________ 4
Хімічні властивості насичених вуглеводнів _____________________________________ 5
Хімічні властивості ненасичених вуглеводнів ___________________________________ 6
Хімічні властивості ацетиленових вуглеводнів __________________________________ 7
Фізичні властивості ацетилену. Застосування ацетилену __________________________ 8
Добування ацетилену _______________________________________________________ 9
Хімічні властивості ароматичних вуглеводнів ___________________________________10
Фізичні властивості та застосування бензену____________________________________ 11
Добування бензину__________________________________________________________12
Хімічні властивості насичених одноатомних спиртів ____________________________13
Добування насичених одноатомних спиртів____________________________________ 14
Фізичні властивості насичених одноатомних та багатоатомних спиртів _____________15
Застосування насичених одноатомних спиртів __________________________________16
Застосування багатоатомних спиртів __________________________________________ 17
Хімічні властивості фенолу __________________________________________________ 18
Застосування фенолу _______________________________________________________ 19
Фізичні властивості фенолу __________________________________________________ 20
Добування альдегідів _______________________________________________________ 21
Застосування альдегідів _____________________________________________________ 22
Хімічні властивості та добування альдегідів ____________________________________ 23
Хімічні властивості насичених одноосновних карбонових кислот __________________24
Фізичні властивості та добування карбонових кислот ____________________________ 25
Застосування карбонових кислот _____________________________________________ 26
Взаємозв’язок між вуглеводнями, спиртами, альдегідами, карбоновими кислотами
і складними естерами _______________________________________________________ 27
Хімічні властивості глюкози _________________________________________________ 28
Характеристика хімічного елемента згідно положення в періодичній системі ________29
Фізичні властивості кисню і озону ____________________________________________ 30
Сульфур(ІV) і сульфур(VІ) оксиди. Фізичні властивості _________________________31
Хімічні властивості сульфур(ІV) і сульфур(VІ) оксидів __________________________32
Фізичні властивості сульфатної кислоти. Хімічні властивості
сульфатної кислоти ________________________________________________________ 33
Фізичні властивості азоту ___________________________________________________ 34
Алотропні модифікації фосфору. Фізичні властивості ___________________________ 35
Хімічні властивості азоту і фосфору __________________________________________ 36
Амоніак. Фізичні і хімічні властивості ________________________________________ 37
Солі амонію. Хімічні властивості ____________________________________________ 38
Фізичні властивості оксидів нітрогену (ІІ) і (ІV) та фосфору (V) __________________ 39
Хімічні властивості нітратної кислоти ________________________________________ 40
Хімічні властивості ортофосфатної кислоти ___________________________________ 41
Класифікація оксидів. Способи добування оксидів ______________________________42
Хімічні властивості оксидів _________________________________________________ 43
Фізичні властивості води ___________________________________________________ 44
Вода – найважливіший природний оксид. Хімічні властивості ____________________ 45
Хімічні властивості кислот __________________________________________________ 46
Хімічні властивості основ ___________________________________________________ 47
Хімічні властивості солей ___________________________________________________ 48
Хімічні властивості вуглецю _________________________________________________ 49
Хімічні властивості силіцію _________________________________________________ 50
Хімічні і фізичні властивості карбон (ІІ), (ІV) і силіцій (ІV) оксидів ________________ 51
Хімічні властивості карбонатної кислоти ______________________________________ 52
Лужні метали. Властивості __________________________________________________ 53
Лужноземельні метали. Властивості __________________________________________ 54
Алюміній. Фізичні та хімічні властивості ______________________________________ 55
Фізичні та хімічні властивості заліза __________________________________________ 56
Способи добування металів __________________________________________________57
Забруднення навколишнього середовища. Схема одержання цукру із цукрового буряка.
__________________________________________________________________________58
Застосування вуглеводів. Волокна. ___________________________________________ 59
Загальний огляд найважливіших полімерів ____________________________________ 60
Найважливіші види синтетичних канчуків ____________________________________ 61
Схема виробництва скла. ___________________________________________________ 62
Фактори, що впливають на швидкість поширення нафтової плями. Людина у
навколишньому середовищі ________________________________________________ 63
Виготовлення штучного волокна ____________________________________________ 64
Схема виробництва штучної шерсті з молока __________________________________ 65
Класифікація полімерів ____________________________________________________ 66
Генетичний зв'язок між класами неорганічних сполук __________________________ 66
Складні неорганічні речовини ______________________________________________ 68
ВСТУП
Даний збірник містить найважливіші хімічні схеми, які використовуються на уроках хімії з 7 по 11 класи згідно чинної програми 12-річної шкільної освіти.
Схематично можна подати не лише контролюючі завдання, а й завдання навчального характеру. Тому метою даного збірника є встановлення тісного зв’язку між контрольними завданнями та навчальним матеріалом, який вивчається у даній темі. Для здійснення цієї мети кожна схема складена по-особливому. Крім завдань, які потрібно вирішити, схеми містять основну частину навчального матеріалу, який у даному випадку треба використати. Таким чином, відбувається багаторазове повторення та закріплення вивченого матеріалу, а також формується вміння застосувати саме той матеріал, який потрібно для розв’язання даної схеми.
Багаторазове повторення за допомогою зорового сприйняття дозволяє розвинути пам'ять та вміння використати накопичену базу знань.
Короткий огляд навчального матеріалу дозволяє запам’ятати найбільш поширеніші властивості речовин. Деякі схеми містять порівняльну характеристику властивостей речовин, які мають подібну будову або походять від одного елемента і мають різні властивості.
Використання таких схем на уроках хімії дозволяє вчителю урізноманітнити навчальний процес, закріпити навчальний матеріал і водночас перевірити якість засвоєння цього матеріалу та вміння використати учнями набутий досвід. Важливе значення мають схеми і для формування компетентності саморозвитку та самоосвіти учнів.
ХІМІЧНІ ВЛАСТИВОСТІ НАСИЧЕНИХ ВУГЛЕВОДНІВ
Напишіть рівняння реакцій запропоновані у схемі:

СН3СООNa
![]()
![]()
![]()

![]()
![]()
![]()
![]() C CH4 Al4C3
C CH4 Al4C3
![]()
![]() C2H5Cl CO2
C2H5Cl CO2
![]()
![]()

![]()
![]()
![]()
CH2 = CH2 K2CO3
![]()
C4H10
![]()
C2Cl6
- Яка реакція є найважливішою для алканів ?
- Вкажіть органічні і неорганічні речовини.
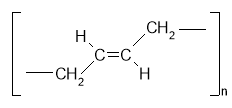
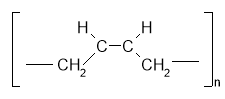
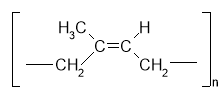
Хімічні властивості ненасичених вуглеводнів
1. Напишіть рівняння реакцій взаємодії вуглеводнів ряду етену з речовинами запропонованими у схемі:
CnH2n – загальна формула ненасичених вуглеводнів ряду етену.
![]()
![]() Н2
Н2
![]() HCl
HCl
n (-CH2 –CH2- ) + +
![]()
![]()
![]()

![]()
![]() C2H2 С2Н4 + Br2
C2H2 С2Н4 + Br2
![]() + +
+ +
![]()
![]()
![]() I2 + H2O
I2 + H2O
![]()
![]()
![]()
![]()
![]() O2
O2
В чому, на ваш погляд, відмінність в будові молекул етану і етену? Яким фактам ми маємо довіряти?
Чи можна припустити, що для ненасичених вуглеводнів ряду етилену, буде характерна реакція приєднання? Які аргументи підтверджують ваші думки? Які докази того, що етен є ненасиченим вуглеводнем? Який приклад ви можете навести? Шо є вашим висновком?
2. Висловіть припущення щодо напрямку реакції:
![]()
![]() СН3 – СН2 – СН = СН2 + НBr
СН3 – СН2 – СН = СН2 + НBr
Чому?
![]()
Хімічні властивості ацетиленових вуглеводнів
1. Напишіть рівняння взаємодії вуглеводнів ряду етину з речовинами запропонованими у схемі.
СnН2n – 2 – загальна формула вуглеводнів ряду етину.
Н2
Br2 +
+ + 2H2
![]()
+ CnH2n - 2
HI
![]()
![]()
 + +
+ +

+ 2Cl2
 H2O
H2O
O2

 2. Допишіть реакції. Як називаються дані реакції ?
2. Допишіть реакції. Як називаються дані реакції ?
Вкажіть умови проходження реакцій

а) СН ≡ СН + Н2О →
![]()
![]()
![]() б)3СН ≡ СН →
б)3СН ≡ СН →


![]()
Фізичні властивості ацетилену

Безбарвний

![]() газ
газ
![]() без запаху має слабку
без запаху має слабку

 наркотичну дію
наркотичну дію

![]()

![]() технічний ацетилен С2Н2 Мr(С2Н2) = 26
технічний ацетилен С2Н2 Мr(С2Н2) = 26

![]() має запах зумовлений
має запах зумовлений

![]() токсичними домішками
токсичними домішками
РН3 та AsН3 трохи легший
за повітря

погано розчиняється
у воді
Застосування ацетилену
З вуглеводнів з потрійним зв’язком велике промислове значення має тільки ацетилен.
При спалюванні ацетилену в кисні температура повітря досягає 3150 0С, тому його використовують для зварювання та різання металів.


 хлоропренового різання і зварювання
хлоропренового різання і зварювання
 каучуку металів
каучуку металів
![]()

![]()
![]() полівінілхлорид виробництво штучних
полівінілхлорид виробництво штучних
волокон



![]() С2Н2
С2Н2
![]()
 оцтова барвників
оцтова барвників


 кислота лаків
кислота лаків

![]() духів і
духів і
оцтовий альдегід одеколонів
![]()
 розчинники (трихлоретан ліків
розчинники (трихлоретан ліків
C2H3Cl3, С2Н2Сl4 тетрахлоретан)
 Добування ацетилену
Добування ацетилену
Ацетилен було відкрито у 1836 р. Е. Деві під час дії води на кальцій карбід. Деві назвав речовину «новим газоподібним двокарбоновим воднем» і встановив молекулярну формулу, що відповідає сучасній С2Н2.
- СаС2 + Н2О → С2Н2 + Са(ОН)2, реакція відбувається бурхливо з виділенням великої кількості теплоти. Цей спосіб запроваджений у 19 столітті, називається карбідним.
- 2СН4 ─15000С→ С2Н2 + 3Н2 – це сучасний спосіб добування ацетилену з метану.
Хімічні властивості ароматичних вуглеводнів.
1. Напишіть рівняння взаємодії бензену з речовинами, поданими у схемі:
2. Вкажіть умови, за яких відбуваються реакції, подані у схемі.
3H2
![]()
![]()
![]()
Br2 O2
 + + +
+ + +
![]()
![]()
 + + 3Cl2
+ + 3Cl2
![]()
![]() HNO3
HNO3
![]() +
+
![]()
![]() CH3Cl
CH3Cl
C6H12
![]()
CH ≡ CH

![]() 3. Гомолог бензену – метилбензен ( С6Н5 – СН3 )- легше
3. Гомолог бензену – метилбензен ( С6Н5 – СН3 )- легше

![]() вступає в реакції заміщення. При цьому заміщуються
вступає в реакції заміщення. При цьому заміщуються
![]() три атоми Гідрогену в положеннях 2,4,6. Напишіть рівняння взаємодії з бромом і нітратною кислотою, назвіть утворені продукти.
три атоми Гідрогену в положеннях 2,4,6. Напишіть рівняння взаємодії з бромом і нітратною кислотою, назвіть утворені продукти.
4. Яку іншу назву ароматичних вуглеводнів ви знаєте?
Відповідь обґрунтуйте.
Фізичні властивості бензену
Мr (С6Н6) = 78
 безбарвна з характерним
безбарвна з характерним
 запахом
запахом
![]()
![]()
![]() летка рідина вогненебезпечна
летка рідина вогненебезпечна

![]() tкип. = 800С не розчиняється у воді
tкип. = 800С не розчиняється у воді
![]()
![]() С6Н6
С6Н6
![]()
![]()

 tпл = 5,50С розчиняється в
tпл = 5,50С розчиняється в
органічних розчинниках
сам є розчинником отруйний
багатьох речовин
при охолодженні легко перетворюється
на білу кристалічну масу з tпл = 5,50С
Систематичне вдихання парів бензену викликає анемію і лейкемію!
Уперше відкритий англійським ученим М. Фарадеєм у 1825 р. у світильному газі.
Застосування бензену
![]()
виробництво
 розчинників
розчинників
![]() Виробництво пластмас
Виробництво пластмас
(фенол-формальдегідні смоли)
![]()

![]() Бутадієн-стирольний каучук
Бутадієн-стирольний каучук
Волокна лавсану

![]()

![]()
![]()
![]() барвників виробництво ліків
барвників виробництво ліків
 (використовують толуол)
(використовують толуол)
 Бензен
Бензен
![]()

![]()

![]()
![]() Добування аніліну
Добування аніліну
![]() вибухових речовин
вибухових речовин
 сахарину
сахарину
як добавка поліпшує
якість моторного палива

засоби для боротьби з
шкідниками і хворобами рослин
(пестициди, інсектициди, фунгіциди)
Добування бензену
![]()
![]() СН2
СН2
![]()
![]() Н2С СН2 дегідрування, Pt,Pd, 5000С
Н2С СН2 дегідрування, Pt,Pd, 5000С
![]()

![]()
![]() Н2С СН2 з циклогексану - 3Н2
Н2С СН2 з циклогексану - 3Н2
СН2

![]() СН2 – СН2 – СН2 дегідрування, Pt, 3000С
СН2 – СН2 – СН2 дегідрування, Pt, 3000С
![]()
![]()
![]()
 СН2 – СН2 – СН2 з гексану - 4Н2
СН2 – СН2 – СН2 з гексану - 4Н2
С, 450-5000С
![]() 3НС ≡ СН
3НС ≡ СН
Ацетилен пропускають крізь активоване вугілля

![]() AlCl3
AlCl3
![]()
![]() + СН3Cl НCl
+ СН3Cl НCl
Алкілування бензену +

![]() - СН3
- СН3
![]()
![]()
Pt, 3000С
![]()
![]() СН3
СН3
З метил циклогексану – 3Н2
Хімічні властивості насичених одноатомних спиртів.
Загальна формула насичених одноатомних спиртів СnН2n+1ОН.
Одноатомні спирти не мають ні яскраво виражених лужних, ні кислотних властивостей, водні розчини спиртів на індикатори не діють.
1. Напишіть рівняння взаємодії етанолу з речовинами запропонованими у схемі, назвіть речовини А, Б, В.
![]()
![]() + H2O
+ H2O
![]()
![]() Na A
Na A
![]()
![]() CH3COH
CH3COH

![]() HCl
HCl
-H2
+ +
![]()
![]() t‹1400C, H2SO4 t›1400C, H2SO4
t‹1400C, H2SO4 t›1400C, H2SO4
![]()
![]()
![]() B С2Н5ОН Б
B С2Н5ОН Б
![]() +
+
-H2O
![]()
![]() +
+
С2Н4 CuO

CH3COOH
![]()
![]() 2. Сформулюйте визначення багатоатомних спиртів. Напишіть рівняння взаємодії гліцеролу з купрум(ІІ) гідроксидом і нітратною кислотою. Назвіть продукти реакцій.
2. Сформулюйте визначення багатоатомних спиртів. Напишіть рівняння взаємодії гліцеролу з купрум(ІІ) гідроксидом і нітратною кислотою. Назвіть продукти реакцій.
3. Первинні та вторинні спирти відносно легко окиснюються. У первинних – атом Карбону, біля якого розміщується гідроксогрупа, окиснюється до альдегідної групи, у вторинних – атом Карбону окислюється до кетоногрупи -С-
l|
Напишіть рівняння окиснення бутан-1-олу і бутан-2-олу. О
Добування насичених одноатомних спиртів.
1. У промисловості спирти іноді добувають із галогенопохідних вуглеводнів, діючи на
них розведеними розчинами гідроксидів натрію, калію і кальцію при нагріванні:
CnH2n+1Cl + KOH → CnH2n+1OH + KCl, це також і лабораторний метод добування
спиртів.
2. Метанол синтезують головним чином із водяного газу:
![]() СО + 2Н2 220 – 300 0С, 5 – 10 МПа, Cu,ZnO СН3ОН – стара назва (деревний спирт), бо
СО + 2Н2 220 – 300 0С, 5 – 10 МПа, Cu,ZnO СН3ОН – стара назва (деревний спирт), бо
раніше метанол виділяли з продуктів піролізу деревини.
Найпоширеніший із спиртів – етанол, його добувають різними способами:


1. Гідратація етилену 3. Гідроліз крохмалю та зброджування
За допомогою водяної пари утвореної глюкози(див. п.2), пшениця,
![]() Н2С=СН2 + НОН t,p,kat C2Н5 ─ОН картопля, рис і т.д.
Н2С=СН2 + НОН t,p,kat C2Н5 ─ОН картопля, рис і т.д.
 (─С6Н10О5─)n + nН2О → nС6Н12О6
(─С6Н10О5─)n + nН2О → nС6Н12О6

![]()
Етанол

 С2Н5ОН
С2Н5ОН


2. Зброджування цукристих 4. Гідроліз клітковини та зброджування
речовин: утвореної глюкози. (див.п.2 і 3)
![]() С6Н12О6 ферменти 2С2Н5ОН + 2СО2 значну кількість етанолу виділяють
С6Н12О6 ферменти 2С2Н5ОН + 2СО2 значну кількість етанолу виділяють
з деревини.
Фізичні властивості насичених одноатомних спиртів
 На відміну від гомологічного ряду насичених і ненасичених вуглеводнів
На відміну від гомологічного ряду насичених і ненасичених вуглеводнів
у ряді спиртів немає газоподібних речовин.
Нижчі спирти – рідини, вищі – з кількістю вуглецевих атомів більше
 12 – тверді речовини.
12 – тверді речовини.
 Спирти мають високі температури кипіння – причиною цього є легкість
Спирти мають високі температури кипіння – причиною цього є легкість
утворення водневих зв’язків між молекулами спирту.
 Із збільшенням молекулярної маси, збільшується температура
Із збільшенням молекулярної маси, збільшується температура
кипіння спиртів.
![]() Із збільшенням молекулярної маси членів гомологічного ряду, розчинність
Із збільшенням молекулярної маси членів гомологічного ряду, розчинність
спиртів зменшується.

СnН2n+1ОН
![]()

 СН3ОН, С2Н5ОН і С3Н7ОН – змішуються з водою у будь-яких
СН3ОН, С2Н5ОН і С3Н7ОН – змішуються з водою у будь-яких
співвідношеннях. Усі спирти легші за воду.
Метанол, етанол, пропан-1-ол мають специфічний алкогольний запах,
середні спирти С4 – С6 – неприємний запах, вищі – запаху не мають.
Фізіологічна дія спиртів на організм негативна. Метиловий спирт СН3ОН –
сильна отрута! У малих кількостях викликає сліпоту, у великих –
спричиняє смерть! Етиловий спирт С2Н5ОН, при частому вживанні
викликає захворювання – алкоголізм!
Фізичні властивості багатоатомних спиртів
![]()
безбарвні


![]()
Гліцерол сиропоподібні
![]()
![]() не отруйний рідини
не отруйний рідини

Етиленгліколь


![]()
 Гліцерол
Гліцерол
![]()

![]() Етиленгліколь – солодкуваті
Етиленгліколь – солодкуваті
сильна отрута на смак


важчі за добре розчиняються
воду у воді

мають високу
![]()
![]() температуру кипіння
температуру кипіння
![]()
![]()
Етиленгліколь – 197 0С Гліцерол – 290 0С
Застосування насичених одноатомних спиртів
І. серед спиртів, найпоширеніше застосовують етиловий спирт:
![]()
Фруктових
![]() вод
вод
![]() Добування оцтової кислоти
Добування оцтової кислоти

![]()
![]() Духів і одеколонів
Духів і одеколонів
 Пальне для двигунів
Пальне для двигунів
![]()
 Для технічних
Для технічних
 потреб, денатурація -
потреб, денатурація -
непридатність для пиття
![]()

![]()
![]() Добування бездимного виробництво ліків
Добування бездимного виробництво ліків
 пороху
пороху


![]() С2Н5ОН
С2Н5ОН
![]() Пальне для двигунів
Пальне для двигунів

![]()

 внутрішнього згоряння
внутрішнього згоряння
Виготовлення
![]() розчинників
розчинників
 Лікеро-горілчані
Лікеро-горілчані
напої дезінфікуючий засіб
![]() медичний спирт Барвників, лаків,
медичний спирт Барвників, лаків,
політур

Бутадієнового та
Бутадієн-стирольного каучуку
ІІ. Метанол використовується головним чином для виробництва формальдегіду, деяких
ліків. Його використовують також як розчинник лаків і фарб.
Пентилові спирти застосовують у виробництві складних ефірів, потрібних для
парфумерії. Ізопентиловий спирт – реагент для визначення жирності молочних
продуктів.
Застосування багатоатомних спиртів
- Гліцерол, який з багатоатомних спиртів найчастіше застосовується, добувають із рослинних і тваринних жирів.
- Він є побічним продуктом при виготовленні мила.
- Останнім часом поширеним є синтез гліцеролу з пропену, що утворюється внаслідок крекінгу нафтопродуктів.
- Водні і спиртові розчини етиленгліколю, застосовуються як незамерзаючі при низьких температурах розчини (антифризи), що замінюють воду в радіаторах автомобільних та авіаційних двигунів у зимовий період.
- Етиленгліколь застосовують також для виготовлення цінного синтетичного волокна – лавсану.

Виробництво вибухових
речовин (динаміт)
![]()

 у парфумерії г у медицині (для
у парфумерії г у медицині (для
![]()
![]() (для виготовлення кремів) виготовлення мазей,
(для виготовлення кремів) виготовлення мазей,
л судинорозширювальних
препаратів)
![]() і
і
для виправлення шкіри

![]() (запобігає висиханню шкіри) ц в органічному синтезі
(запобігає висиханню шкіри) ц в органічному синтезі
![]() (для виробництва синтетичних
(для виробництва синтетичних
е смол)
р

 у текстильній промисловості у поліграфії (для виготовлення
у текстильній промисловості у поліграфії (для виготовлення
![]()
![]() (надає тканинам м´якості, о невисихаючих фарб)
(надає тканинам м´якості, о невисихаючих фарб)
еластичності)
л
Хімічні властивості фенолу
Феноли – це органічні сполуки, у молекулах яких гідроксильні групи безпосередньо зв’язані з бензеновим ядром.
- Напишіть рівняння реакцій, що лежать в основі схеми:
2. Яка з реакцій не відбувається?

3Br2
![]()


O2 KOH

![]()
+ +
 +
+
 H2SO4
H2SO4
![]()
![]() Na С6Н5 - ОН + 3HONO2
Na С6Н5 - ОН + 3HONO2



 NaOH H2O
NaOH H2O
C6H5Cl
3. Якісна реакція на фенол: при додаванні до водного розчину фенолу жовтувато-бурого
розчину ферум(ІІІ) хлориду з'являється фіолетове забарвлення.
3C6H5OH + FeCl3 → (C6H5O)3Fe + 3HCl
4. Наявність гідроксильної групи зумовлює схожість
фенолу на спирти . Вплив бензольного ядра на гідрокси-
![]() льну групу зумовлює значну рухливість її водневого
льну групу зумовлює значну рухливість її водневого
 атома. Тому фенол, на відміну від спиртів, реагує з
атома. Тому фенол, на відміну від спиртів, реагує з
лугами. Вкажіть властивість схожу на властивості спиртів та властивість, яка
відрізняється від властивостей спиртів.
5. Реакції окиснення: фенол за звичайних умов поступово окислюється киснем повітря і з
часом набуває блідо-рожевого кольору. Окислюється він і калій перманганатом, при
цьому фіалкове забарвлення водного розчину солі (C6H5O)3Fe зникає, й утворюється
бурий осад манган(IV) оксиду.
Застосування фенолу
І. Фенол застосовують для виробництва фенолформальдегідних пластмас, барвників, ліків, вибухових речовин та інших речовин. Розчин фенолу у воді має дезинфікуючі властивості.
2,4,6-тринітрофенол (пікринова кислота) використовується для добування вибухових речовин (пікратів). Його використовують також при лікуванні опіків.
Фенол і його похідні – отруйні речовини, дуже небезпечні для всіх живих організмів (людини, тварин, рослин). Тому при виробництві фенолу залишки його вловлюють за допомогою спеціальних пристроїв, побічні продукти, які містять фенол, каталітично окислюють, стічні води обробляють озоном.
![]()
виробництво
фотореактивів
![]()
![]()
![]() Вибухових речовин
Вибухових речовин

![]() Волокна капрону
Волокна капрону
![]() Речовини для дезинфекції
Речовини для дезинфекції
![]()
![]()
![]()
![]() барвників виробництво ліків
барвників виробництво ліків

С6Н5-ОН


![]() Гетинаксу (корпуси
Гетинаксу (корпуси
 Текстоліту (підшипники) телевізорів
Текстоліту (підшипники) телевізорів


 Карболіту (ґудзики,
Карболіту (ґудзики,
 Склотекстоліту штепселі, розетки)
Склотекстоліту штепселі, розетки)
(іграшки для дітей)
![]()

 Волокніт
Волокніт
![]() Виробництво пластмас, (транспортер метро)
Виробництво пластмас, (транспортер метро)
синтетичних смол
феноло-формальдегідна смола
Фізичні властивості фенолу
![]()
Безбарвна кристалічна
речовина
![]()
![]()
![]()

 при потраплянні специфічний
при потраплянні специфічний
на шкіру викликає опіки запах

![]()
![]()
![]() всмоктується через шкіру, на повітрі окинюється,
всмоктується через шкіру, на повітрі окинюється,
 може викликати отруєння набуваючи рожеве забарвлення
може викликати отруєння набуваючи рожеве забарвлення
![]()
![]() С6Н5-ОН
С6Н5-ОН
![]()
![]()

![]()
отруйний температура плавлення
рівна 43 0С

водний розчин –
![]() карболова кислота - дезинфекція частково розчиняється
карболова кислота - дезинфекція частково розчиняється
у воді
Добування альдегідів
- У лабораторії альдегіди добувають окисненням первинних спиртів. Як окисники застосовують купрум(ІІ) оксид, пероксид водню та інші речовини, здатні віддавати кисень. У загальному вигляді це можна показати так:
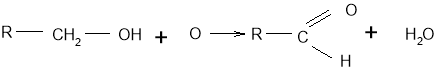
- У промисловості альдегіди добувають різними способами. Найкраще економічно добувати метаналю безпосереднім окисненням метану киснем повітря в спеціальному реакторі:

3. Метаналь добувають окисненням метанолу, пропускаючи його пару разом із
повітрям через реактор з розжареною міддю або срібною сіткою:
4. Етаналь можна добути гідратацією ацетилену в присутності солей ртуті як
каталізатора (реакція Кучерова М.Г.):
Оскільки в цій реакції як каталізатор використовуються отруйні речовини – солі
Ртуті, то останнім часом використовується інший метод добування етаналю.
5. Суміш етилену з повітрям пропускають крізь водний розчин солей міді, заліза і
паладію. Цей процес можна зобразити так:
![]()
Застосування альдегідів

Органічний синтез:
Етаналь використовують для одержання
оцтової кислоти та її похідних
![]()


Пластмаси і смоли: Розчинники:
![]()
![]() Метаналь – бакелітова смола, як розчинники переважно використовують
Метаналь – бакелітова смола, як розчинники переважно використовують
фенол-формальдегідна смола. кетони (пропанон) – розчинник нітроцелю-
лози і ацетилцелюлози.

![]()
![]() Альдегіди
Альдегіди



![]()
 Антисептик: Медицина:
Антисептик: Медицина:
Формалін – водний розчин хлоральгідрат ССl3CH(OH)2 –
метаналю має сильні дезінфікуючі снодійний засіб, входить також до складу
властивості, для зберігання анатомічних деяких анальгетиків (обезболюючих).
препаратів.

 Сільське господарство: Харчова промисловість:
Сільське господарство: Харчова промисловість:
Одержання інсектициду ДДТ бензальдегід, має запах гіркого мигдалю,
(заборонений у використанні, погано використовується в якості харчової добавки.
виводиться з організму)

Виробництво
барвників
Застосування метаналю (формалін) ґрунтується на здатності згортати білки. У с/г формаліном протруюють насіння, проявляє дубильну дію на білки шкіри – робить їх твердішими та негниючими. Взаємодією метаналю з амоніаком добувають відому лікарську речовину уротропін. Етаналь у великій кількості використовують для добування оцтової кислоти.
Ацетонове дихання. Ацетон міститься у невеликих кількостях в крові та сечі людини. У хворих на цукровий діабет його концентрація набагато вища, ніж у здорових людей. Діабетики виділяють надлишковий ацетон при диханні, яке набуває через це специфічний запах і називається – «ацетонове дихання» !!!
Хімічні властивості та добування альдегідів.
У альдегідів хімічні властивості зумовлені наявністю в їхніх молекулах карбонільної групи:
Для них характерні реакції приєднання внаслідок розриву подвійного зв'язку карбонільної групи, а також реакції окиснення, що відбуваються дуже легко за місцем зв'язку
С – Н , який перебуває під впливом карбонільного атома кисню.
Н2
 Cu(OH)2
Cu(OH)2
![]() +
+
+
Ag2O + СН3 - СОН CH4

![]()
![]()
CH ≡ CH
CH2 = CH2
C2H5OH
![]()
![]()

![]()




![]()


1. Вкажіть реакцію «срібного дзеркала» . За яких умов
відбувається реакція ?

Хімічні властивості насичених одноосновних карбонових кислот
Загальні властивості карбонових кислот аналогічні відповідним властивостям неорганічних кислот.
Mg
![]()
ZnO
 CH3 - OH
CH3 - OH

KOH
![]()

![]()
![]() CaCl2 СН3 – СООН Ba(OH)2
CaCl2 СН3 – СООН Ba(OH)2


![]()
Na2SO4
Cl2
C3H7 - OH
1. З одноосновних карбонових кислот метанова кислота



![]()




 найсильніша. Через особливості будови молекул метано-ва кислота подібно до альдегідів легко окиснюється:
найсильніша. Через особливості будови молекул метано-ва кислота подібно до альдегідів легко окиснюється:
![]() Н – СООН + Ag2O NH3,H2O
Н – СООН + Ag2O NH3,H2O
2. При нагріванні з концентрованою сульфатною кислотою
відщеплює воду: Н – СООН →
Фізичні властивості карбонових кислот

Серед кислот, на відміну від альдегідів, газоподібних речовин немає.
Нижчі члени ряду – рідини з гострим запахом, які добре розчиняються у воді.
Із збільшенням молекулярної маси розчинність їх у воді зменшується, а
температура кипіння підвищується

Вищі кислоти (починаючи з нонанової) – речовини тверді, без запаху, у воді не розчиняються.
 Причиною відсутності газоподібних речовин пов’язана з асоціацією молекул
Причиною відсутності газоподібних речовин пов’язана з асоціацією молекул
за допомогою водневих зв’язків. Рідкі кислоти складаються із спарених
молекул – димерів. Метанова кислота навіть у пароподібному стані
складається з димерів.
 Будову димерів карбонових кислот можна зобразити так:
Будову димерів карбонових кислот можна зобразити так:
Між двома молекулами можуть встановитися два водневих зв'язки,
що й зумовлює порівняно велику міцність димерних сполук.
Добування карбонових кислот
- В лабораторії карбонові кислоти можна добувати з їхніх солей, діючи на них сульфатною кислотою при нагріванні:
![]() 2CH3-COONa + H2SO4 t Na2SO4 + 2CH3-COOH
2CH3-COONa + H2SO4 t Na2SO4 + 2CH3-COOH
У промисловості карбонові кислоти добувають різними способами:
І. Окисненням вуглеводнів:
![]() А) 2CH4 + 3O2 kat 2HCOOH + 2H2O;
А) 2CH4 + 3O2 kat 2HCOOH + 2H2O;
![]() Б) 2CH3-CH2-CH2-CH3 + 5O2 p, kat 4CH3COOH + 2H2O – цей спосіб добрий
Б) 2CH3-CH2-CH2-CH3 + 5O2 p, kat 4CH3COOH + 2H2O – цей спосіб добрий
оскільки використовується дешевий бутан (розробив М.М.Емануель).
![]() В) 2C36H74 + 5O2 p, kat 4C17H35-COOH + 2H2O.
В) 2C36H74 + 5O2 p, kat 4C17H35-COOH + 2H2O.
II.Окисненням спиртів:
![]() А) R-CH2-OH + O2 kat R-COOH + H2O
А) R-CH2-OH + O2 kat R-COOH + H2O
![]() Б) CH3-CH2-OH + O2 бактерії CH3-COOH + H2O
Б) CH3-CH2-OH + O2 бактерії CH3-COOH + H2O
ІІІ. Окисненням альдегідів:
![]() А) 2R-COH + O2 kat 2R-COOH
А) 2R-COH + O2 kat 2R-COOH
Б) реакція «срібного дзеркала»:
![]() R-COH + Ag2O t, аміачний розчин R-COOH + 2Ag↓
R-COH + Ag2O t, аміачний розчин R-COOH + 2Ag↓
В) окиснення купрум(ІІ) гідроксидом – реакція «мідного дзеркала»:
![]() R-COH + 2Cu(OH)2 t R-COOH + 2CuOH +H2O
R-COH + 2Cu(OH)2 t R-COOH + 2CuOH +H2O
голубий жовтий
IV. Специфічні способи добування:
![]() А) CH3OH + CO 0,1 MПа,kat CH3-COOH
А) CH3OH + CO 0,1 MПа,kat CH3-COOH
Б) Оцтову кислоту добувають із продуктів піролізу деревини.
![]() В) CO + NaOH t, 0,6-0,8 МПа HCOONa
В) CO + NaOH t, 0,6-0,8 МПа HCOONa
![]() HCOONa + H2SO4 t HCOOH + NaHSO4
HCOONa + H2SO4 t HCOOH + NaHSO4
Застосування карбонових кислот
Мурашина кислота застосовується в промисловості як сильний відновник. Її
1,25%-ний розчин у спирті (мурашиний спирт) застосовується в медицині. Складні естери метанової кислоти використовуються як розчинники і пахучі речовини. Найбільше використовується оцтова кислота.

Добування ліків

 (аспірин)
(аспірин)
![]()
![]() Добування солей – ацетатний шовк
Добування солей – ацетатний шовк
![]() ацетатів
ацетатів

![]()

![]()
![]() фруктові есенції розчинники для
фруктові есенції розчинники для
![]() СН3СООН лаків
СН3СООН лаків


![]()
засоби для боротьби стимулятори росту
![]()

 із шкідниками і рослин
із шкідниками і рослин
хворобами рослин


барвники для кіноплівка,
тканин оргскло

для консервування,
приправа до страв
Натрієві і калієві солі вищих карбонових кислот – основна складова частина мила.
Взаємозв’язок між вуглеводнями, спиртами, альдегідами, карбоновими кислотами і складними естерами.
Під час хімічних реакцій речовини взаємо -перетворюються, тобто між класами речовин існує генетичний зв'язок.

С6Н6
![]()
![]()
![]() С2Н6 С2Н4 С2Н2
С2Н6 С2Н4 С2Н2
![]()
С2Н5 - Cl
![]()
![]()
![]() С2Н5 - ОН СН3 – СОН
С2Н5 - ОН СН3 – СОН
![]()

![]() СН3 – СОО - С2Н5 СН3 - СООН
СН3 – СОО - С2Н5 СН3 - СООН




![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()


Хімічні властивості глюкози.
- Хімічні властивості глюкози зумовлені наявністю гідроксильних і альдегідної групи. Тому глюкоза вступає в реакції, характерні для спиртів і альдегідів.
![]()
Як альдегіди:
![]()

- Подібно до альдегідів може відновлюватись, утворюється шестиатомний спирт – сорбіт: CH2OH – (CHOH)4 – COH + H2
- Вступає в реакцію «срібного дзеркала», окислюючись до глюконової кислоти: CH2OH – (CHOH)4 – COH + Ag2O
- Окисноється купрум (ІІ) гідроксидом під час кипіння до глюконової кислоти: CH2OH – (CHOH)4 – COH + Cu(OH)2 …. + Cu2O + …
![]()
Як спирти:
![]()

4. Як багатоатомний спирт глюкоза вступає в реакції естерифікації з
органічними кислотами :
CH2OH – (CHOH)4 – COH + 5CH3COOH
5. Взаємодіє з гідроксидами металів з утворенням сахаратів:
CH2OH – (CHOH)4 – COH + Ca(OH)2
При взаємодії глюкози з купрум (ІІ) гідроксидом утворюється сахарат міді
- сполука синьго кольору. Реакцію використовують в медицині для
виявлення цукру в сечі.
![]()
Бродіння:
![]()

6. Спиртове бродіння:
C6H12O6 –дріжджі
7. Молочнокисле бродіння:
C6H12O6 –молочнокислі бактерії
8. маслянокисле бродіння:
C6H12O6 ….. + 2H2 + 2CO2
- Допишіть рівняння реакцій запропоновані у схемах. Чому глюкозу відносять до альдегідо-спиртів?
- Чому реакція «срібного дзеркала», яка є характерна для глюкози з фруктозою не відбувається? Яка маса срібла виділиться, якщо в реакцію вступило 360 г глюкози?
Характеристика хімічного елемента згідно положення у періодичній системі.
![]()
кількість
електронів
![]()
![]()
![]()
![]()
![]() Металічний чи Назва протонне атомна
Металічний чи Назва протонне атомна
неметалічний елемента число маса

![]()
![]()
![]()
![]()
![]()
![]() Будова зовнішнього період
Будова зовнішнього період
![]()
![]() енергетичного рівня
енергетичного рівня
![]()
 Елемент
Елемент
![]()
![]()
![]()


![]() Число ряд
Число ряд
нейтронів
![]()
група
![]()

![]() кількість
кількість
енергетичних заряд ядра підгрупа
рівнів

![]() вищий оксид летка сполука
вищий оксид летка сполука
характер оксиду з воднем
- Якими особливостями будови атомів зумовлюються металічні властивості елементів?
- Якими особливостями будови атомів зумовлюються неметалічні властивості елементів?
- Користуючись схемою, опишіть за місцем у періодичній системі та за будовою атомів елементи з порядковими номерами 3 і 15.
- Назвіть елементи, що мають таку будову електронних оболонок, дайте характеристику цим елементам за положенням у періодичній системі:
А) 1S22S22P3,
Б) 1S22S22P63S23P1.
Фізичні властивості кисню і озону.
- Що таке алотропія? Чим пояснюється існування різних алотропних форм?
- Що собою являє озон і де він застосовується?
трохи важчий за
Mr(O2)=32 повітря Mr(пов.)==29
![]() неотруйний погано розчиняється у H2O
неотруйний погано розчиняється у H2O
без запаху ( у 100 обємах Н2О при 200 розчиняється
безбарвний з об’єми О2 )

![]()
![]() газ зріджується при -1830С
газ зріджується при -1830С
![]()
![]() у повітрі 21% О2 твердне при -218,80С Голубого кольору
у повітрі 21% О2 твердне при -218,80С Голубого кольору
________________________
газ О3
![]()
![]() нестійкий сильний окисник
нестійкий сильний окисник
![]()
![]()
![]() синього кольору утворюється під-час грози
синього кольору утворюється під-час грози
![]()
![]() запах свіжості дуже отруйний
запах свіжості дуже отруйний
![]()
![]() розчинний у воді
розчинний у воді
(у 100 обємах Н2О при 200
розчиняється 49 об’ємів О3)
![]() 3. Який об’єм озону може утворитися з 5,6 л кисню ?
3. Який об’єм озону може утворитися з 5,6 л кисню ?
![]()
![]()
![]() 4. Які алотропні модифікації утворює Сульфур ?
4. Які алотропні модифікації утворює Сульфур ?
![]()
![]()
![]() Охарактеризуйте їх фізичні властивості.
Охарактеризуйте їх фізичні властивості.
Застосування озону
окисник ракетного
палива
озонування очищення промислових вибілювання дезинфікуючий
питної води стічних вод тканин і засіб у медицині
мінеральних масел
![]()

![]()
![]()
Сульфур (IV) і сульфур (VI) оксиди. Фізичні властивості.
- Яка фізіологічна дія SO2 ?
- Який вплив на навколишнє середовище оксидів сульфуру ?
газ
![]() безбарвний має різкий запах
безбарвний має різкий запах
![]() ( викликає кашель)
( викликає кашель)
 Мr(SO2) = 64
Мr(SO2) = 64
важкий ( у 2,2 рази важчий за повітря)
![]() SO2
SO2
не горить
у воді не тільки розчиняється,
отруйний а реагує з нею, утворюючи
H2SO3
добре розчиняється у Н2О
![]() 3. Назвіть галузі застосування SO2 та SO3.
3. Назвіть галузі застосування SO2 та SO3.
![]()
![]()
![]()
![]()
![]()
рідина
безбарвна
на повітрі димить,
утворюючи сульфатну
 кислоту
кислоту
легко кристалізується ( 170С )
добре розчиняється SO3
![]() у воді
у воді
![]() летка речовина
летка речовина
уражує дихальні
шляхи, викликає опіки
Mr(SO3) = 80
токсичний
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()

![]() Хімічні властивості сульфур (IV) і сульфур (VI) оксидів.
Хімічні властивості сульфур (IV) і сульфур (VI) оксидів.
1. Оксид сульфуру (VI) димить на повітрі, утворюючи білий туман, бурхливо
взаємодіючи з водою з виділенням великої кількості теплоти. Зобразіть
цей процес рівнянням.
2. Якщо крізь розчин їдкого натру NaOH пропустити сірчистий газ SO2, то
залежно від кількості речовин, які беруть участь в реакції, утвориться кисла
або середня сіль. Напишіть рівняння реакцій, назвіть утворені солі.
![]()
Взаємодія з водою
![]()

 SO2 і SO3
SO2 і SO3
![]()
 взаємодія з
взаємодія з
![]() лугами Взаємодія з основними
лугами Взаємодія з основними
оксидами
3. Напишіть відповідні рівняння реакцій, назвіть продукти реакцій.
4. Напишіть рівняння реакцій, що лежать в основі схеми:
![]() RbHSO4
RbHSO4
S → SO2 → SO3
![]()
Rb2SO4
Фізичні властивості сульфатної кислоти
рідина
Мr(H2SO4) = 98 безбарвна

M(H2SO4) = 98 г/моль
![]() важка (ρ = 1,84 г/см3)
важка (ρ = 1,84 г/см3)

![]()
![]() нелетка двоосновна
нелетка двоосновна
H2SO4
![]()
добре розчинна у воді
оксигеновмісна
їдка рідина ( при попаданні на шкіру змити водою!)
![]()
![]() Хімічні властивості сульфатної кислоти
Хімічні властивості сульфатної кислоти
![]()


![]()
![]() Ba
Ba
Al Na2O
![]()

![]()

![]()
![]() Fe2O3 ZnO
Fe2O3 ZnO
![]()

![]()
 H2SO4
H2SO4
![]()
![]()
![]() NaOH Cr(OH)3
NaOH Cr(OH)3

![]()

Na2CO3 K2S

Li2SiO3

- а) Напишіть якісну реакцію на сульфат- йон. б)Напишіть рівняння реакцій взаємодії концентрованої сульфатної кислоти з металами, що в ряду активності знаходяться до Гідрогену і після нього.
 Фізичні властивості азоту.
Фізичні властивості азоту.
1. Напишіть електронну формулу атома Нітрогену. В чому подібність і
відмінність в будові атомів Нітрогену і Оксигену?
2. Охарактеризуйте за положенням у періодичній системі та будовою атомів:
а) Фосфор, б) Арсен.
![]()
малоактивний газ

![]()

без кольору малорозчинний у воді
( неполярність молекул )
 низькі t0 плавлення твердне – (-2100С)
низькі t0 плавлення твердне – (-2100С)
і кипіння
N2
![]() Mr(N2) = 28
Mr(N2) = 28
![]() стає рідкий – (-1960С)
стає рідкий – (-1960С)
трохи легший за
![]() кристалічна гратка - повітря
кристалічна гратка - повітря
![]() молекулярна
молекулярна
без запаху
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 3. Виходячи з будови зовнішнього енергетичного рівня Нітрогену, Фосфору,
3. Виходячи з будови зовнішнього енергетичного рівня Нітрогену, Фосфору,
Арсену, напишіть формули вищих оксидів та летких водневих сполук.
Поясніть зміну їх властивостей із зростанням протонного числа
елементів.
4. В одній посудині міститься азот, у другій – кисень. Яким чином розпізнати
ці гази?
5. Який тип хімічного зв'язку у молекулі азоту? Чим пояснюється мала
хімічна активність азоту?
Алотропні модифікації Фосфору
Фізичні властивості
Білий фосфор Червоний фосфор Чорний фосфор
![]()
![]()
![]()
▪ схожий на віск ▪твердий ▪ відносно м’який
▪ мяка кристалічна ▪порошкоподібна речовина ▪ речовина схожа на
речовина ▪темно-червоного кольору графіт
▪ безбарвна з жовтуватим ▪немає запаху ▪сіро – чорний відтінок
відтінком ▪плавиться лише ▪шарувата будова
▪запах часнику під тиском при температурі ▪металічний блиск
▪легкоплавкий tпл=44 0С більше 280 0С ▪немає запаху
▪легкозаймистий ▪загоряється при 260 0С при ▪утворюється з білого
▪через легке займання цьому переходить у білий фосфору при
зберігається під водою у темряві не світиться тривалому нагріванні
▪у темряві світиться ▪легко вбирає вологу (гігро- під великим тиском
зеленкувато-жовтим скопічний) ▪у воді і сірковуглеці
світлом (люмінесценція) ▪у воді і сірковуглеці не розчиняється
▪не розчиняється у воді не розчиняється ▪найстійкіша алотропна
▪розчиняється у сірковуглеці ▪при сильному нагріванні без форма
(CS2) і бензині доступу повітря випарову- ▪реакційна здатність
▪кристалічні гратки – ється, а при охолодженні середня
молекулярні Р4 його пара перетворюється ▪кристалічні гратки -
▪висока реакційна здатність на білий фосфор атомні
▪під час нагрівання ▪реакційна здатність низька ▪горить
перетворюється на ▪кристалічні гратки – атомні ▪не отруйний
червоний фосфор ▪не отруйний
▪отруйний
Хімічні властивості азоту і фосфору
1. З киснем азот сполучається за температури електричної дуги, більше
2000 0С. Яку валентність проявляє Нітроген в сполуці, що утворюється?
2. Дайте назву сполукам, що утворюються при взаємодії Mg, Na, Al з азотом.
3. Вкажіть умови за яких можлива реакція між воднем і азотом.


H2
Li
![]()
![]()

 Zn
Zn
![]()
![]() O2
O2

N2
P

![]()
O2 Br2
Ca Cl2
![]()
 4. Вкажіть умови за яких відбувається реакція горіння фосфору в кисні,
4. Вкажіть умови за яких відбувається реакція горіння фосфору в кисні,
назвіть речовину, що утворилася.

 5. Під час повільного окиснення утворюється фосфор (ІІІ) оксид, зобразіть
5. Під час повільного окиснення утворюється фосфор (ІІІ) оксид, зобразіть
цей процес рівнянням?
![]()
![]()
 6. Чи відбувається реакція фосфору з воднем? Відповідь обґрунтуйте.
6. Чи відбувається реакція фосфору з воднем? Відповідь обґрунтуйте.
7. Запишіть рівняння реакцій запропоновані схемою. Назвіть продукти реакцій.
Амоніак. Фізичні і хімічні властивості.
Фізичні властивості
![]()
дуже добре розчиняється у воді
(в 1 об’ємі Н2О – 700 об’ємів NH3)
![]()
різкий запах Мr(NH3) = 17, в 1,7 рази
![]()
![]() легший за повітря
легший за повітря

безбарвний уражує слизові оболонки
![]()
![]() газ очей і дихальних шляхів
газ очей і дихальних шляхів
____________________ NH3 ___________________

![]()


горіння на взаємодія з
повітрі О2 кислотами
взаємодія з
каталітичне водою Н2О
![]() окиснення О2
окиснення О2
Хімічні властивості
1. Для амоніаку характерні реакції окиснення і приєднання. Напишіть рівняння
горіння та каталітичного окиснення амоніаку, урівняйте рівняння
методом електронного балансу, вкажіть окисник та відновник.
2. Напишіть рівняння взаємодії амоніаку з утворенням середніх та кислих
солей з такими кислотами: а) сульфатною, б) ортофосфатною,
в) карбонатною.
3. Індикатор фенолфталеїн в водному розчині амоніаку змінює забарвлення
на малинове, про що це свідчить? Відповідь обґрунтуйте. Зобразіть процес
рівнянням
4. Напишіть рівняння добування амоніаку у лабораторії та у промисловості,
вкажіть умови за яких відбуваються реакції.
Солі амонію. Хімічні властивості.
1. Солі амонію добувають: а) в результаті взаємодії амоніаку з кислотами,
б) при нейтралізації амоній гідроксиду кислотами. Напишіть відповідні
рівняння реакцій з утворенням середніх і кислих солей амонію. В якому
випадку утворюються кислі солі.
(NH4)2S + H3PO4 =
![]() (NH4)2CO3 + HCl =
(NH4)2CO3 + HCl =
![]() (NH4)2SO4 + BaCl2 =
(NH4)2SO4 + BaCl2 =
![]()
NH4Cl + NaOH = 1 2 3

![]() 9 4 NH4NO3 + KOH =
9 4 NH4NO3 + KOH =
t0 8 солі амонію
![]()
![]() NH4Cl = 5
NH4Cl = 5
![]() 7 (NH4)3PO4 + Na2SO4 =
7 (NH4)3PO4 + Na2SO4 =
t0
(NH4)2Cr2O7 = 6
t0
NH4NO3 =
![]()
![]() 2. Напишіть рівняння взаємодії між речовинами у рівняннях 1,2,3,4,5 і 9.
2. Напишіть рівняння взаємодії між речовинами у рівняннях 1,2,3,4,5 і 9.
Складіть повні та скорочені йонні рівняння реакцій.
3. Напишіть рівняння розкладу солей амонію при нагріванні (рівняння 6 і 8).
Назвіть продукти реакцій. Напишіть рівняння розкладу амоній біхромату
(рівняння 7) при нагріванні, якщо в результаті реакції виділяється азот і
утворюється хром (ІІІ) оксид. Чому цю реакцію називають «вулкан» ?
4. Амоній гідрогенкарбонат застосовують при випіканні кондитерських
виробів. Які властивості амоній гідрогенкарбонату при цьому
використовуються ?
Фізичні властивості оксидів Нітрогену (ІІ) і (IV) та
Фосфору.
трохи важчий за повітря в 1,6 рази важчий за повітря
![]()

Mr(NO) =30 Мr(NO2) = 46

погано розчинний з водою вступає у
у воді хімічну взаємодію
![]() без запаху отруйний (подразнює
без запаху отруйний (подразнює
![]() слизові )
слизові )
![]()
![]() газ газ
газ газ
![]()
![]()
![]() NO NO2
NO NO2
![]()
![]()
![]()
![]() безбарвний бурого кольору
безбарвний бурого кольору
P2O5
![]()

![]() пухкий порошок Мr(P2O5) = 142
пухкий порошок Мr(P2O5) = 142
білого
кольору
![]()
гігроскопічний типовий кислотний
![]()
![]()
 ( вбирає воду ) оксид
( вбирає воду ) оксид
1. Нітроген з Оксигеном утворює оксиди в яких проявляє валентність від
І до V. Напишіть формули оксидів та визначте ступені окиснення
Нітрогену в них.
![]()
 2. В якому з оксидів NO чи NO2 масова частка Нітрогену більша? Зробіть
2. В якому з оксидів NO чи NO2 масова частка Нітрогену більша? Зробіть
відповідні обчислення.
3. З метою захисту навколишнього середовища існує кілька способів боротьби
з забрудненням повітря. Наприклад, нітроген (IV) оксид, розкладається за
допомогою каталізатора оксид алюмінію і паладій, на азот і кисень.
Зобразіть цей процес рівнянням.
Хімічні властивості нітратної кислоти
лакмус (рожевий) фенолфталеїн (безбарвний) метилоранж (червоний)


![]()
![]()
змінює забарвлення
![]() індикаторів
індикаторів
нова сіль + нова кислота дисоціює на: Н+ + NO3-
![]()
![]() сильна кислота
сильна кислота

![]()
![]()
сіль нестійких під час нагрівання

![]()
![]() кислот + t і дії світлом розкладається
кислот + t і дії світлом розкладається
![]()
HNO3

![]()
 ? + NO2↑ + ?
? + NO2↑ + ?
+ + +
![]()
![]()
![]() основний основа луг
основний основа луг
![]()

 оксид
оксид
![]()
сіль + вода
![]()
![]() Cu + HNO3 виділяється бурий газ, що свідчить про наявність
Cu + HNO3 виділяється бурий газ, що свідчить про наявність
(конц.) нітрат-йону ( NO3- ).
![]()
![]()
![]() Якісна реакція на нітратну кислоту
Якісна реакція на нітратну кислоту
1. Користуючись схемою, напишіть рівняння реакцій, що характеризують
хімічні властивості нітратної кислоти.
-
 Напишіть якісну реакцію на нітратну кислоту, вкажіть умови реакції.
Напишіть якісну реакцію на нітратну кислоту, вкажіть умови реакції.
- Добудьте нітратну кислоту двома способами, запишіть відповідні рівняння.
4. Напишіть взаємодію концентрованої і розбавленої нітратної кислоти з
цинком і сріблом. Методом електронного балансу знайдіть коефіцієнти.
![]()
![]() Хімічні властивості ортофосфатної кислоти
Хімічні властивості ортофосфатної кислоти
Якісна реакція на ортофосфатну кислоту:
( реактивом на фосфат-аніон РО43- є аргентум-катіон Ag+)
![]() AgNO3 → Ag3PO4↓ + HNO3
AgNO3 → Ag3PO4↓ + HNO3
жовтий осад
+
Н3РО4
![]()
![]()
+ +
![]()
![]()
![]()
![]() дисоціює ступінчасто основний луги
дисоціює ступінчасто основний луги
слабка неорганічна кислота оксид
![]()
Н3РО4 ↔ Н+ + Н2РО4-
Н2РО4- ↔ Н+ + НРО42-
НРО42- ↔ Н+ + РО43- сіль + вода середні і кислі + вода
солі
![]()
![]()
![]()
![]()
![]()
 + +
+ +
![]() метали ( що у витиску вальному солі нестійких кислот
метали ( що у витиску вальному солі нестійких кислот
ряді стоять до Гідрогену )
![]()
![]() сіль + Н2↑ нова сіль + нова кислота
сіль + Н2↑ нова сіль + нова кислота
![]()
![]()
1. Напишіть молекулярні, повні та скорочені йонні рівняння реакцій ортофосфатної
кислоти з: а) кальцієм; б) оксидом кальцію; в) гідроксидом кальцію, взятим у
![]() надлишку та недостачі. Назвіть речовини, що утворилися.
надлишку та недостачі. Назвіть речовини, що утворилися.
2. Де застосовують фосфатну кислоту?
3. При дії нітратної кислоти на фосфор утворюється ортофосфатна кислота. Складіть
рівняння цієї реакції, якщо відомо, що в ній бере участь вода і виділяється нітроген (ІІ)
оксид. Які ще способи добування ортофосфатної кислоти ви знаєте? Запишіть
 рівняння.
рівняння.
Класифікація оксидів

Оксиди




Несолетворні Солетворні
(не утворюють солей) (утворюють солі)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Основні Амфотерні Кислотні
Способи добування оксидів

![]()
![]() Окиснення простих 2Ba + O2 = 2BaO
Окиснення простих 2Ba + O2 = 2BaO
речовин 4Al + 3O2 = 2Al2O3

![]() Окиснення (горіння в CH4 + 2O2 → CO2↑ + 2H2O
Окиснення (горіння в CH4 + 2O2 → CO2↑ + 2H2O
![]() кисні повітря) складних 2ZnS + 3O2 → 2ZnO + 2SO2↑
кисні повітря) складних 2ZnS + 3O2 → 2ZnO + 2SO2↑
речовин

![]() Розклад складних CaCO3 → CaO + CO2↑
Розклад складних CaCO3 → CaO + CO2↑
![]() оксигеновмісних сполук H2SiO3 → SiO2 + H2O
оксигеновмісних сполук H2SiO3 → SiO2 + H2O
під час нагрівання
Хімічні властивості оксидів
Кислотні Основні
![]()
![]()
![]()
![]() взаємодія з водою
взаємодія з водою
![]()
Всі крім SiO2 оксиди активних металів
SO3 + H2O → H2SO4 ( лужних і лужноземельних )
К2О + Н2О → 2КОН
![]()
![]() взаємодія з кислотами
взаємодія з кислотами
![]()
не реагують FeO + 2HNO3 → Fe(NO3)2 + H2O
![]()
![]()
![]() взаємодія з лугами
взаємодія з лугами
СО2 + Са(ОН)2 → СаСО3 + Н2О не реагують
взаємодія між собою
![]()

![]()
![]()
 Р2О5 + 3Na2O → 2Na3PO4 MgO + CO2 → MgCO3
Р2О5 + 3Na2O → 2Na3PO4 MgO + CO2 → MgCO3
1. Чому SiO2 не реагує з водою?
![]() 2. Які оксиди називають амфотерними? Напишіть взаємодію
2. Які оксиди називають амфотерними? Напишіть взаємодію
амфотерних оксидів з кислотами і лугами.
![]()
![]() 3. Закінчіть рівняння реакцій. Розставте коефіцієнти:
3. Закінчіть рівняння реакцій. Розставте коефіцієнти:
![]() а) SrO + H2O = б) P2O5 + H2O =
а) SrO + H2O = б) P2O5 + H2O =
![]() в) SO3 + KOH = г) BaO + H2SO4 =
в) SO3 + KOH = г) BaO + H2SO4 =
д) FeO + SiO2 =
![]() 4. Напишіть формули оксидів, яким відповідають такі гідроксиди:
4. Напишіть формули оксидів, яким відповідають такі гідроксиди:
![]() а) Cr(OH)3 - ; б) NaOH- ; в) Zn(OH)2- ; г) Al(OH)3 - ; д) КОН - ;
а) Cr(OH)3 - ; б) NaOH- ; в) Zn(OH)2- ; г) Al(OH)3 - ; д) КОН - ;
Фізичні властивості води
![]()
рідина
![]()
![]()
![]()
безбарвна без смаку і запаху
В

![]() О
О
 повільно нагрівається при 0 0С - замерзає
повільно нагрівається при 0 0С - замерзає
і повільно охолоджується утворюється лід
( велика теплоємність ) Д

 при 100 0С - кипить А лід має меншу густину
при 100 0С - кипить А лід має меншу густину
утворюється пара від води - плаває

Мr (Н2О) = 18
1. Як можна добути дистильовану воду і де її застосовують?
2. Чи можна дощову воду назвати дистильованою? Відповідь поясніть.
3. З якою метою застосовується вода у сільському господарстві і
промисловості?
4. Яким чином не допустити забруднення води? Запропонуйте свій план
очищення води від забруднення.
![]()
![]()
![]()
![]()
![]()
![]()
Вода – найважливіший природний оксид.
Хімічні властивості.
1. реагує з активними металами
![]()
![]() 2Na + 2HOH → 2NaOH + H2↑
2Na + 2HOH → 2NaOH + H2↑
утворюються розчинні у воді гідроксиди (луги) і водень
2. реагує з менш активними металами при нагріванні
![]() Mg + H2O → MgO + H2↑
Mg + H2O → MgO + H2↑
утворюються оксиди металів і водень
3. реагує з деякими неметалами
![]() С + Н2О → СО + Н2↑
С + Н2О → СО + Н2↑
продукти реакції різні
4. реагує з оксидами активних металів
Li2O + H2O → 2LiOH
утворюються розчинні у воді гідроксиди (луги)
![]() 5. майже з усіма оксидами неметалів
5. майже з усіма оксидами неметалів
![]() СО2 + Н2О ↔ Н2СО3
СО2 + Н2О ↔ Н2СО3
утворюються кислоти
![]() 6. розкладається при дії електричного струму, або високій температурі
6. розкладається при дії електричного струму, або високій температурі
![]() 2Н2О → 2Н2↑ + О2↑
2Н2О → 2Н2↑ + О2↑
уворюються водень і кисень
Вода, найбільш дивовижна речовина в природі: всі тіла при охолодженні стискуються, а вода – розширюється; на її поверхні можуть плавати тіла, важчі за воду; вона ніколи не буває у природі абсолютно чистою; вода навіть може долати гравітацію!
Як можна пояснити ці дивовижні властивості води?
Хімічні властивості кислот
![]()
![]()
![]()
сіль + Н2↑ сіль + вода сіль + вода
(крім нітратної кислоти)
![]()
![]()
![]()
![]()
![]()
![]()
активний метал основний оксид луги і основи
![]()

1. HCl + AgNO3 → 2. H2SO4 + BaCl2 →

Кислоти
3. H3PO4 + AgNO3 → 4. Cu + HNO3 →
![]() конц.
конц.
![]()
змінюють забарвлення індикаторів
![]()
![]()
![]()
![]()
![]()
лакмус фенолфталеїн метилоранж
![]()
![]()
![]()
![]()
![]()
![]()
![]()
рожевий безбарвний червоний
1. Встановіть відповідність між рівняннями якісних реакцій 1, 2, 3, 4, що вказана у схемі та особливістю реакцій:
а) в результаті реакції виділяється бурий газ нітроген (IV) оксиду, б) утворюється
жовтий осад; в) випадає білий сирнистий осад, нерозчинний у воді та кислотах;
г) випадає білий нерозчинний у воді і кислотах осад.
Напишіть відповідні рівняння реакцій та розставте коефіцієнти.
Що ви маєте на увазі коли кажете, що кислоти змінюють забарвлення лакмусу у рожевий колір? Чи можна припустити, що всі кислоти будуть змінювати забарвлення лакмусу однаково? Чи є фактом те, що якщо НCl змінює забарвлення лакмусу на рожевий, чи це означає що вона є кислотою? Наскільки ти в цьому впевнений? Що є твоїм висновком?
Хімічні властивості основ
Луги Нерозчинні основи
![]()
![]()
![]()
![]()
![]()
![]() змінює забарвлення індикаторів не змінює
змінює забарвлення індикаторів не змінює

лакмус → синій
фенолфталеїн → малиновий
метилоранж → жовтий
![]()
![]()
![]() сіль + вода кислотні оксиди не реагує
сіль + вода кислотні оксиди не реагує
![]()
![]() сіль + вода кислоти сіль + вода
сіль + вода кислоти сіль + вода
![]()
![]()
реакція нейтралізації
![]()
![]()
![]()
![]() не розкладаються при нагріванні оксид + вода
не розкладаються при нагріванні оксид + вода
![]()
![]() розкладаються
розкладаються
![]()
![]()
![]() 1. Напишіть рівняння реакцій. Підкресліть реакцію нейтралізації:
1. Напишіть рівняння реакцій. Підкресліть реакцію нейтралізації:
![]()
![]()
![]() а) Al2O3 + HNO3 = ; б) Ba(OH)2 + H3PO4 = ;
а) Al2O3 + HNO3 = ; б) Ba(OH)2 + H3PO4 = ;
![]() в) Mg(OH)2 + HCl = ; г) Zn + H2SO4 = ;
в) Mg(OH)2 + HCl = ; г) Zn + H2SO4 = ;
д) LiOH + H2S = ; е) NaOH + HBr = ;
2. Що таке амфотерність? Наведіть приклади амфотерних гідроксидів
3. За чим визначають валентність металу у складі основ?
4. Що буде, якщо атом Na у складі основ замінити на атом Zn?
Хімічні властивості солей
![]()
![]()
З чим реагує Умови, за яких реакція відбувається
![]()
1. металами якщо метал більш активніший, ніж
Zn + CuSO4 → той, що є в складі солі.
2. сильними кислотами якщо:
А) BaCl2 + H2SO4 → - випадає осад.
Б) K2CO3 + HCl → - кислота, що утворюється, нестійка
В) Na2SiO3 + HNO3 → - кислота, що утворилася, слабша,ніж
та, що вступила в реакцію.
3. лугами якщо одна з утворених речовин
FeSO4 + KOH → випадає в осад.
![]()
4. між собою (у водних розчинах) якщо одна з солей, що утворилася,
СuCl2 + K2S → випадає в осад.
5. з нелеткими кислотними при сильному нагріванні.
оксидами
Na2CO3 + SiO2 →
![]()
![]()
6. деякі розкладаються при нагріванні
t
СаСО3 →
![]()
1. Допишіть рівняння реакцій зображені в схемі. Назвіть солі, що
утворилися?
2. Складіть формули солей за назвою: калій сульфіт, плюмбум (ІІ) нітрат,
хром (ІІІ) сульфат, барій силікат, цинк ортофосфат, станум (ІІ) бромід.
![]()
![]()
Хімічні властивості вуглецю

![]()
![]() ВУГЛЕЦЬ
ВУГЛЕЦЬ
![]()
![]()
відновні окиснювальні
![]()
![]()
повне згоряння
![]() С + О2 → СО2↑
С + О2 → СО2↑
виділяється вуглекислий газ
взаємодія з воднем
С + Н2↑↔ СН4↑
за t = 500 0 С і каталізатора
неповне згоряння
![]() виділяється чадний газ 2С + О2 → 2СО↑
виділяється чадний газ 2С + О2 → 2СО↑
С + Са → СаС2
![]() взаємодія з металами
взаємодія з металами
![]()
![]() 3С + 4Аl → Al4C3 утворюються карбіди
3С + 4Аl → Al4C3 утворюються карбіди
![]()
а) С + CuO →
з основними оксидами б) C + SnO2 →
в) C + WO3 →
відновлює метали з їх оксидів г) C + V2O5 →
![]()
1. За звичайних умов алмаз, графіт та вуглець хімічно інертні, але при високих
температурах ці речовини стають активними. Вкажіть ступені окиснення Карбону у
![]() рівняннях поданих схемою?
рівняннях поданих схемою?
2. Вуглець з воднем утворює сполуки – вуглеводні. Ці сполуки відносяться до органічних
речовин.
3. Порівняйте будову та властивості алмазу і графіту. Яку ще алотропну модифікацію
Карбону ви знаєте?
4. Поясніть, чому вуглець проявляє окисні і відновні властивості?
5. Елемент знаходиться в IV групі періодичної системи. Маса 1 л його вищого оксиду
за нормальних умов становить 1,964 г . Назвіть елемент, запишіть електронну
формулу його атома.
Хімічні властивості Силіцію.
![]()
О2↑ ( при t = 400 0 С і більше
Mg

Н2↑
 (безпосередньо з воднем не реагує)
(безпосередньо з воднем не реагує)
![]()
![]() S Si
S Si
![]()
![]()
![]()
галогени
основні оксиди


![]()
![]()
![]() Si + FeO →
Si + FeO →
1. Напишіть рівняння реакції взаємодії силіцію з речовинами, що запропоновані схемою.
2. Дайте характеристику силіцію згідно його положення у періодичній системі.
3. Охарактеризуйте фізичні властивості силіцію.
4. У лабораторії силіцій добувають при взаємодії чистого піску з порошком магнію.
Напишіть рівняння реакції. Обчисліть вихід силіцію за відношенням до теоретичного,
якщо прореагував силіцій (IV) оксид масою 12 кг і утворився чистий силіцій масою
5 кг.
5. Зовнішній енергетичний рівень атома елемента має будову: ns2np2. Молекулярна маса
леткої водневої сполуки однакова з молекулярною масою кисню. Назвіть елемент.
6. Вищий оксид хімічного елемента IV групи має відносну молекулярну масу 60.
Назвіть хімічний елемент, складіть формулу оксиду та кислоти.
Хімічні і фізичні властивості карбон (ІІ), карбон (IV)
та силіцій (IV) оксидів.
![]() 1. взаємодія з водою : СО2 + Н2О ↔ Н2СО3
1. взаємодія з водою : СО2 + Н2О ↔ Н2СО3
1. горіння в кисні
2СО + О2 = 2СО2 2. з металами: СО2 + 2Mg = MgO + C
3. з основами: CO2 + 2NaOH = Na2CO3 + H2O
2. відновлення металів з
їх оксидів 4. з основними оксидами: СО2 + ВаО = ВаСО3
 СО + FeO = Fe + CO2
СО + FeO = Fe + CO2
сильна отрута ! безбарвний газ, без запаху
безбарвний газ, Mr(CO2) = 44, важчий за повітря
без запаху СО СО2 у 1,5 рази,

 Mr(СО) = 28 розчинний у воді, при звичайній
Mr(СО) = 28 розчинний у воді, при звичайній
легший за температурі і порівняно
повітря високому тиску – зріджується,
малорозчинний SiО2 утворюється «сухий лід»
у воді
1. з лугами при нагріванні: тверда кристалічна речовина,
SiO2 + 2KOH = K2SiO3 + H2O нерозчинна у воді,
тугоплавка tпл. = 17280 С,
2. з основними оксидами при нагріванні: в природі знаходиться у вигляді
SiO2 + MgO = MgSiO3 піску, кварцу, гірського кришталю.
3. з солями, до складу яких входять більш леткі
кислотні оксиди, при нагріванні:
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
1. Складіть рівняння реакцій, відновлення металів з їх оксидів карбон (ІІ) оксидом:
а) ферум (ІІІ) оксид, б) станум (IV) оксид, в) ванадій (V) оксид. Покажіть перехід
електронів і підкресліть однією рискою окисник, а двома – відновник.
2. Складіть рівняння реакцій, утворення карбон (IV) оксиду в природі, лабораторії та
промисловості.
3. Обчисліть масову частку Силіцію в силіцій (IV) оксиді і Карбону в карбон (ІІ) оксиді.
4. Як пояснити отруйність карбон (ІІ) оксиду?
Хімічні властивості карбонатної кислоти.


1. реагує з активними металами: 2. реагує з основними оксидами:
Н2СО3 + Mg → Н2СО3 + СаО →


 3. реагує з лугами:
3. реагує з лугами:
Н2СО3 + NaOH →
при надлишку кислоти
утворюється кисла сіль:
Н2СО3 + KOH →
![]()
![]()
![]() Н2СО3
Н2СО3


4. нестійка кислота 5. дуже слабка кислота, оскільки
Н2СО3 ↔ Н2О + СО2↑ молекули кислоти незначно
дисоціюють на йони:
Н2СО3 ↔ Н+ + НСО3-
НСО3- ↔ Н+ + СО32-
Карбонатна кислота у вільному вигляді не існує, оскільки розкладається (4). Лакмусовий папірець у водному розчині карбонатної кислоти набуває не червоного,
як усі кислоти, а рожевого кольору.
1. При пропусканні карбон (IV) оксиду крізь розчин кальцій гідроксиду спочатку утворюється осад, який потім поступово розчиняється. Напишіть рівняння відповідних
реакцій.
2. За допомогою яких спостережень вами, можна довести, що хліб, молоко, м'ясо містять
вуглець.
3. Допишіть рівняння реакцій. Поставте коефіцієнти:
А) СаСО3 + СО2 + Н2О → ;
Б) K2SiO3 + Al2(SO4)3 → ;
В) NaHCO3 + HCl → ;
Г) Na2SiO3 + HNO3 → ;
Д) Ba(HCO3)2 + HCl → .
4. На магній хлорид масою 18 г подіяли розчином, що містив соду масою 6 г. Яка маса і
кількість речовини утвореного осаду?
Лужні метали. Властивості.
Лужні метали – сильні відновники. Вони енергійно реагують з усіма
 3 неметалами, включаючи водень.
3 неметалами, включаючи водень.
Li 6,941
2S1 1. з галогенами:
 Літій + Cl2 → 2МеCl
Літій + Cl2 → 2МеCl
2/1
![]() 11 2. з іншими неметалами:
11 2. з іншими неметалами:
Na 22,990 + S → Me2S
 3S1 + N2 → Me3N
3S1 + N2 → Me3N
Натрій 3. з воднем:
![]() 2/8/1 + Н2 → 2МеН
2/8/1 + Н2 → 2МеН
![]()
19
![]() К 39,098 2Ме0 з складними речовинами
К 39,098 2Ме0 з складними речовинами
4S1
Калій 4. з водою:
2/8/8/1 + 2НОН → 2МеОН +Н2↑
![]()
37 З кислотами лужні метали не реагують, оскільки реагують
Rb 85,468 активніше з водою, що міститься в кислотах.
5S1
Рубідій
2/8/18/8/1 З киснем при горінні тільки літій утворює оксид складу Ме2О:
4Li + O2 → 2Li2O
![]()
55 Інші лужні метали утворюють пероксиди складу Ме2О2:
Cs 132,91 2Na + O2 → Na2O2
6S1
Цезій Пероксиди є солями пероксиду водню Н2О2, ступінь окиснення
2/8/18/18/8/1 Оксигену у пероксидах – 1.
- Лужні метали легші за воду, м’які, легкоплавкі. Їхня твердість і температура плавлення зменшується від літію до цезію.
- Мають 1 валентний електрон s-типу.
- Ступінь окиснення у сполуках: +1.
- Хімічна активність дуже висока і збільшується від Na до Cs.
- Вища валентність в оксидах, солях, гідроксидах рівна – І.
- Лужні метали належать до І групи головної підгрупи.
Літій належить до лужних металів, але його властивості більш подібні на
властивості Mg. Така «діагональна аналогія» притаманна іншим елементам
ІІ періоду Ве→Al, B→ Si.
- Які способи добування металів ви знаєте? Наведіть приклади.
- Який з гідроксидів лужних металів – найслабший, а який найсильніший? Чому?
Лужноземельні метали. Властивості.
Із зростанням протонного числа зверху вниз зростає радіус
атома. Тому хімічна активність металів зростає від Mg до Ba.

 12 Ме
12 Ме

![]()

 Mg 24,305
Mg 24,305
3S2
Магній
2/8/2
![]()
20
Са 40,08
4S2
Кальцій + Cl2 + S + H2 + O2 + HCl +HOH
![]()
![]()
![]() 2/8/8/2 з галогенами з кислотами
2/8/8/2 з галогенами з кислотами
![]()
![]()
![]()
![]()
38
Sr 87,62
5S2
Стронцій МеCl2 МеS МеH2 МеО МеCl2 Ме(OH)2
2/8/18/8/2 + +
![]() 56 H2 H2
56 H2 H2
Ba 137,34
6S2
Барій З усіх металів ІІ групи головної підгрупи хімічна активність
2/8/18/18/8/2 магнію є найнижчою. Тому з водою магній реагує при
нагріванні, з утворенням магній оксиду, а не гідроксиду.
Mg + H2O → MgO + H2↑
- На зовнішньому енергетичному рівні – два s-електрони.
- Вища валентність в оксидах, гідроксидах, солях – ІІ.
- Ступінь окиснення у сполуках: +2.
- Подібно до лужних металів (крім магнію) є сильними відновниками.
- Мають невисокі густини і твердість.
- В природі знаходяться у вигляді сполук.
- Дайте характеристику Магнію та Кальцію згідно положення у періодичній системі та будовою атома.
- Напишіть рівняння реакцій взаємодії стронцію з речовинами поданими схемою. Поставте коефіцієнти.
- Як з карбонату кальцію можна добути металічний кальцій? Напишіть відповідні рівняння.
- У періодичній системі Кальцій знаходиться біля Калію, але його хімічні властивості подібні до властивостей Натрію, який міститься у ІІ періоді, чому?
- Метал із ступенем окиснення +2 масою 8 г прореагував з водою. В результаті реакції виділився газ об’ємом 4,48 л (н.у.).Який це метал?
Алюміній. Фізичні і хімічні властивості.
![]()
 порядковий номер
порядковий номер
13
![]()
![]() символ Al 26,982 атомна маса
символ Al 26,982 атомна маса
![]() назва елемента Алюміній
назва елемента Алюміній
![]() 3S23P1 електронна конфігурація
3S23P1 електронна конфігурація
![]() розподіл електронів 2/8/3
розподіл електронів 2/8/3
У електрохімічному ряду напруг алюміній стоїть за найактивнішими металами. Але на поверхні алюмінію утворюється оксидна плівка, тому за звичайних умов на алюміній не діє ні кисень, ні вода. Якщо поверхню алюмінію протерти сіллю ртуті, то відбудеться реакція: 2Al + 3HgCl2 2AlCl3 + 3Hg.
Виділена ртуть розчиняє алюміній – амальгама алюмінію. На амальгамованій поверхні оксидна плівка не тримається, тому алюміній реагує з водою за звичайних умов.
2Al + 6H2O 2Al(OH)3 + 3H2
При підвищеній температурі алюміній реагує з багатьма неметалами і складними речовинами:
+ 3O2 (киснем)
![]()
![]()
+ 3Cl2 (галогенами)
![]()
+ 3S (сіркою)
![]()
![]() Al + 3H2SO4 (кислотами)
Al + 3H2SO4 (кислотами)
![]()
+ 3CuSO4 (солями)
![]()
+ 2NaOH + 2H2O
![]()
- На зовнішньому енергетичному рівні – три електрони
- Ступінь окиснення: +3. У сполуках проявляє валентність – ІІІ.
- Є амфотерним металом – сполуки оксид і гідроксид мають амфотерні властивості.
- Взаємодіє з лугами 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2
- Легкий, дуже пластичний метал.
- За електричною провідністю поступається лише сріблу і міді.
ЗАВДАННЯ: Допишіть рівняння реакцій, що лежать в основі схеми.
Фізичні та хімічні властивості заліза.
 Чисте залізо на повітрі стійке. На практиці
Чисте залізо на повітрі стійке. На практиці
26 використовують залізо з домішками. Ковкий
та твердий метал, важкий(густина 7,87 г/см3).
55, 847 Fe Залізо з деякими речовинами реагує при
3d64s2 Ферум звичайній температурі, але з багатьма речовинами
при нагріванні.
![]()
![]() Fe
Fe
![]()
![]()
при звичайній температурі при нагріванні

1. з киснем у вологому повітрі: 1. з киснем:
![]() Fe + O2 Fe2O3 • nH2O 2Fe +2O2 →Fe2O3 • FeO
Fe + O2 Fe2O3 • nH2O 2Fe +2O2 →Fe2O3 • FeO
2. з розвединими кислотами: 2. з хлором:
Fe +2HCl FeCl2 +H2 2Fe +3Cl2FeCl3
3. з солями у водному розчині: 3. з сіркою:
Fe + CuSO4 FeSO4 + Cu Fe + S FeS
4. з водяною парою:
3Fe + 4H2O Fe2O3 • FeO + 4H2
5. з концентрованими кислотами
H2SO4 і HNO3:
Fe + H2SO4 Fe2(SO4)3 + SO2 + H2O
Fe + HNO3 Fe(NO3)3 + NO + H2O
- 8 валентних електронів, але не всі з них беруть участь в утворенні хімічних зв’язків.
- На зовнішньому енергетичному рівні – 2 електрони, атоми Феруму, віддаючи їх, утворюють сполуки, де ступінь окиснення: +2. ( FeCl2)
- Третій енергетичний рівень незавершений, один з його електронів в результаті реакцій може займати вищий енергетичний рівень. Тоді ступінь окиснення: +3. (Fe2O3 або FeCl3), може мати ступінь окиснення: +6 (K2FeO4).
- У сполуках проявляє валентність – ІІ і ІІІ.
-
Має магнітні властивості, здатне швидко намагнічуватися і розмагнічуватися.
- Дайте характеристику Феруму за місцем у періодичній системі і будовою атома.
- Складіть рівняння реакцій, в результаті яких можна добути металічне залізо з його оксидів, використовуючи: а) водень, б) алюміній,
в) карбон (ІІ) оксид.
3. Складіть рівняння реакцій, за допомогою яких можна добути ферум (ІІ) і
ферум (ІІІ) гідроксиди. В якому з гідроксидів масова частка залізі більша?
4. У завданні 5 розставте коефіцієнти методом електронного балансу, вкажіть
окисник та відновник?
Способи добування металів
-
Найактивніші метали (Na, K, Rb, Mg, Ca, Sr, Ba) добувають електролізом. Інші метали відновлюють з їх оксидів вугіллям, карбон (ІІ) оксидом, алюмінієм, воднем, а сульфіди металів спочатку випалюють.
- Відновлення металів з їхніх оксидів вугіллям:
![]() SnO2 + C
SnO2 + C
FeO + C
2. Відновлення карбон (ІІ) оксидом:
Fe2O3 + CO ; V2O5 + CO ;
3. Відновлення за допомогою більш активних металів (алюмінотермія):
MnO2 + Al ; Cr2O3 + Al ;
4. Відновлення металів з їхніх оксидів воднем:
![]()
![]()
![]() PbO
PbO
Fe3O4 WO3
![]() + +
+ +
![]()
![]()
![]()
![]() +
+
![]()
![]() ZnO + H2 + Cr2O3
ZnO + H2 + Cr2O3
![]()
![]() + +
+ +

![]()
CoO Mn2O7
![]()
5. Випалювання сульфідів з наступним відновленням:
2ZnS + 3O2 2ZnO + 2SO2
ZnO + C Zn + CO
6. Електроліз (розчинів і розплавів):
NiSO4 → Ni2+ + SO42–
HOH → H+ + OH–
А+: OH– - ē OH0
4OH0 2H2O + O2
К-: Ni + 2ē Ni0
- Закінчіть рівняння реакцій запропоновані у п.1,2,3,4.
- Чому алюміній не можна відновити з його оксиду ні вугіллям, ні карбон (ІІ) оксидом, а ні воднем?
- Який об’єм карбон (ІІ) оксиду (н.у.) потрібний, щоб відновити залізо, яке містить Fe2O3 масою 960 кг?
- З цинкової обманки (ZnS) масою 97,35 г з масовою часткою домішок 4%, добули цинк оксид. Потім відновили воднем. Обчисліть масу цинку, що утворилася?
Забруднення навколишнього середовища
![]()
 Розлита в результаті аварій сира нафта.
Розлита в результаті аварій сира нафта.


З СО (чадний газ) – утворюється при неповному згорянні
 А різних видів палива в повітрі. При концентрації в повітрі
А різних видів палива в повітрі. При концентрації в повітрі
Б 10% СО на протязі 2 хвилин може призвести до смерті.
Р
 У
У
Д Вуглеводні, що не повністю згоріли – утворюються при
![]()
 Н неповному згорянні палива. При яскравому сонячному
Н неповному згорянні палива. При яскравому сонячному
Е світлі ці вуглеводи можуть утворювати фотохімічні смоги.
Н
Н
 Я Сполуки свинцю. Вони попадають в атмосферу внаслідок
Я Сполуки свинцю. Вони попадають в атмосферу внаслідок
використання тетраетил свинцю в якості антидетонаційної
добавки до бензину.

Оксиди Нітрогену і Сульфуру. Азот і сірка вступають в
реакцію з киснем повітря і утворюють кислотні оксиди.
Останні є причиною випадання кислотних дощів.
Схема одержання цукру із цукрового буряка


![]()
![]()
Цукровий Стружка Розчин сахарози
буряк цукрового буряка з домішками
![]()

СО2↑ Са(ОН)2
![]()
![]()
![]() СаСО3↓ Розчин вапно
СаСО3↓ Розчин вапно
кальцій сахарату



![]() Сахароза Розчин Нерозчинні
Сахароза Розчин Нерозчинні
Сахарози солі кальцію
Застосування вуглеводів

Глюкоза:
У кондитерській промисловості;
У медицині;
У текстильній промисловості;
Для одержання етанолу.


Сахароза: Крохмаль:
У кондитерській промисловості; Як продукт харчування;
Як продукт харчування; Для приготування клею;
Для одержання штучного меду. У виробництві етилового спирту;
Для одержання патоки;
На крохмалення білизни.

Целюлоза:
Для виготовлення паперу
та штучного волокна;
для одержання етилового спирту
та оцтової кислоти;
у виробництві бездимного пороху.
![]() Волокна
Волокна
![]()
![]()
![]()
![]()
Природні Хімічні
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Рослинного Тваринного Штучні Синтетичні
![]()
![]() походження походження
походження походження

![]()
![]()

віскозне, нітрон, лавсан,
![]()
![]() Бавовняне, Шерстяне, ацетатне, капрон, анід,
Бавовняне, Шерстяне, ацетатне, капрон, анід,
лляне. шовкове мідноаміачне. енант.
Загальний огляд найважливіших полімерів
|
Назва |
Формула полімеру |
Зовнішні ознаки |
Реакції на продукти розкладу |
Застосування |
|
Поліетилен |
(- СН2 –СН2 -)n |
Схожий на парафін, відносно м’який і еластичний матеріал. Тонкі плівки прозорі, колір різний. |
Не знебарвлює розчини бромної води (Br2) та KMnO4 |
Для виробництва деталей різноманітних апаратів, водопровідних труб, різноманітних плівок (для парників), предметів домашнього вжитку. |
|
Поліпропілен |
( - СН2 – СН -)n | СН3 |
Твердий, жирний на дотик, білого кольору термопластичний матеріал |
Не знебарвлює розчини бромної води (Br2) та KMnO4 |
Міцніший за поліетилен. Деталі машин, плівок, канатів, труб, високо ізоляційних матеріалів, хімічну апаратуру. |
|
Полівінілхлорид |
( - СН2 – СН -)n | Cl |
Відносно м’який матеріал. При зниженні температури стає твердим і крихким, колір різний. |
Хлороводень. Що виділяється, забарвлює лакмусовий папірець у червоний колір, з розчином AgNO3 утворює осад білого кольору. |
Виробництво штучної шкіри, плащів, клейонки, труб, ізоляційного матеріалу для електричних проводів. Добувають пластмаси двох типів – вініпласт і пластикат. |
|
Полістирол |
( - СН2 – СН - )n | С6Н5 |
Твердий, крихкий, майже прозорий або непрозорий матеріал. Може бути різного кольору. |
Знебарвлює розчини бромної води (Br2) та KMnO4. |
Виготовлення електроізоляційних матеріалів, кислотостійких труб, різних побутових виробів, пінопластів. |
|
Полі метилметакрилат (оргскло) |
СН3 | ( -СН2 – С -)n | СООСН3 |
Тверда. Безбарвна, прозора і світлостійка речовина, що не розбивається при ударі. |
Знебарвлює розчини бромної води (Br2) та KMnO4. |
Скло для літаків, суден, автомобілів, виробництво світлотехнічних виробів, лінз, збільшувального скла, матеріал для лазерної техніки. |
|
Феноло-формальдегідна смола (фенопласти) |
( - С6Н5 – СН2 -)n |
Тверді, крихкі матеріали темного кольору з блискучою поверхнею |
--------- |
Текстоліт – шарикопідшипники і шестерні для машин, волокніт – гальмові накладки для автомашин, східці для ескалаторів, склопласт – деталі великих розмірів: автоцистерни, кузови автомобілів, карболіт – телефонні апарати, електричні контактні плати, гетинакс – гарячий електроізоляційний матеріал в радіо- і електротехніці. |
Найважливіші види синтетичних каучуків
|
Назва |
Формула полімеру |
Властивості та застосування |
|
Бутадієновий каучук |
|
Характерна водо- і газо- непроникність. Еластичність менша, ніж у природного каучуку. Для підвищення міцності і еластичності його вулканізують. Для виробництва кабелів, взуття, предметів домашнього вжитку. |
|
*Дивініловий каучук |
|
За зносостійкістю і еластичністю перевершує природний каучук. Особливо цінний для виготовлення протекторів шин (зовнішньої частини), які зношуються особливо швидко. |
|
Ізопреновий каучук |
|
За зносостійкістю і еластичністю перевершує природний каучук. Особливо цінний для виготовлення протекторів шин (зовнішньої частини), які зношуються особливо швидко. |
|
Хлоропреновий каучук |
( - СН2 – С = СН – СН2 - )n | Cl |
Стійкий проти дії високих температур, бензинів і масел. У виробництві кабелів, трубопроводів для перекачки бензину, нафти. |
|
Бутадієн-стирольний каучук |
( -СН2-СН = СН–СН2–СН- СН2-)n | С6Н5 |
Характерна газонепроникність, але недостатня жаростійкість. У виробництві стрічок для транспортерів, автокамер. |
* Щоб відрізнити цей каучук (регулярна будова) від бутадієнового, що має нерегулярну будову, його назвали дивініловим.
ЛАВСАН – назва волокна утворена з перших літер назви лабораторії, де його розробили, - лабораторія високомолекулярних сполук Академії наук СРСР.
Схема виробництва скла
![]()
Пісок
![]()
![]()
![]()
Сода Крейда
![]()

![]()
![]()
![]()

Борна Промивання Подрібнення Каолін
![]()
![]()
 кислота
кислота
![]()
![]()

![]() Сушіння Перемелення
Сушіння Перемелення
![]()
![]() Просіюванн
Просіюванн
![]()
![]() Змішування і
Змішування і
добування шихти
![]()
![]() Варіння
Варіння
![]()
![]()
Формування
![]()
![]()
Відпалювання
![]()
![]() Готова
Готова
продукція
Фактори, що впливають на швидкість поширення нафтової плями.
 Фотоокиснення
Фотоокиснення
![]()
![]() Випаровування
Випаровування

![]()
Нафтова
 пляма Припливи
пляма Припливи

 Осідання у Розчинення
Осідання у Розчинення
![]() прибережних
прибережних
![]()
![]() водах Розподіл Вбирання
водах Розподіл Вбирання
![]()
 організмами
організмами
 Осадження
Осадження
![]()
Нагромадження
Біологічне
![]() окиснення
окиснення
СО2 + Н2О
Людина у навколишньому середовищі

Біологічний
Колообіг
![]()
![]() Людина
Людина
![]() Споживання
Споживання
 енергії
енергії

Видалення
відходів

Зовнішнє
Обмін дихання
речовин
Самоочищення
Виготовлення штучного волокна

Шовку, виготовленого
з 320 000 коконів,
шовкопряда

Бавовни,
 зібраної з 0,5 га
зібраної з 0,5 га
 1500 м шовкової
1500 м шовкової
тканини, або
160 кг шовку



Кількість штучного з 1 м3 деревини
волокна виготовленого можна виготовити:
з 1 м3 деревини = кількості



600 напівшовкових
костюмів, або 4000
пар шовкових панчіх

 вовни, настриженої з
вовни, настриженої з
25 – 30 овець за рік
200 кг целюлози
Схема виробництва штучної шерсті з молока


МОЛОКО ВИРОБИ З
ШЕРСТІ

![]()

КАЗЕЇН НИТКИ


РОЗЧИНЕННЯ ПРЯДІННЯ
 КАЗЕЇНУ
КАЗЕЇНУ

ФІЛЬТРАЦІЯ ЗНЕВОДНЕННЯ
РОЗЧИНУ
![]() Класифікація полімерів
Класифікація полімерів
![]()
![]()
![]()
![]()


за будовою за відношенням за способом
макромолекул до нагрівання добування (за реакцією)

![]()

![]()
![]()
![]()
![]()
полімеризації поліконденсації
![]()
![]()
лінійні розгалужені
![]()
![]()
термопластичні термореактивні
![]() сітчасті
сітчасті
Генетичний зв'язок між класами неорганічних сполук



![]()
![]()
 Неметал 1 Оксид 2 Кислота
Неметал 1 Оксид 2 Кислота
неметалу 3
 (кисл. окс.)
(кисл. окс.)


 Сіль
Сіль
![]()
![]()
![]() Метал 4 Оксид 5 Основа
Метал 4 Оксид 5 Основа
металу
(осн. окс.)
Завдання: Впишіть формули речовин і здійсніть перетворення:
- Mg → MgO → Mg(OH)2 → MgSO4
- Ca → CaO → Ca(OH)2 → CaCl2
- S → SO2 → H2SO3 → Na2SO3
- C → CO2 → CaCO3 → CO2
- CO2 → Na2CO3 → Na2SO4 → BaCl2
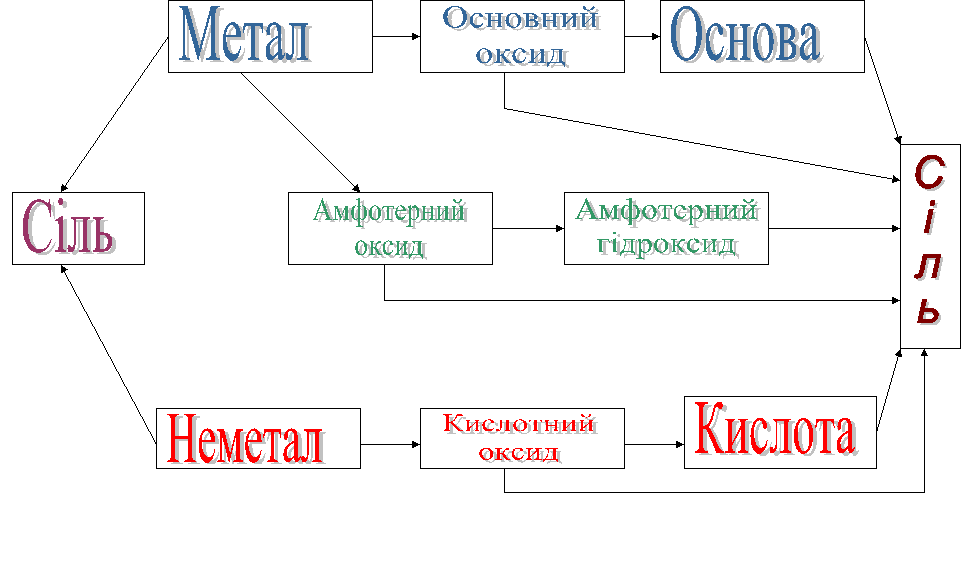
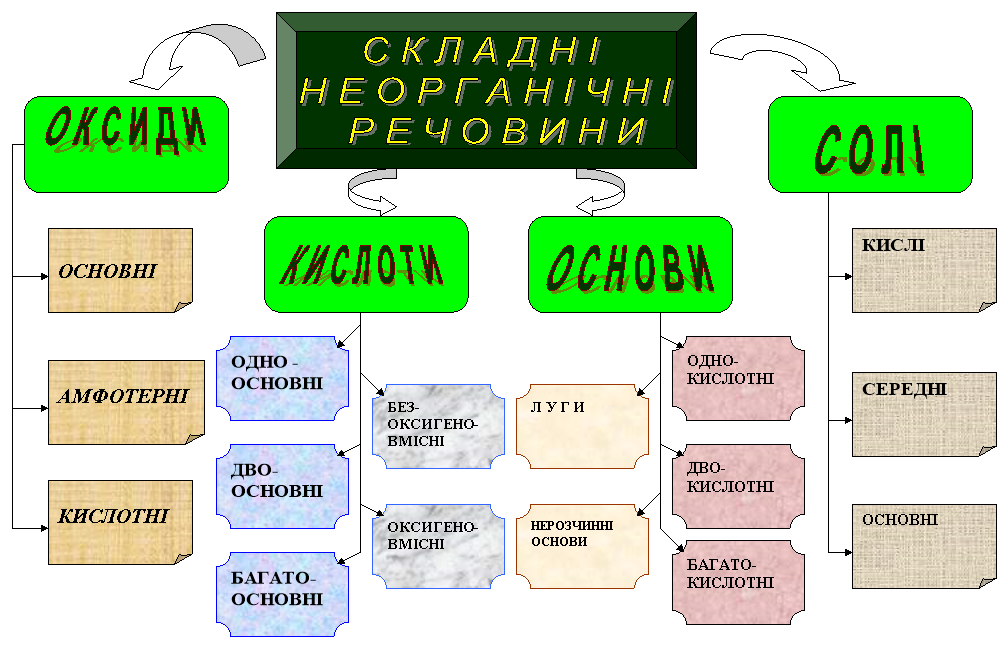
1


про публікацію авторської розробки
Додати розробку