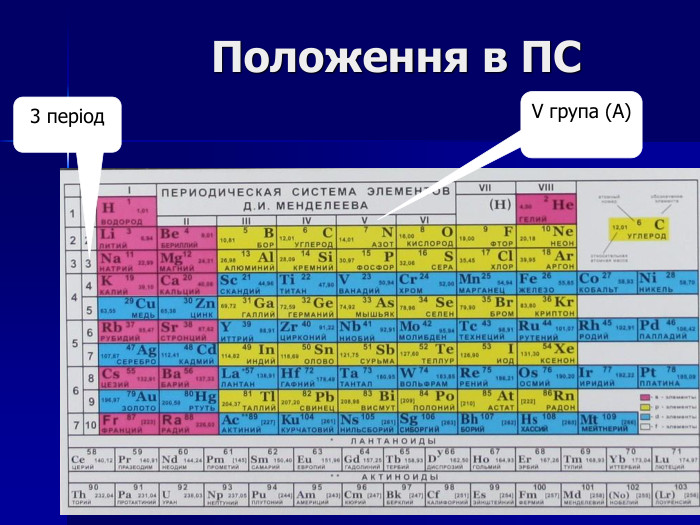
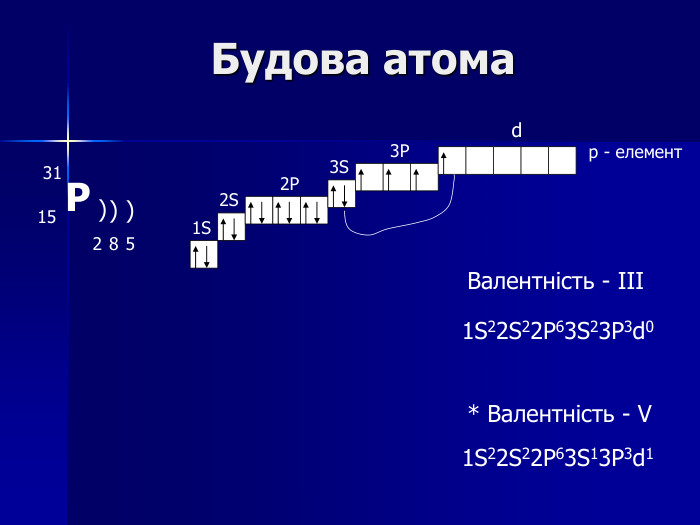
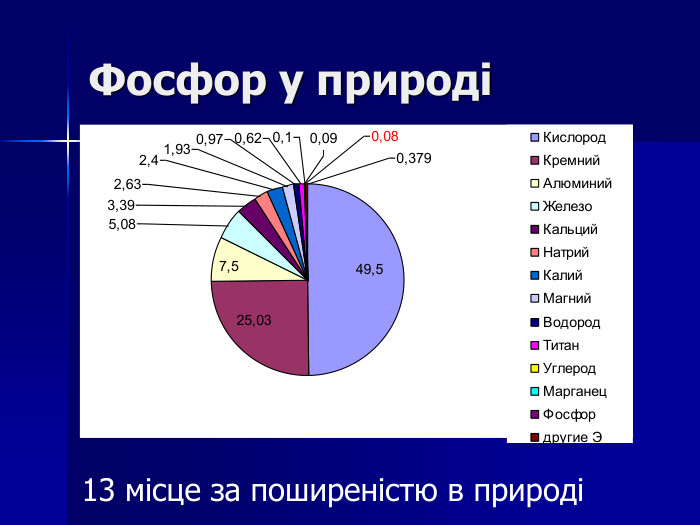
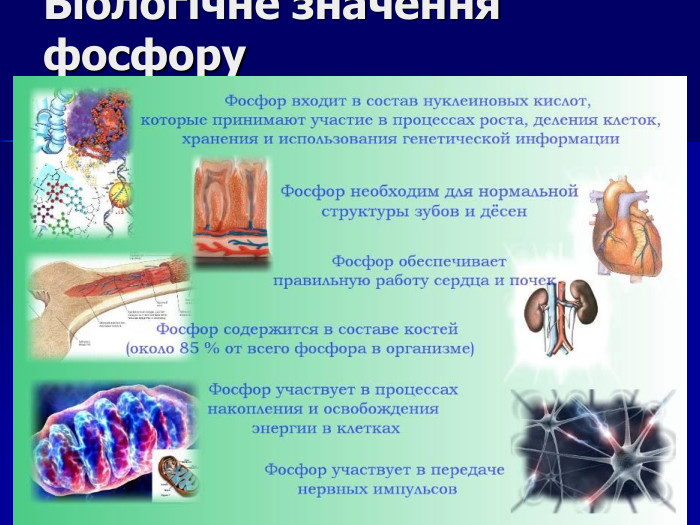
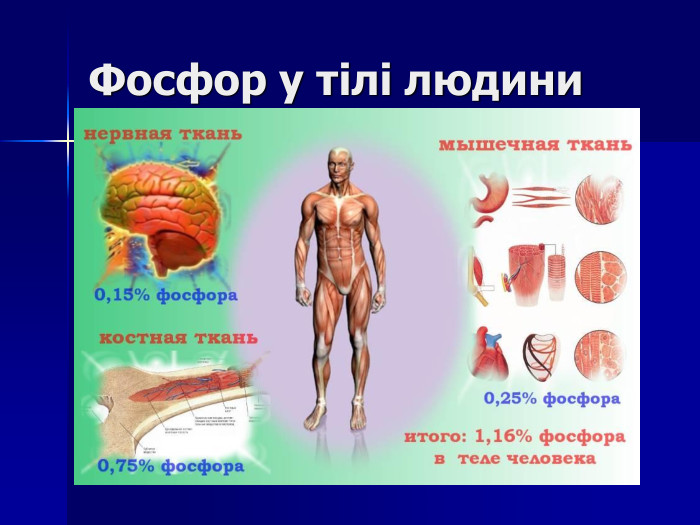
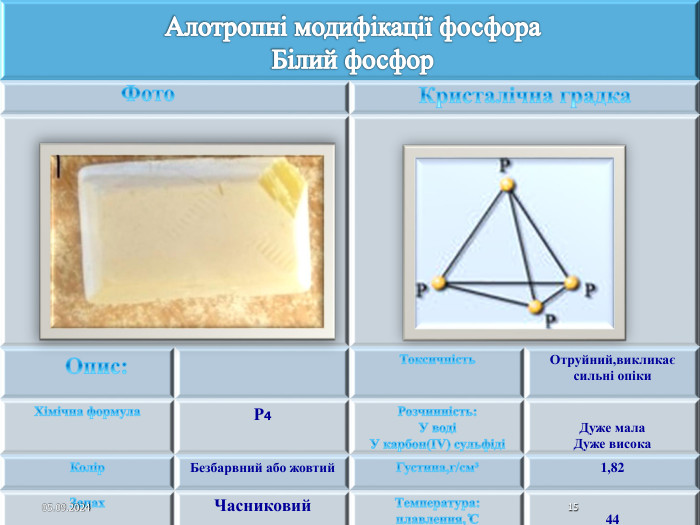
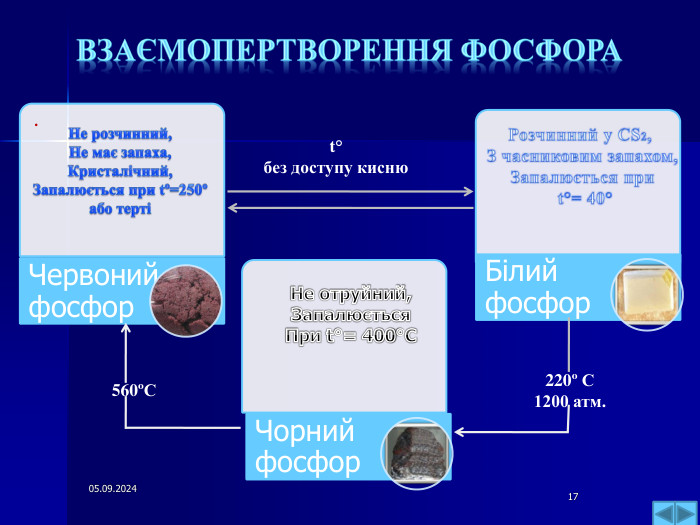
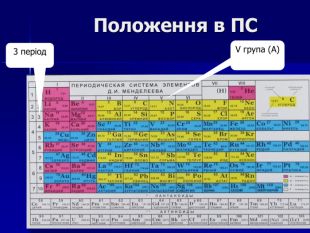
Презентація " Фосфор"
Про матеріал
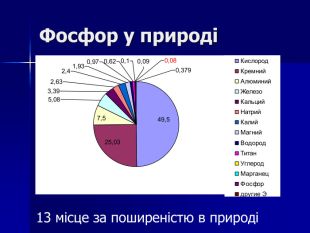
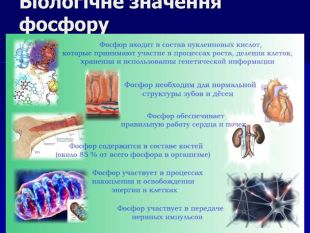
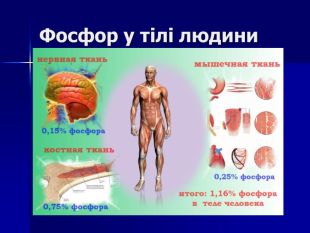
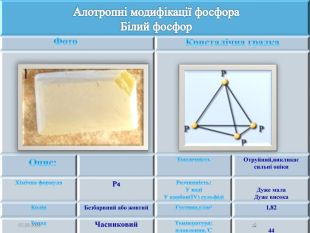
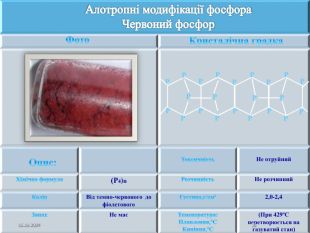
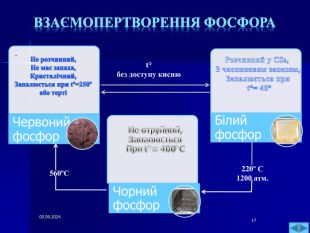
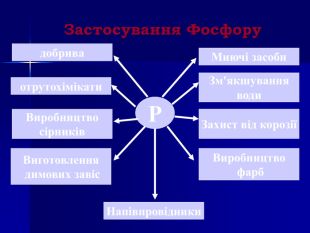
Презентація " Фосфор" за програмою з хімії 10 клас. Характеристика хімічного елемента та властивостей простої речовини та напрямків застосування. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку