Основи. Властивості основ.
Вивчення хімічних властивостей будь-якого класу речовин дає змогу зрозуміти їх природу, місце серед інших речовин, процеси взаємоперетворення. Хімічні властивості основ ви доведете експериментально. Пригадайте,що луги та кислоти-їдкі речовини, з ними слід працювати обережно, дотримуючись правил безпеки.
8 клас Урок 45-46
Тема. Основи. Властивості основ.
Мета:
- ознайомити учнів з фізичними властивостями основ; закріпити знання про класифікації основ на розчинні й нерозчинні; розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі основ; показати дію лугів на індикатори;
- розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей основ;
- виховувати цікавість до хімії.
Обладнання і реактиви: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, таблиця «Правила техніки безпеки в кабінеті хімії», ряд активності металів, хімічні реактиви.
Хід уроку
І-ий міні-модуль Адаптивно-Перетворювальний
I. Організаційний етап. Перевірка домашнього завдання.
II. Актуалізація опорних знань учнів.
• Який клас неорганічних сполук називається основами?
• На які дві групи поділяються основи? (Розчинні (луги) й нерозчинні (малорозчинні))
• 3 допомогою таблиці розчинності наведіть приклади розчинних і нерозчинних основ. (П’ятеро-шестеро учнів по ланцюжку виписують на дошці формули основ.)
• Назвіть записані основи за сучасною українською номенклатурою. (По ланцюжку наступні учні називають основи.)
• які хімічні властивості проявлятимуть основи.
1) Взаємодія з кислотами.
2) Взаємодія з кислотними оксидами.
3) Взаємодія із солями.
ІІІ. Мотивація
Вивчення хімічних властивостей будь-якого класу речовин дає змогу зрозуміти їх природу, місце серед інших речовин, процеси взаємоперетворення. Хімічні властивості основ ви доведете експериментально. Пригадайте,що луги та кислоти-їдкі речовини, з ними слід працювати обережно, дотримуючись правил безпеки.
Групова робота з карткою-завданням.
Дано речовини:
|
№ з/п |
Речовини |
|
1 |
Cu(OH)2,Na2O,P2O5,HNO3,Al2(SO4)3,KOH,HCl |
|
2 |
Fe(OH)2,CaO,SO3,H3PO4,MgCl2,NaOH,H2S |
|
3 |
Fe(OH)3,K2O,CO2,HCl,Zn3(PO4)2,Ba(OH)2,HNO3 |
1. Виберіть серед наведених речовин формули лугів і назвіть їх.
2. Виберіть серед наведених речовин формули нерозчинних основ і назвіть їх.
ІІ-ий міні-модуль
Адаптивно-Перетворювальний
III. Вивчення нового матеріалу.
1.Будова та фізичні властивості основ
Луги - тверді білі речовини, без запаху, добре розчинні у воді.
Нерозчинні гідроксиди – тверді за звичайних умов речовини, без запаху, не проводять електричний струм, не розчиняються у воді
2. Використання основ
Кальцій гідроксид – гашене вапно
Кальцій гідроксид з водою – вапняне молоко
Кальцій гідроксид з кальцій оксидом – негашене вапно
Натрій гідроксид – їдкий натр або каустична сода
Калій гідроксид – їдкий калі.
3. Дія розчинів лугів на індикатори
4 . Хімічні властивості основ
-Основа +кислота=сіль +вода ( реакція нейтралізації, обміну)
-луг + кислотний оксид=сіль + вода
-луг+розчинна сіль=нерозчинний гідроксид+сіль
-нерозчинний гідроксид= оксид +вода
5.Безпека під час роботи з лугами (робота з підручником с 176)
ІІІ-ій міні-модуль
Адаптивно-Перетворювальний
IV.Узагальнення і систематизація знань.
Здійснити перетворення:
CaO→ Ca(OH)2→ CaSO4→ H2SO4→ SO3
Знання властивостей класів неорганічних сполук дозволяє нам припустити, з допомогою яких реакцій можна одержати ту чи іншу речовину.
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+2H2O
SO3+H2O=H2SO4
H2SO4+Ca(OH)2=CaSO4+2H2O
Самостійна робота з карткою-завданням
Завдання 1. Напишіть рівняння взаємодії натрій гідроксиду з речовинами за схемою.
Завдання 2. Виберіть серед записаних реакцій реакції нейтралізації.
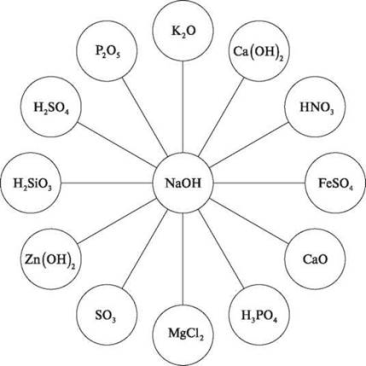
Завдання 3 Здійсніть перетворення:
Сu(ОН)2 → СuO → СuSO4→ Сu(OH)2.
1.Сu(ОН)2 = СuO +H2O
2.СuO+H2SO4 = СuSO4+H2O
3.СuSO4+2NaOH = Сu(OH)2 ↓+2H2O.
Учитель пропонує учням виконати самостійно завдання. Складіть рівняння реакцій хром (III) гідроксиду з хлоридною кислотою і натрій гідроксидом.
Учень, який першим виконав завдання, на дошці записує рівняння реакцій:
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 +3NaOH = Na3CrO3 +3H2O
Cr(OH)3 + NaOH = NaCrO2 + 2H2O
Учні разом з вчителем перевіряють і обговорюють вірність виконання вправи. Учень отримує оцінку.
На картках, що роздані учням, пропонується виконати завдання:
1) Знайти зайве: a) Al(OH)3; NaOH; Zn(OH)2 ; Cr(OH)3
б) Na2O; MgO; Al2O3; CaO
2) Підібрати аналог:
KOH; Ca(OH)2;Zn(OH)2; Ba(OH)2; NaOH; Mg(OH)2; Al(OH)3
3) Скласти ланцюжок перетворень з речовин:
Al; Al2O3; AlCl3; Al(OH)3
Три учня виходять до дошки і показують варіанти своєї роботи.
1) а)Зайвим є NaOH- луг, тому що всі інші речовини є амфотерними основами.
б) Зайвим є Al2O3- амфотерний оксид, тому що всі інші оксиди є основними.
2) KOH- Ca(OH)2, Zn(OH)2-Al(OH)3
Тому,що KOH та Ca(OH)2 – луги, а Zn(OH)2 та Al(OH)3- амфотерні основи
3) Ланцюжок повинен мати вигляд:
Al→ Al2O3→ AlCl3→ Al(OH)3
Учень пояснює чому він запропонував такий варіант виконання завдання.
V. Підсумок уроку.
Учитель ще раз нагадує учням про правила роботи з лугами, підсумовує результати роботи на уроці, виставляє оцінки.
VI. Домашнє завдання.
Опрацювати відповідний параграф підручника, відповісти на запитання до нього, Здійснити перетворення:
BaO→ Ba(OH)2→ BaCO3→ H2CO3→ CO2
ZnO → ZnSO4 → Zn(OH)2→ Na2ZnO2.


про публікацію авторської розробки
Додати розробку
