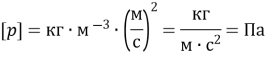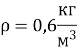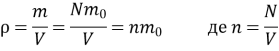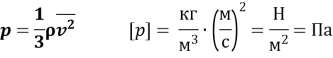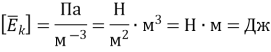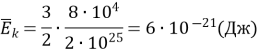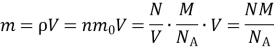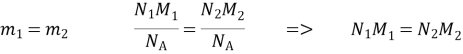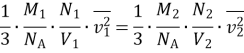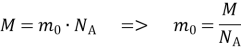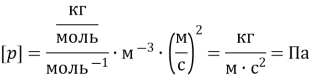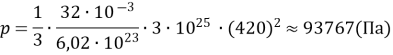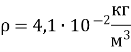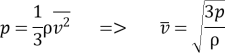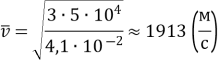Основне рівняння МКТ ідеального газу
1
Урок Основне рівняння МКТ ідеального газу
Мета уроку:
Навчальна: Формувати уявлення учнів про ідеальний газ як найпростішу модель реального газу; про основне рівняння МКТ; формувати вміння застосувати основне рівняння МКТ для розв’язування задач; встановлювати причинно-наслідкові зв’язки, обґрунтувати твердження.
Розвивальна. З метою розвитку мислення розвивати вміння аналізувати навчальний матеріал, умову задачі, хід розв’язання задач; пояснювати подібні матеріали; виявляти аналогії; розкривати загальне і конкретне; встановлювати закономірності.
Виховна. Виховувати уважність, зібраність, спостережливість.
Тип уроку: урок засвоєння нових знань.
Наочність і обладнання: навчальна презентація, комп’ютер, підручник.
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
II. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ ТА ВМІНЬ
Кожне макроскопічне тіло складається з величезної кількості молекул.
Поведінку макроскопічних тіл описують низкою фізичних величин – мікроскопічними і макроскопічними параметрами.
Що це за параметри і як вони пов’язані?
IІІ. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Мікроскопічні і макроскопічні параметри
Мікроскопічні параметри – це фізичні величини, які характеризують властивості та поведінку окремих мікрочастинок речовини. (маси молекул, їх швидкості, концентрація)
Макроскопічні параметрами – це фізичні величини, які характеризують властивості та поведінку макроскопічних тіл без урахування їх молекулярної будови. (об’єм, тиск, температура)
Основне завдання МКТ:
Встановити зв’язок між макроскопічними і мікроскопічними параметрами речовини й, виходячи з цього, знайти рівняння стану даної речовини. Наприклад, знаючи масу молекул, їх середні швидкості й концентрацію, можна знайти об’єм, тиск і температуру даної маси газу, а також визначити тиск газу, якщо відомі його об’єм і температура.
2. Ідеальний газ
Ідеальний газ – це фізична модель газу, молекули якого приймають за матеріальні точки, що не взаємодіють одна з одною на відстані та пружно взаємодіють у моменти зіткнення.
З точки зору молекулярних уявлень, гази складаються з атомів або молекул, відстані між якими значно більші за їх розміри. Внаслідок цього сили взаємодії між молекулами газів практично відсутні. Взаємодія між ними фактично відбувається лише під час короткочасних зіткнень.
Оскільки взаємодія молекул ідеального газу зводиться лише до короткочасних зіткнень і розміри молекул не впливають на тиск і температуру газу, ми можемо вважати, що: ідеальний газ – набір невзаємодіючих матеріальних точок.
3. Основне рівняння МКТ ідеального газу
Проблемне питання
• Чи є сенс розглядати рух кожної окремої молекули та встановлювати швидкість її руху в даний момент часу?
Число молекул величезне, і за секунду кожна молекула змінює швидкість свого руху мільярди разів. Тому фізики використовують середні значення швидкостей молекул.
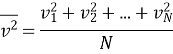
![]() – середній квадрат швидкості
– середній квадрат швидкості
![]() – число молекул
– число молекул
![]() – швидкості руху окремих молекул
– швидкості руху окремих молекул
Середня квадратична швидкість руху молекул – це квадратний корінь із середнього квадрата швидкості.
![]()
Тиск газу є результатом зіткнення молекул газу зі стінками посудини.
Чим швидше рухаються молекули газу і чим більшою є маса цих молекул, тим більшою буде сила їх ударів і тим більший тиск створюватиме газ.
Основне рівняння МКТ ідеального газу:
![]()
![]() – тиск ідеального газу
– тиск ідеального газу
![]() – маса однієї молекули газу
– маса однієї молекули газу
![]() – концентрація молекул
– концентрація молекул ![]()
![]() – середнє значення квадрата швидкості молекул
– середнє значення квадрата швидкості молекул
Коефіцієнт 1/3 зумовлений тривимірністю простору – тим, що під час хаотичного руху молекул всі три напрями рівноправні.
Проблемне питання
• Чому тиск газу збільшується зі збільшенням концентрації молекул?
4. Зв'язок тиску з середньою кінетичною енергією молекули.
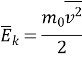
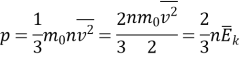
ІV. ЗАКРІПЛЕННЯ НОВИХ ЗНАНЬ І ВМІНЬ
1. Під яким тиском знаходиться газ в посудині, якщо середня квадратична швидкість його молекул 103 м/с, концентрація молекул 3ꞏ1025 м–3, а маса кожної молекули 5ꞏ10–26 кг?
|
Дано:
|
Розв’язання
Відповідь: |
|
|
2. Визначте тиск газу, якщо його густина дорівнює 0,6 кг/м3, а середня квадратична швидкість руху його молекул становить 400 м/с.
|
Дано:
|
Розв’язання
Відповідь: |
|
|
3. Тиск газу дорівнює 80 кПа, а концентрація його молекул 2ꞏ1025 м–3. Визначте середню кінетичну енергію поступального руху молекул газу.
|
Дано:
|
Розв’язання
Відповідь: |
|
|
4. На терезах зрівноважено два однакових закритих балони: перший із киснем, а другий з азотом. Тиск газів однаковий. Порівняйте середні квадратичні швидкості руху молекул кисню та азоту.
|
Дано:
|
Розв’язання
Відповідь: |
|
|
Додаткові задачі
1. Визначте тиск кисню, якщо концентрація його молекул дорівнює 3ꞏ1025 м–3, а середня квадратична швидкість руху його молекул становить 420 м/с.
|
Дано:
|
Розв’язання
Відповідь: |
|
|
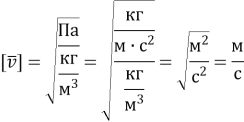
2. Тиск розрідженого газу 5ꞏ104 Па, його густина 4,1ꞏ10–2 кг/м3. Визначте середню квадратичну швидкість хаотичного руху молекул газу.
|
Дано:
|
Розв’язання
Відповідь: |
|
|
V. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
Бесіда за питаннями
1. Дайте означення макроскопічних і мікроскопічних параметрів. Наведіть приклади.
2. Дайте означення ідеального газу.
3. Що таке середній квадрат швидкості руху молекул? середня квадратична швидкість руху молекул?
4. Чому газ тисне на стінки посудини?
5. Які параметри пов’язує основне рівняння МКТ ідеального газу? Запишіть це рівняння.
6. Яким співвідношенням пов’язані тиск і середня кінетична енергія поступального руху молекул ідеального газу? тиск і густина ідеального газу?
VI. Домашнє завдання
Опрацювати § 28, Вправа № 28 (2, 4)


про публікацію авторської розробки
Додати розробку