Урок № 2 Тема. Кислоти, їх склад і назви. Класифікація кислот. Заходи безпеки під час роботи з кислотами. Використання кислот.
Тема. Кислоти, їх склад і назви. Класифікація кислот. Заходи безпеки під час роботи з кислотами. Використання кислот.
Мета уроку:
-розширити знання про класифікацію неорганічних речовин на прикладі
кислот;
-ознайомити учнів із класифікацією кислот за складом, номенклатурою
кислот;
-розглянути фізичні властивості кислот;
-ознайомити з поширеністю кислот у природі та їх використання, сформувати вміння виявляти кислоти за допомогою індикаторів;
-розглянути правила техніки безпеки при роботі з кислотами;
- розвивати вміння логічно та критично мислити, творчо використовувати отриману інформацію, порівнювати та систематизувати.
Основні класів неорганічних сполук. 8 клас
Урок № 2
Тема. Кислоти, їх склад і назви. Класифікація кислот. Заходи безпеки під час роботи з кислотами. Використання кислот.
Мета уроку:
- розширити знання про класифікацію неорганічних речовин на прикладі
кислот;
- ознайомити учнів із класифікацією кислот за складом, номенклатурою
кислот;
- розглянути фізичні властивості кислот;
- ознайомити з поширеністю кислот у природі та їх використання, сформувати вміння виявляти кислоти за допомогою індикаторів;
- розглянути правила техніки безпеки при роботі з кислотами;
- розвивати вміння логічно та критично мислити, творчо використовувати отриману інформацію, порівнювати та систематизувати.
Базові поняття та терміни: складні речовини, валентність,фізичні властивості, кислоти, кислотний залишок, безоксигенові та оксигеновмісні кислоти, основність, індикатори.
Тип уроку: комбінований.
Методи навчання: пояснювально-ілюстративні – бесіда, розповідь; наочні – демонстрації, лабораторний дослід; практичні – виконання завдань; репродуктивні; частково-пошукові, творчі, інтерактивні.
Матеріали: зразки кислот H2SO4, HCl, HNO3, CH3COOH, дві пробірки, розчин лакмусу та метилоранжу.
Обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності.
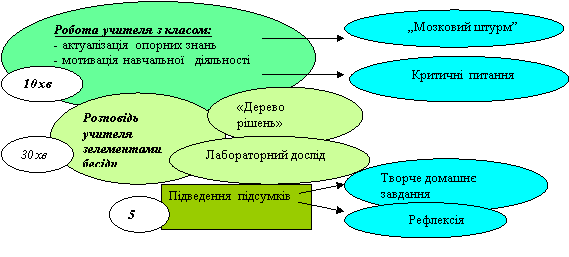
Хід уроку
І. Організаційний етап
Привітання, перевірка готовності учнів до уроку.
Перевірка домашнього завдання. Перевірка виконання письмових завдань.
Учні пишуть на дошці формули вищих оксидів елементів ІІІ періоду, дають назви й указують тип оксиду.
Запитання:
- Як у періоді зі збільшенням порядкового номера хімічних елементів змінюється тип оксидів, які вони утворюють ?(основні – амфотерні – кислотні).
«Мозковий штурм»: « Які речовини?»
а) З яким класом неорганічних речовин ви ознайомились?
б) Які речовини називають оксидами?
в) Як складаються назви оксидів?
г) У якому агрегатному стані перебувають оксиди? Наведіть приклади.
д) За якими ознаками можна класифікувати оксиди?
ІІ. Актуалізація опорних знань
- Мотивація Критичні питання:
- Що спільного між лимоном, томатом, квашеною капустою, щавлем та кефіром?
- Чому від кропиви виникає подразнення шкіри?
- Чому чай після додавання лимону світлішає?
Тема нашого уроку: кислоти. Запитання до учнів – що вам відомо про кислоти?
- Встановлення цілей
Учні формулюють питання, які слід розглянути на уроці:
- Що таке кислоти, який склад вони мають?
- Які назви мають кислоти?
- За якими ознаками класифікують кислоти?
- Яким чином можна виявити кислоти?
- Якими фізичними властивостями характеризуються кислоти?
- Де використовуються кислоти?
ІІІ. Вивчення нового матеріалу.
- Склад та назви кислот.
Розповідь вчителя. У лимонах і грейпфрутах міститься лимонна кислота, у щавлі – щавлева, у яблуках – яблучна, а в оцті, що утворюється при бродінні виноградного або яблучного соку - оцтова. Все це приклади органічних кислот. Серед кислот є й неорганічні. До числа неорганічних (мінеральних) кислот відносяться сульфатна (сірчана) і хлоридна (соляна) кислоти.
Робота з таблицею.
Учні заповнюють у зошитах таблицю. Учитель заповнює таблицю разом з учнями, пояснюючи кожну формулу.
|
Формула |
Назва за номенклатурою |
Тривіальна назва |
Назва кислотного залишку |
|
HF |
Флуоридна |
Флуороводнева, плавикова |
Флуорид |
|
HCl |
Хлоридна |
Хлороводнева, соляна |
Хлорид |
|
HBr |
Бромідна |
Бромоводнева |
Бромід |
|
HI |
Іодидна |
Іодоводнева |
Іодид |
|
HCN |
Ціанідна |
Ціановоднева |
Ціанід |
|
H2S |
Сульфідна |
Сірководнева |
Сульфід |
|
H2SO4 |
Сульфатна |
Сірчана |
Сульфат |
|
H2SO3 |
Сульфітна |
Сірчиста |
Сульфіт |
|
HNO3 |
Нітратна |
Азотна |
Нітрат |
|
HNO2 |
Нітритна |
Азотиста |
Нітрит |
|
H2CO3 |
Карбонатна |
Вугільна |
Карбонат |
|
H2SiO3 |
Силікатна |
Кремнієва |
Силікат |
|
H3PO4 |
Ортофосфатна |
Ортофосфорна |
Ортофосфат |
|
HPO3 |
Метафосфатна |
Метафосфорна |
Метафосфат |
Учням надається завдання: «Дерево рішень»
- Порівняйте склад кислот, визначте спільне.
Висновок учнів: у всіх кислот є атом гідрогену, символ Гідрогену стоїть на першому місці у формулах кислот.
Учитель зауважує, що у формулах кислот можна виділити кислотний залишок. До складу кислотного залишку може входити атом або група атомів.
Учні за допомогою вчителя дають визначення кислот:
- Кислоти – це складні речовини, до складу яких входять атоми Гідрогену й кислотний залишок.
Валентність кислотного залишку дорівнює числу атомів Гідрогену в молекулі кислоти.
Запитання учням: чому? (тому що валентність Гідрогену завжди дорівнює І).
- Класифікація кислот.
Кислоти можна класифікувати за цілим рядом ознак:
- за кількістю атомів Гідрогену;
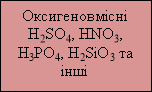
- за наявністю атомів Оксигену;
- за ступенем дисоціації;
- за окисною здатністю;
- за міцністю.


![]()
![]()



![]()



Фізкультхвилинка
-Я називаю оксигеновмісні кислоти- пригаємо, а коли безоксигенові – присідаємо.
-Скількох основна кислота- стільки разів плескаємо в долоні.
- Фізичні властивості кислот.
Демонстрація.
Демонстрація зразків кислот H2SO4, HCl, HNO3.
Робота з підручником.
Учні знайомляться з фізичними властивостями кислот за підручником і виконують завдання. Робота в групах.
- Випишіть формули кислот у різних агрегатних станах.
- Випишіть приклади розчинних і нерозчинних кислот.
- Поширеність кислот у природі.
Розповідь учителя. Кислоти є дуже поширеними речовинами. У своєму житті ви дуже часто з ними стикаєтесь. В багатьох овочах, фруктах і ягодах містяться органічні кислоти – лимонна, яблучна, щавлева, виноградна, винна, янтарна. При скисанні продуктів також утворюються кислоти. Навколо нас зустрічаються також неорганічні кислоти. Навіть прісна вода містить невеликі домішки карбонатної кислоти завдяки розчиненню в ній вуглекислого газу. Дощова вода часто містить домішки сульфітної або сульфідної кислот, які потрапляють у повітря під час виверження вулканів. У шлунку завжди міститься розчин хлоридної кислоти.
- Виявлення кислот
Розповідь учителя. Кислоти являються небезпечними для людини, тому при роботі з ними потрібно дотримуватися правил техніки безпеки. Які ми знаємо правила ІБЖ? Для виявлення кислот в лабораторії використовуються індикатори – складні органічні речовини, що змінюють своє забарвлення у присутності кислот.
У присутності кислоти:
лакмус – червоний;
метилоранж – червоний.
|
|
|
работать можно, Но крайне осторожно. |
|
Если кислоты или щелочи на тебя попадают, |
|
Кислоту в воду добавляют – |
|
ccТолько так кислоту разбавляют. |
Лабораторний дослід. Дія кислот на індикатори.
Відкрийте склянку із хлоридною кислотою. Перевірте, чи має вона запах. Налийте у дві пробірки по 1 мл хлоридної кислоти. В одну пробірку додайте одну-дві краплі розчину лакмусу, а в іншу – метилоранжу. Як змінилося забарвлення індикаторів? Зробіть аналогічний дослід з розчином сульфатної кислоти.
Учні записують спостереження у зошит.
Що спільного між хлоридною і сульфатною кислотами? Чим вони розрізняються?
- Використання кислот.
Кислоти є одними з найважливіших речовин у промисловості, і не тільки в хімічній. Найбільша увага приділяється сульфатній, нітратній, хлоридній та фосфатній кислотам. Їх добувають на хімічних заводах у величезних кількостях, особливо сульфатну. Часто навіть про рівень розвитку якої-небудь країни судять по тому, скільки вона виробляє сульфатної кислоти. А це саме тому, що сульфатну кислоту (як і інші кислоти) використовують майже у всіх галузях народного господарства. Без цих кислот неможливо виготовляти метали, тканини, папір, мінеральні добрива тощо. Величезні об`єми сульфатної кислоти витрачаються у виробництві кольорових металів, мийних засобів, ліків і барвників, вибухових матеріалів, акумуляторів і сірників.
У великих кількостях кислоти використовує і харчова промисловість, і не тільки як смакові приправи для надання кислого смаку. В більшості випадків кислоти (оцтова, лимонна, бензойна, винна, щавлева) використовуються як консерванти – речовини, які уповільнюють псування харчових продуктів.
Майже в кожному домі є оцет (розчин оцтової кислоти) і лимонна кислота для приготування їжі. В домашній аптечці завжди знайдеться аскорбінова кислота (вітамін С), ацетилсаліцилова кислота (аспірин) і борна кислота (її розчин використовується для дезінфекції). (Учитель демонструє добавки та ліки, про які йде мова.)
V. Узагальнення та систематизація знань
Завдання.
- З наведеного переліку речовин випишіть формули кислот: CaO, H2SiO3, K2SO4, HCl, HNO3, MgCl2, CO2, HPO3, NaOH, HBr, HCIO4, AgCl, HF, FeS, H2S, NaNO2, H2SO3. Серед виписаних формул підкресліть формули безоксигенових кислот.
- За формулами кислотних залишків складіть формули кислот та випишіть окремо формули одно-, дво- і трьохосновних кислот:
- Cl, = CO3, - ClO, = BO3, - MnO4, = S, = SeO4, - I, = AsO4, - NO3, = Cr2O7.
3. Дано формули з прозорими розчинами. Відомо, що в одній з них кислота, а в іншій вода. Запропонуйте метод, за яким можна знайти, в якій з пробірок кислота.
V. Домашнє завдання
Опрацювати 7 параграф. Виконати вправи: дост. рівень - №64-65 ст. 43.
Скласти казку про кислоти.(Високий рівень)
Рефлексія. Вправа «Оператор». Учням роздаються картки з термінами та поняттями, які використовувались на уроці, приховавши їх у довільному наборі літер. Знайти ці терміни.


про публікацію авторської розробки
Додати розробку
