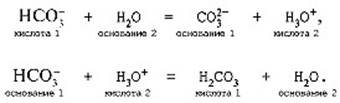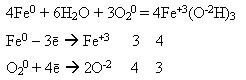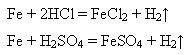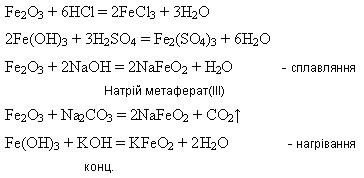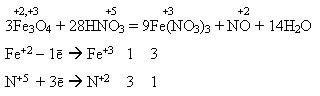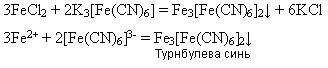Пакет лекційного матеріалу з Неорганічної хімії
Міністерство освіти і науки України
Харківський державний автомобільно-дорожній коледж
Лозівська філія
Пакет лекційного матеріалу
з дисципліни «Хімія»
Міністерство освіти і науки України
Харківський державний автомобільно-дорожній коледж
Лозівська філія
Пакет лекційного матеріалу
з дисципліни «Хімія»

РОЗГЛЯНУТО ТА ПОГОДЖЕНО на засіданні циклової комісії загальноосвітніх дисциплін
протокол №___ від «__» ______ 20__ року голова циклової комісії _______ В.В. Шарий Пакет лекційного матеріалу з дисципліни «Хімія» (неорганічна хімія) /
Н.І. Жук – Лозова: ЛФ ХДАДК, 2017. – 153 с.
Пакет лекційного матеріалу з дисципліни «Хімія» містить матеріали з таких тем, як «Повторення питань курсу хімії неповної освітньої школи», «Неметалічні елементи та їх сполуки», «Металічні елементи та їх сполуки». Матеріали складені відповідно до навчальної програми дисципліни «Хімія».
Для студентів денної форми навчання при вивченні дисципліни «Хімія» за спеціальностями 274 «Автомобільний транспорт», 133 «Галузеве машинобудування», 071 «Облік і оподаткування», 051 «Економіка»,
275 «Транспортні технології (за видами)»
ЗМІСТ
Тема 1. Повторення питань курсу хімії неповної освітньої школи
Заняття 1. Періодичний закон, періодична система хімічних 5
елементів Д. І. Менделєєва. Хімічний зв'язок, будова речовини
Заняття 2. Основні класи неорганічних сполук 15
Заняття 3. Теорія електролітичної дисоціації. Електроліти й 22
неелектроліти
Тема 2. Неметалічні елементи та їх сполуки
Заняття 4. Загальна характеристика неметалічних елементів. 27
Неметали як прості речовини. Хімічні властивості неметалів. Сполуки
неметалів з гідрогеном та оксигеном
Заняття 5. Сульфур, його властивості, сполуки та їх застосування 49
Заняття 6. Нітроген і фосфор, їх місце в ПСХЕ, фізичні властивості. 56
Алотропні видозміни. Фізичні і хімічні властивості нітрогені і фосфору,
взаємодія з металами, оксисеном і гідрогеном
Заняття 7. Амоніак, будова молекули, фізичні та хімічні властивості. 83
Солі амонію, їх властивості. Якісна реакція на амоній.
Заняття 8. Карбон і силіцій, їх місце в ПСХЕ, фізичні та хімічні 91
властивості. Солі карбонатної кислоти, їх поширення у природі,
застосування.
Тема 3. Металічні елементи та їх сполуки
Заняття 9. Загальна характеристика металічних елементів. Метали як 115
прості речовини. Хімічні властивості металів
Заняття 10. Лужні та лужноземельні елементи та їх сполуки 124
Заняття 11. Алюміній, його сполуки, застосування. Ферум, як 138
представник металічних елементів побічних підгруп
ТЕМА 1. ПОВТОРЕННЯ ПИТАНЬ КУРСУ ХІМІЇ НЕПОВНОЇ ОСНОВНОЇ ШКОЛИ
Заняття №1
Дисципліна: «Хімія»
Тема заняття: Періодичний закон, періодична система хімічних елементів
Д. І. Менделєєва. Хімічний зв'язок, будова речовини Мета заняття:
навчальна – узагальнити й систематизувати знання студентів про
періодичне повторення властивостей хімічних елементів і речовин, утворених цими елементами;
розвиваюча – розширити уявлення студентів про будову атома, зв’язок між будовою атомів та їх положенням у періодичній системі; повторити види хімічного зв’язку, типи кристалічних ґраток, зв’язок між будовою атомів, хімічним зв’язком і будовою речовини;
виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: узагальнення й систематизації знань
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: періодична система хімічних елементів
Д. І. Менделєєва, картки із завданнями
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань:
Фронтальна бесіда
1. Наведіть формулювання періодичного закону Д. І. Менделєєва.
2. Наведіть сучасне формулювання періодичного закону.
3. Зобразіть будову атома та іона:
а) Хлору;
б) Натрію.
4. Зобразіть електронну схему утворення молекули між цими атомами,
укажіть тип хімічного зв’язку.
5. Укажіть положення в періодичній системі найсильнішого металу.
Обґрунтуйте свою думку.
6. Укажіть положення в періодичній системі найсильнішого неметалу.
Обґрунтуйте свою думку.
7. Яке місце в періодичній системі займають інертні елементи?
ІІІ Мотивація навчальної діяльності
ІV Сприйняття й засвоєння нових знань:
План
1. Узагальнення й систематизація вивченого матеріалу.
1.1. Будова атома. Квантові числа. Принцип заповнення електронних орбіталей.
1.2. Квантові числа електронів.
1.3. Принципи заповнення орбіталей.
2. Фізичний зміст хімічної періодичності
6
3. Групова робота
4. Підбиття підсумків заняття
5. Домашнє завдання
7
ХІД ЗАНЯТТЯ
1. Узагальнення й систематизація вивченого матеріалу
1.1. Будова атома. Квантові числа. Принцип заповнення електронних орбіталей
У хімічних реакціях ядра атомів залишаються без змін, змінюється лише будова електронних оболонок унаслідок перерозподілу електронів між атомами. Здатністю атомів віддавати або приєднувати електрони визначаються їх хімічні властивості.
Як визначається положення електронів у атомі?
Електрон має подвійну (корпускулярно-хвильову) природу. Електрони в атомі можуть мати лише чітко визначені значення енергії, які залежать від відстані до ядра. Електрони, що мають близькі значення енергії, утворюють енергетичний рівень. Він містить певну кількість електронів – максимально 2n2. Енергетичні рівні поділяються на s-,p-, d- і f-підрівні; їх число дорівнює номеру рівня.
1.2. Квантові числа електронів
Стан кожного електрона в атомі зазвичай описують з допомогою чотирьох квантових чисел: головного (n), орбітального (l), магнітного (m) і спінового (s). Перші три характеризують рух електрона в просторі, а четверте – навколо своєї осі.
Головне квантове число (n). Визначає енергетичний рівень електрона, віддаленість рівня від ядра, розмір електронної хмарини. Має цілі значення (n = 1, 2, 3...) і відповідає номеру періоду. З періодичної системи для будь-якого елемента за номером періоду можна визначити число енергетичних рівнів атома й зовнішній енергетичний рівень.
Завдання 1 (робота по ланцюжку). Назвіть число енергетичних рівнів у атомі елемента: Ферум, Натрій, Сульфур, Силіцій, Бром, Радій.
1. Що таке електронна орбіталь?
2. Яких форм можуть набувати електронні орбіталі?
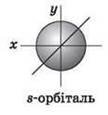
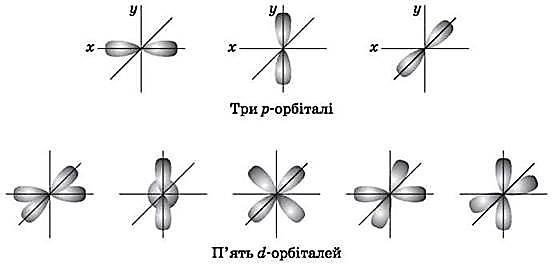
Орбітальне квантове число (l) характеризує геометричну форму орбіталі. Має значення цілих чисел від 0 до (n-1). Незалежно від номера енергетичного рівня кожному значенню орбітального квантового числа відповідає орбіталь особливої форми. Набір орбіталей з однаковими значеннями п називається енергетичним рівнем, з однаковими n і l – підрівнем. Для l = 0 s-підрівень, s-орбіталь – орбіталь сфера; l = 1 р-підрівень, р-орбіталь – орбіталь гантель; l = 2 d-підрівень, d-орбіталь – орбіталь складної форми; l = 3 f-підрівень, f-орбіталь – орбіталь ще більш складної форми.
Згадайте, які електрони можуть розташовуватися на першому рівні; на другому рівні; на третьому рівні. (Заповнюємо таблицю.)
|
Номер рівня |
Максимальна кількість електронів |
Підрівні |
|
1 |
2 |
s |
|
2 |
8 |
s, р |
|
3 |
18 |
s, р, d |
|
4 |
32 |
s, р, d, f |
|
5 |
50 |
s, р, d, f, g |
Магнітне квантове число (m) характеризує положення електронної орбіталі в просторі.
Для s-орбіталі (l = 0 таке положення одне й відповідає m = 0. Сфера не може мати різні орієнтації в просторі.
Для р-орбіталі (l = 1 – три рівноцінні орієнтації в просторі. Для dорбіталі (l = 2) – п’ять рівноцінних орієнтацій у просторі.
Отже, на s-підрівні – одна, на р-підрівні – три, на d-підрівні – п’ять, на fпідрівні – сім орбіталей.
Що таке «спін»?
Спінове квантове число (s) характеризує магнітний момент, що виникає під час обертання електрона навколо своєї осі. Може мати лише два значення:
+1/2 та -1/2, що відповідають протилежним напрямкам обертання.
1.3. Принципи заповнення орбіталей
1. Принцип Паулі. В атомі не може бути двох електронів, у яких значення всіх квантових чисел (n, l, m, s) були б однаковими, тобто на кожній орбіталі може знаходитися не більш ніж два електрони (з протилежними спінами).
2. Енергія орбіталей зростає в ряді:
1s < 2s < 2р < 3s < 3р < 4s < 3d < 4р < 5s < 4d < 5р < 6s < 5d" < 4f < 6р < 7s.
3. Правило Хунда. Атом в основному стані повинен мати максимально можливе число неспарених електронів у межах певного підрівня.
Повна електронна формула елемента
Запис, що відбиває розподіл електронів у атомі хімічного елемента по енергетичних рівнях і підрівнях, називається електронною конфігурацією цього атома.
Завдання 2. Порівняйте схему будови атома, електронну і графічну формули будови атома:
а) Оксигену й магнію;
б) Калію та Хлору;
в) Калію та Скандію.
2. Фізичний зміст хімічної періодичності
Періодичні зміни властивостей хімічних елементів зумовлені правильним повторенням електронної конфігурації зовнішнього енергетичного рівня (валентних електронів) їхніх атомів зі збільшенням заряду ядра.
Графічним зображенням періодичного закону є періодична таблиця.
Що таке період у періодичній системі? Скільки елементів може знаходитися в кожному періоді?
Періоди – це горизонтальні ряди елементів з однаковим максимальним значенням головного квантового числа валентних електронів. Періоди можуть складатися з 2 (перший), 8 (другий і третій), 18 (четвертий та п’ятий) або 32 (шостий) елементів, залежно від кількості електронів на зовнішньому енергетичному рівні. Останній, сьомий, період незавершений. Усі періоди (крім першого) починаються лужним металом (s-елементом), а закінчуються інертним газом (ns2nр6).
Чим визначаються металічні й неметалічні властивості елементів? металічні властивості розглядаються як здатність атомів елементів легко віддавати електрони, а неметалічні – приєднувати електрони через прагнення атомів набути стійкої конфігурації із заповненими підрівнями. Заповнення зовнішнього s-підрівня вказує на металічні властивості атома, а формування зовнішнього р-підрівня – на неметалічні властивості. Збільшення числа електронів на р-підрівні (від одного до п’яти) посилює неметалічні властивості атома. Атоми з повністю сформованою, енергетично стійкою конфігурацією зовнішнього електронного шару (ns2nр6) є хімічно інертними.
У великих періодах перехід властивостей від активного металу до інертного газу відбувається більш плавно, ніж у малих періодах, оскільки формується внутрішній (n–1) d-підрівень за збереження зовнішнього ns2-шару.
Великі періоди складаються з парних і непарних рядів.
В елементів парних рядів на зовнішньому шарі містяться ns2-електрони, тому переважають металічні властивості, а їх ослаблення зі зростанням заряду ядра є незначним; у непарних рядах формується nр-підрівень, що пояснює значне ослаблення металічних властивостей.
Що таке групи в періодичній системі? Які елементи об’єднуються в головні та побічні підгрупи?
Групи – вертикальні стовпці елементів з однаковим числом валентних електронів, що дорівнює номеру групи. Розрізняють головні й побічні підгрупи.
Головні підгрупи складаються з елементів малих і великих періодів, валентні електрони яких розташовані на зовнішніх ns- і nр-підрівнях.
Побічні підгрупи складаються з елементів лише великих періодів. їхні валентні електрони знаходяться на зовнішньому ns- підрівні та внутрішньому (n-1) d-підрівні (або (n-2) f-підрівні).
Залежно від того, який підрівень (s-, р-, d- чи f-) заповнюється валентними електронами, елементи періодичної системи поділяються на такі: sелементи (елементи головної підгрупи першої та другої груп), р-елементи (елементи головних підгруп третьої – восьмої груп), d-елементи (елементи побічних підгруп), f-елементи (лантаноїди, актиноїди).
У головних підгрупах зверху вниз металічні властивості посилюються, а неметалічні слабшають. Елементи головних і побічних груп значною мірою відрізняються за властивостями.
Номер групи показує вищу валентність елемента (крім O, F, елементів підгрупи Купруму та восьмої групи).
Загальними для елементів головних і побічних підгруп є формули вищих оксидів (а також їхніх гідратів). У вищих оксидів та їхніх гідратів елементів першої – третьої груп (крім Бору) переважають основні властивості, з четвертої по восьму – кислотні. (Заповнюємо таблицю.)
|
Група |
І |
ІІ |
III |
IV |
V |
VI |
VII |
VIII (крім інертних газів) |
|
Вищий оксид |
E2O |
ЕО |
E2O3 |
EO2 |
E2O5 |
EO3 |
E2O7 |
EO4 |
|
Гідрат вищого оксиду |
ЕОН |
E(OH)2 |
E(OH)3 |
H2EO3 |
H3EO4 |
H2EO4 |
HEO4 |
H4EO4 |
Як змінюються металічні й неметалічні властивості в періодах? у групах?
Від положення елементів у періодичній системі залежать властивості атома, пов’язані з його електронною конфігурацією: атомний радіус – у періоді зліва направо зменшується, а в підгрупі згори вниз зростає; енергія іонізації – у періоді зростає, а в підгрупі зменшується; електронегативність – у періоді збільшується, а в підгрупі зменшується.
3. Групова робота
На підставі періодичної таблиці охарактеризуйте хімічний елемент із порядковим номером: 11, 9, 7, 17, 13, 10 за планом:
1. Положення в періодичній таблиці (порядковий номер; період, ряд; група, підгрупа; атомна маса)
2. Будова атома (заряд ядра; склад ядра — кількість протонів р11, нейтронів n01 та електронів e-; кількість енергетичних рівнів і підрівнів; формула електронної конфігурації; квантові комірки; за числом і характером валентних електронів визначити тип елемента)
3. Формули й хімічний характер сполук (вищого оксиду й гідроксиду; сполук із Гідрогеном)
4. Порівняти із сусідами (у періоді, у групі)
Учні складають звіт про виконане завдання, подають його на обговорення в класі, по черзі коментують помилки. Викладач узагальнює й оцінює відповіді.
4. Підбиття підсумків заняття
Викладач підбиває підсумки заняття, оцінює роботу студентів.
5. Домашнє завдання
Повторити матеріал про
будову атомів, хімічний зв’язок, будову речовини.
ТЕМА 1. ПОВТОРЕННЯ ПИТАНЬ КУРСУ ХІМІЇ НЕПОВНОЇ ОСНОВНОЇ ШКОЛИ
Заняття № 2
Дисципліна: «Хімія»
Тема заняття: Основні класи неорганічних сполук Мета заняття:
навчальна – повторити хімічні поняття, розглянуті під час вивчення хімії у 8 класі;
розвиваюча – узагальнити й систематизувати знання про класи неорганічних сполук, їх генетичні зв’язки, хімічні
властивості;
виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: узагальнення й систематизації знань
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, опорні схеми
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань:
Фронтальна бесіда
1. Назвіть основні поняття й закони, вивчені у 8 класі. Дайте визначення поняттям: моль, молярна маса, молярний об’єм та ін.
2. Наведіть формулювання законів:
а) збереження маси;
б) об’ємних відносин;
в) періодичного закону.
ІІІ Мотивація навчальної діяльності
ІV Сприйняття й засвоєння нових знань:
План
1. Узагальнення й систематизація вивченого матеріалу.
1.1. Класи неорганічних сполук.
1.2. Формули й назви кислот і кислотних залишків.
1.3. Основні способи одержання солей різних типів.
1.4. Генетичний зв’язок класів неорганічних сполук.
2. Підбиття підсумків заняттяї
3. Домашнє завдання
ХІД ЗАНЯТТЯ
1. Узагальнення й систематизація вивченого матеріалу
1.1. Класи неорганічних сполук
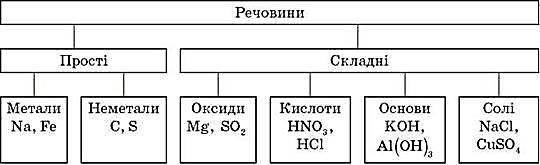
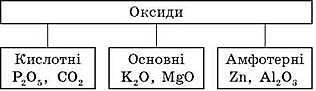
Оксиди – складні сполуки, що складаються з двох хімічних елементів, один з яких – Оксиген валентністю II.
Основи – складні речовини, що складаються з атомів металів, з’єднаних з однією або кількома гідроксильними групами.
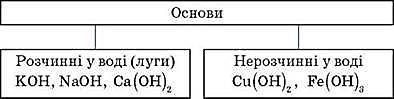
УВАГА! Луги утворюють лише десять елементів періодичної системи хімічних елементів Д. І. Менделєєва: шість лужних металів и літій, натрій, калій, рубідій, цезій, францій, та чотири лужноземельні метали – кальцій, стронцій, барій, радій.
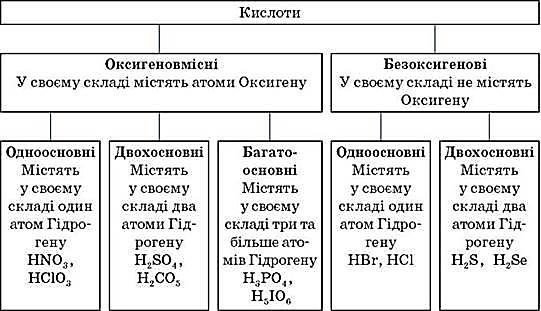
Кислоти – складні речовини, утворені одним або кількома атомами Гідрогену, з’єднаними з кислотним залишком.
Солі – складні речовини, утворені атомами металів, з’єднаними з кислотними залишками.
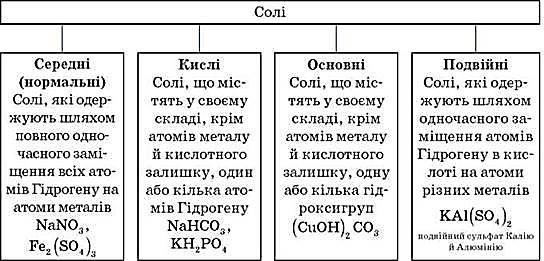
УВАГА! Щоб правильно назвати кислу сіль, необхідно до назви нормальної солі додати префікс гідроген- або дигідроген- залежно від числа атомів Гідрогену, що входять до складу кислої солі.
1.2. Формули й назви кислот і кислотних залишків
|
Кислота |
Кислотний залишок |
||
|
назва |
формула |
назва |
формула |
|
Хлоридна (соляна) |
HCl |
Хлорид |
Cl- |
|
Флуоридна(плавикова) |
HF |
Флуорид |
F- |
|
Бромідна(бромоводнева) |
HBr |
Бромід |
Br- |
|
Іодидна (іодоводнева) |
HI |
Іодид |
I- |
|
Хлорнуватиста |
HClO |
Гіпохлорит |
ClO- |
|
Хлорнувата |
HClO3 |
Хлорат |
ClO3- |
|
Хлорна |
HClO4 |
Перхлорат |
ClO4- |
|
Нітритна (азотиста) |
HNO2 |
Нітрит |
NO2- |
|
Нітратна (азотна) |
HNO3 |
Нітрат |
NO3- |
|
Сульфідна (сірководнева) |
H2S |
Сульфід |
S2- |
|
Гідрогенсульфід |
HS- |
||
|
Сульфітна (сірчиста) |
H2SO3 |
Сульфіт |
SO32- |
|
Гідрогенсульфіт |
HSO3- |
||
|
Сульфатна (сірчана) |
H2SO4 |
Сульфат |
SO42- |
|
Гідрогенсульфат |
HSO4- |
||
|
Карбонатна (вугільна) |
H2CO3 |
Карбонат |
CO32- |
|
Гідрогенкарбонат |
HCO3- |
||
|
Силікатна |
H2SiO3 |
Силікат |
SiO32- |
|
Фосфатна (ортофосфатна) |
H3PO4 |
Ортофосфат |
PO43- |
|
Гідрогенортофосфат |
HPO42- |
||
|
Дигідрогенортофосфат |
H2PO4- |
||
|
Мурашина |
НСООН |
Форміат |
HCOO- |
|
Оцтова |
CH3COOH |
Ацетат |
CH3COO- |
Наприклад, KHCO3 – калій гідрогенкарбонат;
KH2PO4 – калій дигідрогенортофосфат.
Слід пам’ятати, що кислі солі можуть утворювати дві й більше основні кислоти, як оксигеновмісні, так і безоксигенові.
Щоб назвати основну сіль, необхідно до назви нормальної солі додати префікс гідрокси- або дигідрокси- залежно від числа груп OH-, що входять до складу солі.
Наприклад, (CuOH)2CO3 – купрум(ІІ) гідроксикарбонат.
Слід пам’ятати, що основні солі здатні утворювати лише основи, що містять у своєму складі дві й більше гідроксигруп.
Однак слід розуміти, що багато які з кислих і основних солей можуть існувати лише теоретично, реально ж у розчинах такі солі, як правило, нестабільні.
1.3. Основні способи одержання солей різних типів
А. Нормальних (середніх):
3KOH + H3PO4 = K3PO4 + 3H2O
Основу й кислоту взято для взаємодії в стехіометричних кількостях
(тобто вони реагують одна з одною без залишку).
Завдання 1.
Допишіть рівняння реакцій.
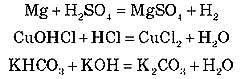
Кислих:
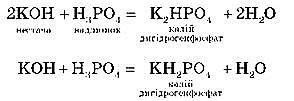
Для одержання кислих солей кислота береться в надлишку, а основа – у нестачі.
Основних:
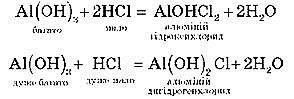
Для одержання основних солей основа береться в надлишку, а кислота – у нестачі.
1.4. Генетичний зв’язок класів неорганічних сполук
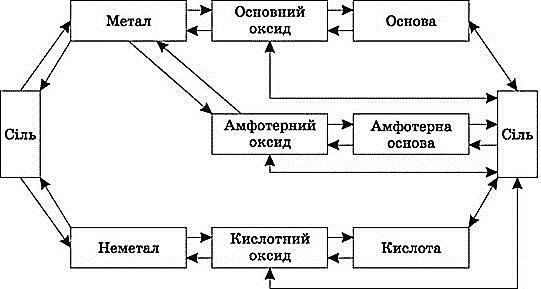
Завдання 2 (робота в парах). Здійсніть перетворення за схемами.
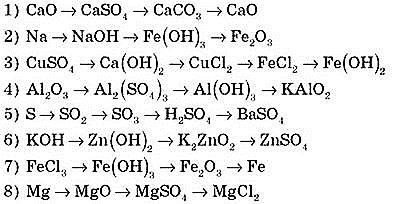
2. Підбиття підсумків заняття
Студенти разом з викладачем перевіряють правильність заповнення схеми, виправляють помилки. Викладач підбиває підсумки заняття, оцінює, заохочує найбільш активних студентів.
3. Домашнє завдання
Повторити основні класи неорганічних сполук.
ТЕМА 1. ПОВТОРЕННЯ ПИТАНЬ КУРСУ ХІМІЇ НЕПОВНОЇ ОСНОВНОЇ ШКОЛИ
Заняття № 3
Дисципліна: «Хімія»
Тема заняття: Теорія електролітичної дисоціації. Електроліти й неелектроліти Мета заняття:
навчальна – пояснити залежність електролітичної дисоціації від будови молекул розчиненої речовини й розчинника; ознайомити учнів з поділом речовин на електроліти й неелектроліти за електропровідністю в розчині або розплаві;
розвиваюча – формувати уявлення студентів про процеси, що
відбуваються в розчинах; ознайомити з поняттям
«електролітична дисоціація»;
виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: засвоєння нових знань
Міждисциплінарний зв’язок: «Екологія», «Біологія» Дидактичне забезпечення: таблиця розчинності, прилад для визначення електропровідності в розчинах, медіа-фрагмент
«Схема дисоціації NaCl і HCl»
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
З курсу природознавства й фізики ми пам’ятаємо, що метали проводять електричний струм.
1. Хто може пояснити, чому ця властивість притаманна металам? (Металевий зв’язок, металеві кристалічні ґратки, вільні електрони в кристалічних ґратках і катіони у вузлах)
2. Який метал має найвищу електропровідність? (Срібло, золото, мідь)
3. Назвіть речовини, що проводять електричний струм (крім металів) і
мають вільні електрони. (Графіт)
4. Чи проводить електричний струм вода? (Так, ні)
ІІІ Мотивація навчальної діяльності
Чому розчини й розплави кислот, основ і солей проводять електричний струм?
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
1.1. Електролітична дисоціація.
1.2. Основні положення ТЕД
2. Підбиття підсумків заняттяї
3. Домашнє завдання
ХІД ЗАНЯТТЯ
1. Вивчення нового матеріалу
Речовини, розчини й розплави яких проводять електричний струм, називаються електролітами. (До них належать усі солі, кислоти, основи, більшість основних оксидів, тобто речовини з іонним і ковалентним полярним типами зв’язку.)
Речовини, розчини й розплави яких не проводять електричний струм, називаються неелектролітами. (Це прості речовини – неметали, речовини немолекулярної будови, більшість органічних речовин.)
1.1. Електролітична дисоціація
Чому розчини й розплави кислот, основ і солей проводять електричний струм?
Необхідно згадати особливості будови молекули H2О (диполь, з ковалентним полярним зв’язком).
У разі потрапляння у воду речовини з іонним зв’язком, наприклад NaCl (переглядаємо медіа-фрагмент – схему дисоціації натрій хлориду), диполі води орієнтуються відносно іонів цієї речовини протилежно зарядженими полюсами. У результаті електростатичної взаємодії між іонами розчиненої речовини й молекулами води відбувається гідратація іонів, що ослабляє зв’язок між ними, який поступово руйнується.
NaCl
![]() Na+
+ Cl-
Na+
+ Cl-
Утворюється два протилежно заряджені гідратовані іони.
Під час розчинення у воді речовин з ковалентним полярним зв’язком процесу дисоціації передує поляризація зв’язку (переглядаємо медіа-фрагмент – схему дисоціації HCl).
HCl
![]() H+ +
Cl-
H+ +
Cl-
Такі уявлення про дисоціацію у водних розчинах сполук сформувалися не відразу. Сванте Арреніус та інші прихильники фізичної теорії назвали цей процес електролітичною дисоціацією.
Електролітична дисоціація – це розпад електролітів на іони в розчині або розплаві.
Основні положення теорії електролітичної дисоціації (ТЕД) сформулював шведський учений Сванте Арреніус у 1887 р., за що в 1901 р. отримав
Нобелівську премію з хімії.
1.2. Основні положення ТЕД
1. Дисоціація електролітів відбувається під дією полярних молекул розчинника.
2. Дисоціація – оборотний процес. Зворотний процес називається
асоціацією.
3. Молекули, що дисоціюють, розпадаються на катіони й аніони,
причому заряд усіх катіонів дорівнює сумарному заряду всіх аніонів.
Під дією електричного струму в розчині виникає спрямований рух йонів: катіонів – до катода, аніонів – до анода.
Уперше припущення, що в розчині відбувається сполучення речовини й розчинника, висловив Д. І. Менделєєв.
Згодом І. О. Каблуков і В. О. Кистяковський об’єднали обидві теорії й показали, що розчинення – складний фізико-хімічний процес.
Розглянемо на прикладах:
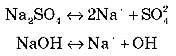
Самостійно запишіть рівняння дисоціації речовин:
2. Підбиття підсумків заняття
Сьогодні ми дізналися, що розчинення – складний процес.
1. Які явища супроводжують розчинення?
2. Чи завжди в розчині протікатимуть усі перелічені процеси?
Розгляньмо це на прикладі трьох речовин:
|
|
NaCl |
C12H22O11 |
H2SO4 |
|
Руйнування ґраток |
+ |
+ |
- |
|
Дифузія |
+ |
+ |
+ |
|
Гідратація |
+ |
+ |
+ |
|
Дисоціація |
+ |
- |
+ |
3. Домашнє завдання
Опрацювати матеріа, відповісти на запитання до нього, виконати вправи.
Написати рівняння дисоціації в розчинах таких речовин:
ü K2SO4;
ü H2SO4;
ü RbOH;
ü BaCl2;
ü HBr;
ü AlCl3.
ТЕМА 2. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Заняття № 4
Дисципліна: «Хімія»
Тема заняття: Загальна характеристика неметалічних елементів. Неметали
як прості речовини. Хімічні властивості неметалів. Сполуки неметалів з гідрогеном та оксигеном Мета заняття:
навчальна – навчитися визначати положення неметалічних елементів в перiодичнiй системі, повторити особливості їх будови, розглянути прості речовини. На прикладі Оксигену i Карбону, ознайомитися з явищем алотропії, показати значення озонового шару для життя живих організмів. Проаналізувати поширення неметалічних елементів у природі та їх застосування. Ознайомитися з фізичними та хімічними властивостями неметалів, показати взаємозв’язок між будовою кристалічних граток та фізичними властивостями неметалів, удосконалити вміння складати рівняння реакцій
розвиваюча – поглибити знання про неметали на прикладі їх сполук з Гідрогеном; розглянути будову, фізичні, хімічні властивості, добування гідроген хлориду та амоніаку; продовжити формувати вміння писати рівняння хімічних реакцій
виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: засвоєння нових знань
Міждисциплінарний зв’язок: «Екологія», «Біологія» Дидактичне забезпечення: таблиця розчинності, прилад для визначення електропровідності в розчинах, медіа-фрагмент
«Схема дисоціації NaCl і HCl»
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань Бесіда:
Яке положення займають неметалічні елементи у періодичній системі елементів?
Яку назву мають неметалічні елементи VI групи головної підгрупи, VII групи головної підгрупи, VIII групи головної підгрупи?
Як змінюються неметалічні властивості елементів у групах, періодах?
Чому?
Яку будову мають прості речовини неметали?
Що таке алотропія? Алотропні видозміни?
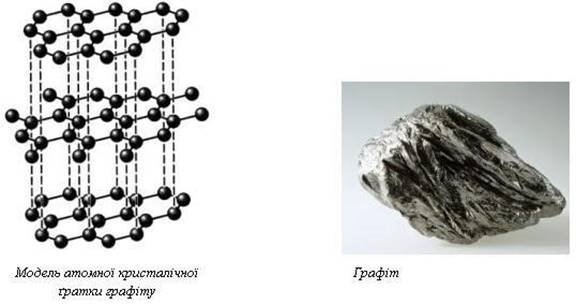
Охарактеризуйте кисень і озон, алмаз і графіт?
Де застосовують неметали?
ІІІ Мотивація навчальної діяльності
1. Визначати положення неметалічних елементів у перiодичнiй системі;
2. Знати особливості будови неметалічних елементів;
3. Вміти писати електроні та графічні формули неметалічних елементів, визначати їх ступені окислення та валентності;
4. Давати характеристику елементу за положенням в періодичній
системі;
5. Знати прості речовини неметали, їх будову;
6. Характеризувати явище алотропії та поширення неметалічних
елементів у природі.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу
2. Неметалічні елементи, розташування в періодичній системі, загальна характеристика
3. Загальна характеристика неметалічних елементів
4. Поняття про алотропію. Озон
5. Роль озону в збереженні життя на Землі.
3. Підсумок заняття.
6. Домашнє завдання
ХІД ЗАНЯТТЯ 1. Вивчення нового матеріалу
1.1. Поширеність у природі.
На нашій планеті неметалічні елементи більш поширені, ніж металічні. Атмосфера складається переважно з азоту і кисню – простих речовин Нітрогену й Оксигену. У повітрі є домішки інертних газів, водяної пари, вуглекислого газу, деяких інших сполук неметалічних елементів.
Основна речовина гідросфери – вода. У ній розчинені гази, які входять до складу повітря, а також солі хлоридної, карбонатної, сульфатної кислот.
У літосфері міститься майже 90 хімічних елементів, однак і в ній більш поширені неметалічні елементи. Вони утворюють велику кількість мінералів

У живих організмах переважають органічні речовини і вода, а це – також сполуки неметалічних елементів.
Поширеність хімічних елементів оцінюють, зіставляючи кількості їхніх атомів.
Відношення кількості атомів елемента до кількості атомів усіх елементів у певному середовищі називають атомною часткою елемента.
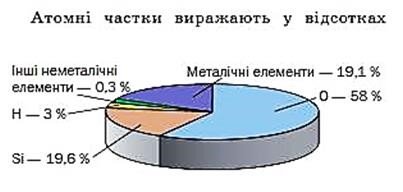
1.2. Атоми і йони.
За електронною будовою зовнішнього енергетичного рівня атомів більшість неметалічних елементів є елементами, а Гідроген і Гелій – з-елементами.
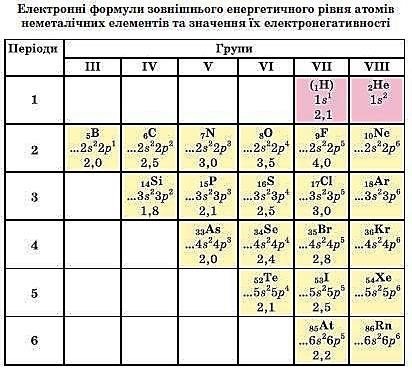
Атоми неметалічних елементів на зовнішньому енергетичному рівні мають, як правило, від 4 до 8 електронів. Майже всі вони можуть приєднувати певну кількість електронів і перетворюватися на негативно заряджені йони – аніони.
Приклад перетворення атома Сульфуру на сульфід-іон:

На зовнішньому енергетичному рівні нової частинки (аніона) перебуває 8 електронів, тобто електронний октет. Проілюструємо розглянуту властивість атомів неметалічних елементів загальною схемою:
![]()
Отже, такі атоми здатні бути окисниками; під час відповідних хімічних реакцій вони зазнають відновлення.
У молекулах багатьох речовин (Н2, СО2, Н2S04, С2Н5ОН та ін.) містяться атоми неметалічних елементів, сполучені ковалентними зв'язками. Хімічний зв'язок такого типу реалізується завдяки утворенню спільних електронних пар із неспарених електронів двох атомів. Ділянки перекривання орбіталей можуть бути рівновіддаленими від ядер атомів (наприклад, у молекулі Н:Н) або зміщеними в бік одного з них (Н:Вг). У першому випадку ковалентний зв'язок є неполярним, а в другому – полярним. Зміщення спільної електронної пари позначають стрілкою або записом зарядів над символами елементів:
![]()
Величину, яка характеризує здатність атома притягувати електрони, називають електронегативністю. Зіставляючи її значення для різних елементів, можна з'ясувати, чи зміщується спільна електронна пара, а якщо зміщується, то до якого атома.
Здатність атомів неметалічних елементів приєднувати електрони або зміщувати їх у свій бік зростає у періоді зліва направо, а в групі – знизу догори. Тому найтиповіший неметалічний елемент перебуває у правому верхньому куті періодичної системи. Це – Флуор.
1.3. Валентність.
Значення валентності хімічного елемента визначається кількістю спільних електронних пар, які утворює його атом з іншими атомами. Вам відомо, що валентні можливості елемента можна передбачити за кількістю неспарених електронів в атомі. Наприклад, в атомі Оксигену – два неспарені електрони, тому він має бути двовалентним.
За наявності вакантних орбіталей зовнішнього енергетичного рівня атоми можуть переходити у збуджений стан. Його позначають зірочками справа від символу елемента. Для атома Бору існує один збуджений стан, для атома Сульфуру можливі два такі стани, а для атома Хлору – три.
Покажемо процес збудження атома Сульфуру за допомогою електронних формул та їх графічних варіантів (у дужках – формули сполук із відповідною валентністю елемента):
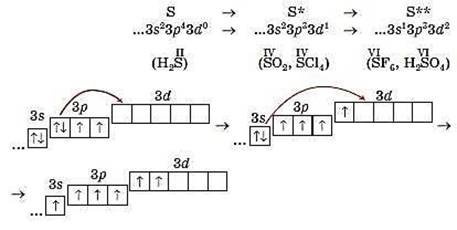
Елементи, атоми яких не бувають у збудженому стані, – Флуор, Оксиген
(вони мають сталу валентність), Нітроген.
1.4. Ступені окиснення.
Вам відомо, що ступінь окиснення елемента – це умовний цілочисельний заряд його атома в речовині. Значення ступенів окиснення неметалічного елемента можна передбачити, враховуючи заряд його простого йона, можливі значення валентності атома і зіставляючи цей елемент з іншими за електронегативністю. При визначенні ступеня окиснення елемента в речовині користуються правилом електронейтральності: сума ступенів окиснення всіх атомів у речовині дорівнює нулю.
Значення ступеня окиснення елемента (без урахування знака) в речовині часто збігається зі значенням його валентності:
![]()
Існують речовини, у яких ступені окиснення елементів відрізняються від значень валентності. Це – прості речовини (крім інертних газів), деякі неорганічні сполуки, багато органічних сполук.
2. Неметалічні елементи, розташування в періодичній системі, загальна характеристика
Скористайтеся фрагментом періодичної системи хімічних елементів Д. І. Менделєєва та ознайомтеся з назвами й символами неметалічних елементів, які зображені на рожевому та жовтому фонах .
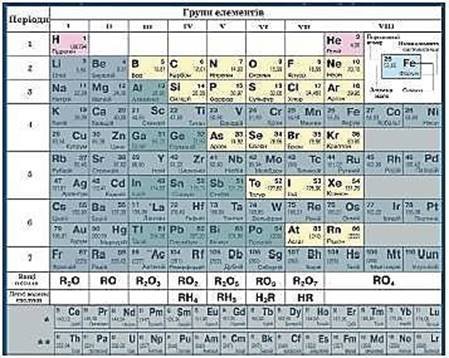
Установіть:
1. Чи властиве неметалічним елементам розміщення на початку періодів? Який виняток існує?
2. Чи властиве неметалічним елементам розміщення в кінці періодів? Який виняток існує?
3. У головних чи побічних підгрупах розміщені неметалічні елементи?
4. Чи є серед неметалічних елементів хоча б один, розміщений у побічній підгрупі?
Після проведеної пошукової діяльності сформулюйте загальний висновок про місце неметалічних елементів у групах, підгрупах, періодах і рядах.
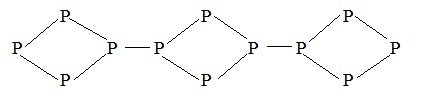
2.1. Особливості будови атомів неметалічних хімічних елементів.
Приклад 1. Неметалічні елементи одного періоду. Неметалічні елементи Бор, Карбон, Нітроген, Оксиген, Флуор і Неон належать до другого періоду періодичної системи хімічних елементів і мають такі електронні та графічні електронні формули атомів:
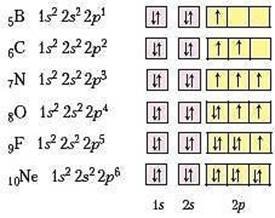
За цими формулами чітко простежується однакова будова першого енергетичного рівня неметалічних елементів другого періоду й поступове збільшення числа електронів на другому (зовнішньому) енергетичному рівні, доки останній елемент Неон не досягне завершеності зовнішнього енергетичного рівня. Починаючи з Нітрогену, в атомах цих хімічних елементів спостерігається поступове зменшення кількості неспарених електронів на зовнішньому енергетичному рівні. Так, атом Нітрогену здатний утворити три спільні електронні пари з іншими атомами, Оксигену – дві, Флуору – одну. В атомі Неону відсутні неспарені електрони, і він не утворює хімічних зв'язків з іншими атомами.
Розглянуті приклади доводять, що атоми неметалічних елементів другого періоду мають по 2 енергетичних рівні, але відрізняються кількістю електронів на зовнішньому енергетичному рівні.
Особливістю атомів неметалічних елементів є те, що кількість електронів на зовнішньому енергетичному рівні збігається з номером групи. Тому без запису електронної формули атома, наприклад, неметалічного елемента VII групи Астату можна з упевненістю сказати, що з 85 електронів його електронної оболонки 7 містяться на зовнішньому енергетичному рівні.
Напишіть електронні й графічні електронні формули неметалічних елементів третього періоду й зробіть висновок, що спільного та чим відрізняється будова електронних оболонок їх атомів.
З вивченого в 9 класі пригадайте, чому в більшості сполук Карбон чотиривалентний, а не двовалентний.
Приклад 2. Неметалічні елементи однієї підгрупи.
Карбон і Силіцій розташовані в IV групі в головній підгрупі періодичної системи хімічних елементів, тобто є елементами однієї групи й підгрупи.
Напишемо електронну та графічну електронну формули атома Силіцію:
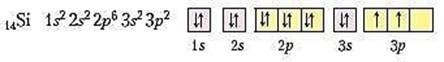
Скористаємося електронною й графічною електронною формулами атома Карбону з прикладу 1 й порівняємо електронні формули атомів цих хімічних елементів. Результати порівняння вказують на те, що електронні оболонки їх атомів відрізняються кількістю енергетичних рівнів, проте на зовнішньому енергетичному рівні в них однакова кількість електронів і вона чисельно дорівнює номеру групи.
Електронні формули атомів Карбону і Силіцію свідчать, що неметалічні елементи IV групи головної підгрупи мають однакову будову зовнішнього енергетичного рівня і кількість електронів на ньому дорівнює половині електронів зовнішнього завершеного восьмиелектронного енергетичного рівня.
Приклад 3. Характеристика неметалічного елемента за будовою атома й розміщенням у періодичній системі.
Хімічний елемент з протонним числом 52 – Телур Те – розташований у періодичній системі хімічних елементів у п'ятому періоді, сьомому ряді, VI групі, головній підгрупі.
Відносна атомна маса 128. Ядро атома має заряд +52 і складається з 52 протонів і 76 нейтронів (128-52=76). Електронна оболонка атома налічує 52 електрони, які розташовані на п'ятьох енергетичних рівнях. На зовнішньому енергетичному рівні є б електронів, тому максимальна валентність Телуру б, максимальний ступінь окиснення +б. Формула вищого оксиду – ТеО3. Оскільки Телур – аналог (так називають елементи однієї підгрупи) Оксигену і Сульфуру.
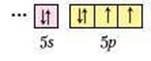
З графічної електронної формули зовнішнього енергетичного рівня бачимо, що для його завершення не вистачає 2 електронів, тому з Гідрогеном Телур утворює сполуку Н2Те.
3. Загальна характеристика неметалічних елементів
3.1. Історичні відомості
Про історію відкриття кисню, молекули якого складаються з елемента Оксигену, ви довідалися ще у 8 класі. Тепер ознайомтеся з деякими історичними відомостями про сірку, що складається з елемента Сульфуру.
Сірка відома людині з давніх-давен. Легендарний давньогрецький поет Гомер, який жив між XII і VIII ст. до н. є. і вважається автором епічних поем «Іліада» і «Одіссея», зазначає, що сірка застосовувалась для куріння під час релігійних обрядів. Вона входила до складу славнозвісного в історії стародавнього світу грецького вогню. Секретом його виготовлення володіли грецькі царі протягом чотирьох віків. У 941 р. під стінами Царграду було знищено флот київського князя Ігоря. Літописець, розповідаючи про цю подію, зазначає, що греки пускали вогонь, ніби блискавку на небі, яка спалювала воїнів Ігоря, через що вони не змогли подолати греків. Про найдавніше знайомство людини з сіркою свідчить і походження її назви (від санскритського слова «сіра», що означає світло-жовтий).
Оксиген і Сульфур – елементи VI групи періодичної системи, входять до складу головної підгрупи.
За положенням, яке займають Оксиген і Сульфур у періодичній системі, обґрунтуйте будову їхніх атомів і запишіть електронні формули.
Санскрит – стародавня мова Індії.
3.2. Електронна будова
Що ж видно з електронних формул Оксигену 1s22s22р4 і Сульфуру
1s22s22р63s23р4.
Вони показують, що в атомах Оксигену і Сульфуру на зовнішньому електронному шарі міститься по 6 електронів (див. підкреслене в електронних формулах) – ns2np4. В атомах Оксигену ці 6 зовнішніх електронів розміщуються на орбіталях двох типів – s i p (одна s- і три р- орбіталі):
8On=2
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
За рахунок двох неспарених р –
електронів атом Оксигену, як правило, утворює два ковалентні зв'язки. При цьому він проявляє ступінь окиснення – 2, наприклад Н2О2 , Fe2О3 2 , H2SО4 2 .
У сполуках з найбільш електронегативним елементом – Флуором Оксиген виявляє позитивний ступінь окиснення, наприклад у фториді оксигену О 2 F2 1 .
Існують сполуки, що містять зв'язок Оксиген – Оксиген (О–О), на приклад пероксид гідрогену Н2О2 або пероксид барію ВаO2. Ступінь окиснення Оксигену в таких сполуках дорівнює, як вважається, –1.
На відміну від Оксигену, який міститься у другому періоді періодичної системи і електрони в його атомах розміщені на двох електронних шарах (а електрони другого шару – на s- і р- орбіталях), Сульфур міститься у третьому періоді. Це означає, що електрони в атомах Сульфуру розміщені на трьох електронних шарах, а електрони третього шару можуть розміщуватись на s-, p- і d- орбіталях (якщо атом перебуває у збудженому стані).
Отже, на відміну від атома Оксигену атом Сульфуру (ізольований, хімічно не зв'язаний) на зовнішньому електронному шарі має вільні орбіталі, на які можуть переходити електрони під час збудження атома, коли із затратою деякої енергії відбувається розпаровування електронних пар для утворення хімічних зв'язків з іншими атомами.
3.3. Історичні відомості
Відкриття азоту N2, молекули якого складаються з елемента Нітрогену N. приписують шотландському вченому Даніслю Резерфорду, який у 1772 р., досліджуючи частину повітря, що залишилася під дзвоном, декілька днів жила миша, встановив, що це «повітря» не підтримує ні дихання, ні горіння. Він вважав, що воно насичене флогістоном, і назвав його «отруйним повітрям».
Майже у цей самий час азот добули К. Шеєле, Дж. Прістлі, Г. Кавендіш. Проте всі ці видатні вчені були переконаними прихильниками теорії флогістону і з ним пов'язували властивості «отруйного повітря». Лише А. Лавуазьє, який вів наступ на флогістон, у 1776 р. дослідив цей газ і довів, що він є простою речовиною, а згодом і запропонував для нього назву азот – «безжиттєвий» (від грец. слів «а» – заперечення і «зое» – життя).
Фосфор було відкрито у 1669 р. Хеннінгом Брандом, алхіміком з Гамбурга, який намагався відшукати філософський камінь, за допомогою якого старі люди нібито молодшають, хворі видужують, а неблагородні метали перетворюються на золото. Під час одного з дослідів X. Бранд випарив сечу, залишок змішав з вугіллям та піском і продовжував випарювати. Невдовзі у колбі утворилася речовина, що світилася у темряві (фосфор – від грец. світлоносний).
Нітроген і Фосфор – типові елементи V групи періодичної системи, належать до головної підгрупи.
3.4. Електронна будова
Електронні формули Нітрогену 1s22s22p3 і Фосфору 1s22s22p63s23p3
показують, що в їхніх атомах на зовнішньому електронному шарі міститься по 5 електронів. В атомі Нітрогену вони розміщені на орбіталях у такий спосіб:
7Nn=2
s p
|
↓ |
|
|
|
Ступінь окиснення Нітрогену в сполуках може бути від -3 (коли атом відтягує 3 електрони від атома менш електронегативного елемента) до +5 (коли 1, 2, 3, 4 або всі 5 валентних електронів відтягуються до атомів більш електронегативних елементів, ніж Нітроген).
Атом Фосфору має подібну електронну будову зовнішнього електронного шару:
15Pn =3
s p d
|
↓ |
↑ |
|
|
|
|
|
|
|
|
основний стан атома
Відмінність полягає у тому, що в атомі Фосфору на зовнішньому електронному шарі є вільні d-орбіталі, це дає можливість йому переходити у збуджений стан (порівняйте з Сульфуром):
15P n = 3
s p d
|
↓ |
↑ |
|
|
|
|
|
|
|
|
збуджений стан атома
Згідно з кількістю неспарених електронів у основному і збудженому станах атом Фосфору в сполуках може виявляти ступені окиснення -3, +3,+5.
Елемент Нітроген у вільному стані існує у формі простої речовини – азоту. Молекула азоту двохатомна N2. Атоми Нітрогену об'єднуються один з одним за допомогою трьох електронних пар і утворюють міцний потрійний зв'язки (три ковалентні зв'язки):
:N. + .N: → :N = N:
Утворення фосфором кількох алотропних форм пояснюється різним розміщенням атомів один відносно одного у кристалічних ґратках.
У природі Нітроген зустрічається як у вільному стані, так і у зв'язаному. У вільному стані Нітроген у вигляді азоту входить до складу повітря (об'ємна частка N2 становить 78 %, масова – 75,6 %). Оскільки азот з повітря витрачається мало, його запаси в атмосфері залишаються сталими. У вигляді неорганічних сполук Нітроген у невеликих кількостях є в ґрунті. Проте у вигляді складних органічних сполук – білків – він увіходить до складу всіх живих організмів, беручи участь у їх життєдіяльності.
На відміну від Нітрогену Фосфор зустрічається в природі тільки в сполуках. Найважливіші мінерали, до складу яких уходить фосфат кальцію Са3(РО4)2, – це фосфорити и апатити. Найбільше у світі родовище апатитів на Кольському півострові у Хібінських горах.
В Україні родовища фосфоритів зустрічаються у Придністров'ї, на Харківщині, в Чернігівській та Запорізькій областях.
Елемент Фосфор–важлива складова частина організму людини, тварин і рослин. З рослин найбагатші на Фосфор бобові, соняшник і горіхи. В організмі людини Фосфор виявлений в усіх тканинах, особливо у нервовій і кістковій. Він входить до складу деяких ферментів, міститься в зубах, фосфор – життєво важливий елемент для всіх організмів.
3.5. Історичні відомості
Ім'я першовідкривача вуглецю, що «гадається в основному з Карбону, невідоме. Невідомо й те, яка з алотропних форм Карбону – алмаз чи графіт – була відкрита раніше. Історія використання людиною цієї речовини сягає у глибочінь століть, у доісторичні часи. Напевно твердити можна лише те, що до алмазу й графіту людина вже знала вугілля. А визнання Карбону хімічним елементом сталося лише у 1775 p., завдяки роботам французького вченого А. Лавуазьє.
Силіцій, незважаючи на велику поширеність його у природі, відкрили порівняно пізно. У 1811 р. французькі хіміки Ж. Л. Гей-Люссак і Л. Ж. Тенар добули чистий силіцій (проста речовина, що складається з елемента Силіцію). Новий елемент назвали Силіцієм (від лат. silex – кремінь), що означає «камінь, який дає вогонь». Так назвали твердий камінь, що під час удару викресав іскру.
Тривалий час його використовували замість сірників для добування вогню.
Карбон і Силіцій – типові елементи IV групи періодичної системи, належать до головної підгрупи.
3.6. Електронна будова
Електронні формули Карбону 1s22s22p2 і Силіцію 1s22s22p63s23p2 показують, що в їхніх атомах на зовнішньому електронному шарі міститься по 4 електрони.
Вони розміщені на орбіталях у такий спосіб:
6Сn=2
s p
|
↓ |
↑ |
↑ |
|
|___________↑
Зверніть увагу: в атомах Карбону і Силіцію на зовнышньому електронному шарі є вільна p-орбіталь. Тому один s-електрон зовнішнього шару під час збудження атома може переходити на цюp-орбіталь (збуджений стан атома):
6С*n = 2
s p
|
|
↑ |
↑ |
|
14Si*n = 3
s p d
|
↑ |
↑ |
↑ |
↑ |
|
|
|
|
|
Згідно з такою електронною будовою атомів елементи Карбон і Силіцій виявляють у сполуках ступінь окиснення-4, +2, +4.
4. Поняття про алотропію. Озон
Хімічні елементи у вільному стані існують у формі простих речовин. Так, елемент Оксиген утворює дві прості речовини – кисень О2 та озон О3.
Озон. Якщо на кисень подіяти електричним розрядом, то з'являється характерний запах свіжості – утворюється газуватий озон:
3О2 →2О3;ΔH=283,6 кДж.
Кисень поглинає енергію і перетворюється на озон, а озон самовільно розкладається, утворюючи кисень.
Обидві прості речовини – кисень О2 і озон О3 – утворені одним і тим самим хімічним елементом – Оксигеном, а властивості у них різні.
Явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою, називається алотропією, а самі прості речовини – алотропними формами (модифікаціями).
Отже, кисень О2 і озон О3 – алотропні форми елемента Оксигену.
Порівняння властивостей кисню О2 й озону О3 засвідчує, що окисна активність озону вища, ніж кисню. Наприклад, вже за звичайних умов він окиснює багато які малоактивні прості речовини (срібло, ртуть тощо):
8Ag+2О3=4Ag2О+О2↑
|
Властивості простих речовин |
Прості речовини кисень |
Прості речовини озон |
|
Агрегатний стан за звичайних умов |
Газ |
Газ |
|
Колір |
Безбарвний |
Синій |
|
Запах |
Без запаху |
Різкий, своєрідний |
|
Розчинність (у 100 об'ємах Н2О при 20ºС) |
3 об'єми |
49 об'ємів |
|
Густина газу за н. у. |
1,43 г/л |
2,14 г/л |
|
Температура кипіння |
-193°С |
-112°С |
|
Температура плавлення |
-219°С |
-192°С |
|
Фізіологічна дія |
Неотруйний |
Дуже отруйний |
|
Хімічні властивості |
Окисник |
Дуже сильний окисник |
|
Реакційна здатність |
Висока |
Дуже висока |
Підвищена окисна здатність озону (порівняно з киснем) пояснюється низькою енергією відриву атома Оксигену від молекули озону 03, і в реакціях окиснення беруть участь саме ці атоми Оксигену.
Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральних масел; як дезінфікуючий засіб у медицині; як окисник ракетного палива.
Фізіологічна дія озону: він отруйний для людини, тварин і рослин. Невеликі концентрації озону в повітрі створюють відчуття свіжості, але вдихання повітря навіть із зовсім малою концентрацією озону викликає подразнення дихальних шляхів, кашель, блювоту, запаморочення, стомленість. Проте озон може бути не лише шкідливим, а й корисним.
5. Роль озону в збереженні життя на Землі.
Біля поверхні Землі озону мало. Його концентрація у повітрі коливається (вночі менша, вдень більша). Влітку і навесні його в повітрі у 3,5 рази більше, ніж узимку і восени. Над полярними частинами Землі вміст озону в повітрі вищий, ніж над екватором, в атмосфері міст – вищий, ніж у сільській місцевості. 3 віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20 – 25 км. Там утворюється так званий озоновий шар.
Озоновий шар відіграє значну роль у збереженні життя на нашій планеті. Він затримує найбільш згубну для людини, тварин і рослин частину ультрафіолетової радіації Сонця, яка спричинює онкологічні (ракові) захворювання шкіри. Окрім того, озоновий шар разом з вуглекислим газом С02 поглинає інфрачервоне випромінювання Землі і тим самим запобігає її охолодженню. Так озоновий шар забезпечує збереження життя на Землі.
Виникає запитання, звідки ж береться озон в атмосфері і як саме він захищає нас.
Озон утворюється у верхніх шарах атмосфери внаслідок поглинання киснем ультрафіолетового випромінювання Сонця:
О2+hv→О+О
О+О2→О3
Крім того, поглинаючи променисту енергію Сонця (фотони), молекули кисню переходять у збуджений стан і під час дальшої взаємодії зі звичайним киснем також утворюють озон. Озон, що утворився, огортає Землю з усіх боків. Але молекули озону існують недовго. Відбувається зворотна реакція фотохімічного розкладу озону, яка, власне, являє собою поглинання озоном фотонів: О3+hv→О2+О
Отже, в атмосфері існує цикл озону – збалансовані утворення і розклад його. Результатом існування цього циклу є перетворення ультрафіолетового випромінювання Сонця на теплову енергію. Але для нас головна «заслуга» озону полягає в тому, що він, «жертвуючи собою», поглинає ультрафіолетове випромінювання і тим самим не допускає високоенергетичні фотони Сонця до Землі.
Озоновий шар не є стабільним. Він може самовільно то збільшуватись, то зменшуватись над певною місцевістю по кілька разів на рік. Під впливом природних факторів (фото-хімічного розкладу, виверження вулканів, значного переміщення великих повітряних мас), а більшою мірою під впливом забруднення навколишнього середовища він зазнає руйнування, внаслідок чого утворюються так звані «озонові дірки», які збільшують ультрафіолетове навантаження на все живе на Землі.
Причиною техногенного руйнування озонового шару є забруднення атмосфери оксидами нітрогену, наявність яких у 20 разів збільшує токсичність озону. Так, масове викидання в атмосферу вихлопних газів реактивних літаків, що містять оксиди нітрогену, руйнує озоновий шар. Окрім того, використання хлоро- і флуоровмісних речовин (фреонів) у холодильних машинах також спричинює руйнування озонового шару. Адже фреони, якщо потрапляють в атмосферу, реагують лише з озоном, бо відносно інших речовин вони інертні. Внаслідок цього над місцевістю може утворитися «озонова дірка».
Над Україною (окрім південної частини) загальний вміст озону за останні 20 років зменшився на 6 %, і утворилася і аномальна зона. Вам про це слід пам'ятати! Особливо небезпечна «озонова дірка» влітку. У цей період дуже потерпають очі, тому треба користуватися сонцезахисними окулярами. Варто утримуватися і від загару, щоб не зашкодити шкірі.
Алотропія кисню й озону зумовлена різною кількістю атомів Оксигену в молекулах речовин – О2 і О3.
Проте буває й інша причина алотропії – різна структура кристалів. З таким типом алотропії ви ознайомитеся на прикладі сірки.
Сірка за звичайних умов – крихка кристалічна речовина жовтого кольору. Погано проводить теплоту і не проводить електричного струму. У воді не розчиняється, краще розчиняється в деяких розчинниках (у сірковуглеці CS2, бензині, ефірі та ін.).
І в розчинах, і в кристалах сірка складається з циклічних молекул S8, які за формою нагадують корону. Але в кристалах ці молекули можуть бути упаковані по-різному.
Якщо молекули розташовані щільно, утворюється алотропна форма ромбічна сірка. Менш щільне упакування молекул спричинює виникнення іншої алотропної форми – моноклінної сірки.
Різна будова кристалів ромбічної і моноклінної сірки зумовлює різні їхні фізичні властивості.
Якщо сірку розплавити і швидко охолодити, утворюється ще одна алотропна форма: пластична сірка – коричнева гумоподібна маса. Їй можна надати будь-якої форми, навіть розтягнути в нитку. Ця властивість пластичної сірки пояснюється тим, що вона не містить молекул S8, а складається з довгих ланцюжків атомів Сульфуру. Ці ланцюжки безладно переплутані між собою. Під час розтягування вони розпрямляються, а якщо випустити – знову скручуються. Цим пояснюється еластичність даної форми. Але пластична сірка дуже нестійка, швидко загусає, твердне, стає крихкою і перетворюється на ромбічну.
Отже, у сірки є дві основні алотропні форми: ромбічна і моноклінна. Обидві вони складаються з молекул S8, a різняться кристалічною будовою.
|
Властивості простих речовин |
Сірка ромбічна |
Сірка моноклінна |
|
Колір |
Лимонно-жовтий |
Блідо-жовтий, майже безбарвний |
|
Густина |
2,07 г/см3 |
1,96 г/см3 |
|
Температура плавлення |
112,8 °С |
119,3 °С |
У природі зустрічаються найбільш стійкі алотропні форми. Так, до складу земної атмосфери входить кисень, бо його молекули стійкіші, ніж молекули озону.
Сірка зустрічається в природі у вільному стані (самородна сірка), а також у вигляді різних сполук – сульфідів металів, сульфатів тощо.
6. Підсумок заняття.
7. Домашнє завдання
Опрацювати матеріал
відповідного параграфа, дати відповіді на запитання до нього, виконати вправи.
ТЕМА 2. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Заняття № 5
Дисципліна: «Хімія»
Тема заняття: Сульфур, його властивості, сполуки та їх застосування Мета заняття:
навчальна – знати характеристику елементів VІ групи головної підгрупи
(ІІ рівень засвоєння); фізичні та хімічні властивості сірки
розвиваюча – розвивати навики добування, сірки (ІІ рівень засвоєння); виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: засвоєння нових знань
Міждисциплінарний зв’язок: «Екологія», «Біологія» Дидактичне забезпечення: таблиця розчинності, прилад для визначення електропровідності в розчинах, медіа-фрагмент
«Схема дисоціації NaCl і HCl»
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
ІІІ Мотивація навчальної діяльності
Активізація розумової діяльності студентів на заняттях з хімії за допомогою комп’ютерних візуальних засобів.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу
2. Підведення підсумків заняття
3. Домашня робота
ХІД ЗАНЯТТЯ
1. Вивчення нового матеріалу
Сульфур – дивовижний хімічний елемент. Сірка відома людині із сивої давнини. Згадки про неї можна знайти в міфах. Легендарний давньогрецький поет Гомер, що жив між XII та XIII ст. до н. є., автор епічних поем «Іліада» та «Одіссея» зазначає, що сірка використовувалася для куріння в релігійних обрядах.
Сульфур входить до складу відомого в історії стародавнього світу «грецького вогню». Грецькі царі володіли секретом його виготовлення впродовж чотирьох століть.
1.1. Сульфур(ІV) оксид
Сульфур утворює два оксиди – сульфур(ІV) оксид і сульфур(VІ) оксид. Найбільше значення серед сполук Сульфуру зі ступенем окиснення +4 має сульфур(ІV) оксид (сульфур діоксид, сірчистий газ) SO2. Має молекулярні кристалічні ґратки. У його молекулі Сульфур утворює чотири ковалентні зв’язки:
1.2. Фізичні властивості і фізіологічна дія
Сульфур(ІV) оксид – безбарвний газ з різким задушливим запахом, отруйний. Тяжчий за повітря більш як удвічі. Добре розчиняється у воді. В одному об’ємі води розчиняється 40 об’ємів S02.
Сульфур(ІV) оксид – дуже токсична речовина, це один з найбільш небезпечних забруднювачів навколишнього середовища. Він потрапляє в повітря при спалюванні вугілля, окисненні сульфідних руд. У повітрі він взаємодіє з водяними парами, утворюючи сульфітну кислоту, яка разом з продуктом її окиснення – сульфатною кислотою – спричиняє появу кислотних дощів. Кислотні дощі негативно впливають на рослинний світ, викликають низку захворювань у живих істот, руйнують будівельні споруди.
1.3. Добування сульфур(ІV) оксиду Лабораторні способи:
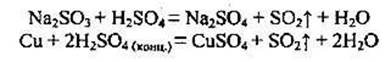
Промислові способи:
• спалювання сірки:
![]()
• випалювання піриту:
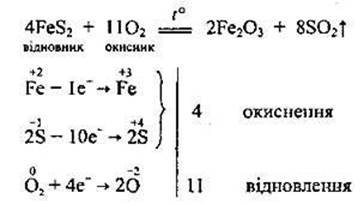
1.4. Хімічні властивості сульфур(ІV) оксиду
Сірчистий газ – це типовий кислотний оксид, якому відповідає сульфітна кислота.
1. Виявляє загальні властивості кислотних оксидів. Він взаємодіє з водою, утворюючи сульфітну кислоту, з основними та амфотерними оксидами, з основами, утворюючи два типи солей: кислі (гідрогенсульфіти) та середні (сульфіти):
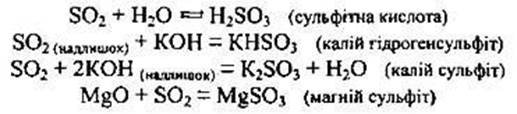
2. Сірчистий газ виявляє властивості як окисника, так і відновника. Ступінь окиснення Сульфуру в SO2 є проміжним (+4), а тому сульфур(ІV) оксид може бути і відновником, і окисником, а також може диспропорціонувати:
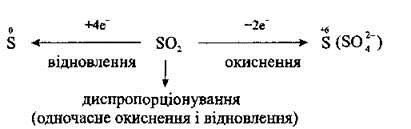
Реагуючи із сильнішими окисниками, SO2 виявляє відновні властивості:
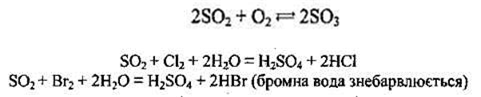
Реагуючи із сильним відновником, SO2 стає окисником:
![]()
Сірчистий газ диспропорціонує, якщо його пропустити крізь гарячий концентрований розчин лугу:
![]()
Відновні властивості в сульфур(ІV) оксиду виражені яскравіше.
1.5. Застосування
Сірчистий газ використовують для добування кальцій гідрогенсульфіту, який застосовують при переробці деревини на целюлозу. Сульфур(ІV) оксид необхідний для відбілювання текстильних виробів, знищення шкідників, щоб зберегти овочі і фрукти від плісняви і гнилісних мікробів. У значних кількостях сірчистий газ використовують для добування сульфатної кислоти. Також його використовують у текстильній промисловості для вибілювання тканин.
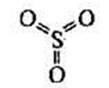
Сульфур(VІ) оксид (сульфур триоксид, сірчаний ангідрид) SO3 – це вищий оксид Сульфуру.
1.6. Фізичні властивості та фізіологічна дія
За стандартних умов – це безбарвна летка рідина з різким запахом, яка складається із циклічних тримерів (SO3)3. Це токсична речовина, яка уражає слизові оболонки і дихальні шляхи. За температури 16,8 °С твердне і перетворюється на прозору кристалічну масу. Окремі молекули в газоподібному стані мають форму плоского правильного трикутника. Усі атоми розміщені в одній площині. Валентні кути становлять 120°:
Добування сульфур(VІ) оксиду Лабораторні способи:
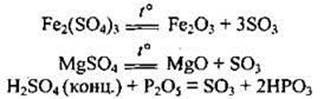
Промисловий спосіб (каталізатори — Pt, V2O5):
![]()
1.7. Хімічні властивості сульфур(VІ) оксиду
Сульфур(VІ) оксид виявляє загальні властивості кислотних оксидів:
енергійно:реагує з водою, взаємодіє з основними та амфотерними оксидами, а також з гідроксидами, утворюючи кислі або середні солі:
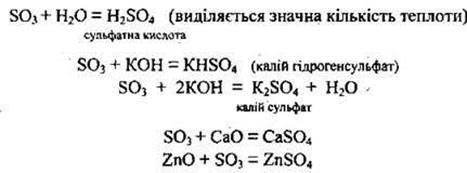
Сульфур(V) оксид розчиняється в безводній сульфатній кислоті, утворюючи олеум. Зазвичай олеум містить 18-20 % SO3 (іноді до 60 %).
![]()
Олеум містить і піросульфатні кислоти:
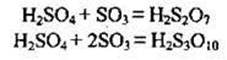
Сульфур(VІ) оксид виявляє сильні окисні властивості, тому що Сульфур у цій сполуці має максимальний ступінь окиснення:
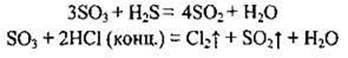
6. Підсумок заняття.
7. Домашнє завдання
Опрацювати конспект
ТЕМА 2. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Заняття № 6
Дисципліна: «Хімія» Тема заняття: Нітроген і фосфор, їх місце в ПСХЕ, фізичні властивості. Алотропні видозміни. Фізичні і хімічні властивості азоту і фосфору, взаємодія з елементами, оксисеном і гідрогеном Мета заняття:
навчальна – ознайомити студентів із поширення в природі та фізичними властивостями сполук Нітрогену та Фосфору (β=І); розібрати та обґрунтувати хімічні властивості азоту та фосфору, як простих речовин, а також основних їх сполук
(β=ІІ);
розвиваюча – розширити знання студентів про біологічну роль та галузі застосування азоту та фосфору, а також їх сполук (β=І)
виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: засвоєння нових знань
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: таблиця хімічних елементів
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
ІІІ Мотивація навчальної діяльності
Активізація розумової діяльності студентів на заняттях з хімії за допомогою комп’ютерних візуальних засобів.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Азот.
3. Фосфор.
4. Підведення підсумків заняття.
5. Домашня робота.
ХІД ЗАНЯТТЯ
1. Вивчення нового матеріалу
До VА групи періодичної системи належать два типових елементи - азот N і фосфор Р, а також три їх електронні аналоги - елементи великих періодів: миш'як As, сурма Sb і вісмут Ві. Елементи VА групи на зовнішньому енергетичному рівні містять п'ять електронів пs2np3 .Наявність валентних d-орбіталей у атомів елементів, крім азоту, обумовлює можливість переходу s-електронів на dпідрівень, завдяки чому ці елементи виявляють валентність 5, яка відповідає номеру групи. У своїх сполуках елементи VА групи мають широкий діапазон ступенів окиснення від -3 до +5.
У межах VА групи розміри атомів та іонів зростають, енергії іонізації закономірно зменшуються. Неметалічні властивості зверху донизу зменшуються, а металічні збільшуються.
2. Азот
Азот – перший р-елемент VА Групи. У перекладі з грецької «азот» означає «нежиттєдіяльний». Таку назву азот одержав за нездатність підтримувати горіння органічних речовин. Для життєдіяльності живих і рослинних організмів азот насправді дуже важливий – він входить до складу білкових речовин, без яких неможливе існування.
На зовнішньому енергетичному рівні атом азоту містить 5 електронів, які розміщуються на чотирьох валентних орбіталях 2s2, 2p1x, 2p1y, 2p1z. Внаслідок відсутності d-підрівня азот не може переходити у збуджений стан. У зв'язку з цим максимальна валентність азоту в сполуках дорівнює чотирьом.
Ступінь окиснення азоту в його сполуках змінюється у широких межах від – 3 до +5.
У більшості сполук азоту хімічний зв'язок між атомами ковалентний, тому ступінь окиснення азоту та його валентність не співпадають.
2.1. Поширення в природі та одержання азоту
Основна маса азоту зосереджена її в атмосфері у вигляді простої речовини (78 об. часток, %). Зв'язаний азот утворює мінерали у формі нітратів: чилійська NаNО3, індійська К, і норвезькаСа(NО3)2 селітри. Крім того азот входить до складу білкових тіл усіх рослинних і тваринних організмів.
В техніці азот отримують фракційною перегонкою рідкого повітря.
У лабораторії азот одержують нагріванням суміші розчинів хлориду амонію і нітриту натрію. Спочатку як проміжний продукт утворюється нітрит амонію. Це термічне нестійка сполука, яка при подальшому нагріванні розкладається:
NH4Cl + NaNO2 = NH4NO2 + NaCl
NH4NO2 → N2↑ + 2H2O
Азот можна одержати також іншими методами:
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O,
2NH3 + 3CuO → N2 + 3Cu + 3H2O, 2NaN3 → 3N2 + 2Na.
2.2. Фізичні та хімічні властивості
Азот – безбарвний газ, який не має ні смаку, ні запаху. Він погано розчиняється у воді та органічних розчинниках.
Потрійний зв'язок між атомами у молекулі N2 виключно міцний, його енергія дисоціації дорівнює 946 кДж/моль.
Внаслідок міцності молекули азот хімічно малоактивний, при кімнатній температурі реагує лише з літієм, утворюючи нітрид літію Li3N:
6Li + N2 = 2Li3N
Активність азоту зростає з підвищенням температури. При високих температурах і у присутності каталізаторів азот взаємодіє з неметалами: киснем, воднем, галогенами та ін.
Використовують азот головним чином для промислового одержання аміаку, азотної кислоти, а також як хімічно інертний газ для заповнення балонів електроламп, як середовище для перекачки нафтопродуктів та проведення хімічних синтезів, які потребують особливих умов.
При проведенні деяких хірургічних операцій методом кріотерапії використовують рідкий азот, який зберігають у посудині Дьюара.
2.3. Водневі сполуки азоту
Азот утворює декілька сполук з воднем, з яких найбільше значення має аміак. У молекулі аміаку атомні орбіталі азоту знаходяться у sp3 - гібридизованому стані та утворюють три s-зв'язки з трьома атомами водню, які займають три вершини тетраедра. Четверта першина містить неподілену електронну пару азоту.
У промисловості одержують аміак прямим синтезом з азоту та водню:
N2 + 3H2 → 2NH3
Реакцію проводять при температурі 450—500 °С і тиску ≈ 30 МПа у присутності залізного каталізатора, активованого оксидами (Аl2O3, К2О та ін.).
У лабораторії його одержують нагріванням суміші хлориду амонію з гідроксидом кальцію:
2NH4Cl + Ca(OH)2 = 2NH3↑ + 2H2O + CaCl2
За звичайних умов аміак безбарвний газ з різким специфічним запахом. При вдиханні значних кількостей аміаку відбувається подразнення слизових оболонок очей та органів дихання. Аміак майже у 1,7 раза легший за повітря, 1 л його має масу 0,77 г. При охолодженні до —33,4°С аміак скраплюється, а при —77,8 °С твердіє. Перевести у рідкий стан аміак можна і при звичайній температурі, але при високому тиску. Легкість переходу газоподібного аміаку в рідкий стан пояснюється полярністю зв'язків N—Н в його молекулі і дією міцних міжмолекулярних водневих зв'язків.
Завдяки значній полярності молекул рідкий аміак є відмінним неводним розчинником. Так, у рідкому аміаку добре розчиняються лужні та лужноземельні метали, фосфор, йод, сірка, більшість солей і кислот.
Аміак — полярна речовина, тому він чудово розчиняється у полярному розчиннику — воді. При 0 °С один об'єм води поглинає 1200 об'ємів газоподібного аміаку. Легка розчинність аміаку у воді пояснюється міцними водневими зв'язками, які утворюються за донорно-акцепторним механізмом:
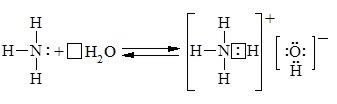
Утворені при цьому гідроксид-іони обумовлюють лужне середовище розчину. Виходячи з низької константи дисоціації, можна сказати, що гідрат аміаку NH3 H2O це слабка основа:
NН3 + Н2О ↔ NН3 · Н2О ↔ NН4+ + ОН-
Рівновага дисоціації гідрату аміаку значно зміщена ліворуч. Тому говорити про існування іонної сполуки NН4ОН (гідроксиду амонію) не можна.
Концентрований водний розчин аміаку містить 25 % (мас.) NH3 і має густину 0,91 г/см3.
У хімічному відношенні аміак досить активний. Оскільки азот у NH3 має нижчий ступінь окиснення —3, аміак виявляє тільки відновні властивості. На повітрі аміак не горить, але в атмосфері кисню він окиснюється до вільного азоту:
4NH3 + 3O2 = 2N2 + 6H2O
У присутності платинового каталізатора окиснення аміаку перебігає до оксиду азоту (ІІ):
4NН3 + 5О2 = 4NО + Н2О
Аміак виявляє відновні властивості також у реакціях з іншими окисниками.
Так, розчин аміаку при нагріванні знебарвлює розчин перманганату калію:
2NН3 + 2КМnО4 = N2 + 2МnО2 +2КОН + 2Н2О
-6е + 2NН3 + 6ОН- ↔ 2N2 + 6Н2О 1
+3е + МnО4- + 2Н2О ↔ МnО2 + ОН- 2
2NН3 + 6ОН-+ 2МnО4- + 4Н2О ↔ N2 + 6Н2О + 2МnО2 + 8ОН-
Крім реакцій окиснення аміак вступає в реакції заміщення. Відомі похідні NH3, в яких атоми водню заміщені на метал, галоген, групу ОН або органічний залишок.
При розчиненні в NH3 лужних металів утворюються відповідні аміди:
2Nа + 2NH3 → 2NаNН2 + Н2↑ амід натрію
При нагріванні деяких речовин в атмосфері азоту утворюються іонні нітриди (Mg3N2, Mn3N2) та нітриди, в яких зв'язок близький до ковалентного (ВN, Si3N4 та ін.).
Аміди лужних металів і нітриди, які утворені активними металами при кімнатній температурі, гідролізуються:
NaNH2 + H2O ↔ NaOH + NH3
Mg3N2 + 6H2O ↔ 3Mg(OH)2 + 2NH3
Неподілена електронна пара азоту надає молекулі аміаку властивості донора. Тому аміак, як ліганд середнього поля, утворює комплексні сполуки, які називають аміакатами. Наприклад: [Ag(NH3)2]OH, [Cu(NH3)4]SO4, [Со(NH3)6]С12.
Одна з найважливіших властивостей аміаку – здатність утворювати солі амонію. При взаємодії аміаку з протоном утворюється іон амонію NH4+. Як і в молекулі NH3, в іоні амонію атомні орбіталі азоту знаходяться у стані sр3гідридизації та утворюють чотири рівноцінні зв'язки, один з яких утворений за донорно-акцепторним механізмом:
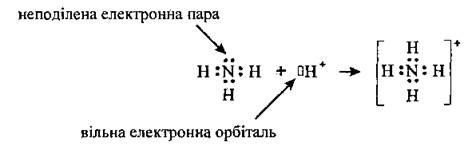
З аніонами кислот іон амонію утворює тверді кристалічні добре розчинні речовини – солі амонію: NH4Cl - хлорид амонію, ((NH4)2SO4– сульфат амонію, NH4NO3 – нітрат амонію.
Особливістю солей амонію, порівняно із солями лужних металів, є їх низька термічна стійкість і леткість ряду солей. Продукти термічного розкладу солей амонію визначаються природою аніона. Якщо сіль амонію утворена кислотою неоkисником, її нагрівання не супроводжується окиснювально-відновними реакціями. При підвищеній температурі хлорид амонію дисоціює оборотне:
NH4Cl → NH3 + HCl
утворюючи леткі продукти NH3 і НС1, які при охолодженні знову стають NH4Cl.
Реакція розкладання карбонату та гідрокарбонату амонію може відбуватися навіть при кімнатній температурі:
(NH4)2CO3 → 2NH3 + H2O + CO2
Гідрокарбонат амонію NH4HCO3 використовують в хлібопекарстві. Його застосування засновано на тому, що при незначному нагріванні одержують NH3 і СО2, які розпушують тісто.
Не супроводжується окиснювальними реакціями і нагрівання гідрофосфатів амонію:
(NH4)2HPO4 → 2NH3 + H3PO4
NH4H2PO4 → NH3 + H2O + HPO3
Якщо сіль амонію утворена кислотою окисником, має місце окиснювання азоту катіона амонію, наприклад:
NH4NO3 → N2O + 2H2O NH4NO2 → N2 + 2H2O
Солі амонію є сильними електролітами, в розчинах вони дисоціюють на катіони амонію та кислотні залишки. При цьому внаслідок гідролізу катіона
NH4+ їх розчини мають кислу реакцію:
NH4Cl → NH4+ + Cl- NH4+ + H2O → NH3 + H3O+ Крім NH3 відомі дві інші водневі сполуки азоту – гідразин N2H4 і гідроксиламін NH2ОН. Обидві ці речовини важливі як для неорганічної, так і органічної хімії.
Гідразин N2H4 формально можна розглядати як продукт заміщення одного з атомів водню в молекулі аміаку на групу NH2. Одержують гідразин дією на водний розчин аміаку гіпохлориту натрію. При цьому як проміжний продукт утворюється хлорамін NH2Cl:
NH3 + NaClO = NH2Cl + NaCl
Хлорамін з надлишком аміаку утворює гідразин:
NH2Cl + NH3 + NaOH = H2N – NH2 + NaCl + H2O
Безводний гідразин N2H4 - димуча рідина з температурою кипіння 114 °С.
Гідразин має кутову будову та може бути представлений схемою:
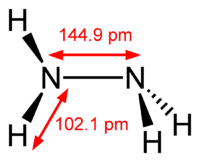
Кожний атом азоту в молекулі гідразину містить неподілену пару електронів. Тому гідразин може утворювати ковалентні зв'язки за донорноакцепторним механізмом з утворенням солей гідразинію:
NH2 – NH2 + H2O = [NH2 – +NH3]OH- гідроксид гідразинію NH2 – NH2 + HCl = [NH2 – +NH3]Cl- хлорид гідразинію
Для протонування другого атома азоту гідразину необхідно створити в розчині надлишок сильної кислоти:
[NH2 – +NH3]Cl- + HCl = [+NH3 – +NH3][Cl-]2 дихлорид гідразинію
Звичайними солями гідразинію є хлорид гідразинію NH2NH2 • НС1 і сульфат гідразиніюNH2NH2 · H2SO4.
У фармацевтичній практиці використовують гідразин гідрат NH2NH2· Н2О як відновник, а також для одержання біологічно активних похідних карбонових кислот-гідразидів.
У зв'язку з тим, що в гідразині азот знаходиться в проміжному ступені окиснення (-2), гідразин виявляє окиснювально-відновну двоїстість з перевагою відновної активності:
5N2H4 + KMnO4 + 6H2SO4 = 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
-4e + N2H4 → N2 + 4H+ 5
+5e + MnO4- + 8H+ → Mn2+ + 4H2O 4
5N2H4 + 4MnO4- + 32H+ → 5N2 + 20H+ + 4Mn2+ + 16H2O
Відновити гідразин до NH3 можна лише сильними відновниками, наприклад, Sn2+, Zn:
Zn + N2H4 + 4HCl → 2NH4Cl + ZnCl2
Гідроксиламін NН2ОН можна представити як похідне аміаку, в якому атом водню заміщений на групу ОН. Одержують гідроксиламін відновленням нітратів або нітритів:
HNO3 + 6H = NH2OH + 2H2O
Гідроксиламін – безбарвні кристали (tпл = 33 °С), термічно стійкі. Водні розчини гідроксиламіну також стійкі.
Оскільки атом азоту в гідроксиламіні має ступінь окиснення -1, він може функціонувати як окисник і як відновник. Так, у лужному середовищі гідроксиламін відновлює йод за реакцією:
2NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O
У кислому середовищі гідроксиламін є окисником, наприклад у реакції з солями Fе(ІІ):
4FeSO4 + 2NH2OH + 3H2SO4 = 2Fe2(SO4)3 + (NH4)2SO4 + 2H2O
Гідроксиламін використовують в органічній хімії для одержання гідроксамових кислот.
2.4. Оксиди азоту
З киснем азот утворює ряд оксидів N2O, NO, N2O3, NO2, N2O4, N2O5.
Нітрогену (І) оксид N2О
Його одержують термічним розкладанням нітрату амонію:
NH4NO3 = N2O + H2O
Це безбарвний газ із слабким приємним запахом і солодкуватим смаком.
Молекула N2О має лінійну будову. Хімічний зв'язок у N2О можна описати валентною схемою:
N- = N+ = O
N2О несолетворний оксид, тому в воді розчиняється мало і не взаємодіє з нею. При кімнатній температурі нітрогену (І) оксид відносно інертний і не реагує з галогенами, лужними металами, кислотами і лугами. При нагріванні N2О легко розкладається на азот і кисень:
2N2O = 2N2 + O2
При нагріванні його реакційна здатність сильно зростає. В атмосфері оксиду азоту (І) згоряє більшість неорганічних і органічних речовин:
2P + 5N2O = P2O5 + 5N2
Нітрогену (ІІ) оксид NО. Основним промисловим способом одержання NО є окиснення аміаку в присутності каталізаторів:
4NH3 + 5O2 = 4NO + 6H2O
У лабораторії оксид азоту (ІІ) одержують дією розведеної азотної кислоти на мідні ошурки:
3Cu = 8HNO3(p) = 3Cu(NO3)2 + 2NO + 4H2O
Нітрогену (ІІ) оксид утворюється в атмосфері з азоту і кисню при громових розрядах.
NО – безбарвний, малорозчинний у воді газ. Він є несолетворним оксидом, тому з водою не реагує.
Будову молекули оксиду азоту (ІІ) можна представити схемою:
Молекула NО містить непарне число електронів (5 від атома азоту і 6 від атома кисню), тому має один неспарений електрон. Такі частинки вважають радикалами.
Нітрогену (ІІІ) оксид N2О3. При низьких температурах N2О3 має вигляд темно-синьої рідини, яка кристалізується при температурі нижче –102 °С, кипить при +3,5 °С, розкладаючись на оксид азоту(ІІ) і оксид азоту(ІV): N2O3 → NO + NO2
Одержують нітрогену (ПІ) оксид охолодженням суміші NO2, з NO.
Нітрогену (ІІІ) оксид – кислотний оксид, він легко поглинається лугами, утворюючи нітрити:
N2O3+ 2NаОН = 2NаNО2 + H2O
Дією на нітрити розведеною сірчаною кислотою утворюють азотисту кислоту:
2NаNО2 + НSO4 = 2НNО2 + Na2SO4
Нітрогену (ІV) оксид NO2 – бурий газ із специфічним запахом, важчий за повітря, подразнює дихальні шляхи, дуже отруйний. Нітрогену (II) оксид NO легко окиснюється киснем з утворенням NO2:
2NО + О2 = 2NО2
Це промисловий метод одержання NO2, з якого потім одержують азотну кислоту. У невеликих кількостях в лабораторіях добувають NO2 взаємодією міді з концентрованою азотною кислотою:
Сu + 4НNО3 = Сu(NО3)2 + 2NО2 + 2Н2O
Будову молекули NO2 можна представити у вигляді кутової форми:
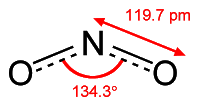
Порядок зв'язку в NO2 дорівнює 1,5. Один неспарений електрон, локалізований на атомі азоту, обумовлює парамагнітні властивості молекули NO2.
Як і всі молекули з непарним електроном, NO2 легко димеризується.
Рівновага між парамагнітним мономером і діамагнітним димером регулюється температурою:
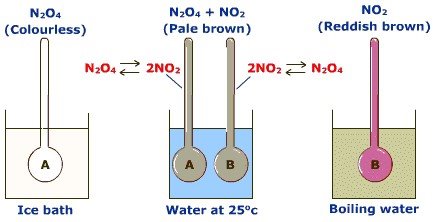
Як рідкий, так і твердий діоксид безбарвний, складається з плоских молекул N2O4
Оксид азоту(ІV) — сильний окисник, більшість речовин (вугілля, сірка, фосфор) згоряють в ньому:
2NО2 + 2С → 2СО2 + N2
2NО2 + 2S → 2SO2 + N2
При розчиненні NO2 у воді утворюються дві кислоти — азотиста і азотна:
2NО2 + Н2O = НNО3 + НNО2
При розчиненні NO2 в лугах утворюється суміш нітрату і нітриту:
2NО2 + 2NаОН = NаNО3 + NаNО2 + Н2O
Нітрогену (V) оксид N2O5. Це біла кристалічна речовина, термічно нестійка, легко розкладається на нітрогену (ІV) оксид і кисень:
2N2O5 ↔ 4NO2 +O2
Одержують оксид азоту(V) дегідратацією азотної кислоти за допомогою Р2О5 або окисненням NO2 озоном:
2НNО3 + Р2O5 = 2НРО3 + N2O5
6NO2 + O3 = 3N2O5
У газоподібному стані оксид азоту(V) має молекулярну структуру:
У твердому стані N2О5 має структуру, яка утворена іонами NO2+ і NO3-.
N2O5 — найсильніший окисник серед оксидів азоту. При розчиненні у воді утворює азотну кислоту:
N2O5 + Н2O = 2НNO3
Азотиста (нітритна) кислота НNО2. Відома лише у водному розчині. Це кислота середньої сили (Kд = 4 10-4).
У зв'язку з тим, що атом азоту в нітрит-іоні знаходиться у проміжному ступені окиснення +3, нітрити мають окиснювально-відновну двоїстість.
У реакціях з відновниками, такими як I-, S2-, Fe2+, нітрити у кислому середовищі виявляють окиснювальні властивості, відновлюючись при цьому до NO:
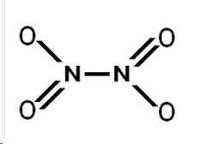
2КI + 2NаNО2 + 2Н2SO4 = І2 + 2NO + К2SO4 + Nа2SO4 + 2Н2O
У кислому середовищі при дії аніонів-окисників, таких як СlO3-, МnО4-, Сr2О72- і деяких інших, нітрити окиснюються до нітратів:
5NаNО2 + 2КМnО4 + ЗН2SO4 == 5NаNО3 + 2МnSO4 + К2SO4 + ЗН2O
Здатність нітрит-іонів знебарвлювати перманганат-іони у кислому середовищі і вилучати йод із підкислених розчинів йодидів дозволяє використовувати ці реакції для якісного виявлення нітрит-іонів.
Азотна (нітратна) кислота НNО3. Це безбарвна рідина, tкип = 84 °С, tпл = — 41,6 °С. Димуча НNО3 (100 %) має густину 1,52 г/см3 і вже при кімнатній температурі під дією світла частково розкладається з утворенням NO2, що зумовлює її жовте забарвлення:
4НNО3 = 4NО2 + 2Н2O + О2
Азотну кислоту з масовою часткою НNОз 65 % називають концентрованою. Будову молекул HNO3 на схемі:
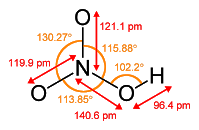
У промисловості азотну кислоту одержують окисненням аміаку до оксиду азоту(ІІ) у присутності каталізатора (сітка із сплаву платини з родієм), оксиду азоту(П) до діоксиду азоту, який потім розчиняють у гарячій воді у присутності кисню повітря:
4NН3 + 5O2 = 4NО + 6Н2O
2NO + О2 = 2NО2
4NО2 + 2Н2O + О2 = 4НNO3
У лабораторії азотну кислоту з масовою часткою 98 % одержують кип'ятінням нітратів калію або натрію з концентрованою сірчаною кислотою:
2КNO3 + Н2SO4 = 2НNO3 + К2SO4
Азотна кислота одна з найсильніших кислот. У розведених водних розчинах вона повністю дисоційована на іони:
НNO3 → H+ +NO3-
З хімічної точки зору азотна кислота є сильним окисником. Вона окиснює більшість металів і неметалів. Неметали при дії азотної кислоти окиснюються у кисневмісні кислоти з вищим ступенем окиснення кислотоутворюючого неметалу, наприклад:
S0 + 6НNО3 = Н2S+6O4 + 6NО2 + 2Н2O
3Р0 + 5НNО3 + 2Н2O = 3Н3Р+5О4 + 5NО.
Продукти відновлення азотної кислоти залежать від фізико-хімічної природи металу, від концентрації кислоти та температури. Відомо, що чим вище концентрація НNO3, тим менше відновлюється азот. Слід зазначити, що у процесі відновлення азотної кислоти утворюється суміш сполук, в яких азот знаходиться в різному ступені окиснення від +4 (NO2) до —3 (NH4NO3). Але як продукт хімічної реакції зазвичай записують ту речовину, вміст якої в суміші максимальний.
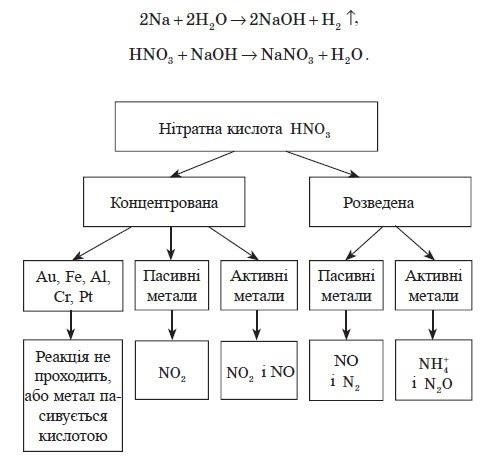
Такі метали як золото, платина, осмій, іридій, тантал і вольфрам стійкі до дії азотної кислоти. А такі активні метали як залізо, алюміній і хром з азотною кислотою не взаємодіють з причини утворення на їх поверхні міцної оксидної плівки (процес пасивації).
Метали, які розташовані у ряді напруг від Н до Аu, розчиняються у концентрованій НNO3з виділенням NO2. З розведеною азотною кислотою процес перебігає з виділенням оксиду азоту (ІІ):
Сu + 4НNO3(k) = Сu(NО3)2 + 2NO2 + 2Н2O
3Аg + 4НNO3(p) = 3АgNО3 + NO + 2Н2O
Метали середньої активності (від Fе до Н) відновлюють концентровану азотну кислоту до NO, а дуже розведену до NН4NО3:
3Рb + 8НNO3(k) = 3Рb(NO3)2 + 2NО + 4H2O
4Fе + 10НNО3(дуже розведена) = 4Fе(NО3)2 + NH4NO3 + ЗН2O.
Активні метали розташовані у ряді напруг значно лівіше водню (від Zn до Li), концентровану азотну кислоту відновлюють до оксиду азоту (I):
4Са + 10HNO3(k) = 4Са(NО3)2 + N2O + 5Н2O
а дуже розведену НNО3 відновлюють до NH4+:
4Са + 10НNО3(дуже розведена) = 4Са(NO3)2 + NH4NO3 + 3Н2O.
Більш сильну окиснювальну дію виявляє суміш концентрованих азотної та соляної кислот (1:3) — «царська водка». Вона розчиняє «царя металів» — золото та інші метали. Значна її окиснювальна дія обумовлена утворенням атомарного хлору і хлориду нітрозилу, які також є сильними окисниками:
НNО3 + 3НС1 = 2Сl + NOCl + 2Н2O
Аu + НNО3 + 3НС1 = АuСl3 + NO + 2Н2O
У надлишку НС1 золото утворює тетрахлороаурат (ПІ) водню:
АuСІз + НС1 = Н[АuCl4]
Робота з концентрованою азотною кислотою потребує особливої обережності. При попаданні крапель азотної кислоти на шкіру утворюються опіки у вигляді жовтих плям — продуктів нітрування речовин білкової природи, які містять бензольні кільця.
Солі азотної кислоти – нітрати одержують дією НNО3 на метали, оксиди, гідроксиди та карбонати. Усі нітрати добре розчинні у воді. Їх розчини мають незначні окиснювальні властивості. Лише у лужному середовищі нітрати окиснюють Zn і Li:
4Zn + NaNO3 + 7NаОН + 6Н2O = 4Nа2[Zn(ОН)4] + NН3
- 2е + Zn0 + 4OН- = [Zn(ОН)4]2- 4
+ 8е +NO3- + 6Н2О = NH3 + 9OН- 1
4Zn + 16OН- + NO3-+ 6Н2O → 4[Zn(ОН)4]2- + NH3 + 9OН-
Сильними окисниками нітрати стають у розплавах, наприклад:
Fe2О3 + 3КNО3 + 4КОН = 2К2FеО4 + 3КNO2 + 2Н2O.
Окиснювальні властивості нітрату калію лежать в основі виготовлення і горіння чорного пороху:
2КNO3 + 3С + S = N2 + 3СО2 + К2S
Нітрати досить стійкі при звичайних температурах, але при нагріванні розкладаються з виділенням кисню. При розкладанні нітратів металів, які розташовані у ряді стандартних електродних потенціалів зліва від магнію, утворюються нітрити металів і кисень, наприклад:
2КNO3 = 2КNO2 + О2
Ва(NO3)2 = Ва(NO2)2 + О2
Нітрати металів від Мg до Сu перетворюються на оксиди, наприклад:
2Сu(NО3)2 = 2СuО + 4NO2+ О2
При термічному розкладі нітратів неактивних металів виділяється вільний метал:
2АgNО3 = 2Аg + 2NO2 + О2
Нg(NO3)2 = Нg + 2NO2 + О2
Нітрати натрію, калію, амонію і кальцію, які використовують як азотні добрива, називають селітрами.
3. Фосфор
Фосфор Р 1s22s22p63s23p3 є електронним аналогом азоту. Однак з ряду причин хімічні властивості фосфору значно відрізняються від властивостей азоту.
Зростання атомного радіуса фосфору приводить до зменшення енергії іонізації, стабілізації позитивних ступенів окиснення, у тому числі +5.
Внаслідок наявності у фосфорі вакантних 3d-орбіталей з'являється можливість переходу 3s-електрона на 3d-підрівень (у збудженому стані). При цьому 5 неспарених електронів утворюють 5 ковалентних зв'язків за обмінним механізмом. Крім 5sp3d-гібридизації РF5 атомні орбіталі фосфору можуть перебувати також у sp3d2-гібридному стані [PF6-]
Природні сполуки та одержання фосфору
Вміст фосфору в земній корі складає 0,04 %. На відміну від азоту фосфор зустрічається у природі лише у вигляді сполук. Найважливіші мінерали фосфору:

фосфорит Са3(РО4)2

апатит 3Са3(РО4)2 –СаХ2 (X - F, Сl, ОН).
У зв'язку з тим, що фосфор у природних сполуках знаходиться в найвищому ступені окиснення (+5), для одержання у вільному стані його необхідно відновити. У ролі відновника використовують вуглець. В електропіч подають суміш подрібненого фосфориту з піском та вугіллям, її нагрівають електричною дугою. При цьому відбувається процес, який виражають рівнянням:
2Са3(РО4)2 + 10С + 6SіO2 = Р4 + 6СаSiO3 + 10СО
Діоксид кремнію зв'язує кальцій у легкоплавкий шлак. Пару фосфору конденсують під водою, при цьому утворюється білий фосфор.
3.1. Фізичні та хімічні властивості фосфору
Фосфор утворює декілька алотропних модифікацій, найважливіші з них: білий, червоний і чорний фосфор.
Білий фосфор – м'яка, безбарвна, воскоподібна, легкоплавка tпл = 44,1 °С; tкип = 275 °С) і летка речовина. Він розчиняється в СS2 і деяких органічних розчинниках, але малорозчинний у воді, тому зберігають фосфор під шаром води.
Пара фосфору складається з молекул Р4
У компактному стані білий фосфор має молекулярну кристалічну решітку, яка складається з тетраедричних молекул Р4. В цій молекулі зв'язки Р–Р досить легко руйнуються, а малий кут Р–Р–Р обумовлює значну напруженість зв'язків у молекулі. Указані фактори пояснюють досить високу реакційну здатність білого фосфору. На повітрі при незначному нагріванні він спалахує. Горіння супроводжується розбризкуванням. Бризки фосфору утворюють опіки шкіри, які довго не гояться. Повільне окиснення фосфору на повітрі супроводжується хемілюмінесценцією (світінням). У перекладі з грецької мови слово фосфор означає «світлоносець».
При взаємодії з металами фосфор виявляє окиснювальні властивості:
6Са+ Р4 = 2Са3P2
У реакціях з активними неметалами – киснем, галогенами, сіркою – фосфор виступає як відновник.
За умов недостатньої кількості окисника утворюються оксиди, хлориди і сульфіди фосфору у нижчому ступені окиснення:
Р4 + 3О4= 2Р2О3
Р4 + 6С12 = 4РС13
Р4 + 6S = 2Р2S3
У надлишку кисню, хлору та сірки утворюються сполуки фосфору у вищому ступені окиснення:
Р4 + 5О2 = 2Р2О5
Р4 + 10Сl2 = 2РСl5
Р4 + 10S = 2Р2S5
Азотна кислота окиснює фосфор до ортофосфорної кислоти:
3Р4 + 20НNО3 + 8Н2O = 12H3РО4 + 20NО
Подібно до багатьох неметалів, таких як галогени, сірка, кремній, фосфор у проміжному ступені окиснення диспропорціо-нує у водних розчинах лугів:
Р4 + 3NаОН + 3Н2O = РН3 + 3NаРН2O2 гіпофосфіт натрію
При тривалому нагріванні до 300 °С без доступу повітря білий фосфор перетворюється у червоний. Червоний фосфор — це полімерна речовина такої будови:
Полімерна будова червоного фосфору обумовлює його хімічну інертність. Наприклад, температура його згоряння на повітрі (300 °С) значно вища, ніж білого фосфору. Однак сильні окисники, такі як хлорат калію (бертолетова сіль), взаємодіють з червоним фосфором за умов тертя або удару. Цю властивість червоного фосфору використовують при виготовленні сірників.
Чорний фосфор одержують нагріванням білого фосфору при температурі 220 °С і тиску 1200 МПа. За зовнішнім виглядом він нагадує графіт. У хімічному відношенні чорний фосфор найменш реакційне здатний, спалахує лише при нагріванні до 400 °С.
3.2. Сполуки фосфору
На відміну від азоту фосфор не реагує з воднем, хоча сполуки з ним утворює. Гідрид фосфору РН3 (фосфін) одержують гідролізом фосфіду кальцію:
Са3Р2 + 6Н2O = 3Са(ОН)2 + 2РН3
або нагріванням білого фосфору в розчині лугу:
2Р4 + 3Ва(ОН)2 + 6Н2O = 2РН3 + 3Ва(РН2O2)2
Фосфін – газ із неприємним запахом тухлої риби. Його повільне окиснення супроводжується хемілюмінесценцією як і білого фосфору. Фосфін малорозчинний у воді і, на відміну від аміаку, не взаємодіє з нею, що пояснюється відсутністю міжмолекулярних водневих зв'язків.
Електроноакцепторні властивості фосфін виявляє лише з найбільш сильними донорами протонів (НСlO4 і НІ):
РН3 + НС1O4 = РН4ClО4.
Перхлорат фосфонію – нестійка кристалічна речовина, яка легко розкладається водою.
3.3. Кисневмісні сполуки фосфору
Фосфор утворює оксиди та ряд кисневмісних кислот:
Р2О3 – оксид фосфору (ІІІ);
Р2О5 – оксид фосфору (V);
НРО3 – метафосфорна кислота;
Н4Р2О7 – дифосфорна кислота;
Н3РО4 – ортофосфорна кислота;
Н2[РНО3] – фосфориста кислота;
Н[РН2О2] – фосфорнуватиста кислота.
Оксид фосфору (V) зберігає свою тривіальну назву, що склалася історично, але дійсна молекулярна формула цієї речовини Р4O10:
P4O10 одержують спалюванням фосфору в надлишку кисню:
Р4 + 5O2 = Р4O10
Р4О10 – біла кристалічна дуже гігроскопічна речовина, сублімується при 360 °С. Це одна з найактивніших водовіднімаючих речовин. Так, вона перетворює концентровану азотну кислоту на оксид азоту(V), а сірчану на оксид сірки(VІ):
12НNO3 + Р4O10 = 4Н3РО4 + 6N2O5
6Н2SO4 + Р4O10 = 4Н3РО4 + 6SO3
З водою оксид фосфору (V) утворює суміш фосфорних кислот, склад яких визначається співвідношенням оксиду і води та іншими умовами. При розчиненні Р4О10 у холодній воді одержують тетраметафосфорну кислоту.
Р4O10 + 2Н2O = (НРО3)4.
Цей тетрамер можна представити у вигляді кільцевої форми:
За інших умов можна одержати дифосфорну (пірофосфорну) кислоту:
Р4O10 + 4Н2O = 2Н4Р2O7
яка має таку просторову будову:
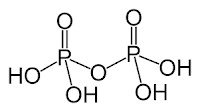
Кип'ятінням Р4O10 з надлишком води одержують ортофосфорну кислоту.
Р4O10 + 6Н2O = 4Н3РО4
При кип'ятінні розведеного водного розчину тетраметафосфорної кислоти (НРО3)4 вона перетворюється на ортофосфорну:
(НРО3)4 + 4Н2O = 4Н3РО4
В промисловості ортофосфорну кислоту одержують із фосфату кальцію:
Са3(РО4)2 + 2H2SO4= 3СаSO4 + 2Н3РО4
Ортофосфорна кислота Н3РО4 (яку часто називають фосфорною) має таку будову:
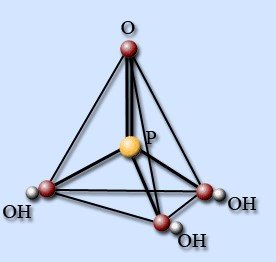
В обезвоженому стані Н3РО4 – безбарвні, дуже гігроскопічні кристали з tпл = 42 °С. У твердій речовині та в концентрованих розчинах діють міжмолекулярні водневі зв'язки. Саме тому кислота, яка поступає у продаж з масовою часткою 90 %, є безбарвною сиропоподібною рідиною.
У водному розчині Н3РО4 – триосновна кислота середньої сили:
Н3РО4 ↔ Н+ + H2РО4- К1 = 8 · 10-3
Н2РО4- ↔ H+ + НРО42- К2 = 1 · 10-7
НРО42- ↔ Н+ + РО43- К3 = 2 · 10-12
Н3РО4 утворює три типи солей: фосфати Nа3РО4, Са3(РО4)2; гідрофосфати NаНРO4, СаНРО4 та дигідрофосфати NаН2РО4, Сa(H2РО4)2. Серед середніх солей розчинні у воді лише фосфати лужних металів та амонію, серед кислих – ще й гідро- та дигідрофосфати лужноземельних металів. Розчинні солі фосфорної кислоти використовують як добриво у сільському господарстві.
Ортофосфати лужних металів, як солі, утворені сильними основами і кислотою середньої сили, гідролізуються у водних розчинах з утворенням лужного середовища:
Na3PO4 → 3Nа+ + РО43-
РО43- + Н2O → НРО42- + ОН-
Nа3РО4 + Н2O → Nа2НРО4 + NаОН
Для лікування сечокам'яної хвороби призначається лікарський препарат «Уродан». До його складу входить гідрофосфат натрію. Слаболужне середовище, яке утворюється внаслідок гідролізу солі, сприяє розчиненню каменів, утворених сечовою кислотою:
Nа2НРО4 → 2Nа+ + НРО42-
НРО42- + Н2O → Н2РО4- + ОН-
Nа2НРО4 + Н2O → NаН2РО4 + NаОН
Не менш цікавими є сполуки фосфору в інших ступенях окиснення. Оксид фосфору (IIІ)утворюється при взаємодії фосфору з недостачею кисню. Існує у вигляді декількох алотропних модифікацій. Основна модифікація має молекулярну кристалічну решітку, у вузлах якої знаходяться димерні молекули Р4O6 Інші модифікації оксиду фосфору (ІІІ) – полімерні сполуки.
У хімічних реакціях оксид фосфору(ПІ) виявляє кислотну природу. При розчиненні у воді утворює фосфористу кислоту.
Р4O6 + 6Н2O = 4Н2[РНО3]
Фосфориста кислота – безбарвні, добре розчинні у воді кристали з tпл =74 °С. Будова молекули має вигляд:
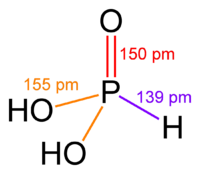
Згідно з наведеною формулою один атом водню зв'язаний із фосфором безпосередньо і нездатний до заміщення, тому фосфориста кислота – двохосновна кислота середньої сили. Н2[РНО3] утворює солі – фосфіти.
Сполуки фосфору(ІП) – сильні відновники. Вони відновлюють малоактивні метали із розчинів їх солей:
Н2[РНО3] + НgС12 + Н2O = Н3РО4 + Нg + 4НС1
Реакції якісного визначення фосфат-іону РО3-
У зв'язку з тим, що заміщені фосфати використовують у медицині та сільському господарстві як добрива, для них розроблені реакції тотожності.
Утворення малорозчинного фосфату срібла. При взаємодії Nа2НРO4 з розчином АgNO3утворюється осад забарвленого у жовтий колір фосфату срібла:
ЗАgNO3 + Nа2НР4 = Аg3PO4 + 2NаNО3 + НNО3.
Утворення магній-амоній фосфату — MgNH4PO4. До розчину
Nа2НРO4 додають магнезіальну суміш (МеСІ2, NH4Cl, NH3 • Н2О): Nа2НРО4 + МgС12 + NН3 Н2O = МgNН4РО4 + 2NаС1 + Н2O. білий осад
4. Підсумок заняття.
Дайте відповідь на питання:
1. Охарактеризуйте поширення в природі та основні властивості азоту
2. Опишіть властивості аміаку
3. Охарактеризуйте механізм утворення іону амонію
4. Опишіть фізичні та хімічні властивості солей амонію
5. Біологічна роль азоту та його сполук
6. Охарактеризуйте поширення в природі, а також фізичні властивості фосфору
7. Опишіть хімічні властивості фосфору
8.Біологічна роль фосфору та його сполук
5. Домашнє завдання
Опрацювати конспект
ТЕМА 2. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Заняття № 7
Дисципліна: «Хімія»
Тема заняття: Амоніак, будова молекул, фізичні та хімічні властивості.
Солі амонію, їх властивості. Якісна реакція на амоній.
Мета заняття:
навчальна – ознайомити зі складом, особливостями будови молекули й фізичними властивостями амоніаку, розчинністю амоніаку у воді й дією індикаторів на розчин, особливостями взаємодії амоніаку з водою й кислотами; формувати вміння складати іонно-молекулярні рівняння реакції на прикладі властивостей амоніаку; розповісти про застосування амоніаку; розширити уявлення про солі та їх загальні властивості на прикладі солей амонію; ознайомити студентів зі специфічними властивостями солей амонію; дати уявлення про способи одержання солей амонію;
розвиваюча – розвивати вміння складати іонно-молекулярні рівняння відповідних реакцій на прикладі хімічних властивостей амоніаку; удосконалювати вміння проводити хімічний експеримент, спостерігати за перебігом реакцій і робити узагальнюючі висновки;
виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: засвоєння нових знань
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: таблиця хімічних елементів
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с.
9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
1. Напишіть рівняння одержання амоніаку, укажіть окисник і відновник.
2. Охарактеризуйте цю реакцію, назвіть умови, необхідні для перебігу цієї реакції.
ІІІ Мотивація навчальної діяльності
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Підведення підсумків заняття.
3. Домашня робота.
ХІД ЗАНЯТТЯ
1. Вивчення нового матеріалу
Амоніак – будова молекули й фізичні властивості молекула NH3 має структуру трикутної піраміди з атомом Нітрогену у вершині. Хімічний зв’язок утворюється шляхом перекривання s-орбіталей трьох атомів Гідрогену і трьох рорбіталей Нітрогену. р-хмари перпендикулярні, але кут між зв’язками перевищує 90°, тому що електронні хмари атомів Гідрогену відштовхуються й утворюють кут зв’язку 107°. Довжина зв’язку N – H становить 1,01 А.
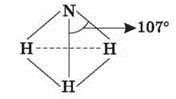
Фізичні властивості: безбарвний газ із різким запахом, добре розчинний у воді (до 700 л амоніаку в 1 л води). Температура плавлення дорівнює –77,7 °С, температура кипіння 33,4 °С.
1.1. Хімічні властивості амоніаку
1. Окиснення для молекули амоніаку є мало-характерним, оскільки молекула амоніаку стійка.
a. На повітрі не горить, але в атмосфері кисню згоряє жовтим полум’ям:
4NH3
+ 3О2 ![]() 6H2О + 2N2 + 303 ккал
6H2О + 2N2 + 303 ккал
Зверніть увагу на те, що суміш амоніаку й кисню внаслідок нагрівання може вибухати!
b. Неповне окиснення в присутності каталізатора
(kat — Pt, Fe2О3, Cr2О3):
![]()
Тут каталізатор не лише прискорює, але і змінює напрям реакції.
2. Для амоніаку характерні реакції приєднання з утворенням іона амонію.
a. Взаємодія з водою:
![]()
Утворюється ковалентний зв’язок за донорно-акцепторним механізмом:
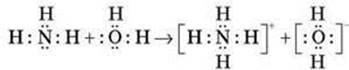
У розчині амоніаку індикатори змінюють колір: лакмус – на синій, фенолфталеїн — на малиновий, що вказує на лужне середовище розчину амоніаку.
Іон NH4+ має форму правильного тетраедра, усі зв’язки – ковалентні полярні, рівноцінні (мають однакову довжину й кут зв’язку).
b. Приєднання кислот:
NH3
+ HCl ![]() NH4Cl
NH4Cl
За цілковитої відсутності води реакція не протікає:
NH4ОH
+ HCl ![]() NH4Cl + H2О
NH4Cl + H2О
Висновок: розчин амоніаку NH3 — основа, оскільки взаємодіє з кислотами, а розчин має лужну реакцію.
1. Напишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
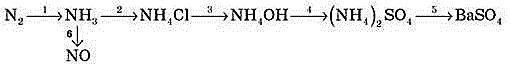
Укажіть, як змінюється ступінь окиснення Нітрогену в 1-й і 6-й реакціях.
2. Демонстрація досліду «Дим без вогню». Особливості взаємодії амоніаку з хлоридною кислотою:
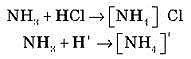
3. Запишіть рівняння взаємодії амоніаку із сульфатною кислотою в молекулярній та іонній формах:
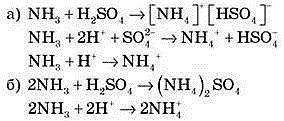
Висновок: NH+ можна розглядати у формулах як іон одновалентного металу.
4. Якісною реакцією на іон амонію є реакція взаємодії з лугами. При цьому утворюється слабка основа NH4OH, що легко розкладається на амоніак і воду, при цьому з’являється запах амоніаку. Усі солі й розчини, що містять іон амонію, мають слабкий запах амоніаку.
2. Підбиття підсумків заняття
Самостійна робота (додаток 1)
3. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Додаток 1
Варіант І
Завдання 1. Складіть повні та скорочені іонні рівняння реакцій між речовинами.
а) амоній гідроксид і ортофосфатна кислота;
б) амоній сульфат і кальцій гідроксид.
Завдання 2. Напишіть рівняння окисно-відновної реакції одержання речовин.
Нітроген(ІІ) оксид.
Укажіть умови зміщення хімічної рівноваги в цих реакціях у бік утворення продукту реакції.
Завдання 3. Поясніть механізм утворення іона амонію NH4+ у реакціях.
Розчинення амоніаку у воді.
Варіант ІІ
Завдання 1. Складіть повні та скорочені іонні рівняння реакцій між речовинами.
а) магній хлорид і амоній фосфат;
б) амоній нітрат і калій гідроксид.
Завдання 2. Напишіть рівняння окисно-відновної реакції одержання речовин.
Амоніак.
Укажіть умови зміщення хімічної рівноваги в цих реакціях у бік утворення продукту реакції.
Завдання 3. Поясніть механізм утворення іона амонію NH4+ у реакціях.
Взаємодії амоніаку з хлоридною кислотою.
ТЕМА 2. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Заняття № 8
Дисципліна: «Хімія»
Тема заняття: Карбон і сицілій, їх місце в ПСХЕ, фізичні та хімічні властивості. Солі карбонатної кислоти, їх поширення у природі, застосування.
Мета заняття:
навчальна – визначити поняття «алотропія», «адсорбція» (ІІ рівень засвоєння); розглянути хімічні властивості вуглецю та кремнію, як простих речовин, а також їх сполук (ІІ рівень засвоєння).
розвиваюча – розглянути поширення в природі та фізичні властивості сполук Карбону та Силіцію (ІІ рівень засвоєння);
виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: засвоєння нових знань
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: таблиця хімічних елементів
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
ІІІ Мотивація навчальної діяльності
Активізація розумової діяльності студентів на заняттях з хімії за допомогою комп’ютерних візуальних засобів.
ІV Сприйняття й засвоєння нових знань:
План
4. Вивчення нового матеріалу.
5. Вуглець.
6. Кремній.
7. Підведення підсумків заняття.
8. Домашня робота.
ХІД ЗАНЯТТЯ
4. Вивчення нового матеріалу
До р-елементів IV трупи належать вуглець С, кремній Si, германій Ge, олово Sn і свинець Pb. Електронна конфігурація зовнішнього енергетичного рівня атомів цих елементів у не збудженому стані – ns2nр2.
Електронну будову зовнішніх рівнів атомів перших двох елементів підгрупи можна подати так:
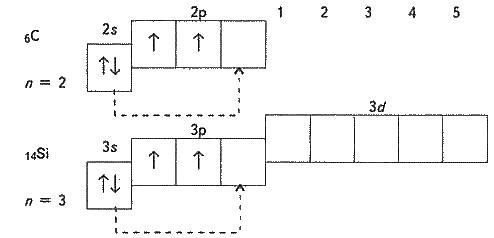
В незбудженому стані їх атоми мають по два неспарених електрони. Оскільки атоми всієї підгрупи мають на зовнішньому рівні вільні орбіталі, то при переході в збуджений стан розпаровують електрони s-підрівнів (показано штриховими стрілками).
Елементи головної та побічної підгруп IV групи дуже подібні до металів. Це підтверджується наявністю невеликої кількості електронів у зовнішніх електронних шарах атомів. Лише Карбон і Силіцій є неметалами. Між елементами головної та побічної підгруп IVгрупи відмінність у властивостях менша, ніж між елементами VI та V груп.
Наявність чотирьох електронів у зовнішньому електронному шарі атомів елементів підгрупи Карбону є ознакою того, що вони можуть бути чотиривалентними. Стабільність зовнішнього електронного шару може визначатись як відщепленням, так і приєднанням чотирьох електронів.
Отже, елементи підгрупи Карбону можуть утворювати сполуки як з активними неметалами, так і з металами, виявляючи у цьому разі ступені окиснення від +4 до -4.
Елементи підгрупи Карбону завдяки наявності двох неспарених релектронів здатні утворювати сполуки, в яких вони двовалентні. Роль ns2електронів із збільшенням радіусів атомів послаблюється, а неспарені pелектрони легше притягуються орбіталями інших атомів, тому від Карбону до Плюмбуму зростає здатність елементів виявляти ступінь окиснення +2.
Елементи підгрупи карбону утворюють оксиди із загальними формулами RO2 і RO, а водневі сполуки – з формулою RH4. Гідрати вищих
оксидів карбону і силіцію мають кислотні властивості, гідрати останніх елементів амфотерні, причому кислотні властивості сильніше виражені у гідратів германію, основні – у гідратів плюмбуму. Від карбону до плюмбуму зменшується міцність водневих сполук RH4: СH4 – стійка сполука, а РbH4 у вільному стані не виділений. У підгрупі зі зростанням порядкового номера зменшується енергія іонізації атома і збільшується атомний радіус, тобто неметалічні властивості слабшають, а металічні – посилюються.
Атомні радіуси елементів ІVА групи при переході від вуглецю до свинцю закономірно збільшуються, енергія іонізації та відносна електронегативність зменшуються, неметалічні властивості послаблюються, а металічні підсилюються.
Вуглець істотно відрізняється від інших елементів ІVA групи високим показником енергії іонізації. Вуглець – типовий неметалічний елемент.
5. Вуглець
5.1. Поширення в природі
Вуглець знаходиться в природі у вільному стані та в сполуках. Більша його частина входить до складу карбонатів СаСО3, MgCO3, нафти, природного газу, кам'яного і бурого вугілля. В атмосфері вуглець знаходиться у вигляді діоксиду вуглецю 0,03 %. У розчиненому стані діоксид вуглецю міститься в усіх природних водах. Велика роль вуглецю у живій природі. Тканини тварин і рослин складаються із сполук вуглецю. Рослини поглинають діоксид вуглецю і шляхом фотосинтезу утворюють життєво важливі складні органічні сполуки.
5.2. Алотропні видозміни фізичні та хімічні властивості вуглецю
Вуглець існує у вигляді декількох алотропних видозмін – це алмаз, графіт, карбін і полікумулен. Так званий аморфний вуглець (сажа, деревне і кістяне вугілля) не є окремою алотропною модифікацією вуглецю, а складається з дрібнодисперсних кристалів графіту.
Алмаз – прозора безбарвна кристалічна речовина. У кристалічній решітці алмазу атомні орбіталі вуглецю знаходяться у стані sр3-гібридизації. Кожний атом утворює чотири міцні ковалентні зв'язки. По відношенню до будьякого атома вуглецю чотири найближчих сусідніх атома розташовані у вершинах правильного тетраедра. Міцні тримірні зв'язки у кристалічній решітці алмаза визначають його найважливіші фізичні та хімічні властивості.
Алмаз найтвердіший з усіх відомих у природі речовин. Він не проводить електричний струм, погано проводить теплоту, хімічно малоактивний. Кислоти і луги не діють на нього навіть при високій температурі. Алмаз горить лише у чистому кисні при 600-800 °С. Продуктом його горіння є діоксид вуглецю.
Алмази можна одержати штучно з графіту при високому тиску і високих температурах у присутності металічних каталізаторів (Сг, Fe, Pt). Дуже висока міцність алмазу надає можливість використовувати його для обробки особливо твердих матеріалів, при буровиx роботах. Добре відшліфовані прозорі кристали алмазу називають діамантами, з них виготовляють ювелірні прикраси.
Друга важлива модифікація вуглецю – графіт. Це сіро-чорна кристалічна речовина з металічним блиском. На відміну від алмаза графіт дуже м'який, добре проводить електричний струм. Графіту властиві тугоплавкість, жаростійкість і хімічна інертність.
Різниця у фізичних і хімічних властивостях алмаза і графіту обумовлена особливостями будови їх кристалів. Атоми вуглецю в графіті розташовані у кутах правильних шестикутників, які знаходяться у паралельних площинах. Кожний атом вуглецю на площині оточується трьома сусідами (sр2-гібридизація атомних орбіталей). В алмазі довжина зв'язку С-С досить мала (0,154 нм), але ще менша (0,134 нм) відстань між атомами вуглецю в шараx графіту. Відстань між паралельними шарами графіту дуже велика (0,335 нм). Це вказує на існування лише слабкого зв’язку між шарами. Тому графіт має меншу за алмаз густину, легко розщеплюється на тонкі лусочки. Цим пояснюється здатність графіту залишати написи на папері.
У природі зустрічаються великі поклади графіту. Штучний графіт можна одержати шляхом сумісного нагрівання суміші коксу з піском і смолами у спеціальних печах при температурі близько 3000 °С з подальшою кристалізацією одержаного «аморфного вуглецю».
Графіт широко використовують у техніці. З нього виготовляють електроди в електролізерах, вогнестійкі тиглі, рухомі контакти в електричних двигунах, мастильні матеріали та олівці.
У зв'язку з тим, що графіт має здатність поглинати нейтрони, він є основним конструкційним матеріалом у ядерних реакторах.
Карбін – чорна дрібнокристалічна речовина. Одержують його дегідруванням ацетилену, з "n" молекул в умовах окиснювального процесу (Сu2+ ® Сu+) при прожарюванні до 1000 °С. При цьому одержують лінійний полімер, в якому атомні орбіталі вуглецю знаходяться у стані sр-гібридизації: – С≡С–С ≡ С–С ≡ С–
Довжина зв'язку С–С у карбіні ще менша, ніж у графіті (0,126 нм). При нагріванні до 800 °С карбін перетворюється на графіт.
Одержано інший лінійний полімер вуглецю – полікумулен в якому атоми вуглецю з'єднані подвійними зв'язками:
= С = С = С =
Чистий аморфний вуглець не розчиняється у звичайних розчинниках, розчиняється у розплавлених металах (платина, нікель). Густина аморфного вуглецю становить 1,8 – 2,1 г/см3, температура плавлення 3500 °С; він погано проводить електричний струм.
Електронна структура атома Карбону 1s22s22p2. Залежно від числа σзв'язків координаційне число атома Карбону може дорівнювати чотирьом (sp3гібридизація), трьом (sp2-гібридизація) і двом (sp-гібридизація). Ступені окиснення Карбону бувають -4, 0, +4 і +2.
На відміну від інших елементів, число валентних електронів атома Карбону дорівнює числу валентних орбіталей. Атом Карбону у валентному стані 1s22s2px2py2pz містить чотири неспарених електрони і не має ні вільних орбіталей, ні неподілених пар електронів. Така електронна будова атома Карбону і положення його на шкалі електронегативностей (середина) зумовлюють унікальні властивості цього елемента. Саме цим зумовлено існування численної кількості різноманітних органічних сполук.
Оскільки атом Карбону характеризується проміжним значенням електронегативності, він може утворювати ковалентні зв'язки з усіма реакційноздатними елементами. Неможливістю донорно-акцепторної взаємодії пояснюється приблизно однакова міцність зв'язків атома Карбону з атомом Гідрогену, у якого немає неподілених пар електронів, і з іншими атомами, в яких вони є. Зв'язки С – С характеризуються високою міцністю (351,8 кДж). Чотиривалентність Карбону забезпечує великі можливості для розгалуження ланцюгів атомів Карбону з утворенням циклічних структур. Енергетичне вигіднішим є формування ланцюгів ... – С – С – С –..., а не молекул С2.
З різних модифікацій Карбону найактивнішою є аморфна, менш активним є графіт і ще менш активним алмаз. Усі три прості речовини за дуже високих температур здатні сполучатися з киснем. Окисники у цьому разі діють на алмаз тільки з поверхні.
Вугілля легко сполучається з киснем під час нагрівання і є добрим відновником.
Безпосередньо з воднем вуглець сполучається лише в разі дуже сильного нагрівання за наявності каталізатора. Реакція оборотна:
С + 2Н2 ↔ СН4, ∆H = 75,2 кДж.
Карбон утворює багато сполук з галогенами, найпростіші з них мають формулу СГ4. Безпосередньою взаємодією вуглецю з фтором добувають CF4; з іншими галогенами вуглець не взаємодіє. Діючи галогенами на метан, добувають СС14.
5.3. Хімічні властивості вуглецю
За звичайної температури вугілля досить інертне. Його хімічна активність виявляється лише при високих температурах. Як окисник, вугілля реагує з деякими металами і неметалами. Сполуки карбону з металами називаються карбідами. Наприклад:
4Al + 3C = Al4C3
Велике практичне значення має карбід кальцію, який добувають нагріванням вапна СаО і коксу в електропечах:
СаО + 3С = СаС2 + CO.
З воднем вугілля за наявності нікелевого каталізатора і при нагріванні утворює метан – основну складову частину природних горючих газів:
С + 2Н2 = СН4.
Однак для вугілля більш характерні реакції, в яких він виявляє відновні властивості. Це має місце при повному згорянні карбону будь-якої алотропічної модифікації:
С + О2 = СО2.
Вугілля відновлює залізо, мідь, цинк, свинець та інші метали з їх оксидів, що широко використовується в металургії під час добування цих металів.
Наприклад:
2ZnO + С = 2Zn + CO2.
Дуже важлива хімічна властивість карбону – здатність його атомів утворювати міцні зв'язки між собою – вуглецеві ланцюги.
5.4. Активоване вугілля
У хіміко-фармацевтичній і медичній практиці застосовують такий важливий фізико-хімічний процес як адсорбція. Тіла, на поверхні яких відбувається поглинання газів, пари і розчинених речовин, називають адсорбентами. Речовини, що адсорбуються, називають адсорбатами. Найчастіше як адсорбент використовують активоване вугілля. Його одержують спалюванням деревини нехвойних порід, кісток, фруктових кісточок при температурі 170-400 °С без доступу повітря. При цьому відбувається випалювання органічних речовин і утворення об'ємного вуглецевого каркасу. Одержане вугілля-сирець активують, видаляючи з пор продукти сухої перегонки. Це досягається дією перегрітої водяної пари при температурі 800-900 °С. Після подрібнення одержують активоване вугілля з дуже розвиненою поверхнею. Питома поверхня деяких сортів такого вугілля досягає 100 м2/г.
Явище адсорбції легко продемонструвати, профільтрувавши воду, підфарбовану яким-небудь барвником, через активоване або деревне вугілля. Для цього в лійку поміщається фільтр із фільтрувального паперу, насипається шар подрібненого деревного або активованого вугілля, лійку закріплюють над порожньою склянкою. У лійку обережно наливають підфарбовану воду. У склянці збирається прозорий безбарвний фільтрат.
Адсорбційна здатність вугілля зумовлюється його поруватістю. Чим більше пор, тим більша поверхня вугілля і тим більша адсорбційна здатність. Звичайно пори деревного вугілля частково заповнені різними речовинами, що знижує його адсорбційну здатність. Для підсилення адсорбції вугілля спеціально обробляють – нагрівають у струмені водяної пари, щоб звільнити його пори від забруднюючих речовин. Оброблене таким способом вугілля називають активним.
Активоване вугілля використовують у промисловості для розділення суміші газів і розчинених речовин, осушення та очистки газів (наприклад, повітря у протигазах), рідин (етиловий спирт очищають від сивушних масел). У медичній практиці активоване вугілля використовують у вигляді препарату "Карболен", який призначають при захворюваннях системи травлення, які супроводжуються підвищеною кислотністю, бродінням, метеоризмом. Великі дози активованого вугілля рекомендують для профілактики і лікування деяких алергічних захворювань.
5.5. Кисневі сполуки вуглецю
Карбон (ІІ) оксид CO – безбарвний, дуже отруйний газ, без запаху. Утворюється при спалюванні вуглецю або його сполук при недостачі кисню, а також внаслідок взаємодії оксиду вуглецю(ІV) з розжареним вугіллям:
2С + О2 = 2СО,
СО2(г) + С(к) = 2СО(г).
У лабораторії карбон (ІІ) оксид одержують нагріванням до 100 °С мурашиної кислоти НСООН у присутності сірчаної кислоти: НСООН = СО + Н2О
За хімічною будовою, деякими фізичними і хімічним властивостями оксид вуглецю(ІІ) має велику схожість з молекулярним азотом. Енергія зв'язку в молекулі CO – 1075 кДж/моль. близька до енергії зв'язку в молекулі N2 – 940 кДж/моль. Це пояснюється тим, що, як і в молекулі N2, в карбон (ІІ) оксиді існує потрійний зв'язок. Згідно з методом ВЗ у молекулі CO – два ковалентні зв'язки, утворені за обмінним механізмом, та один ковалентний, утворений за донорно-акцепторним механізмом. При цьому донором електронної пари є атом кисню – вільну орбіталь (акцептор) надає незбуджений атом вуглецю:
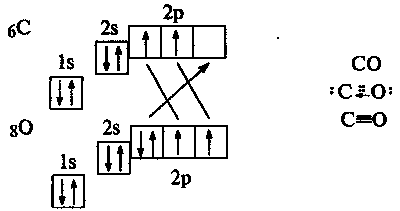
Наявність потрійного зв'язку в молекулі пояснює хімічну інертність карбон (ІІ) оксиду за звичайних умов. При нагріванні він виявляє відновні властивості, що широко використовують у пірометалургії:
Fe2О3 + 3СО = 2Fe + 3СО2.
Деякі d-елементи приєднують карбон (ІІ) оксид з утворенням карбонілів металів, наприклад: [Fe(CO)5], [CrСО)6], [Мn(СО)10], [Ni(CO)4]. Вони леткі рідини або тверді речовини. Хімічно стійкі. При нагріванні вище певної температури карбоніли розкладаються з утворенням дрібнодисперсного металу та карбон (ІІ) оксиду. Їх використовують для одержання високо чистих металів. Будову карбонілів розглядають при вивченні d-елементів.
Карбон (ІІ) оксид завжди вважали несолетворним оксидом. Однак пропусканням струму CO над розплавленим NaОН одержують сіль мурашиної кислоти – форміат натрію НСООNa. Таким чином, у жорстких умовах (200 °С, 15,2 · 10-5 Па) оксид вуглецю (ІІ) виявляє властивості ангідриду. Під дією світла оксид вуглецю(ІІ) вступає в реакцію
СО + Сl = СOCl2
Внаслідок реакції утворюється СОСІ2 який з хімічної точки зору є хлорангідридом вугільної кислоти. Вперше СОСІ2 одержав англійський хімік Гемфрі Деві. У зв'язку з тим, що реакція синтезу відбувається при освітленні, сполука СОСІ2 дістала поетичну назву "фосген", що в перекладі з англійської – "народжений світлом". Але виявилось, що фосген – це сильна отрута, яка спричиняє параліч дихальних шляхів.
У наш час фосген одержують взаємодією CO і С12 при 125–150 °С над активованим вугіллям. Фосген використовують у хімічній промисловості для одержання барвників, ліків, пластмас і каучуків.
Карбон (ІV) оксид – СО2 (вуглекислий газ) безбарвний газ, у 1,5 рази важчий за повітря. Під дією високого тиску (5,05 · 106 Па) перетворюється на
безбарвну рідину. При її охолодженні внаслідок випарювання
СО2 перетворюється на тверду снігоподібну масу («сухий лід»). Близько 0,03 % карбону (ІV) оксид входить до складу повітря. Він утворюється при горінні вугілля, окисненні органічних речовин (процеси дихання, бродіння, гниття), міститься у багатьох мінеральних водах. У техніці його одержують випалюванням вапняку:
СаСО3 = СО2 + СаО.
Такий вуглекислий газ може містити домішки. Тому у харчовій промисловості використовують вуглекислий газ, який збирають над чанами, в яких проходить бродіння при одержанні спирту. В лабораторіях СО2 одержують в апараті Кіппа дією на мармур хлороводневої кислоти:
СаСО3 + 2НС1 = СО2 + Н2О + СаС12.
Молекула діоксиду вуглецю має симетричну лінійну будову О=С=О, з довжиною зв'язку С=О 0,116 нм. Хоча зв'язки С=О мають полярний характер, внаслідок симетричності молекула CO, в цілому неполярна. Цим можна пояснити погану розчинність вуглекислого газу у воді. При 15 °С 1 об'єм Н2О розчиняє 1 об'єм СО2.
За хімічною природою карбон (ІV) оксид є кислотоутворюючим оксидом.
При розчиненні у воді утворює нестійку вугільну кислоту, у розчині якої встановлюється рівновага:
СО2 ↔ Н2О ↔ Н2СО3 ↔ Н+ + НСО3- ↔ 2Н+ + СО32-.
У зв'язку з тим, що вугільна кислота двохосновна і слабка, вона дисоціює ступінчасто:
Н2СО3 = Н+ + НСО3-, Кд1 = 4,5 · 10-7;
НСО3- = Н++ СО32-, Кд2 = 4,8 · 10-11.
Іон СО32- має плоску трикутну будову. Атом вуглецю за рахунок електронів, які знаходяться на sр2-гібридизованих орбіталях, утворює три σзв'язки, які лежать у площині під кутом 120°. Четвертий, не гібридизований електрон вуглецю утворює π-зв'язок. Три атоми кисню мають шість неспарених електронв. В утворенні делокалізованих π-зв'язків з атомом вуглецю приймають участь чотири електрони. Останні два – обумовлюють заряд йона 2-. Насправді усі три зв'язки між вуглецем і атомами кисню рівноцінні і негативний заряд рівномірно розподіляється між усіма атомами кисню.
Вугільна кислота, як двохосновна, утворює середні та кислі солі. Перші називають карбонатами, другі – гідрокарбонатами: Na2CO3 і СаСО3 – карбонати натрію і кальцію; NaHCO3 і Са(НСО3)2 – гідрокарбонати натрію і кальцію. Усі гідрокарбонати та карбонати лужних металів і амонію добре розчинні у воді.
У розчині карбонат-іони гідролізуються з утворенням лужного середовища:
СО32- + Н2О = НСО3- + ОН-.
Водні розчини гідрокарбонатів лужних металів, внаслідок гідролізу гідрокарбонат-іонів мають слабколужне середовище з рН = 8.4:
Солі вугільної кислоти термічно нестійкі. Стійкими є лише карбонати лужних металів. Вони, крім Lі2СО3, плавляться без розкладу. Розкладання карбонатів лужноземельних металів необхідно проводити при значному нагріванні, так СаСО3 розкладається при 825 °С:
СаСО2 = СаО + CO2
Що стосується карбонатів малоактивних металів (міді, срібла, ртуті), то вони зовсім нестійкі. Для розкладання Ag2CO3 достатньо нагрівання до 100 °С.
Гідрокарбонати як лужних, так і лужноземельних металів легко розкладаються при слабкому нагріванні:
2NaHCO3 = Na2CO3 + CO2 + Н2О.
Стабільність гідрокарбонатів і карбонатів зростає із збільшенням металічних властивостей солетворних елементів.
5.6. Твердість води та способи її усунення
У природі чистої води не буває: вона завжди містить домішки яких-небудь речовин. Зокрема, взаємодіючи із солями, що містяться в земній корі, вона набуває певної твердості.
Твердість води – сукупність властивостей, зумовлених вмістом у воді катіонів кальцію і катіонів магнію.
Якщо концентрація цих катіонів велика, то воду називають твердою, якщо мала – м'якою. Саме вони надають специфічних властивостей природним водам. Під час прання білизни у твердій воді погіршується якість тканин і підвищуються витрати мила, необхідного на зв'язування катіонів Са2+ і Mg2+:
2С17Н35СОО- + Са2+ = (С17Н35СОО)2Са; 2С17Н35СОО- + Мg2+ = (С17Н35СОО)2Мg,
і піна утворюється лише після повного осадження цих катіонів.
Щоправда, деякі синтетичні мийні засоби добре миють і у твердій воді, оскільки їх кальцієві і магнієві солі легко розчиняються. У твердій воді погано розварюються харчові продукти, а зварені у ній овочі несмачні. Дуже погано заварюється чай, і смак його втрачається. Водночас у санітарно-гігієнічному відношенні ці катіони не є небезпечними, хоча при високому вмісті катіонів Mg2+ (як у морі чи океані) вода гіркувата на смак і виявляє послаблюючу дію.
Тверда вода непридатна для використання у парових котлах: розчинені у ній солі під час кип'ятіння утворюють на стінках котлів шар накипу, який погано проводить теплоту. Це призводить до перевитрат палива, передчасного зносу котлів, а іноді, внаслідок перегрівання котлів, і до аварії. Твердість води шкідлива для металевих конструкцій, трубопроводів, кожухів охолоджуваних машин.
Катіони кальцію Са2+ зумовлюють кальцієву твердість, а катіони Mg2+ – магнієвутвердість води. Загальна твердість складається з кальцієвої і магнієвої, тобто із сумарної концентрації у воді катіонів Са2+ і Mg2+.
Відносно процесів зм'якшення води розрізняють твердість карбонатну і некарбонатну. Карбонатною називається твердість, зумовлена наявністю тієї частини катіонів Са2+ і Mg2+, яка еквівалентна гідрокарбонатним іонам НСО-, що містяться у воді. Іншими словами, карбонатна твердість спричинена наявністю гідрокарбонатів кальцію і магнію. Під час кип'ятіння гідрокарбонати руйнуються, а малорозчинні карбонати, що утворюються, випадають в осад, і загальна твердість води зменшується на значення карбонатної твердості. Тому карбонатну твердість називають також тимчасовою твердістю. Під час. кип'ятіння катіони Са2+ осідають у вигляді карбонату кальцію:
Са2+ + 2НСО3- = СаСО3 + Н2О + СО2,
а катіони магнію Mg2+ – у вигляді основного карбонату або у вигляді гідроксиду магнію (при рН > 10,3):
2Mg2+ + 2НСО3- + 2ОН- = (МgОН)2СО3 + Н2О + СО2
Та частина твердості, що зберігається після кип'ятіння води, називається некарбонатною. Вона визначається вмістом у воді кальцієвих і магнієвих солей сильних кислот, переважно сульфатів і хлоридів. Під час кип'ятіння ці солі не видаляються, а тому некарбонатну твердість називають також постійною твердістю.
За значенням твердості природну воду розрізняють як дуже м'яку – з твердістю до 1,5; м'яку – від 1,5 до 4; середньої твердості – від 4 до 8; тверду – від 8 до 12 і дуже тверду – понад 12,мекв/л.
Дуже часто тверду воду перед використанням зм'якшують. Звичайно цього досягають обробкою води різними хімічними речовинами. Так, карбонатну твердість можна усунути додаванням гашеного вапна:
Са2+ + 2HCO3- + Са2+ + 2OН- = 2СаСО3 + 2Н2О;
Mg2+ + 2HCO3- + 2Са2+ + 4OН- = 2Mg(OH)2 + 2CaCO3 + 2Н2О.
При одночасному додаванні вапна і соди можна позбутися карбонатної і некарбонатної твердості (вапняно-содовий спосіб). Карбонатна твердість при цьому усувається вапном (див. вище), а некарбонатна – содою: Са2+ + CO32- = СаСО3;
Mg2+ + CO32- = MgСО3 і далі
MgCO3 + Са2+ + 2OН- = Mg(OH)2 + CaCO3.
Застосовують й інші способи усунення твердості води, серед яких один з найсучасніших ґрунтується на застосуванні катіонітів (катіонітний спосіб). Є такі тверді речовини, які містять у своєму складі рухливі іони, здатні обмінюватися на іони зовнішнього середовища. Вони дістали назву іонітів. Особливо поширені іонообмінні смоли, які добувають на основі синтетичних полімерів.
Іоніти (іонообмінні смоли) поділяють на дві групи. Одні з них обмінюють свої катіони на катіони середовища і називаються катіонітами, інші обмінюють свої аніони і називаються аніонітами. Іоніти не розчиняються у розчинах солей, кислот і лугів.
Для усунення твердості води застосовують катіоніти – синтетичні іонообмінні смоли і алюмосилікати.
Якщо пропускати воду крізь шари катіоніту, то іони натрію будуть обмінюватися на іони кальцію і магнію. Схематично ці процеси можна виразити рівняннями:
Са2+ + Na2R = 2Na+ + CaR;
Mg2+ + Na2R = 2Na+ + MgR.
Отже, іони кальцію і магнію переходять з розчину в катіоніт, а іони натрію – з катіоніту в розчин; твердість при цьому усувається.
Після використання більшої частини іонів натрію катіоніти звичайно регенерують – витримують у розчині хлориду натрію, за участю якого відбувається зворотний процес іони натрію заміщують у катюнпі іони кальцію і магнію, які переходять у розчин:
CaR + 2Na+ = Na2R + Са2+;
MgR + 2Na+ = Na2R + Mg2+.
Регенерований катіоніт знову можна використовувати для зм'якшення нових порцій твердої води.
6. Кремній
6.1. Поширення у природі
Кремній – другий за розповсюдженням, у природі після кисню елемент періодичної системи. У вільному стані у природі не зустрічається. Земна кора більше ніж наполовину складається з кремнезему SiO2, силікатних і алюмосилікатних порід.
6.2. Фізичні та хімічні властивості
Кремній – типовий неметал і найближчий електронний аналог вуглецю. У сполуках з киснем та іншими неметалами виявляє ступінь окиснення +4, рідше +2, у сполуках з воднем -4.
У атома кремнію, як і у атома вуглецю, в незбудженому стані на s-орбіталі знаходяться два спарених електрони, а р-орбіталі мають два неспарених електрони. У зв'язку із збільшенням числа електронних шарів у кремнію атомний радіус більший, ніж у вуглецю, а енергія іонізації і спорідненість до електрону – менші. Цим пояснюється зниження міцності міжатомних зв'язків, особливо у гомоатомних ланцюгах. Кремній на відміну від вуглецю менш схильний утворювати кратні зв'язки.
Оскільки у атома кремнію зовнішній енергетичний рівень має 3d-орбіталі, крім координаційного числа 4 у стані sр3-гібридизації, у нього зустрічаються сполуки, де кремній шестивалентний у sp3d2-гібридизованому стані.
Залежно від умов одержання кремній різниться за зовнішнім виглядом та властивостями. Аморфний кремній одержують прожарюванням суміші діоксиду кремнію з магнієм:
SiO2 + 2Mg = Si + 2MgO.
Це бурий реакційноздатний порошок. Якщо відновлювати діоксид кремнію вугіллям в електропечах, утворюється кристалічний кремній у вигляді сірих твердих, але досить крихких кристалів з температурою плавлення 1415 °С. SiO2 + 2С = Si + 2СО
Як показали досліди, аморфний і кристалічний кремній не є алотропними модифікаціями кремнію, вони різняться лише ступенем дисперсності.
Хімічна активність кремнію дуже залежить від стану його поверхні. Аморфний кремній значно легше вступає у хімічну взаємодію, ніж кристалічні компактні зразки. Дрібнодисперсний кремній реагує з фтором за звичайних умов: Si + 2F2 = SiF4.
Хлором і киснем кремній окиснюється лише при підвищеній температурі з утворенням SiCl4і SiO2. Взаємодія з вуглецем, азотом, бором перебігає лише при дуже високій температурі.
За звичайних умов кислоти на кремній не діють. Розчиняється він лише у суміші фтористоводневої та азотної кислот. При цьому азотна кислота окиснює кремній, а плавикова переводить нерозчинні продукти окиснення (SiO2) у комплексну сполуку – гексафторосилікат (ІV) водню:
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8Н2О.
У водному розчині H2[SiF6] стійка сильна кислота, в молекулі якої атомні орбіталі кремнію знаходяться у стані sp3d2 -гібридизації. У розчинах лугів кремній розчиняється навіть при зниженій температурі:
Si + 2NaOH + H2O = Na2SiО3 + 2H2
Кремній високої чистоти застосовують в електроніці і в електротехніці як напівпровідниковий матеріал.
Сполуки кремнію
Діоксид кремнію SiO2 – найбільш поширений оксид в земній корі. Він існує у вигляді декількох модифікацій. Звичайною формою SiO2 є кварц. Забруднений домішками кварц – звичайний пісок.
У воді SiO2 практично нерозчинний. Не діють на нього і кислоти, за винятком HF:
SiO2 + 4HF = SiF4 + 2Н2О,
Причиною розчинності SiO2 у HF є, по-перше, утворення газоподібного SiF4, а по-друге, у надлишку HF тетрафторид кремнію утворює добре розчинну у воді комплексну сполуку H[SiF6];
SiF4+ 2HF = H2[SiF6].
Із лугами SiO2 реагує повільно, нагрівання прискорює цей процес:
SiO2 + 2NaOH = Na2SiО3 + H2O.
Формула утвореного внаслідок реакції метасилікату натрію умовна, оскільки в залежності від умов проведення реакції утворюються силікати різної будови. Силікат натрію одержують спіканням SiO2 а гідроксидом натрію або карбонатом натрію:
SiO2 + Na2CO3 = Na2SiО3 + CO2
Здатність діоксиду кремнію взаємодіяти з лужними реагентами доводить його кислотну природу.
Утворений силікат натрію часто називають "розчинним склом", і його водні розчини «рідким склом», яке застосовують у будівництві для закріплення грунту.
Як сіль слабкої кислоти, силікат натрію у водному розчині сильно гідролізований:
Na2SiO3 = 2Na+ + SiO32-
SiO32- + H2O = HSiО3- + OH-,
2HSiO3- =Si2O52- + H2O
2Na2SiО3 + H2O = Na2Si2O5 + 2NaOH.
Внаслідок гідролізу утворюється диметасилікат натрію, і реакція середовища стає лужною.
Оскільки SiO2 нерозчинний у воді, метакремнієву кислоту, одержують непрямим шляхом — дією мінеральних кислот на розчини метасилікатів: Na2SiO3 + 2HC1 = H2SiО3 + 2NaСІ
Утворена кремнієва кислота виділяється з розчину у вигляді драглистого осаду – золю. Його склад відповідає формулі xSiO2 · уН2О. Залежно від умов проведення реакції утворюються різні кремнієві кислоти. Найпростішими кислотами є: H2SiО3 – метакремніева і – H4SiО4ортокремнієва кислоти. Усі кислоти, для яких х > 1, називають полікремнієвими.
Утворений золь кремнієвих кислот має ланцюгову і шарувату структуру. Через деякий час утворюється об'ємна, тримірна сітка. Золі кремнієвої кислоти спонтанно переходять у гелі. Цей процес значно прискорюють нагріванням.
Висушений гель кремнієвої кислоти (силікагель) має пористу будову із сильно розвинутою внутрішньою поверхнею. Його використовують як активний адсорбент газів, рідин і пароподібної води.
Водневі сполуки кремнію називають силанами або кремневоднями. За складом і структурою кремневодні анілогічні вуглеводням.
Формула сполук гомологічного ряду силанів має вигляд SiпH2п+2. У вільному стані виділені: SiH4 – моносилан, Si2H6 – дисилан, Si3H8 – трисилан тощо до Si6H14 включно.
Одержують силани дією кислот на силіциди активних металів:
Mg2Si + 4HC1 = 2MgCl2 + SiH4,
а також відновленням галогенідів кремнію воднем:
SiCl4 + 4Н2 = SiH4 + 4HC1.
За будовою і фізичними властивостями силани схожі на насичені вуглеводні. За хімічними властивостями вони різко відрізняються від представників гомологічного ряду метану. Це пояснюють меншою міцністю зв'язків Si-Si та більшою іонністю зв'язку Si—H порівняно із зв'язками С-С та СН.
Силани виявляють значні відновні властивості, легко окиснюються киснем повітря:
SiH4 + 2О2 = SiO2 + 2Н2О відновлюють KMnO4 до МnО2
3SiH4 + 8КМnО4 = 3SiO2 + МnО2 + 8КОН + 2Н2О
Силани застосовують для синтезу кремнійорганічних сполук. Гідролізом галогенозаміщених силанів одержують водневокисневі сполуки кремнію силікони. В них атоми кремнію зв'язані між собою через кисневий місток. Силікони з довгими ланцюгами є маслянистими рідинами, або пастоподібними речовинами і навіть каучукоподібними матеріалами. Силікони використовують в естетичній хірургії. Силіконові пластмаси — конструкційний матеріал для виготовлення внутрішніх протезів.
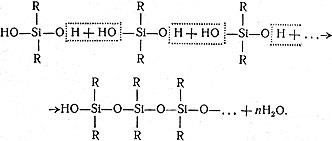
Галогеніди кремнію SіГ4 можна одержати синтезом з відповідних елементів. За звичайних умов SiF4 газоподібний, SiCl4 і SiBr4 – рідини, SiІ4 –
тверда речовина. Усі вони взаємодіють з водою. Продуктами гідролізу SiF4 e суміш двох кислот – слабкої H7SiО3 і сильної H3[SiF6]. SiF4 + 3H2O = H2SiО3 + 4HF
2HF + SiF4 = H2[SiF6], 3SiF4 + 3H2O = H2SiО3 + 2H3[SiF6].
Гідроліз солеподібного SiCl4 перебігає до кінця:
SiCl4 + 4H2О = H2SiО4 + 4HC1.
Молекули H4SiO4 з часом полімеризуються з відщепленням води:
H4SiО4 - Н2О = Н2SіО3.
Внаслідок гідролізу SiCl4 у вологому повітрі дуже димить. Тетрафторид кремнію, як і силани, застосовують для одержання кремнійорганічних сполук.
6.3. Поняття про будівельні матеріали
Із штучних силікатів найбільше значення мають скло, цемент і кераміка.
Керамікою називають матеріали і різні вироби, які виготовляють з природних глин шляхом формування, сушіння і випалювання. Це цегла, облицювальні плитки, черепиця, труби, глиняний посуд, фарфорові та фаянсові вироби тощо.
Скло. Склад звичайного віконного скла наближено виражається формулою Na2О∙СаО∙6SiO2.
Скло добувають сплавлянням у спеціальних печах суміші соди Na2CO3, вапняку СаСО3 і білого піску SiO2. Хімізм процесу можна представити так: при сплавлянні утворюються силікати натрію і кальцію: SiO2 + Na2СО3 = Na2SiO3 + СО2;
SiO2 + СаСО3 = СаSiO3 + СО2.
Ці силікати та кремнезем (його беруть у надлишку) сплавляють у масу, яка поступово охолоджується:
Na2SiO3 + СаSiO3 + 4SiО2 = Na2О∙СаО∙6SiO2.
Для виготовлення спеціального скла змінюють склад вихідної суміші. Замінюючи соду Na2СО3 поташем К2СО3, отримують тугоплавке скло (для хімічного посуду). Замінюючи крейду СаСО3 оксидом плюмбуму (II) PbO, а соду – поташем, добувають кришталеве скло. Воно має більшу променезаломлювальну здатність і застосовується для виготовлення художнього посуду.
Добавки оксидів металів до вихідної суміші надають склу різного забарвлення: оксид хрому (ІІІ) Сг2О3 – зеленого, оксид кобальту (IІ) СоО – синього, оксид мангану (ІV) МnО2 – червонувато-лілового і т.д. Скло при підвищенні температури поступово розм'якшується і переходить в рідкий стан. Зворотний процес також здійснюється поступово – скляна маса загусає в міру охолодження. На цій властивості скла ґрунтується формування з нього різних виробів. За допомогою машин із скляної маси витягують листове скло.
Із скла виготовляють волокна і тканини для технічних потреб. Освоєно випуск склокристалічних матеріалів – сигналів, які порівняно зі склом мають більшу міцність. З них виготовляють електричні ізолятори, посуд і т. ін.
Цемент. Звичайний силікатний цемент, або портландцемент, – зеленуватосірий порошок, який під час змішування з водою твердне на повітрі (або у воді), перетворюючись на камедеподібну масу. Звичайно його добувають прожарюванням (1400-1600°С) до спікання сировинної суміші, що складається з вапняку та глини.
Прожарювання здійснюється у спеціальних циліндричних обертових печах.
Спечена зерниста маса, що утворюється, називається клінкером. Це – напівфабрикат. Клінкер з відповідними добавками розмелюють до тонкого порошку в кульових млинах і отримують остаточний продукт.
У природі трапляються породи, які містять вапняк і глину у співвідношеннях, необхідних для добування портландцементу, їх називають мергелями. Значні поклади мергелю є в районі Новоросійська; на їх основі працюють великі цементні заводи.
Суміш сировини готують і штучним способом. Регулюючи склад суміші, отримують різні види цементу – швидкотвердіючі, морозостійкі, корозійностійкі та ін.
Із суміші цементу, води і наповнювачів (пісок, гравій, щебінь, шлак) після їх затвердіння отримують штучний камінь – бетон. Суміш цих матеріалів до затвердіння називається бетонною сумішшю. При затвердінні цементне тісто зв'язує зерна наповнювачів. Тверднення відбувається навіть у воді. Бетон зі стальною арматурою (внутрішнім каркасом) називається залізобетоном. Бетон і залізобетони у значних кількостях йдуть на спорудження гідроелектростанцій, шляхів, несучих конструкцій будівель.
Розроблено і виготовляються також бетони, в яких як зв’язуюче використовуються органічні полімери або полімери разом із цементом. Це так звані пластобетони, що мають особливі властивості.
Реакція якісного виявлення карбонат-іонів
У пробірку з газовідвідною трубкою помацають суху випробовувану речовину і додають декілька крапель розведеної сірчаної кислоти:
СО32- + 2Н+ = Н2СО3 ®СО2 + Н2О
Газовідвідну трубку опускають в іншу пробірку з вапняною або баритовою Ва(ОН)2водою:
Са(ОН)2 + СО2 = СаСО3 + Н2О.
Діоксид вуглецю, що виділяється, утворює малорозчинні осади СаСО3 або ВаСО3, які при дії надлишку СО2 переходять у розчинні гідрокарбонати кальцію чи барію:
СаСО3 + СО2 + Н2О = Са(НСО3)2.
Реакція якісного виявлення силікат-іонів
До розчину, який містить силікат-іони, додають розведену соляну або сірчану кислоту:
SiO32- + 2Н+ = H2SiО3.
У присутності силікат-іонів кремнієва кислота виділяється у вигляді білого драглистого осаду.
4. Підсумок заняття.
Дайте відповідь на питання:
1. Охарактеризуйте властивості елементів IV групи головної підгрупи згідно положення в періодичні системі.
2. Дайте визначення поняттю «алотропія». Охарактеризуйте явище на прикладі Карбону (доповіді студентів: ―Графіт‖, ―Алмаз‖).
3. Дайте характеристику кремнію, як простої речовини (фізичні властивості, поширення в природі, методи добування)
4. Хімічні властивості сполук Карбону та Силіцію (2 студенти біля дошки).
5. Галузі застосування кремнію та його сполук.
6. Охарактеризуйте фізичні властивості та біологічну роль карбон (II) оксиду.
7. Охарактеризуйте фізичні властивості та біологічну роль карбон (IV) оксиду.
5. Домашнє завдання
Опрацювати конспект
ТЕМА 3. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Заняття № 9
Дисципліна: «Хімія»
Тема заняття: Загальна характеристика металічних елементів. Метали як прості речовини. Хімічні властивості металів Мета заняття:
навчальна – на основі знань про періодичну систему елементів і будову атома дати загальну характеристику металічних елементів за їх положенням у періодичній системі й будовою атомів;
розвиваюча – поглибити знання студентів про метали як прості речовини; розглянути природу металічного зв’язку, будову металічної кристалічної ґратки.
виховна – виховувати цілеспрямованість, розширювати світогляд студентів.
Тип заняття: засвоєння нових знань
Міждисциплінарний зв’язок: «Екологія», «Біологія»
Дидактичне забезпечення: ПСХЕ, таблиці «Види хімічного зв’язку», «Типи кристалічних ґраток».
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
Прийом «Мозковий штурм»
1. Запишіть електронні формули Натрію, Магнію, Літію, Кальцію, Алюмінію, Карбону, Силіцію. Знайдіть елементи, у яких однакова кількість електронів на зовнішній оболонці. Згрупуйте їх попарно. Які з цих пар належать до металічних елементів? Де вони розташовані в періодичній системі?
2. На дошці записані основні поняття теми, які учні мають згадати й дати їм пояснення:
ü металічні елементи;
ü положення металічних елементів у пс;
ü особливості будови атомів металів (електрони на зовнішньому рівні, радіус атомів);
ü зміна металічних властивостей у періодах;
ü зміна металічних властивостей у групах.
ІІІ Мотивація навчальної діяльності
Наше життя неможливе без застосування металів для різних потреб. Але, щоб уміти застосовувати метали, треба знати їх будову та властивості.
Сьогодні на уроці ми поглибимо знання про металічні елементи, будову їх атомів та особливості будови на прикладі нового типу зв’язку – металічного, характерного тільки для металів.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Підведення підсумків заняття.
3. Домашня робота.
ХІД ЗАНЯТТЯ
1. Вивчення нового матеріалу
Доцільно почати вивчення нового матеріалу з короткого підсумку – огляду питань «Мозкового штурму». Підкреслити, що:
ü прості речовини поділяються на метали й неметали;
ü метали розташовані в лівій нижній частині періодичної системи,
переважно в І–ІІІ групах та побічних підгрупах інших груп під діагоналлю В – At;
ü у металів на зовнішній оболонці невелика кількість електронів (від
одного до трьох) та більші радіуси атомів порівняно з неметалами, тому що вони розташовані на початку періодів;
ü у періодах зі збільшенням протонних чисел металічні властивості
зліва направо зменшуються, у групах зі збільшенням протонних чисел зверху вниз металічні властивості збільшуються;
ü родини лантаноїдів та актиноїдів також належать до металів.
1.1. Загальна характеристика металічних елементів за їх положенням у періодичній системі та будовою атомів.
У даний час у періодичній системі Д.І.Менделєєва знаходиться 118 елементів, з яких близько 90 відносять до металів. Групи I А, II А, III А майже повністю складаються з металів (за винятком бору). Нижні місця у інших А – групах займають метали (олово, свинець, бісмут, полоній). Крім того із металів складаються В – групи періодичної системи. Усі f- елементи також відносяться до металів.
У атомах металів на зовнішньому енергетичному рівні звичайно міститься від одного до трьох електронів, їхні атоми мають, як правило, великий радіус. Атоми металів на відміну від атомів неметалів легко віддають зовнішні електрони, тобто є сильними відновниками. Тому атоми металів перетворюються в позитивно заряджені іони. Електрони, які відірвалися від атомів, відносно вільно рухаються між позитивно зарядженими іонами металів. Між цими частинками виникає зв'язок, тобто електрони ніби цементують окремі шари по¬зитивно заряджених іонів, що містяться у вузлах кристалічних решіток. Оскільки електрони перебувають у безперервному русі, то при їх зіткненні з позитивно зарядженими іонами останні перетворюються в нейтральні атоми, а потім знову в іони і т. д.
1.2. Кристалічні решітки
Кристалічні решітки, у вузлах яких містяться позитивно заряджені іони і деяка кількість нейтральних атомів, між якими рухаються відносно вільні електрони, називають металічними. Зв'язок, який здійснюють ці відносно вільні електрони між іонами металів, що утворюють кристалічну решітку, називають металічним.
Будова речовини. Метали в твердому етапі Кристалічні решітки, кристалічні речовини з металічним типом зв'язку. У перехідних металах зв'язок між атомами частково є ковалентним.
1.3. Знаходження металів у природі і загальні способи їх добування
Найпоширенішим металом у земній корі є алюміній. За ним ідуть залізо, кальцій, натрій, калій, магній і титан. Вміст інших металів незначний. Такі наприклад, хрому в земній корі за масою лише 0,3 %, нікелю – 0,2 %, а міді – 0,01 %.
Метали зустрічаються в природі як у вільному вигляді, так і в різних сполуках.
У природі метали існують переважно у вигляді сполук – оксидів (Fе3O4, Fе2O3), сульфідів (ZnS, РЬS), сульфатів (СаSO4, ВаSO4), хлоридів (КС1, NaCl), карбонатів (СаСO3, FеСO3, ZnСO3), фосфатів (Са3(РO4)2) і нітратів (NaNO3, KNO3).
У вільному стані в земній корі трапляються лише метали, які в ряду стандартних електродних потенціалів знаходяться праворуч від водню – мідь, ртуть, срібло, золото, платина.
Способи добування. Найактивніші метали Na, К, Са, Мg добувають електролізом. Менш активні метали відновлюють з їхніх оксидів вугіллям, оксидом вуглецю (II) або алюмінієм, а сульфіди металів спочатку випалюють.
1. Відновлення металів з їхніх оксидів вугіллям або оксидом вуглецю, воднем (II):
Cu + C = Cu + CO Zn + C = Zn + CO
СаО + Н2 = Н2О + Са
2. Якщо метал одержують із сульфідів, ці сполуки спочатку перетворюють на оксиди шляхом випалювання сульфідів металів з наступним відновленням утворених оксидів:
2ZnS +3O2 = 2ZnO + 2SO2
3. Відновленням металів з їхніх оксидів активнішими металами
(алюмінотермія):
3MnO2 + 4Al = 2Al2O3 + 3Mn
4. Електроліз розплавів.
1.4. Загальні фізичні та хімічні властивості металів.
Усі метали, крім ртуті та францію, за звичайної температури – це тверді речовини кристалічної будови. У кристалічному стані вони добре відбивають світло і тому непрозорі, мають характерний металічний блиск. Найкраще відбивають світло індій та срібло, тому їх використовують для виготовлення дзеркал у прожекторах і рефлекторах. Майже всі метали (за винятком золота та міді) мають білий або сірий колір з різними відтінками. У порошкоподібному стані більшість металів набувають чорного або темно-сірого кольору. Усі метали добре проводять електричний струм і теплоту. Найкращі провідники електричного струму та теплоти – срібло і мідь.
Метали – пластичні речовини. Пластичність – це здатність легко змінювати форму під дією зовнішніх сил і зберігати одержану форму після припинення цієї дії. Найбільш пластичний метал – золото. З нього можна виготовляти дуже тонку фольгу і тягнути тонкі нитки. Характерні фізичні властивості металів пояснюються особливостями їх внутрішньої структури: наявністю електронного газу – вільних електронів.
Густина, температури плавлення, кипіння та твердість металів залежать від їх індивідуальних властивостей – маси атома, заряду ядра, міцності металічного зв'язку.
За густиною метали поділяють на легкі, густина яких не перевищує 5000 кг • м~3 (літій, натрій, магній, алюміній тощо), і важкі з густиною понад 5000 кг • м~3 (цинк, залізо, мідь, ртуть тощо). За температурами плавлення розрізняють легкоплавкі та тугоплавкі метали. Найнижчу температуру плавлення має ртуть (– 38,87 °С), найвищу – вольфрам (3410 °С). За твердістю метали поділяють на тверді та м'які. Найтвердішими є хром і вольфрам, найм'якішими – натрій, калій та індій.
За іншими ознаками розрізняють такі метали: чорні (залізо, марганець, хром), кольорові (усі інші), рідкісні (літій, рубідій, цезій, берилій, молібден, вольфрам, цирконій, гафній, ванадій, ніобій, тантал та іи.), рідкісноземельні (скандій, ітрій, лантан і лантаноїди), розсіяні (галій, індій, талій і германій), лужні (літій, натрій, калій, рубідій, цезій, францій), лужноземельні (кальцій, стронцій, барій, радій), благородні (золото, срібло, платина, паладій, родій, іридій, рутеній та осмій), радіоактивні (технецій, прометій, полоній, францій, радій, актиній та актиноїди) тощо.
1.5. Хімічні властивості.
Хімічні властивості металів визначаються здатністю їх атомів легко віддавати свої валентні електрони і перетворюватися на позитивні іони внаслідок низьких значень електронегативностей, які обумовлені невисокими енергіями іонізації атомів і невеликою (часто від'ємною) спорідненістю до електрона.
1. З простими речовинами (киснем, сіркою, хлором, азотом, фосфором, воднем, вуглецем):
Са + Cl2 = CaCl2
2Mg + O2 = 2MgO 2Na + S = Na2S Ca + C = CaC2
2Na + H2 = 2NaH
3Mg + N2 = Mg3N2 3Ca + 2P = Ca3P2
2. З складними речовинами (водою, кислотами, солями): Zn + 2HCl = ZnCl2 + H2
2Na + 2НОН(H2O) = 2NaОН + H2 Fe + CuSO4 = FeSO4 + Cu
1.6. Поширеність металічних елементів та їх сполук у природі.
Найпоширенішим металом у земній корі є алюміній. За ним ідуть залізо, кальцій, натрій, калій, магній і титан. Вміст інших металів незначний. Такі наприклад, хрому в земній корі за масою лише 0,3 %, нікелю – 0,2 %, а міді – 0,01 %.
Метали зустрічаються в природі як у вільному вигляді, так і в різних сполуках
У природі метали існують переважно у вигляді сполук – оксидів (Fе3O4, Fе2O3), сульфідів (ZnS, РЬS), сульфатів (СаSO4, ВаSO4), хлоридів (КС1, NaCl), карбонатів (СаСO3, FеСO3, ZnСO3), фосфатів (Са3(РO4)2) і нітратів (NaNO3, KNO3).
У вільному стані в земній корі трапляються лише метали, які в ряду стандартних електродних потенціалів знаходяться праворуч від водню – мідь, ртуть, срібло, золото, платина.
2. Підбиття підсумків заняття
Прийом «Вірю – не вірю»
Студенти повинні підняти руку, якщо вони приймають за правильне («вірю») певне твердження.
1. Метали розташовані у правій верхній частині періодичної системи. (Ні)
2. Прості речовини поділяються на метали й неметали. (Так)
3. У металів на зовнішній оболонці невелика кількість електронів – від одного до трьох. (Так)
4. У металів менші радіуси атомів порівняно з неметалами. (Ні)
5. У періодах зі збільшенням протонних чисел металічні властивості зліва направо зменшуються. (Так)
6. У групах зі збільшенням протонних чисел металічні властивості зверху вниз зменшуються. (Ні)
7. Металічний зв’язок обумовлюють вільні електрони – електронний газ.
(Так)
3. Домашнє завдання
Опрацювати конспект
ТЕМА 3. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Заняття № 10
Дисципліна: «Хімія»
Тема заняття: Лужні та лужноземельні елементи та їх сполуки Мета заняття:
навчальна – поглибити й розширити знання про метали на прикладі лужноземельних елементів; вивчити зв'язок між властивостями оксидів та гідроксидів, солей Кальцію та
Магнію, їх одержанням і застосуванням;
розвиваюча – розвивати спостережливість студентів на занятті хімії; розвивати пізнавальний інтерес студентів до предмету; розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей Кальцію й Магнію, та їхніх сполук; розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки;
виховна – формувати науковий світогляд студентів при вивченні фізичних та хімічних властивостей лужноземельних металів та їхніх сполук, їх застосування; сприяти екологічному вихованню..
Тип заняття: засвоєння нових знань
Міждисциплінарний зв’язок: «Екологія», «Біологія» Дидактичне забезпечення: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, металічний Кальцій, циліндр з дистильованою водою, фенолфталеїн
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія,
2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
Бесіда
1. Як називаються елементи першої групи головної підгрупи?
2. Які фізичні властивості лужних металів?
3. Які хімічні властивості лужних металів?
4. Назвіть найактивніший лужний метал.
ІІІ Мотивація навчальної діяльності
Кальцій є дуже розповсюдженими хімічним елементом, як у природі, так і в організмі людини. Тож давайте розглянемо властивості цього елемента та родини, до якої він входить .
ІV Сприйняття й засвоєння нових знань:
План
4. Вивчення нового матеріалу.
5. Підведення підсумків заняття.
6. Домашня робота.
ХІД ЗАНЯТТЯ
1. Вивчення нового матеріалу
1.1. Положення в Періодичній системі хімічних елементів Д.І.Менделєєва.
Будова атома.
Прості речовини елементів І групи головної підгрупи називаються лужними металами. Лужними вони називаються тому, що їх гідроксиди є сильними лугами. До цих елементів належать Літій, Натрій, Калій, Рубідій, Цезій і Францій.
Атоми лужних металів, маючи один електрон на зовнішньому енергетичному рівні (s1), легко віддають його при хімічних реакціях. Віддаючи електрон, нейтральні атоми перетворюються в однозарядні позитивні йони: Na0 – 1ē → Na+
У сполуках ці елементи проявляють ступінь окиснення +1 і утворюють тільки йонні сполуки. У вільному вигляді атоми електронейтральні (ступінь окиснення нуль). Валентність І.
В межах кожного періоду це найбільш активні металічні елементи і найсильніші відновники. Із зростанням порядкового номера збільшується радіус атомів. Зовнішній або валентний електрон усе більше віддаляється від ядра і металічні властивості зростають
Li → Na → K → Rb → Fr.
Елементи другої групи головної підгрупи періодичної системи елементів називають лужноземельними металами тому, що гідроксиди цих металів проявляють лужні властивості, а оксиди цих металів тугоплавкі і подібні до оксидів алюмінію і важких металів, які назвали землями. Пластичні метали, але значно твердіші за лужні метали, менш легкоплавні.
Зовнішній електронний шар атома Кальцію складається з двох електронів. Віддаючи ці два електрони атом перетворюється на позитивно заряджений катіон
Ca2+. У своїх сполуках Кальцій двовалентний.
1.2. Знаходження в природі
Внаслідок хімічної активності лужні метали зустрічаються в природі у вигляді сполук:
Натрію в земній корі становить 2,64%.
NaCl – кухонна сіль, кам’яна сіль.
Na2SO4 • 10H2O – глауберова сіль.
Na2CO3 – сода кальцинована.
NaNO3 – чилійська селітра.
Вміст Калію в земній корі становить 2,6% K2CO3 – поташ ( у золі деяких рослин).
KCl • NaCl – сильвініт.
KCl • MgCl2 • 6H2O – карналіт.
KCl • MgSO4 • 6H2O – каїніт.
К – входить до складу майже всіх рослин
Інші елементи належать до рідкісних, і їх сполук у природі мало. Францій добуто штучно в результаті ядерних реакцій.
Кальцій хімічно активний, тому зустрічається в природі тільки у вигляді сполук. За вмістом у земній корі він посідає п’яте місце. Найбільш поширеною сполукою є мінерал кальцит СаСО3 (головна складова частина вапняку, мармуру, крейди та прозора різновидність кальциту – ісландський шпат).
Кальцій карбонат входить до складу мінералу доломіту – СаСO3•MgСO3, плавикового шпату СаF2, норвезької селітри Са(NO3)2, входить до складу алюмосилікатів. Часто зустрічаються поклади кальцій сульфату у вигляді мінералу гіпсу – СаSO4•2H2O. Кальцій у вигляді фосфату Са3(РО4)2 входить до складу фосфориту й апатиту. Йони Кальцію містяться у природних водах і ґрунті, в організмі тварин: в кістках (близько 80% кальцій фосфату), черепашках молюсків, яєчній шкарлупі.
Магній входить до складу силікатів, азбесту, тальку, доломіту, карналіту.
1.3. Фізичні та хімічні властивості лужних та лужноземельних металів.
Натрій і калій – метали сріблясто-білого кольору з незначними відтінками на свіжозрізаній поверхні, легкі, м’які, легко ріжуться ножем, легкоплавкі. На повітрі лужні метали легко окиснюються, тому блискуча поверхня свіжого зрізу металу швидко мутніє. Лужні метали зберігають в олії або їх покривають шаром гасу. Лужні метали добре розчиняються у ртуті, утворюючи амальгами. Температура плавлення натрію становить – 97,8ºC (зменшується від літію до цезію). Натрій і калій мають високу електричну і теплову провідність. Внесені у полум’я пальника сполуки натрію забарвлюють полум’я у жовтий колір, а калію – у фіолетовий. Цю властивість використовують для розпізнавання цих сполук.
Кальцій твердий, легкий, ковкий, легкоплавкий метал. Сполуки Кальцію забарвлюють полум’я у цегляно-червоний колір. Як і лужні метали, його зберігають під шаром гасу.
Хімічні властивості металів та їх сполук
Лужні метали найактивніші з усіх металів. Вони розміщені на початку електрохімічного ряду напруг металів. Реакційна здатність дуже велика. Уже при кіматній температурі вони реагують з багатьма неметалами:
ü воднем при нагріванні утворюють тверді речовини гідриди. Гідриди металів легко розкладаються водою з утворенням відповідного лугу і водню:
2Na + H2 = 2NaH;
NaH + H2O = NaOH + H2.
ü під час горіння натрію і калію в кисні утворюються пероксиди:
2Na + O2 = Na2O2.
Під час повільного окиснення або горіння в умовах недостачі кисню утворюються оксиди:
4Na + O2 = 2Na2O.
ü внаслідок взаємодії з іншими неметалами (Cl2, N2, P, S, Si, Br2, I2, C) утворюються солі – тверді кристалічні йонні сполуки:.
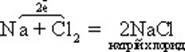
ü калій і натрій бурхливо реагують з водою за звичайних умов з утворенням гідроксидів і водню:
2Na + 2H2O = 2NaOH + H2↑.
При взаємодії з водою кусочок натрію плавиться і набувши форму кульки «бігає» по поверхні води завдяки підштовхуванню його воднем, який виділяється.
При взаємодії калію з водою утворений водень самозагоряється.
ü натрій і калій енергійно взаємодіють з кислотами – слабкими окисниками
HCl, H2SO4(розбавлена), HBr, HI, H2S тощо, з утворенням солі і водню:
2Na + 2HCl = 2NaCl + H2.
Під час реакції з кислотами – сильними окисниками HNO3 і концентрованою H2SO4натрій і калій відновлюють Нітроген і Сульфур відповідних кислот до нижчих ступенів окиснення. Паралельно відбувається взаємодія цих металів з водою з утворенням водню. Ці реакції супроводжуються вибухом:
8Na + 10HNO3(розб) = 8NaNO3 + NH4NO3 + 3H2O; 8Na + 5H2SO4 = 4Na2SO4 + H2S + 4H2O.
Кальцій є активним металом.
1. Взаємодія з неметалами: за звичайних умов кальцій легко вступає в реакцію з киснем повітря та галогенами, наприклад:
Ca + Cl2 = CaCl2.
Під час нагрівання кальцій реагує з азотом, сіркою, вуглецем, фосфором і воднем, утворюючи солі – йонні кристалічні сполуки:
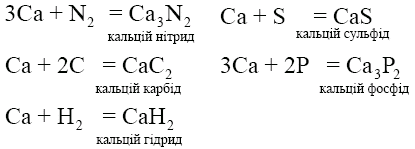
При нагріванні на повітрі кальцій згоряє, утворюючи кальцій оксид: 2Ca + O2 = 2CaO.
2. Взаємодіє з холодною водою повільно, а з гарячою – дуже енергійно з утворенням гідроксиду і водню:
Ca + 2H2О = Ca(ОН)2 + H2.
Фенолфталеїн у добутому розчині набуває малинового забарвлення.
3. Кальцій активно реагує з кислотами:
Ca + 2HCl = CaCl2 + H2.
4. Кальцій може відбирати Оксиген від оксидів та галоген від галогенідів менш активних металів, тобто має відновні властивості:
2Ca + TiO2 = 2CaO + Ti
2Ca + TiCl4 = 2CaCl2 + Ti
1.4. Добування лужних та лужноземельних металів
Натрій добувають електролізом розплавів натрій хлориду та натрій гідроксиду. Добувати калій електролізом KCl і KOH небезпечно і економічно не вигідно. Калій добувають так:
ü через розплавлений калій хлорид пропускають пару натрію при 800ºС, а пару калію що виділяється, конденсують
KCl + Na = NaCl + K;
ü взаємодія розплавленого калій гідроксиду з рідким натрієм в
реакційній колонці з нікелю:
KOH + Na = NaOH + K.
У промисловості кальцій добувають електролізом розплаву суміші кальцій хлориду CaCl2 і кальцій флуориду CaF2 у відношенні 3 : 1. Останній додають для зниження температури плавлення суміші.
1.5. Сполуки лужних та лужноземельних металів
Оксиди Na2O і K2O – основні. Це тверді речовини білого кольору. Добувають натрій оксид нагріваючи натрій в недостатній кількості кисню при температурі не вищій 180°С, або при нагріванні суміші натрій пероксиду з металічним натрієм:
Na2O2 + 2Na = 2Na2O.
При взаємодії оксидів з водою утворюють гідроксиди: Na2O + H2O = 2NaOH.
Практичне значення має натрій пероксид, який взаємодіє з вуглекислим газом з виділенням кисню. Цю реакцію використовують на підводних човнах, космічних кораблях та закритих приміщеннях для регенерації повітря: 2Na2O2 + CO2 = 2Na2CO3 + O2.
Гідроксиди NaOH і KOH – білі, непрозорі, тверді кристалічні речовини, дуже гігроскопічні, милкі на дотик, вони роз’їдають шкіру і тканини, тому називаються їдкими лугами: KOH – їдке калі, NaOH – їдкий натр, каустик або каустична сода (в перекладі «пекуча»).
Гідроксиди лужних металів не можна нагрівати в скляній, фарфоровій і платиновій посудині до плавлення, тому що в розплавленому стані вони роз’їдають скло, фарфор, а при доступі повітря і платину.
Виявляють усі властивості основ.
Тверді гідроксиди NaOН і KOH поглинають вологу на повітрі, завдяки чому використовуються для осушування газів. Тверді гідроксиди та їх водні розчини поглинають вуглекислий газ:
NaOH + CO2 = NaHCO3.
У воді добре розчиняються з виділенням великої кількості теплоти. Розчини лугів змінюють колір індикаторів – фіолетовий лакмус синіє, а безбарвний фенолфталеїн стає малиновим. Луги взаємодіють з кислотами, кислотними оксидами та солями малоактивних металічних елементів:
2KOH + H2SO4 = K2SO4 + 2H2O
(реакція нейтралізації) 2KOH + СO2 = K2СO3 + H2O
2KOH + CuCl2 = 2KCl + Cu(OH)2
(утворення нерозчинної основи)
Натрій утворює солі з усіма кислотами.
Більшість солей білі, добре розчинні у воді.
Застосування
NaCl – найважливіша із солей.
Ця сіль необхідна нашому організму, тому ми вживаємо її в їжу. Її використовують для консервування харчових продуктів, добування натрій гідроксиду, соди, хлору, хлоридної кислоти.
Na2CO3 – для виробництва скла, твердого мила, пом’якшення води при фарбуванні, очистки замаслених деталей.
NaOH – для очистки нафтопродуктів, в паперовій і текстильній промисловості, виробництво штучних волокон, напівпровідників, мила.
NaHCO3 – харчова сода.
Na2SiO3 – рідке скло, силікатний клей.
NaNO3 – харчова приправа (азотне добриво).
K – теплоносій в ядерних реакторах, використовують у фотоелементах, в органічному синтезі.
Na – як каталізатор в оргсинтезі (виробництво каучуку), відновник тугоплавких металів, як теплоносій в ядерних реакторах, наповнювач газорозрядних натрієвих ламп, в сплавах із свинцем для виготовлення підшипників.
KOH – добування рідкого мила, електроліт в акумуляторах, очищувач повітря.
K2CO3 – для виробництва скла, рідкого мила, як мінеральне добриво.
KMnO4 – для дезінфекції.
K2Cr2O7 – дублення шкіри, виробництва оранжевих барвників.
Калій являє собою елемент, конче необхідний для живлення рослин. Натрій впливає на скорочення м’язів, забезпечує нормальне функціонування серцевого м’яза, регулює середовище організму.
Натрій приймає участь у підтриманні кислотно-лужного балансу в організмі. Натрій у великій кількості міститься в рослинах, які ростуть на засолених ґрунтах. У цих рослинах він створює осмотичний тиск клітинного соку, завдяки чому вони вбирають воду із засолених ґрунтів.
Завдяки великій хімічній активності металічний кальцій застосовують для відновлення деяких тугоплавких металів (титан, цирконій) з їхніх оксидів. Його використовують для очищення чавуну і сталі від домішок, для добування деяких сплавів (свинцево-кальцієвих), для виготовлення підшипників та оболонок кабелів.
Сполуки кальцію
Кальцій оксид CaO (технічні назви: негашене вапно, кипілка, палене вапно) – тугоплавна речовина білого кольору, температура плавлення 2570ºС, з яскраво вираженими основними властивостями.
Добувають кальцій оксид окисненням кальцію:
2Ca + O2 = 2CaO;
а в промисловості випалюванням вапняку при температурі 1000-1100ºС: CaCO3 t= CaO + CO2.
Як усі основні оксиди взаємодіє з кислотами та кислотними оксидами з утворенням солей.
CaO + 2HCl = CaCl2 + H2O CaO + SO3 = CaSO4.
Оксид кальцію, зв’язуючи вуглекислий газ, перетворюється в карбонати: CaO + CO2 = CaCO3.
Взаємодію кальцій оксиду з водою, називають гашенням вапна, яке відбувається з виділенням великої кількості теплоти. Частина води при цьому перетворюється в пару, а шматочки оксиду розсипаються в крихку масу кальцій гідроксиду, який називають гашеним вапном:
CaO + H2O = Ca(OH)2.
Кальцій оксид застосовують переважно для гасіння вапна. Його застосовують у промисловості як в’яжучий матеріал.
Кальцій гідроксид Ca(OH)2 – (гашене вапно) тверда речовина білого кольору погано розчинна у воді, у подрібненому стані його називають пушонкою.
Розчин (завись) вапна у воді називають вапняним молоком. Його застосовують для біління приміщень, вапнування дерев, у виробництві цукру. Безбарвний прозорий розчин Ca(OH)2 називають вапняною водою. Суміш гашеного вапна, піску і води називається вапняним розчином. Кальцій гідроксид має лужні властивості. Він взаємодіє з кислотами, кислотними оксидами та солями малоактивних металів.
Під час пропускання вуглекислого газу через вапняну воду, прозорий розчин мутніє, тому що утворюється нерозчинний у воді кальцій карбонат CaCO3.
Ca(OH)2 + CO2 = CaCO3 + H2O.
Це якісна реакція на йони кальцію.
У разі тривалого пропускання вуглекислого газу каламуть зникає, тому що кальцій карбонат перетворюється на розчинний у воді кальцій гідрогенкарбонат Ca(HCO3)2.
Ця реакція оборотна. Під час нагрівання розчин кальцій гідрогенкарбонату мутніє, оскільки утворюється нерозчинний кальцій карбонат і виділяється вуглекислий газ.
Ці реакції відіграють важливу роль у природі. Дощова вода розчиняє вуглекислий газ і, просочуючись крізь ґрунт, взаємодіє з вапняком, розчиняючи його у вигляді гідрокарбонату. Особливо ця реакція відбувається в товщах вапнякових порід. Коли така вода виходить на поверхню і випаровується, залишається кальцій карбонат. У результаті колообігу солей кальцію утворюються карстові печери, виникнення у них сталактитів і сталагмітів.
Кальцій, необхідний всім живим організмам: забезпечує ріст скелета, він прискорює роботу серцевого м’язу, необхідний для утворення цитоплазматичних мембран, впливає на в’язкість цитоплазми. Кров з пониженим вмістом Са2+ не згортається на повітрі, тому при найменшій подряпині це може призвести до втрати крові. Без Кальцію в ґрунтовому розчині не можуть нормально розвиватися корені, вони ослизнюються. При нестачі Кальцію в рослинах верхні пагони біліють, а потім з’являються жовтуваті плями. У кісточкових плодових дерев при цьому на корі виникають тріщини, з яких витікає клей, і значно погіршується або зовсім припиняється плодоношення.
Ca(NO3)2 використовують як цінне нітратне добриво.
Гашене вапно в складі вапняного розчину, широко використовують в будівництві для скріплення цегли і штукатурки. З часом, вбираючи з повітря вуглекислий газ, суміш «тужавіє» внаслідок утворення кальцій карбонату, і стає настільки міцною, що коли ламаються старі будинки, тріщини проходять по цеглинах, а не по прошарках, що їх зв’язують.
З численних солей кальцію найпоширеніші в природі і найбільше практичне значення мають карбонати.
Крейда – для виробництва ґуми, фарби, зубного порошку.
CaCO3 – у будівництві, металургії, виробництві цементу, вапнуванні ґрунтів, видалення пустої породи при виробництві сталі і чавуну.
CaSO4•2H2O – у медицині.
CaSO4•H2O – у будівництві, виготовленні статуеток, поліпшенні структури ґрунтів.
Ca(OH)2 – в суміші з CuSO4 – «бордокська рідина» проти шкідників сільського господарства.
Слід пам’ятати, що працювати із лужними металами й лугами можна, тільки захистивши очі окулярами або прозорим екраном.
4. Підбиття підсумків заняття
Напишіть рівняння хімічних реакцій, щоб здійснити ланцюжок перетворень:
1. Ca → CaO → Ca(OH)2 → CaCO3 → CaHCO3
2. Mg → MgO → MgCl2 →MgSO4
5. Домашнє завдання
Опрацювати конспект
ТЕМА 3. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Заняття № 11
Дисципліна: «Хімія»
Тема заняття: Алюміній, його сполуки, застосування. Ферум, як представник металічних елементів побічних підгруп Мета заняття:
навчальна – розглянути розташування елементу Алюмінію в періодичній системі (β=ІІ); розібрати внутрішню будову, фізичні та хімічні властивості металів ІІІА групи, а також основних їх сполук (β=ІІ); розібрати та обґрунтувати загальну характеристику, поширення в природі, методи одержання, фізичні та хімічні властивості елементів ІІІ А групи, а також основних їх сполук (β=ІІ);
розвиваюча – розвивати спостережливість студентів на занятті хімії; розвивати пізнавальний інтерес студентів до предмету; розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей заліза та його сполук; розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки;
виховна – виховувати свідоме відношення до процесу навчання, організованості, дисциплінованості.
Тип заняття: засвоєння нових знань
Міждисциплінарний зв’язок: «Екологія», «Біологія» Дидактичне забезпечення: періодична система хімічних елементів, таблиця розчинності, ряд активності металів.
Література: 1. Ярошенко О.Г. Хімія 10 клас. – Київ: Грамота, 2010. – 223 с.
2. Величко Л.П. Хімія 11 клас академічний рівень. – Київ: Освіта, 2012. – 220 с.
3. Домбровський А.В., Лукашова Н.І., Лукашов С.М. Хімія 1011 клас. – Київ: Освіта, 1998. – 192 с.
4. Хомченко І.Г. Загальна хімія./Пер. з рос. М.Д.Михайлової.–
К.: Вища шк., 1993.– 424 с.
5. Буринська Н.Н., Величко Л.П. Хімія 10 клас. – Київ: Ірпінь, 1999. – 176 с.
6. Ярошенко О.Г. Хімія 9 клас. – Київ: Освіта, 2009. – 224 с.
7. Попель П.П., Крикля Л.С. Хімія 10 клас. – Київ: Академія, 2018 – 185 с.
8. Ярошенко О.В. Хімія 10 клас – Київ: Грамота, 2010 – 230 с. 9. Величко Л.П. Хімія 11 клас – Київ: Грамота 2010 – 296 с.
10. http://www.colleg.ua
11. http://www.alhimik.ua
ЗМІСТ ЗАНЯТТЯ І Організаційний момент:
• привітання з групою;
• перевірка присутніх на занятті;
• оголошення теми та мети заняття.
ІІ Актуалізація опорних знань
Бесіда
1. Назвіть хімічні елементи головної підгрупи?
2. Назвіть хімічні властивості Алюмінію та його сполук.
3. Які ви знаєте елементи,що входять до побічних підгруп?
ІІІ Мотивація навчальної діяльності
Ми вже з вами розглянули властивості Алюмінію та його сполук, а сьогодні розглянемо властивості заліза та його сполук.
ІV Сприйняття й засвоєння нових знань:
План
1. Вивчення нового матеріалу.
2. Підведення підсумків заняття.
3. Домашня робота.
ХІД ЗАНЯТТЯ
1. Вивчення нового матеріалу
1.1. Алюміній
Електронна формула атома алюмінію у незбудженому стані
1s22s22р63s23р1
У порівнянні з бором атомний радіус алюмінію більший, а енергія іонізації менша, тому металічні властивості з переходом до алюмінію зростають. На відміну від неметалу бору алюміній є амфотерним елементом. Так, металічний алюміній, його оксид та гідроксид розчиняються як у кислотах так і в лугах. Природні сполуки та одержання алюмінію

Алюміній – один з найпоширеніших елементів. Він займає перше місце серед металів і третє місце після кисню і кремнію. У зв’язку з високою хімічною активністю алюміній у вільному стані в природі не зустрічається. Найбільш доступні поклади гідратів оксиду у алюмінію типу бокситів Аl2О3 Н2О, а також поклади кріоліту Na3AlF6.

Проте більша частина алюмінію міститься в алюмосилікатах, з яких в основному сформована земна кора. Їм відповідають такі мінерали як каолін Аl2О3 2SiO2 2H2O і нефелін Nа2О Аl2О3 · 2SiO2.
Алюміній одержують електролітично у значних кількостях з бокситу А12О3 · nН2О (де n = 1-3). Він є найбільш цінною алюмінієвою рудою, яка містить більш 50 % Аl2О3.

Боксит, в якому присутні, домішки заліза, міді та кремнію, очищаютьрозчиненням у водному розчині NaOH з наступним переосадженням у вигляді Аl(ОН)3 за допомогою СО2.Гідроксид алюмінію нагрівають до утворення Аl2О3, яки розчиняють у розплаві кріоліту Na3AlF6 для зниження температури плавлення електроліту і поліпшення перебігу процесу. Проводять електроліз при 800-1000 С.
Одержаний за таким методом алюміній містить 98,5 – 99,8 % основної речовини. Шляхом електролітичного рафінування можна одержати алюміній з чистотою 9,9 %.
Фізичні та хімічні властивості алюмінію
Алюміній – сріблясто-білий метал, відносно легкий. Завдяки високій пластичності, легко піддається прокату, штампуванню і волочінню. При виробництві готових лікарських засобів широко використовують алюмінієву фольгу як пакувальний матеріал.
На повітрі алюміній вкривається дуже міцною тонкою плівкою Аl2О3 (приблизної 10 – 6см). Це пояснює його стійкість за звичайних умов до дії кисню, води і багатьох інших реагентів. При прожарюванні дрібнодисперсного порошкоподібного алюмінію він енергійно згоряє на повітрі:
4А1 + 3О2 = 2А12О3
Аналогічно відбувається його взаємодія з сіркою:
2А1 + 3S = A12S3
З галогенами, за винятком йоду, алюміній взаємодіє при кімнатній температурі. При змочуванні водою (каталізатор) суміші подрібнених алюмінію та йоду відбувається бурхлива реакція:
2А1 + 3І2 → 2А1І3
За звичайних умов алюміній не взаємодіє з водою. Оксидну плівку з поверхні алюмінію можна зняти двома шляхами: механічним і амальгуванням. Оскільки ртуть має здатність розчиняти в собі алюміній з утворенням речовини темно-сірого кольору – амальгами, то цілісність оксидної плівки можна порушити дією металічної ртуті чи нанесенням на алюмінієву поверхню розчину
Hg(NO3)2 При цьому відбувається «витиснення» металічної ртуті з розчину
Hg(II):
2А1 + 3Hg2+ = 2А13+ + 3Hg
Внаслідок втрати захисної плівки алюміній: активно взаємодіє з водою з утворенням гідроксиду алюмінію та виділенням бульбашок водню:
2А1 + 6Н2О = 2А1(ОН)2 + 3Н2
У зв'язку з тим, що алюміній має амфотерні властивості, він легко розчиняється у розчинах кислот:
2А1 + 6НС1 + 12Н2О = 2[А1(ОН2)6]С13 + 3Н2
У водному розчині алюміній завжди утворює гідратований іон
[Аl(ОН2)6])+, в якому він має координаційне число 6.
У розчинах лугів алюміній розчиняється з утворенням гексагідроксокомплексів:
2А1 + 6NaOH + 6Н2О = Na3[Al(OH)6] +3Н2
Оскільки на поверхні металічного алюмінію існує міцна захисна плівка А12О3, алюміній не взаємодіє з концентрованими азотною і сірчаною кислотами.
Нагріванням алюмінію з вуглецем в електричній печі (2000°) одержують карбід А14С3, який взаємодіє з водою з утворенням гідроксиду алюмінію і метану:
А14С3+ 12Н2О = 4А1(ОН)3+3СН4
Найважливіші сполуки алюмінію
Оксид алюмінію Аl2О3. При нагріванні алюміній енергійно взаємодіє з киснем:
4А1 + 3О2 = 2А12О3
Оксид алюмінію існує у вигляді двох модифікацій: α-А12О3 і γ-А12О3. Частіше зустрічається α-форма А12О3 – корунд. Інколи у природі трапляється корунд, у структурі якого присутні інші елементи, що надають йому певного забарвлення. Червоний рубін забарвлений домішками сполук Сr(ІІІ), синій сапфір – домішками Ti(IV) і Fe(III) – коштовне каміння.
Корунд за твердістю поступається лише алмазу, карборунду (SіC), ельбору (BN), його використовують як абразивний матеріал у вигляді корундових кругів та наждаку. α-Форма А12О3 хімічно досить стійка сполука, не взаємодіє з водою і кислотами, γ-Форму А12О3 одержують дегідратацією водного оксиду А12О3 ▪ nН2О при температурі ~450 С.
γ-Форма легко поглинає воду і розчиняється в кислотах. У розчинний стан її можна перевести сплавленням з лугами:
А12О3 + 2КОН = 2КА1О2 + Н2О
Утворений метаалюмінат натрію добре розчиняється у воді, при цьому він практично повністю гідролізується:
КАlО2 + 2Н2О = А1(ОН)3 + NaOH
або
КА1О2 + 4Н2О = К[АІ(ОН)4(ОН2)2]
При дегідратації свіжоприготованого гідроксиду алюмінію утворюється γ-
А12О3 – алюмогель. Це пориста речовина, яка не розчиняється у воді і не набрякає, використовується у техніці як адсорбент.
Внаслідок амфотерності оксид алюмінію розчиняється у кислотах і розчинах лугів:
А12О3 + 6НС1 + 9Н2О = 2[АІ(ОН2)6]С13
А12О3 + 6КОН + 3Н2О = 2K3[Al(OH)6]
Гідроксид алюмінію А1(ОН)3 Оскільки оксид алюмінію не розчиняється у воді, А1(ОН)3одержують не прямим методом, а взаємодією розчинних солей АІ(ІІІ) з аміаком (луги для цього не використовують у зв'язку з можливістю розчинення АІ(ОН) з утворенням гідроксокомплексів):
Al2(SO4)3 + 6NH3 · Н2О = 2А1(ОН)3 + 3(NH4)2SO4
Білий драглистий осад гідроксиду алюмінію розчиняється як у кислотах
А1(ОН)3 + 3НС1 = А1С13 + 3Н2О
Так у розчинах лугів, що дозволяє говорити про його амфотерність
Аl(ОН)3 + 3NaOH = Na3[Al(OH)6]
У гідроксиді алюмінію основні та кислотні властивості виражені приблизно однаково.
Cлід зазначити, що склад продуктів розчинення гідроксиду алюмінію у розчинах лугів не треба спрощувати з урахуванням складного процесу гідратації. Координаційне число Аl(ІІІ) у водному розчин і завжди дорівнює 6.
При розчиненні полімерної структури [Al(OH)3. aq] у розчинах лугів відбувається заміщення Н2О у координаційній сфері А1(Ш) на іони ОН- з утворенням гідроксокомплексів складу: [A1(OH)5 · H2O]2-, [A1(OH)6]3 – тощо. Солі алюмінію [АІ(ОН2)6]3+ добре розчинні у воді та внаслідок гідролізу мають кисле середовище. Гідроліз солей алюмінію є складним і багатостадійним процесом:
[Аl(ОН2)6]3+ + Н2О ↔ [A1(OH3)5OH]2+ + Н3О+
[A1(OH2)5OH]2+ + Н2О ↔ [Аl(ОН2)4(ОН)2]+ + Н3О+
[Аl(ОН2)4(ОН)2]+ + Н2О ↔ [А1(ОН2)3(ОН)3 + Н3О+
За таким механізмом гідролізуються усі солі Аl(ІІІ), які утворені сильними кислотами, та їх кристалогідрати: А1СІ3, A12(SO4)3, AІ2(SO4)3 · 18Н2О, Al(NO3)3 . 6Н2О.
Солі Аl (ІІІ), які утворені слабкими кислотами, підлягають такому сильному гідролізу, що у гідратованому стані Існувати не можуть (наприклад, A12S3, A12(CO3)3). Внаслідок гідролізу за катіоном і аніоном процес перебігає до кінця, тому одержати сульфід алюмінію змішуванням розчинів А1С13 і Na2S неможливо. У водних розчинах кожного з цих реагентів, взятих окремо, відбувається гідроліз за ступенем, внаслідок якого у випадку А1С13 виникає кисле середовище, а у випадку Na2S – лужне:
Аl3+ + Н2О ↔ А1ОН2+ + Н+
S2- + Н2О ↔ HS- + ОН-
При змішуванні цих розчинів, внаслідок реакції нейтралізації, зменшується концентрація іонів водню та гідроксид-іонів і, згідно з принципом Ле-Шательє, рівновага гідролізу зміщується праворуч. Таким чином, A1О3 і Na2S у водному розчині взаємно підсилюють гідроліз один одного, він перебігає до кінця, не утворюючи Al2S3:
2А1С13 + 3Na2S + 6H2O = 2А1(ОН)3 + 3H2S + 6NaCl
Аналогічно відбувається взаємне підсилення гідролізу при змішуванні розчинів солей АІ(ІІІ) з розчинами карбонатів лужних металів:
2А1Сl3 + 3Na2CO3 + ЗН2О ↔ 2А1(ОН)3 + ЗСО2 + 6NaCl
Галогеніди алюмінію АlHal3 за звичайних умов — безбарвні кристалічні речовини. На відміну від інших галогенідів алюмінію, його фторид у воді практично нерозчинний. Хлорид, бромід та йодид алюмінію добре розчиняються у воді, а внаслідок гідролізу димлять на повітрі.
У пароподібному стані та в деяких органічних розчинниках А1С13 знаходиться у вигляді димеру А12С16. Прості молекули АlСl3 існують лише при високій температурі та утворюються після термічної дисоціації А12С16 при 700 °С.
Будова димерної молекули А12С16 пояснюється наявністю місткових зв'язків:
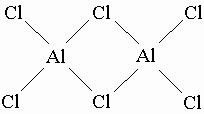
Три зв'язки атом алюмінію утворює за обмінним механізмом за рахунок своїх трьох електронів, які знаходяться на sр3-гібридизованих атомних орбіталях і р-електронів трьох атомі а хлору. Четвертий зв'язок утворюється за донорноакцепторним механізмом. Акцептором електронної пари є р-орбіталь алюмінію, а донором – і атом хлору.
Фторид алюмінію одержують синтезом з елементів:
2А1 + 3F2 = 2A1F3
Безводний А1Сl3 можна одержати нагріванням алюмінію в струмі хлору чи газоподібного НС1:
2А1 + 3С12 = 2А1Сl3
Бромід і йодид алюмінію синтезують із елементів при нагріванні. Безводний хлорид алюмінію використовують як каталізатор в Органічній хімії. Сульфат алюмінію A12(SO4)3•18Н2О застосовують для очистки природних вод від колоїдних частинок, які співосаджуються з об'ємним осадом гідроксиду алюмінію, що утворюється внаслідок гідролізу цієї солі.
Металічний алюміній широко використовують у сучасній техніці. Він входить до складу легких сплавів: дюралюміну (сплав алюмінію, міді, магнію і марганцю), силуміну (сплаву алюмінію і кремнію) та деяких інших. Легкість, пластичність і стійкість до корозії забезпечили алюмінію та його сплавам використання в авіаційній, автомобільній і космічній промисловості. В електротехніці алюміній замінив мідь як матеріал для виготовлення дроту.
Положення в Періодичній системі.Учні характеризують положення Феруму у Періодичній системі хімічних елементів Д.І. Менделєєва.
1.2. Феруму.
Ферум – d-елемент VІІІБ групи (або побічної підгрупи VІІІ групи) періодичної системи.
Будова атома:
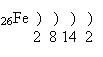
Електронна конфігурація атома Феруму: 1s22s22p62s23p63d64s2
Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками:
В атомі Феруму вісім валентних електонів (3d64s2), тому він виявляє змінні ступені окиснення.
Найхарактерніші ступені окиснення +2 і +3 Фізичні властивості заліза:
Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза = 7,87 г/см3 температура плавлення tпл=1535oС.
Має здатність намагнічуватися.
Хімічні властивості заліза та його сполук.
Взаємодія з неметалами:
1. З киснем:
2. З іншими неметалами при підвищенні температури:
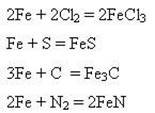
Взаємодія з водою після зняття оксидної плівки:
У розжареному стані (понад 700ОС) взаємодіє з водою (водяною парою):
![]()
На вологому повітрі та у воді, яка містить кисень, залізо зазнає корозії, воно іржавіє, вкриваючись жовто-бурою плівкою, яка переважно складається із ферум(ІІІ) гідроксиду, але плівка не захищає метал від подальшої корозії:
взаємодіє з хлоридною і розбавленою сульфатною кислотами:
Концентрована (безводна) сульфатна кислота пасивує залізо, що дає змогу зберігати і перевозити її у залізних цистернах. Концентрована нітратна кислота також пасивує залізо.
Залізо відновлює менш активні метали з розчинів їхніх солей:
Fe + CuSO4 = FeSO4 + Cu
у подрібненому вигляді залізо може взаємодіяти з концентрованим гарячим розчином лугу з утворенням комплексних гідроксисолей:
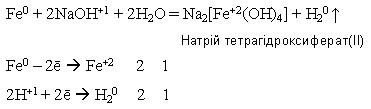
Оксиди і гідроксиди Феруму обох ступенів окиснення мають амфотерні властивості. У сполук Феруму(ІІ) вони дуже слабко виражені, тому ферум(ІІ) оксид і ферум(ІІ) гідроксид виявляють переважно основні властивості: FeO + 2HCl = FeCl2 + H2O
Fe(OH)2 + H2SO4 = FeSO4 + H2O
Ферум(ІІ) оксид з лугами не взаємодіє.
Ферум(ІІ) гідроксид, якщо він свіжодобутий і під час кип’ятіння реагує з концентрованим розчином лугу:
Fe(OH)2 + 2NaOH = Na2[Fe(OH)4]
Натрій тетрагідроксиферат(ІІ)
Ферум(ІІ) гідроксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІ):
![]()
Саме так відбувається реакція без доступу повітря. У протилежному разі ферум(ІІ) гідроксид легко окиснюється до ферум(ІІІ) гідроксиду:
![]()
Сполуки Феруму(ІІІ).
Оксид і гідроксид Феруму(ІІІ) мають більш виражені амфотерні властивості:
Посилення кислотних властивостей сполук Феруму(ІІІ) порівняно із сполуками Феруму(ІІ) пояснюється збільшенням ковалентності зв’язку Fe – O із підвищенням ступеня окиснення Феруму.
Ферум(ІІІ) оксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІІ):
![]()
Гідроксиди Феруму(ІІ) і (ІІІ) під час нагрівання розкладаються:
2Fe(OH)3 = Fe2O3 + 3H2O Fe(OH)2 = FeO + H2O
Подвійний (змішаний) оксид.
Під час взаємодії з кислотами утворює суміш двох солей – Феруму(ІІ) і
Феруму(ІІІ):
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2O
Під час взаємодії з нітратною кислотою утворюється лише одна сіль – ферум(ІІІ) нітрат внаслідок окиснення сполук Феруму(ІІ) до сполук Феруму(ІІІ):
Якісні реакції на солі Феруму(ІІ) і Феруму(ІІІ)
Реактивом на йони Феруму(ІІ) є червона кров’яна сіль K3[Fe(CN)6 ] - калій гексаціаноферат(ІІІ), яка під час взаємодії з солями Феруму(ІІ) дає осад синього кольору – турнбулеву синь:
Реактивом на йони Феруму(ІІІ) є жовта кров’яна сіль K4[Fe(CN)6] - калій гексаціаноферат(ІІ), яка під час взаємодії з солями Феруму(ІІІ) дає осад синього кольору – берлінську лазур:
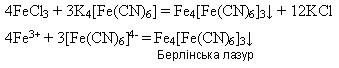
Іншим реактивом на йони Феруму(ІІІ) є амоній тіоціанат NH4SCN або калій тіоціанат KSCN. Утворюється сполука темно-червоного кольору:
Застосування:
Масова частка Феруму в земній корі становить 5 %. Він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе3О4, гематит Fe2О3, лімоніт – Fe2O3 • nH2O, сидерит FеСО3, пірит FеS2.
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку – вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби – недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум:
петрушку, печінку, телятину, гречку, курагу тощо.
2. Підбиття підсумків заняття Дайте відповідь на запитання
1. Дайте загальну характеристику елементів ІІІА групи
2. Охарактеризуйте методи одержання елементів ІІІА групи
3. Опишіть фізичні та хімічні властивості Алюмінію
4. Охарактеризуйте сполуки Алюмінія
5. Охарактеризуйте біологічне значення і використання у медичній
практиці сполук елементів ІІІА групи
3. Домашнє завдання
Опрацювати конспект


про публікацію авторської розробки
Додати розробку