Періодичний закон і періодична система Д.І.Менделєєва



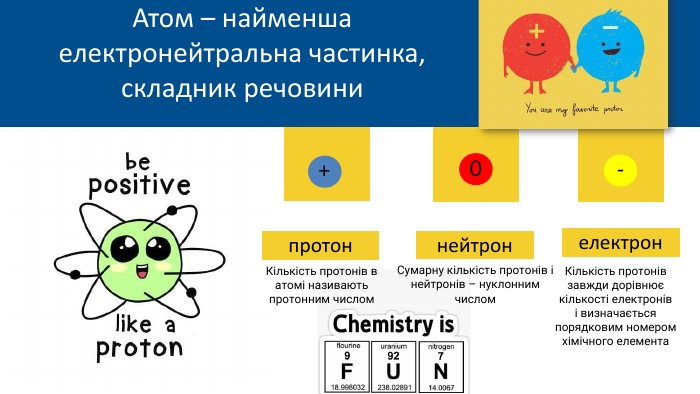
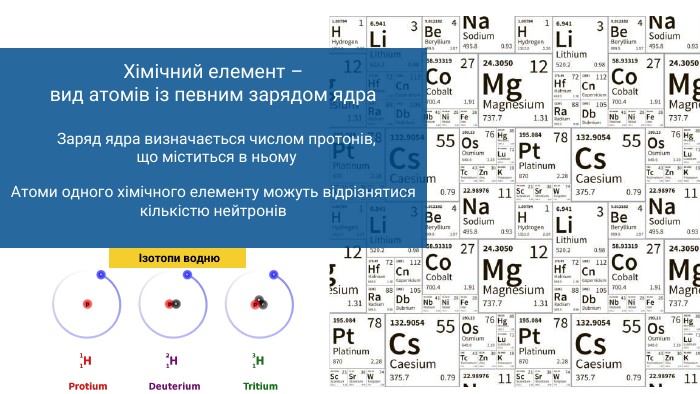








протон. Сумарну кількість протонів і нейтронів – нуклонним числом. Кількість протонів в атомі називають протонним числом. Кількість протонів завжди дорівнює кількості електроніві визначається порядковим номером хімічного елемента+0-Атом – найменша електронейтральна частинка, складник речовининейтронелектрон
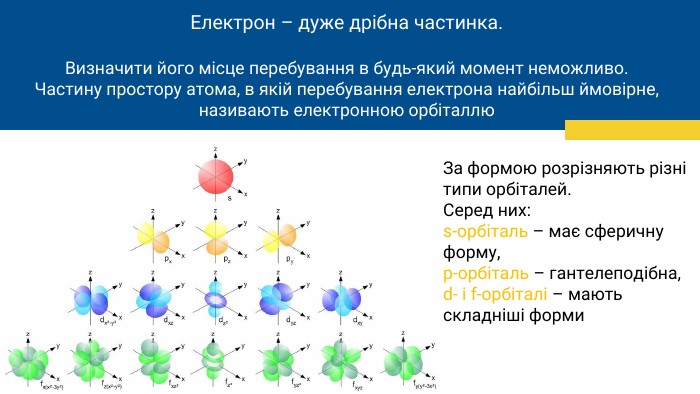
Електрон – дуже дрібна частинка. Визначити його місце перебування в будь-який момент неможливо. Частину простору атома, в якій перебування електрона найбільш ймовірне,називають електронною орбіталлю. За формою розрізняють різні типи орбіталей. Серед них: s-орбіталь – має сферичну форму,p-орбіталь – гантелеподібна,d- і f-орбіталі – мають складніші форми
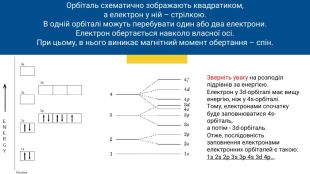
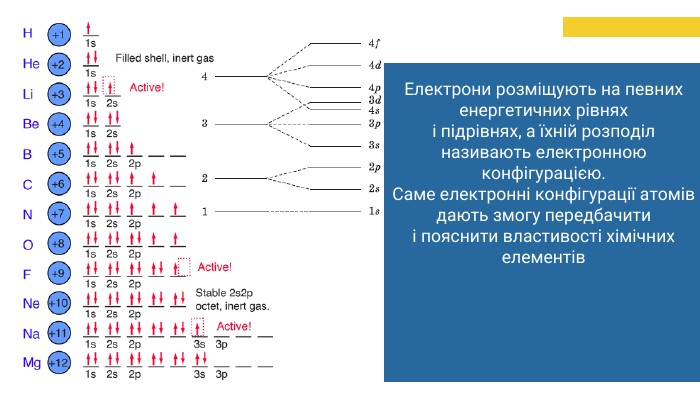
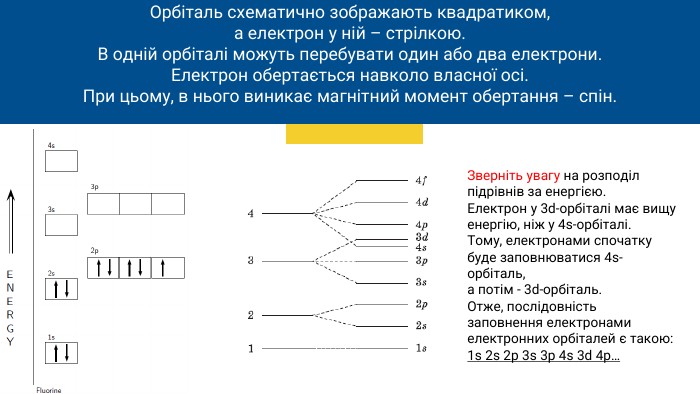
Орбіталь схематично зображають квадратиком,а електрон у ній – стрілкою. В одній орбіталі можуть перебувати один або два електрони. Електрон обертається навколо власної осі. При цьому, в нього виникає магнітний момент обертання – спін. Зверніть увагу на розподіл підрівнів за енергією. Електрон у 3d-орбіталі має вищу енергію, ніж у 4s-орбіталі. Тому, електронами спочатку буде заповнюватися 4s-орбіталь,а потім - 3d-орбіталь. Отже, послідовність заповнення електронами електронних орбіталей є такою:1s 2s 2p 3s 3p 4s 3d 4p…
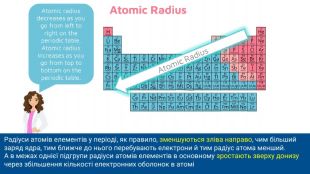
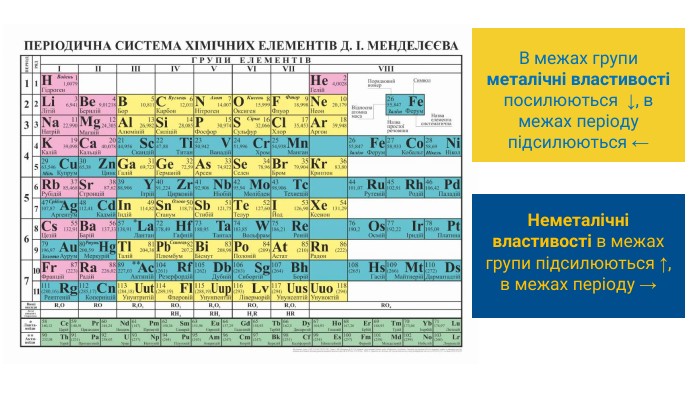
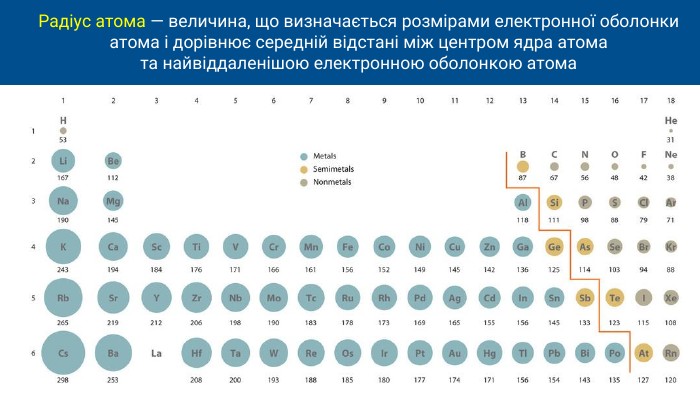
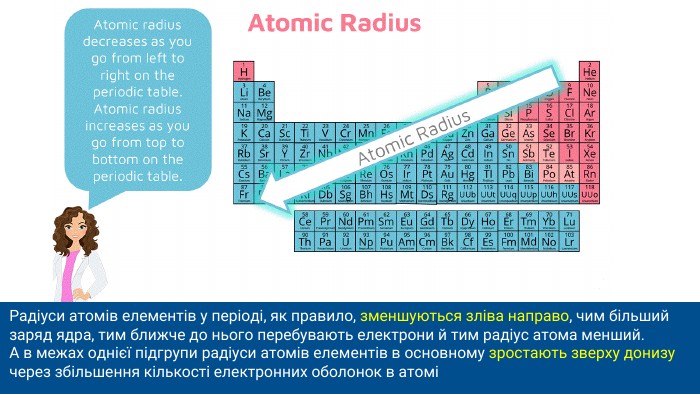
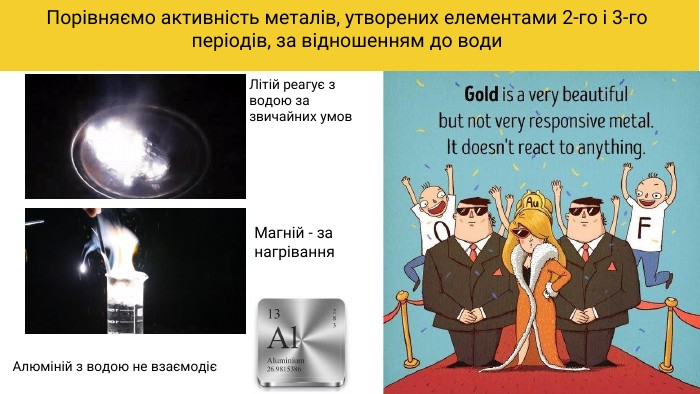
Радіуси атомів елементів у періоді, як правило, зменшуються зліва направо, чим більший заряд ядра, тим ближче до нього перебувають електрони й тим радіус атома менший. А в межах однієї підгрупи радіуси атомів елементів в основному зростають зверху донизу через збільшення кількості електронних оболонок в атомі
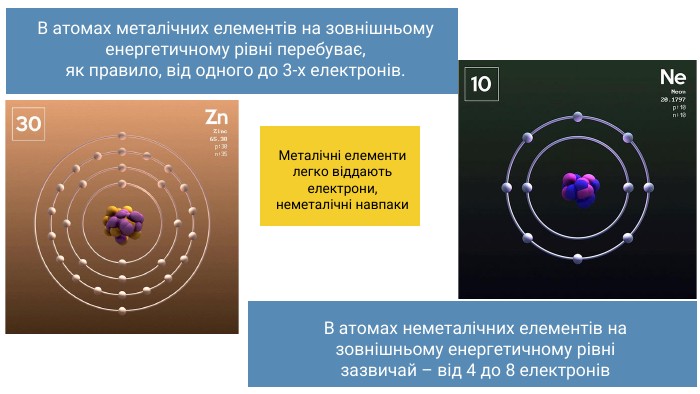
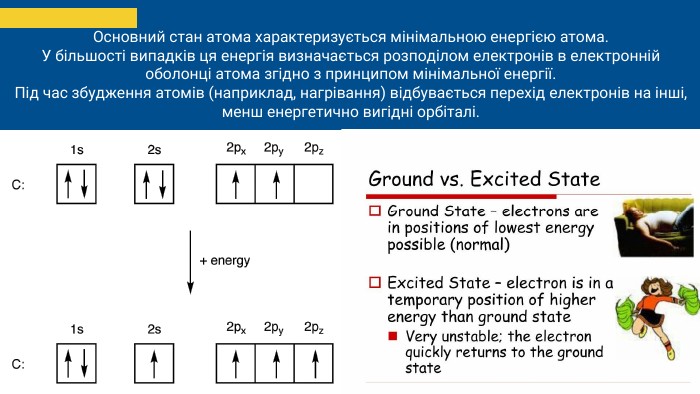
Основний стан атома характеризується мінімальною енергією атома. У більшості випадків ця енергія визначається розподілом електронів в електронній оболонці атома згідно з принципом мінімальної енергії. Під час збудження атомів (наприклад, нагрівання) відбувається перехід електронів на інші, менш енергетично вигідні орбіталі.
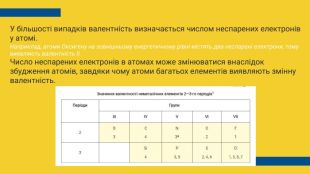
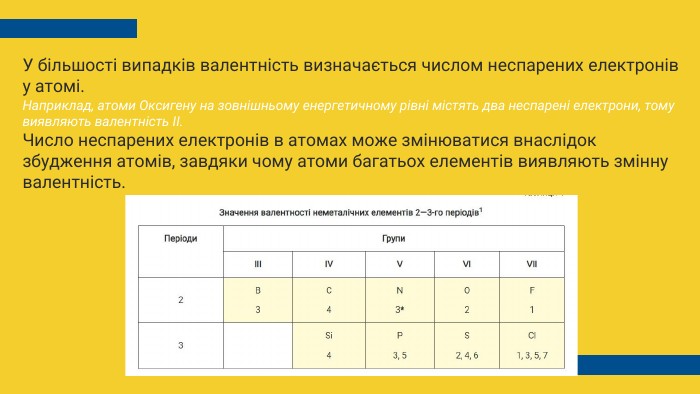
У більшості випадків валентність визначається числом неспарених електронів у атомі. Наприклад, атоми Оксигену на зовнішньому енергетичному рівні містять два неспарені електрони, тому виявляють валентність II. Число неспарених електронів в атомах може змінюватися внаслідок збудження атомів, завдяки чому атоми багатьох елементів виявляють змінну валентність.
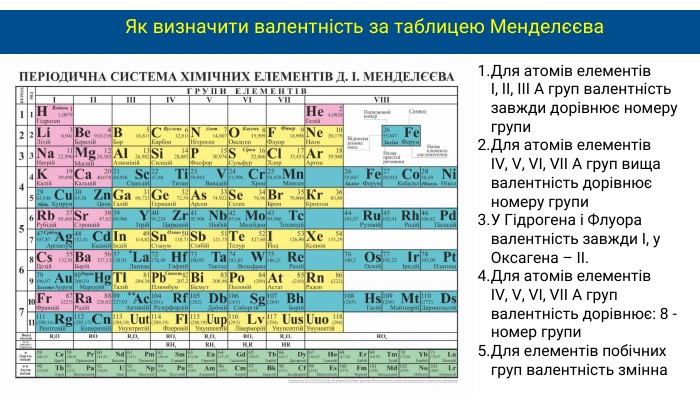
Як визначити валентність за таблицею Менделєєва. Для атомів елементів І, ІІ, ІІІ А груп валентність завжди дорівнює номеру групи. Для атомів елементів IV, V, VI, VII A груп вища валентність дорівнює номеру групи. У Гідрогена і Флуора валентність завжди І, у Оксагена – ІІ. Для атомів елементів IV, V, VI, VII A груп валентність дорівнює: 8 - номер групи. Для елементів побічних груп валентність змінна
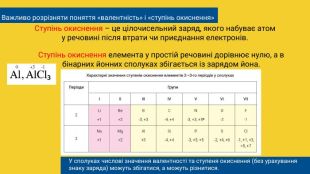
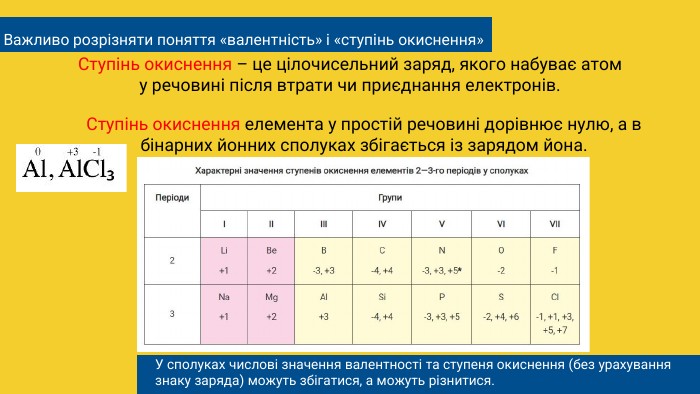
Важливо розрізняти поняття «валентність» і «ступінь окиснення»Ступінь окиснення – це цілочисельний заряд, якого набуває атому речовині після втрати чи приєднання електронів. Ступінь окиснення елемента у простій речовині дорівнює нулю, а в бінарних йонних сполуках збігається із зарядом йона. У сполуках числові значення валентності та ступеня окиснення (без урахування знаку заряда) можуть збігатися, а можуть різнитися.
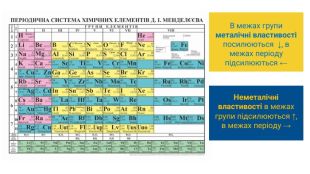
Металічний характер елементів у періоді слабшає, а неметалічний характер посилюється (у галогенів він виражений найбільш яскраво). Останні елементи кожного періоду називають інертними, оскільки їх прості речовини надзвичайно пасивні (гелій, неон і аргон не вступають у хімічні реакції). Періодичність змін характеру хімічних елементів. Якщо «рухатись» по періодичній системі за зростанням зарядів ядер атомів, тобто за збільшенням порядкових номерів елементів, то зафіксуємо періодичну зміну типів і хімічної активності простих речовин. Періодичність змін властивостей простих речовин
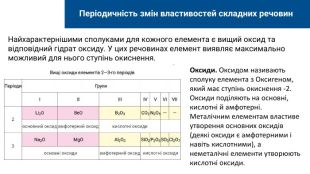
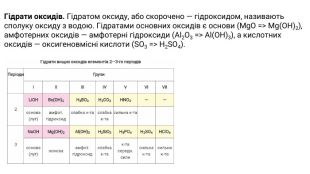
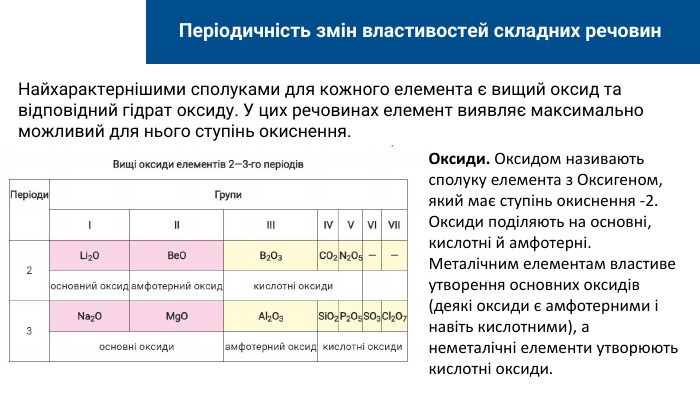
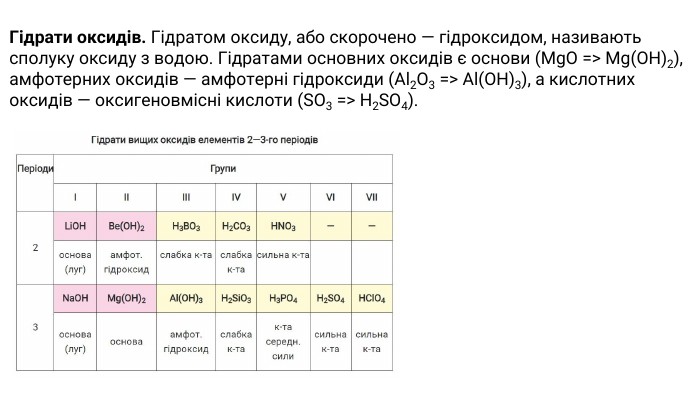
Найхарактернішими сполуками для кожного елемента є вищий оксид та відповідний гідрат оксиду. У цих речовинах елемент виявляє максимально можливий для нього ступінь окиснення. Періодичність змін властивостей складних речовин. Оксиди. Оксидом називають сполуку елемента з Оксигеном, який має ступінь окиснення -2. Оксиди поділяють на основні, кислотні й амфотерні. Металічним елементам властиве утворення основних оксидів (деякі оксиди є амфотерними і навіть кислотними), а неметалічні елементи утворюють кислотні оксиди.


про публікацію авторської розробки
Додати розробку