Періодичний закон та періодична система. Будова атома
Посібник для вивчення теми: "Періодичний закон та періодична система. Будова атома". Містить тематичні тести по темі.
![]()
УКРАЇНА
ЯРУНСЬКА СІЛЬСЬКА РАДА
Орепівський ліцей
вул. Дем'янчука Степана, 64, с. Орепи,
Звягельський р-н, Житомирська обл., 11764, orepyschool@gmail.com
Код ЄДРПОУ 06669833
Періодичний закон
та періодична система
![]() Д.І. Менделєєва
Д.І. Менделєєва
Будова атома
Навчальний посібник
2022
Затверджено методичною радою Орепівського ліцею Ярунської сільської ради Звягельського району Житомирської області. Протокол №3 від 26.12.2022 р.
Укладач: Ничипорук Юрій Васильович – вчитель хімії та біології Орепівського ліцею Ярунської сільської ради Звягельського району Житомирської області, спеціаліст вищої категорії.
Рецензенти:
Приймак О. І. – заступник директора з навчально-виховної роботи Орепівського ліцею Ярунської сільської ради Звягельського району Житомирської області.
Гордійчук І. С. - заступник директора з навчально-виховної роботи Колодянського ліцею Ярунської сільської ради Звягельського району Житомирської області.
22
Навчальний посібник для учнів 8 та 11 класів з метою розкриття історичних передумов відкриття Періодичного закону та роль особистості в цьому. Періодичний закон, відкритий Д. І. Менделєєвим , відзначений в історії науки як початок нової ери у розвитку однієї з провідних сучасних наук – хімії. У посібнику розповідається: як було відкрито періодичний закон, як була знайдена розгадка періодичності, викладається суть періодичного закону на рівні знань. Містить тести для самоконтролю та тестовий контроль з теми, завдання з яких – переважно, тестові завдання по темі за минулі роки ЗНО.
Використані джерела:
1. П. Попель, Л. Крикля, Хімія, підручник для 11 класу, Київ, Академія, 2019
2. П. Попель, Л. Крикля, Хімія, підручник для 11 класу, Київ, Академія, 2021
3. А.А. Макареня, Ю.В. Рисев, Д.И. Менделеев, М., Просвещение, 1988
4. Популярная библиотека химических елементов, М., Наука, 1983
5. И.В. Петрянов, Д.Н. Трифонов, Великий закон, М. Педагогика, 1984
ЗМІСТ
§1 Групи подібних елементів …………………………….. 3
Спроби класифікації хімічних елементів …………… 6
§2 Періодичний закон та періодична система ………… 7
§3 Будова атома …………………………………..………. 12
§4 Стан електронів у атома ……….……………..…….. 17
§5 Збуджений і не збуджений стан атома.
Можлива валентність ……………………….….….... 21
§6 Характеристика елементів, їх простих речовин та сполук за місцем у періодичній системі ……………. 23
Лабораторний дослід 11.
Дослідження характеру гідратів оксидів 33
Натрію, Алюмінію, Сульфуру(VI) ……………………………. 24
§ 7 Значення періодичного закону.
Життя і наукова діяльність Д.І. Менделєєва ………… 26
Контрольне тестування по темі …………….…... 29
Відповіді на тести для самоконтролю ………..…. 49
Додатки ……………………………………………… 50
Періодичний закон і періодична система
Д.І.Менделєєва
§1 Групи подібних елементів
На час відкриття Періодичного закону вже було відомо 63 елементи.
Виникла потреба у їх класифікації.
Спочатку вчені всі елементи поділяли на дві групи - металічні і неметалічні:
|
|
|
|
|
|
|
К, Na, Fe, Cu, Al O, N, S, Cl, C, I
При спробі класифікації хімічних елементів вчені об'єднували їх за
властивостями в окремі групи: 44 лужні металічні елементи (метали легкі, м'які, ріжуться ножем):
|
Символ |
Оксид |
Гідроксид |
Реакція з водою за звичайних умов |
|
Li |
Li2O |
LiOH |
2Li + 2H2O → 2LiOH + H2↑ |
|
Na |
Na2O |
NaOH |
2Na + 2H2O → 2NaOH + H2↑ |
|
K |
K2O |
KOH |
2K + 2H2O → 2KOH + H2↑ |
|
Rb |
Rb2O |
RbOH |
2Rb + 2H2O → 2RbOH + H2↑ |
|
Cs |
Cs2O |
CsOH |
2Cs + 2H2O → 2CsOH + H2↑ |
|
Fr |
Fr2O |
FrOH |
2Fr + 2H2O → 2FrOH + H2↑ |
галогени(в перекладі - солетворні)
|
Символ |
Проста речовина |
Сполука з Гідрогеном |
Сіль |
|
F |
F2 |
HF (газ, розчин якого - кислота) |
CaF2 |
|
Cl |
Cl2 |
HCl (газ, розчин якого - кислота) |
CaCl2 |
|
Br |
Br2 |
HBr (газ, розчин якого - кислота) |
CaBr2 |
|
I |
I2 |
HI (газ, розчин якого - кислота) |
CaI2 |
інертні елементи(благородні)
Прості речовини - гази без кольору і запаху, хімічно надзвичайно інертні.
|
Символ |
Проста речовина |
|
He |
He |
|
Ne |
Ne |
|
Ar |
Ar |
|
Kr |
Kr |
|
Xe |
Xe |
|
Rn |
Rn |
55
Тест для самоконтролю
1. Інертний газ із радіоактивними властивостями, що застосовується в медицині для лікування є
А радон
Б ксенон
В гелій
Г аргон
2. Встановіть відповідність між назвою елементів та їх символами:
|
1 Li, Na, K, Rb, Cs, Fr |
А лужні елементи |
|
2 He, Ne, Ar, Kr, Xe, Rn |
Б лужноземельні елементи |
|
3 Be, Mg, Ca, Sr, Ba, Ra |
В галогени |
4 F, Cl, Br, I, At Г інертні елементи
|
1 |
2 |
3 |
4 |
|
|
|
|
|
3. У подібні групи хімічні елементи об’єднують А за подібністю будови їх простих речовин
Б за подібністю властивостей їх простих речовин
В за подібністю будови та властивостей їх сполук
Г за всіма вище вказаними ознаками
Спроби класифікації хімічних елементів 66
До Д.І. Менделєєва були спроби класифікувати відомі на той час 63 хімічні елементи.
******
Так у 1829 р. німецький хімік І. Дьоберейнер згрупував елементи з подібними хімічними властивостями по трійкам (тріади):
Li Cl
Na Br
K I і т.д.
*****
У 1849р. російський хімік Г.І. Гесс у підручнику "Основания чистой химии" описував чотири групи неметалічних елементів із схожими хімічними властивостями:
|
I |
Te |
C |
N |
|
Br |
Se |
B |
P |
|
Cl |
S |
Si |
As |
|
F |
O |
|
|
*****
У 1862р. француз А. Бег’є де Шанкуртуа запропонував систему елементів у вигляді спіральної лінії на поверхні циліндра. На кожному витку по 16 елементів. Подібні елементи розміщувались один під одним. Але ніхто з вчених не звернув на цю роботу
уваги.
*****
У 1866 р. англійський хімік А. Ньюлендс запропонував так званий закон октав.
Він вважав, що у світі, в хімії і в музиці все підкоряється одній гармонії. Тому властивості хімічних елементів, розміщених за зростанням атомної ваги, повинні повторюватись через кожні сім елементів, як і в октаві через кожні сім нот.
*****
Ближче всіх до істини виявились англієць В. Одлінг та німець Л. Мейєр. У 1864
р. Мейєр запропонував таблицю, де всі відомі хімічні елементи були розбиті на шість груп, відповідно до їх валентності.
77
§2 Періодичний закон та періодична система
хімічних елементів Д.І.Менделєєва
17 лютого 1869 р., збираючись у дорогу, професор Петербурзького університету Дмитро Іванович Менделєєв на звороті листа, в якому його просили приїхати та допомогти виробництву, зробив перший прикид таблиці хімічних елементів.


Попередники Менделєєва, що помітили деякі прояви великої закономірності у світі хімічних елементів, з різних причин не змогли піднятися до великого узагальнення та усвідомити існування у світі фундаментального закону.
Передумовами відкриття періодичного закону Менделєєв бачив три речі: по-перше, були визначені атомні маси більшості відомих елементів;
по-друге, з'явилось чітке поняття про групи подібних за хімічними властивостями лементів; по-третє, до 1869 р. було вивчено хімію рідкісних елементів.
Вирішальним кроком до відкриття періодичного закону було те, що Менделєєв розмістив всі елементи за зростанням атомних ваг.
"Перші думки про періодичність,- писав Д.І.Менделєєв,- викладені мною в листі, який 1 березня 1869 р. був висланий мною багатьом вченим."
Примітно те, що в цій самій першій таблиці вже були залишені і
відмічені знаком питання порожні місця. (Вчений передбачив існування невідомих на
88
той час елементів. Передбачені Менделєєвим елементи нині називаються: Скандій, Галій,
Германій, Технецій, Гафній, Реній, Астат, Францій, Радій, Актиній, Протактиній.)

Д.І.Менделєєв розмістив елементи у порядку зростання атомної ваги:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K...Kr
1 4 7 9 11 12 14 16 19 20 23 24 27 28 31 32 35 40 39 84
При цьому впадає у вічі, що такий ряд можна поділити на ділянки, які починаються лужним елементом та закінчуються інертним . Якщо розмістити їх одна під одною то вибудовується чітка таблиця, у якій подібні елементи розміщені у одному вертикальному рядочку, утворюючи вісім груп подібних елементів:
І ІІ ІІІ IV V VI VII VIII
1 H He
2 Li Be B C N O F Ne
3 Na Mg Al Si P S Cl Ar
4 K Ca Ga Ge As Se Br Kr
По горизонталі розміщуються елементи, що утворюють періоди. Кожен період починається лужним елементом і закінчується інертним елементом. У періодах помітний плавний перехід від типових металічних властивостей до неметалічних. На основі цих закономірностей Менделєєв сформулював періодичний закон:
Властивості простих тіл, а також форми та властивості 99 сполук хімічних елементів знаходяться у періодичній залежності від атомних ваг (мас) елементів.
Сучасне формулювання періодичного закону див. ст.11.
Періоди 1,2,3 - малі періоди. Періоди 4,5,6,7 містять більше восьми елементів, тому називаються - великі періоди.
Кожна група елементів поділяється на головну (А) і побічну (Б) підгрупи.
До головних підгруп належать елементи малих і великих періодів, а до побічних – тільки великих періодів.
Сучасна періодична система а) довга форма
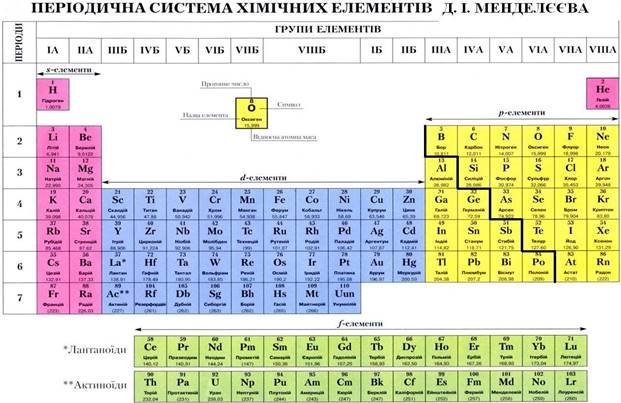
1010
б) коротка форма
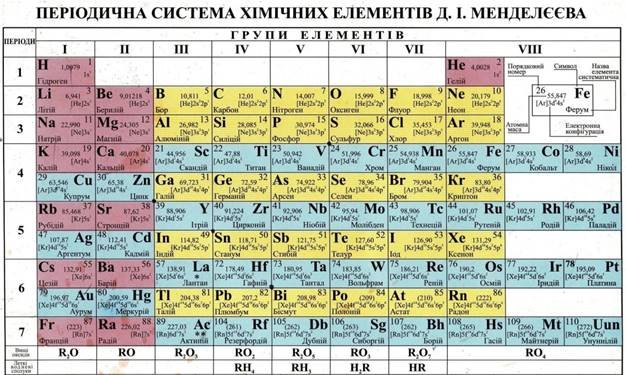
Тест для самоконтролю
4. Визначте рядок, утворений лише з тих елементів, що входять до головної підгрупи періодичної системи Д.І. Менделєєва.
А. Cr; Ca; Hg
Б. F; Mn; I
В. Al; Ag; S
Г. Li; Na; K
5. Виберіть дату відкриття періодичного закону:
А 17 лютого 1869 року
Б 1 березня 1869 року
В 1 березня 1896 року Г 17 лютого 1986 року
6. Визначте номер елемента другого періоду третьої групи головної підгрупи. А №5
Б №12 В №13
Г №15
1111
БУДОВА АТОМА
§3 Будова атома.
В свій час Менделєєв визнавав: "... причин періодичності ми не знаємо".
Йому не вдалося дожити до розгадки цієї таємниці.
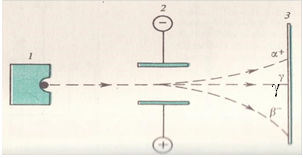
Ще у 1896 р. француз А.Беккерель, а пізніше П'єр Кюрі та Марія Склодовська-Кюрі спостерігали випромінювання деякими елементами (радіоактивними) енергії та променів, схожих на рентгенівські. Явище назвали - радіоактивність.
Дія електричного поля на радіоактивні промені:
 α+
α+
β−
β - частинки - це електрони, α - частинки - це ядра атома Гелію, γ - промені 1212 схожі до рентгенівських.
У травні 1911 року англієць Е. Резерфорд висунув ядерну, або планетарну модель атома: у центрі його масивне, позитивно заряджене ядро, а навколо, як планети навколо
Сонця, по орбітах рухаються електрони.

У 1913 р. голландець А. ван ден Брук передбачив, а англієць Г. Мозлі довів: заряд ядра атома любого елемента чисельно рівний порядковому номеру елемента у періодичній системі.
Тому сучасне формулювання періодичного закону на основі
теорії будови атомів звучить так:
Властивості елементів, їхніх простих речовин та сполук перебувають у періодичній залежності від заряду ядра їх атомів.
А у 1932 р. було відкрито частинку нейтрон, що немає заряду.
Отже склад атома такий:
 Будова атома
Будова атома 
![]() Ядро Електрони Протони Нейтрони мають заряд « - »
Ядро Електрони Протони Нейтрони мають заряд « - »
мають заряд « + » без заряду
1313
Кількість протонів і нейтронів у ядрі - нуклонне число (протони та нейтрони називають однаково - нуклони).
Кількість протонів у ядрі - протонне число.
Для опису атомних структурних одиниць використовують слово нуклід.
Атоми одного елемента з різною атомною масою називають - ізотопи
(у ізотопів однакова кількість протонів у ядрі, але різна кількість нейтронів).
Нукліди позначають так:
12 1 2 3 Нуклонне число тобто Масове число
С Н Н Н Символ елемента
6 1 1 1 Число протонів тобто Атомний номер
Якщо відносна атомна маса елемента не є цілим числом, то це тому, що даний елемент являє собою суміш ізотопів.
Радіоактивні ізотопи (радіонукліди) - нестійкі, що самовільно перетворюються на інші нукліди, виділяючи при цьому енергію. Швидкість їх розпаду характеризують періодом напіврозпаду - час протягом якого розпадається половина атомів. А сам розпад атомів називають ядерною реакцією.
Радіоактивними є ізотопи, у яких різниця нейтронів і протонів порядку 40 і більше.
Кількість електронів у атома така ж, як і кількість протонів у ядрі
(тобто відповідає номеру елемента у періодичній системі).
Електрони у атома розміщені на різних енергетичних рівнях, число яких співпадає з номером періоду у періодичній системі. Чим далі енергетичний рівень від ядра атома, тим більшу енергію мають електрони, що на ньому знаходяться. Максимально кількість електронів на кожному рівні визначають за
1414 формулою: N = 2n2, де n - номер рівня (номер періоду).
Ядро ● 1) 2) 3) 4) 5) 6) 7) електронні рівні
2 8 18 32 32 32 32 максимальна кількість
(50) (72) (98) електронів
Останній (зовнішній) рівень максимально може помістити вісім електронів (тоді його називають: завершений рівень).
У елементів головних підгруп (А-груп) кількість електронів на останньому (зовнішньому) енергетичному рівні відповідає номеру групи.
Номеру групи відповідає вища (найбільша) валентність елемента.
Схеми будови атомів перших трьох періодів зображено у таблиці:
I VIII
|
|
1 |
H 1 +1 ) 1 |
Групи
II III IV V VI VII |
He 2 +2 ) 2 |
|||||
|
2 |
Li 3 +3 ) ) 2 1 |
Be 4 +4 ) ) 2 2 |
B 5 +5 ) ) 2 3 |
C 6 +6 ) ) 2 4 |
N 7 +7 ) ) 2 5 |
O 8 +8 ) ) 2 6 |
F 9 +9 ) ) 2 7 |
Ne 10 +11 ) ) 2 8 |
|
|
3 |
Na 11 +11 ) ) ) 2 8 1 |
Mg 12 +12 ) ) ) 2 8 2 |
Al 13 +13 ) ) ) 2 8 3 |
Si 14 +14 ) ) ) 2 8 4 |
P 15 +15 ) ) ) 2 8 5 |
S 16 +16 ) ) ) 2 8 6 |
Cl 17 +17 ) ) ) 2 8 7 |
Ar 18 +18 ) ) ) 2 8 8 |
|
|
4 |
K 19 +19 ) ) ) ) 2 8 8 1 |
Ca 20 +20 ) ) ) ) 2 8 8 2 |
і так далі |
|
|||||
№ елемента = заряд ядра його атома такількість електронів 1515
№ періоду = кількість енергетичних (електронних) рівнів
№ групи головної підгрупи = кількість електронів на останньому рівні
Як видно з таблиці, у кожному періоді зліва направо збільшується число електронів на останньому рівні на 1. Відстань від ядра до останнього електронного рівня (радіус атома) : зростає по групі зверху до низу; зменшується у періоді зліва направо (за рахунок притягання до більш позитивного ядра).
Тест для самоконтролю
7. Однакову кількість енергетичних рівнів мають атоми елементів із протонними числами
А. 8 і 16
Б. 15 і 33
В. 7 і 15
Г. 15 і 16
8. Яка кількість нейтронів у нукліді Алюмінію
А. 11
Б. 13
В. 14
Г. 12
9. Визначте протонне число хімічного елемента, атом якого на зовнішній електронній оболонці містить три електрони
А 20
Б 8
В 13 Г 6
10. Однакову кількість електронів на зовнішньому енергетичному рівні мають атоми хімічних елементів з протонними числами:
А. 13 і 14
Б. 6 і 14
В. 6 і 7
1616 Г. 14 і 22
11. Визначте правильні твердження: 1. протонне число Калію 19; 2. протонне число Натрію 23; 3. протонне число Калію 39; 4. протонне число Натрію11
А 2, 3 Б 1, 4
В 2, 4 Г 3, 4
12. Атоми хімічних елементів, утворюючи молекули, намагаються утворити стійку зовнішню оболонку, що містить
А вісім електронів
Б чотири електрони
В три електрони
Г шість електронів
13. Кількість електронів на зовнішньому енергетичному рівні в атомі елемента втричі більша, ніж в атомі Магнію. Електрони в атомі елемента розміщені на трьох енергетичних рівнях. Визначте формулу вищого оксиду цього елемента та обчисліть суму індексів.
14. Виберіть нерадіоактивний нуклід.
222
А Rn
86
238 U
Б
92
244
В Pu
94
112
Г Cd
48
15. Останній електронний рівень (шар), що містить 8 електронів називають А незавершений
Б недовершений
|
В завершений Г перевершений |
1717 |
§4 Стан електронів у атома
Кожен електрон знаходиться на певній орбіталі (підрівні). Існує чотири види орбіталей: s-орбіталь; р-орбіталі; d-орбіталі; f-орбіталі. Їх можна уявити як хмари певної форми:
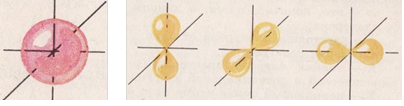
S-орбіталь р-орбіталі d-орбіталі f-орбіталі
Розподіл орбіталей по електронним рівням (оболонкам)
● 1) 2) 3) 4) 5) 6) 7) s s s s s s s 3p 3p 3p 3p 3p 3p
5d 5d 5d 5d 5d
7f 7f 7f 7f
Як видно із схеми, на кожному наступному рівні появляється новий вид орбіталей. На кожному рівні є тільки одна s-орбіталь, починаючи з 1818 другого - три р-орбіталі, починаючи з третього - п'ять d-орбіталей, починаючи з четвертого - сім f-орбіталей.
Позначають підрівні так:
1s 2s 2p 3s 3p 3d (читається: один ес, два ес, два пе, три ес три де і т.д. )
![]() номери електронних рівнів
номери електронних рівнів
2s-орбіталь
1s- орбіталь

2p 3p 4p
На одній орбіталі поміщається не більше 2-ох електронів.
Формули атомів
Графічна формула
Для запису формули атома кожну орбіталь позначають коміркою а електрони, що знаходяться на ній стрілкою: ![]() або
або ![]()
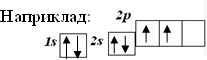
Наприклад: графічна формула атома Оксигену
2p
![]() 1s 2s
1s 2s
графічна формула атома Сульфуру
3d 1919
2p 3p
![]()
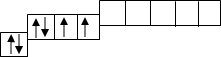 1s
1s ![]() 2s 3s
2s 3s
![]()
![]() Електрони - називають "спарені", а - називають "неспарені". Електрони займають спочатку s-орбіталі потім р-орбіталі, по- можливості, вільні орбіталі, тому записують:
Електрони - називають "спарені", а - називають "неспарені". Електрони займають спочатку s-орбіталі потім р-орбіталі, по- можливості, вільні орбіталі, тому записують:
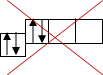
![]() а не
а не
правильно неправильно
Електронна формула
Для запису формули кількість електронів на підрівні записують цифрою у правому верхньому куточку символу орбіталі.
Наприклад: електронна формула атома Оксигену
2 2 4
1s 2s 2p Читається "один ес два, два ес два, два пе чотири".
електронна формула атома Сульфуру 1s2 2s2 2p6 3s2 3p4
Читається "один ес два, два ес два, два пе шість, три ес два, три пе чотири".
Тест для самоконтролю
16. Виберіть загальну електронну формулу зовнішнього електронного шару атомів лужних металів
А ns1
Б ns2np2
В ns2np1 Г ns2
17. Позначте електронну формулу , що належить атому магнію
А 1s22 s22p63 s1 Б 1s22 s22p6
В 1s22 s22p63 s2 22 s22p2 2020
Г 1s
18. Виберіть електронну, формулу атома елемента, якщо його вищий оксид відповідає загальній формулі Е205:
А 1S22S22P3 Б 1s22s2
В 1s22s22p2 Г 1s2s2p1
19. Установіть відповідність хімічних елементів та їх електронної конфігурації атомів.
1. Li А. 1s22s22p63s23p64s1
2. Na Б. 1s22s22p63s1
3. Rb В. 1s22s1
4. K Г. 1s22s22p62s23p63d104s24p64d105s1
|
|
А |
Б |
В |
Г |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
§5 Збуджений і не збуджений стани атома.
Можлива валентність.
У не збудженому стані електрони займають підрівні з меншою енергією:
 С
С
У збудженому стані електрони зовнішнього рівня, набувши енергії, переходять на вищу вільну орбіталь:
Наприклад: 2121
С* 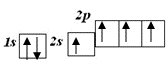
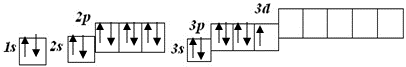
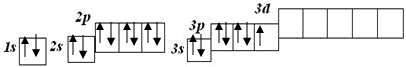
Кількість неспарених електронів вказує на можливу валентність Карбону:
ІІ і ІV.
Для порівняння:
Оксигенмає постійну валентність ІІ тому, що у його атома можливі тільки два неспарені електрони:
О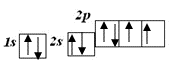
А у Сульфуру можлива валентність ІІ, ІV, VI тому, що у його атома можливі три стани з такими числами неспарених електронів:
Незбуджений стан
S 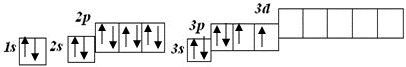
валентність II
Перший збуджений стан
S* 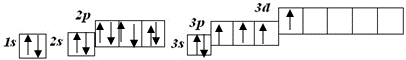
валентність IV
Другий збуджений стан
S** 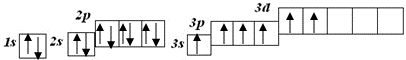
валентність VI
Тест для самоконтролю
20.Визначте можливу валентність Калію (№19) та Галію (№31).
А І і ІІ
Б І і ІІІ
В ІІ і ІІІ 2222
Г ІІ і ІV
21.Визначте можливу валентність Фосфору.
А І і ІІ
Б ІІ і ІІІ
В ІІІ і ІV
Г ІІІ і V
22. Виберіть можливу валентність хлору
А І
Б І і ІІІ
В ІІІ, IV і VI
Г I, III, V і VII
§ 6 Характеристика елементів, їх
простих речовин та сполук за місцем у періодичній системі.
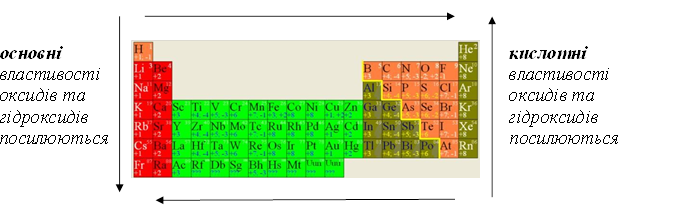
Властивості елементів:
Неметалічні властивості посилюються
 властивості властивості посилюються посилюються
властивості властивості посилюються посилюються
Металічні властивості посилюються
Жовта лінія від Бору до Астату розділяє металічні та неметалічні елементи.
 |
2323
Властивості сполук елементів (оксидів та гідроксидів):
кислотні властивості оксидів та
гідроксидів посилюються
основнівластивості оксидів та
гідроксидів посилюються
Лабораторний дослід 11.
Тема: Дослідження характеру гідратів оксидів Натрію, Алюмінію, Сульфуру(VI).
Мета : з’ясувати хімічний характер гідратів оксидів Натрію,
Алюмінію, Сульфуру(VI), дослідивши їх відношення до індикаторів, кислот і лугів.
Зробити висновки про залежність їх кислотно-основних властивостей залежності від положення у періодичній системі Натрію, Алюмінію, Сульфуру.
Обладнання: розчини натрій гідроксиду, сульфатної кислоти, алюміній хлориду; універсальний індикаторний папір; пробірки.
Хід роботи.
Виконайте дії та тести.
Дія 1. Дія розчину натрій гідроксиду на універсальний індикаторний папір.
Змочіть універсальний індикаторний папір розчином натрій гідроксиду.
Що спостерігаєте?
А зміна забарвлення індикатора з жовтого на червоне 2424
Б зміна забарвлення індикатора з жовтого на синє
В зміна забарвлення індикатора з жовтого на фіолетове
Г забарвлення не змінилось
Розчин натрій гідроксиду виявляє
А основні властивості
Б кислотні властивості
В амфотерні властивості
Г є хімічно інертним
Дія 2. Дія розчину сульфатної кислоти на універсальний індикаторний
папір.
Змочіть універсальний індикаторний папір розчином сульфатної кислоти.
Що спостерігаєте?
А зміна забарвлення індикатора з жовтого на червоне
Б зміна забарвлення індикатора з жовтого на синє
В зміна забарвлення індикатора з жовтого на фіолетове
Г забарвлення не змінилось
Розчин сульфатної кислоти виявляє
А основні властивості
Б кислотні властивості
В амфотерні властивості
Г є хімічно інертним
Дія 3. Добування алюміній гідроксиду та виявлення його відношення до лугу і кислоти.
До розчину алюміній хлориду повільно приливайте розчин лугу (натрій гідроксиду) до появи змін. Що спостерігаєте?
А виділення газу
Б поява білого драглистого осаду
В поява синього драглистого осаду
Г змін нема
Складіть рівняння реакції.
Одержаний продукт розділіть на дві пробірки.
У першу пробірку додайте кислоти до появи змін. Що спостерігаєте?
А виділення газу
Б розчинення драглистого осаду 2525
В поява синього драглистого осаду
Г змін нема
У другу пробірку додайте розчину натрій гідроксиду до появи змін. Що спостерігаєте?
А виділення газу
Б розчинення драглистого осаду
В поява синього драглистого осаду
Г змін нема
Складіть рівняння реакцій.
Висновок:
А алюміній гідроксид виявляє тільки основні властивості
Б алюміній гідроксид виявляє тільки кислотні властивості
В алюміній гідроксид виявляє амфотерні властивості
Г алюміній гідроксид є хімічно інертним
Загальний висновок:
А основні властивості гідратів оксидів елементів у періоді зліва направо поступово змінюються на кислотні
Б кислотні властивості гідратів оксидів елементів у періоді зліва
направо поступово змінюються на основні
В кислотно-основні властивості гідратів оксидів елементів у періоді не змінюються
Тест для самоконтролю
23. Позначте хімічний символ елемента – неметалу:
А. Zn
Б. Si
В. Ge
Г. V
24. Розмістіть елементи в порядку зростання кислотних властивостей їхніх гідроксидів.
|
|
А |
Б |
В |
Г |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
А Si
Б P
В S
Г Cl
25. Виберіть правильне твердження: 1. кальцій оксид – основний оксид;
2. сульфур(VI) оксид – кислотний оксид; 3. фосфор(V) оксид – основний оксид; 2626
4. калій оксид – кислотний оксид
А 1 і 2
Б 3 і 4
В 1 і 3
Г 2 і 4
§ 7 Значення періодичного закону
Життя і наукова діяльність Д.І. Менделєєва
Відкриття періодичного закону поклало початок новому етапу у розвитку хімії в цілому, а також відіграло важливу роль у створенні теорії будови атома, в розумінні того, як проявляються закони діалектики в хімії. Періодичний закон підвів до строгої системи всю багатоманітність властивостей елементів та їх хімічних сполук, пов’язуючи в одне ціле будову атомів, їх здатність до хімічних впливів, хімічні та фізичні властивості хімічних сполук.
На схилі віку Д.І. Менделєєв, аналізуючи зроблене ним, писав: «Розпочавши (1855 р.) з вчителювання у Сімферопольській гімназії, я відслужив 48 років Батьківщині і науці. Плоди моїх трудів перш за все у науковій відомості,
що складає гордість – не мою особисту, але і загальні російську, так як всі найголовніші академії, починаючи з Лондонської, Римської, Бельгійської, Паризької, Берлінської та Бостонської, вибрали мене своїм членом, як і багато вчених товариств Росії, Західної Європи та Америки, всього більше 50-ти товариств і закладів.

2727
Д.І. Менделєєв в період Д.І. Менделєєв (1861) Д.І. Менделєєв (1869) завершення навчання у (рік відкриття періодичного
Головному педагогічному закону) інституті

Д.І. Менделєєв – заслужений професор петербурзького
університету (1887)
Найкращі часи життя і його головну силу взяло викладання у 2-му
Кадетському корпусі, в Інженерній Академії, в Інституті шляхів сполучення, в Технологічному інституті та в Університеті. Із тисяч моїх учнів багато тепер всюди видатних діячів, професорів, адміністраторів, і, зустрічаючи їх, завжди чув, що добре у них насіння поклав, а не просту відбував повинність. Третя служба моя Батьківщині найменше видима, хоч турбувала мене з юних років до цього часу. Це служба по мірі сил і можливостей на користь росту російської промисловості, починаючи з сільськогосподарської, в якій особисто діяв, показав на ділі можливість і вигідність, ще в 60-х роках, інтенсивного господарства та організував видатні у нас дослідження по розведенню хлібів. Особисті зусилля впевнили мене, на жаль, дуже скоро в тому, що з одним землеробством Росія не двинеться до потрібним їй прогресу, багатству і сили, залишиться країною бідною, що важливіше всього ріст інших видів промисловості: рудної справи, фабрик, заводів, шляхів сполучення та
торгівлі…» (Із архіву Д.І. Менделєєва. – Т.1. – Л., 1961. – с. 31 – 32.)

Д.І. Менделєєв із учасниками експедиції на Урал (1899)
 2828
2828
Сім’я Д.І. Менделєєва.
У сім’ї вченого було три сини і три дочки. Двоє дітей від першого браку з Фєозвою Нікітічною Лєщовою (1828 – 1906): Володимир (1865 – 1898) і Ольга (1868 – 1950) та четверо дітей від другого браку із Анною Іванівною Поповою (1860 – 1942): Любов (1881 – 1939) – дружина російського поета О. Блока, Іван (1883 – 1936) та близнята Марія (1886 –
1952) і Василь (1886 – 1922).
Д.І. Менделєєв з дітьми
Володею і Олею в Боблово (1876)
Контрольне тестування по темі
«Періодичний закон і періодична система елементів Д.І. Менделєєва. Будова атома»
Варіант І
І. ЗАВДАННЯ З ВИБОРОМ ОДНІЄЇ ПРАВИЛЬНОЇ ВІДПОВІДІ. (0,5 бала)
1.Виберіть ряд елементів – галогенів:
А Na, K, Rb, Cs
Б F, Cl, Br, I
B He, Ne, Ar, Kr
Г Be, Mg, Ca, Sr
2.Яка кількість електронів у атома Гідрогену
А 1
Б 2
B 5
Г 15 2929
3.У періодичній залежності від чого перебувають властивості елементів, їх простих речовин та сполук?
А від атомних ваг елементів
Б від кількості електронів на останньому енергетичному рівні
B не перебувають у якійсь залежності
Г від заряду ядер їх атомів
4.Елемент Кальцій у періодичній системі знаходиться
А у малому періоді, головній підгрупі
Б у великому періоді, головній підгрупі
B у малому періоді, побічній підгрупі
Г у великому періоді, побічній підгрупі
5.Позначте заряд ядра у атома Хрому:
А +24
Б - 24
B +42
Г - 42
6.Позначте кількість електронів на останньому енергетичному рівні у атома Германію:
А 1
Б 4
B 3
Г 2
7. Позначте метал, який утворює лише основний оксид:
А. Zn
Б. N
В. Сr
Г. Sr
8. Однакову кількість енергетичних рівнів мають атоми елементів із протонними числами
А. 8 і 16
Б. 15 і 33
В. 7 і 15
Г. 15 і 16
9. Яка кількість нейтронів у нукліді Алюмінію
А. 11
Б. 13
В. 14 3030
Г. 12
10. Укажіть хімічну формулу кислотного оксиду
А. SO2
Б. CaO
В. ZnO
Г. BaO
11. Сполука, що належить до амфотерних гідроксидів, це:
А. Al(OH)3
Б. NaOН
В. Ba(OН)2
Г. KOН
12. Визначте правильні твердження.
1) протонне число Калію 19 2) протонне число Натрію 23 3) протонне число Калію 39 4) протонне число Натрію 11
А.2,3
Б. 1,4
В. 2,4
Г. 3,4
13. Позначте хімічний елемент, відносна молекулярна маса водневої сполуки якого (RH2) дорівнює 34:
А. Cl
Б. Al
В. N
Г. S
14. Атоми хімічних елементів, утворюючи молекули, намагаються утворити стійку зовнішню оболонку, що містить
А. вісім електронів
Б. чотири електрони
В. три електрони
Г. шість електронів
ІІ. ЗАВДАННЯ НА ВСТАНОВЛЕННЯ ВІДПОВІДНОСТІ.(0,5 бала)
15.Встановіть відповідність між частинками та їх зарядом: 3131
1 протон А негативний
2 електрон Б без заряду
3 нейтрон B позитивний
16. Встановіть відповідність між номером та кількістю частинок:
1 № елемента А кількість електронів на останньому
2 № періоду енергетичному рівні
3 № головної підгрупи Б заряд ядра
В кількість енергетичних рівнів
Г кількість орбіталей
17. Встановіть відповідність між назвою елемента та електронною формулою його атома:
2 2 6
|
1 Гідроген |
|
А 1S 2S 2P |
|
2 Неон |
|
1 Б 1S |
|
3 Бор |
|
2 2 1 В 1S 2S 2P |
|
4 Флуор |
|
2 2 5 Г 1S 2S 2P |
18. Установіть відповідність між назвами мікроелементів, що містяться в лікувальних водах, та будовою зовнішніх електронних шарів їхніх атомів
|
1. Магній 2. Літій 3. Іод 4. Арсен |
А. 2s1 Б. 3s2 В. 3d54s2 Г. 4s24p3 Д. 5s25p5 |
ІІІ. ЗАВДАННЯ НА ВСТАНОВЛЕННЯ ПРАВИЛЬНОЇ ПОСЛІДОВНОСТІ. (0,5 бала)
19. Встановіть ланцюжок, що показує зростання кислотних властивостей сполук:
А Cl2O7 3232
Б SO3
B Р2О5
Г SiO2
20. Встановіть ланцюжок, що показує посилення металічних властивостей елементів:
А Стронцій
Б Барій
В Кальцій
Г Магній
IV. ЗАВДАННЯ ВІДКРИТОЇ ФОРМИ З КОРОТКОЮ ВІДПОВІДДЮ.(0,5 бала)
21.Назвіть елемент, якому відповідає графічна формула атома
22. Кількість електронів на зовнішньому енергетичному рівні в атомі елемента вдвічі менша, ніж в атомі Аргону. Електрони в атомі елемента розміщені на трьох енергетичних рівнях. Визначте формулу вищого оксиду цього елемента та впишіть у відповідь суму індексів.
23. Яке число неспарених електронів на останньому рівні у атома Селену?
24. Яку найменшу валентність проявляє Германій?
Варіант ІІ
І. ЗАВДАННЯ З ВИБОРОМ ОДНІЄЇ ПРАВИЛЬНОЇ ВІДПОВІД .(0,5 бала)
1.Виберіть ряд лужних елементів:
А F, Cl, Br, I
Б Na, K, Rb, Cs
B He, Ne, Ar, Kr
Г Be, Mg, Ca, Sr
2.Яка кількість електронів у атома Гелію
А 2
Б 1
B 4
Г 12
А IV 3333 3. Яку максимальну валентність проявляє Бром?
Б V
B VI
Г VII
4.Елемент Бром у періодичній системі знаходиться:
А у малому періоді, головній підгрупі
Б у великому періоді, головній підгрупі
B у малому періоді, побічній підгрупі
Г у великому періоді, побічній підгрупі
5. Позначте заряд ядра у атома Цинку:
А +30
Б -25 B +25
Г -30
6. Позначте кількість електронів на останньому енергетичному рівні у атома Стронцію:
7. Позначте метал, який утворює лише основний оксид:
А. АІ
Б. P
В.S
Г.Са
8. Однакову кількість енергетичних рівнів мають атоми елементів із протонними числами
А. 9 і 16
Б. 14 і 32
В. 7 і 15
Г. 3 і 9
9. Яка кількість нейтронів у нукліді Cиліцію
А. 11
Б. 13
В. 14
Г. 12
10. Укажіть хімічну формулу кислотного оксиду
А. SO3 3434
Б. CaO
В. ZnO
Г. К2O
11. Сполука, що належить до амфотерних гідроксидів, це:
А. Al(OH)3
Б. NaOН
В. Ba(OН)2
Г. KOН
12. Визначте правильні твердження.
1) протонне число Магнію 12 2) протонне число Натрію 23 3) протонне число Калію 39 4) протонне число Кальцію 20
А. 2,3
Б. 1,4
В. 2,4
Г. 3,4
13. Позначте хімічний елемент, відносна молекулярна маса водневої сполуки якого (RH3) дорівнює 17:
А. S
Б. Al
В. Cl
Г. N
14. Атоми хімічних елементів, утворюючи молекули, намагаються утворити стійку зовнішню оболонку, що містить
А. вісім електронів
Б. чотири електрони
В. три електрони
Г. шість електронів
ІІ. ЗАВДАННЯ НА ВСТАНОВЛЕННЯ ВІДПОВІДНОСТІ. (0,5 бала)
15. Встановіть відповідність між числом та номером:
|
1 кількість протонів 2 максимальна валентність 3 число енергетичних рівнів
|
А номер групи (гол. підгрупа) Б номер періоду B номер елемента |
3535 |
16. Встановіть відповідність між термінами та кількістю частинок у атома:
1 нуклонне число А кількість електронів на останньому
2 протонне число енергетичному рівні
3 № головної підгрупи Б кількість протонів та нейтронів
В кількість протонів
17. Встановіть відповідність між назвою елемента та електронною формулою його атома:
2 2 2
1 Гелій А 1S 2S 2P
2
2 Карбон Б 1S
2 2 4
3 Сульфур В 1S 2S 2P
2 2
4 Берилій Г 1S 2S
18. Установіть відповідність між назвами мікроелементів, що містяться в лікувальних водах, та будовою зовнішніх електронних шарів їхніх атомів
|
1. Літій 2. Іод 3. Магній |
А. 5s25p5 Б. 2s1 В. 3d54s2 |
|
4. Арсен |
Г. 4s24p3 Д. 3s2 |
ІІІ. ЗАВДАННЯ НА ВСТАНОВЛЕННЯ ПРАВИЛЬНОЇ ПОСЛІДОВНОСТІ. (0,5 бала)
19. Встановіть ланцюжок, що показує зростання основних властивостей сполук: А SrO
Б CaO
B MgO
Г BeO
20.Встановіть ланцюжок, що показує посилення неметалічних властивостей елементів: А Сульфур Б Хлор
В Фосфор 3636
Г Силіцій
IV. ЗАВДАННЯ ВІДКРИТОЇ ФОРМИ З КОРОТКОЮ ВІДПОВІДДЮ. (0,5 бала)
21.Назвіть елемент, якому відповідає електронна формула атома
1S22S22P63S23P5
22. Кількість електронів на зовнішньому енергетичному рівні в атомі елемента на 2 більша, ніж в атомі Алюнію. Електрони в атомі елемента розміщені на трьох енергетичних рівнях. Визначте формулу водневої сполуки цього елемента та обчисліть суму індексів.
23. Яке число неспарених електронів на останньому рівні у атома Германію?
24. Яку найменшу валентність проявляє Селен?
Варіант ІІІ
І. ЗАВДАННЯ З ВИБОРОМ ОДНІЄЇ ПРАВИЛЬНОЇ ВІДПОВІДІ. (0,5 бала)
1.Виберіть ряд елементів – інертних:
А Na, K, Rb, Cs
Б He, Ne, Ar, Kr
B F, Cl, Br, I
Г Be, Mg, Ca, Sr
2.Яка кількість електронів у атома Бору
А 5
Б 2
B 1
Г 11
3.У періодичній залежності від чого перебувають властивості елементів, їх простих 3737 речовин та сполук?
А від атомних ваг елементів
Б від кількості електронів на останньому енергетичному рівні
B не перебувають у якійсь залежності
Г від заряду ядер їх атомів
4.Елемент Бром у періодичній системі знаходиться
А у малому періоді, головній підгрупі
Б у великому періоді, головній підгрупі
B у малому періоді, побічній підгрупі
Г у великому періоді, побічній підгрупі
5.Позначте заряд ядра у атома Феруму:
А +26
Б - 24
B +42
Г - 42
6.Позначте кількість електронів на останньому енергетичному рівні у атома Галію:
А 1
Б 3
B 4
Г 2
7. Позначте метал, який утворює лише основний оксид:
А. Zn
Б. N
В. С Г. К
8. Однакову кількість енергетичних рівнів мають атоми елементів із протонними числами
А. 8 і 16
Б. 15 і 33
В. 7 і 15
Г. 31 і 36
9. Яка кількість нейтронів у нукліді Сульфуру
А. 19
Б. 13
В. 16
Г. 22
10. Укажіть хімічну формулу кислотного оксиду
А. SеO3 3838
Б. CaO
В. ZnO
Г. BaO
11. Сполука, що належить до амфотерних гідроксидів, це:
А. Al(OH)3
Б. NaOН
В. Ba(OН)2
Г. KOН
12. Визначте правильні твердження. 1) протонне число Силіцію 14 2) протонне число Натрію 23 3) протонне число Калію 39 4) протонне число Хлору 17
А. 2,3
Б. 1,4
В. 2,4
Г. 3,4
13. Позначте хімічний елемент, відносна молекулярна маса водневої сполуки якого (RH3) дорівнює 34:
А. Cl
Б. Al
В. N
Г. Р
14. Атоми хімічних елементів, утворюючи молекули, намагаються утворити стійку зовнішню оболонку, що містить А. вісім електронів
Б. чотири електрони
В. три електрони
Г. шість електронів
ІІ. ЗАВДАННЯ НА ВСТАНОВЛЕННЯ ВІДПОВІДНОСТІ. (0,5 бала)
15.Встановіть відповідність між частинками та їх зарядом:
1 електрон А позитивний
2 протон Б без заряду
3 нейтрон B негативний
16.Встановіть відповідність між номером та кількістю частинок:
1 № елемента А кількість енергетичних рівнів
2 № головної підгрупи Б заряд ядра
3 № періоду В кількість електронів на останньому
енергетичному рівні
Г кількість орбіталей
17. Встановіть відповідність між назвою елемента та електронною формулою його атома: 3939
2 2 1
|
1 Флуор |
|
А 1S 2S 2P |
|
2 Бор |
|
2 2 5 Б 1S 2S 2P |
|
3 Неон |
|
2 2 6 В 1S 2S 2P |
|
4 Гідроген |
|
1 Г 1S |
18. Установіть відповідність між назвами мікроелементів, що містяться в лікувальних водах, та будовою зовнішніх електронних шарів їхніх атомів
|
1. Магній 2. Літій 3. Іод 4. Арсен |
А. 2s1 Б. 3s2 В. 3d54s2 Г. 4s24p3 Д. 5s25p5 |
ІІІ. ЗАВДАННЯ НА ВСТАНОВЛЕННЯ ПРАВИЛЬНОЇ ПОСЛІДОВНОСТІ. (0,5 бала)
19. Встановіть ланцюжок, що показує зростання кислотних властивостей сполук:
А Cl2O7
Б SO3
B Р2О5
Г CO2
20. Встановіть ланцюжок, що показує посилення металічних властивостей елементів:
А Цезій
Б Рубідій
В Калій
Г Натрій
IV. ЗАВДАННЯ ВІДКРИТОЇ ФОРМИ З КОРОТКОЮ ВІДПОВІДДЮ. (0,5 бала)
21.Назвіть елемент, якому відповідає графічна формула атома
4040
22. Кількість електронів на зовнішньому енергетичному рівні в атомі елемента така, як в атомі Гідрогену. Електрони в атомі елемента розміщені на трьох енергетичних рівнях. Визначте формулу вищого оксиду цього елемента та впишіть у відповідь суму індексів.
23. Яке число неспарених електронів на останньому рівні у атома Телуру?
24. Яку найменшу валентність проявляє Силіцій?
Варіант ІV
І. ЗАВДАННЯ З ВИБОРОМ ОДНІЄЇ ПРАВИЛЬНОЇ ВІДПОВІДІ. (0,5 бала)
1.Виберіть ряд лужних елементів:
А F, Cl, Br, I
Б Na, K, Rb, Cs
B He, Ne, Ar, Kr
Г Be, Mg, Ca, Sr
2.Яка кількість електронів у атома Натрію
А 11
Б 23
B 5
Г 15
А V 4141 3. Яку максимальну валентність проявляє Телур?
Б IV
B VII
Г VI
4. Елемент Бром у періодичній системі знаходиться:
А у шостому періоді, четвертій підгрупі
Б у четвертому періоді, сьомій підгрупі
B у другому періоді, шостій підгрупі
Г у третьому періоді, сьомій підгрупі
5. Позначте заряд ядра у атома Стануму:
А +50
Б -25 B +25
Г -50
6. Позначте кількість електронів на останньому енергетичному рівні у атома Алюмінію:
А 3
Б 2 B 1
Г 4
7. Позначте метал, який утворює лише основний оксид:
А. АІ
Б. P
В.S
Г.Ва
8. Однакову кількість енергетичних рівнів мають атоми елементів із протонними числами
А. 9 і 16
Б. 14 і 32
В. 7 і 15
Г. 12 і 18
9. Яка кількість нейтронів у нукліді Аргону
А. 11
Б. 13
В. 22
Г. 12
10. Укажіть хімічну формулу кислотного оксиду
А. C2lO7 4242
Б. CaO
В. FeO
Г. К2O
11. Сполука, що належить до амфотерних гідроксидів, це:
А. Al(OH)3
Б. NaOН
В. Ba(OН)2
Г. KOН
12. Визначте правильні твердження.
1) протонне число Карбону 6 2) протонне число Натрію 23 3) протонне число Калію 39 4) протонне число Гелію 2
А. 2,3
Б. 1,4
В. 2,4
Г. 3,4
13. Позначте хімічний елемент, відносна молекулярна маса водневої сполуки якого (RH4) дорівнює 16:
А. S
Б. Al
В. Cl
Г. С
14. Атоми хімічних елементів, утворюючи молекули, намагаються утворити стійку зовнішню оболонку, що містить
А. вісім електронів
Б. чотири електрони
В. три електрони
Г. шість електронів
ІІ. ЗАВДАННЯ НА ВСТАНОВЛЕННЯ ВІДПОВІДНОСТІ. (0,5 бала)
15. Встановіть відповідність між числом та номером:
|
1 кількість протонів 2 максимальна валентність 3 число енергетичних рівнів
|
А номер групи (гол. підгрупа) Б номер періоду B номер елемента |
4343 |
16. Встановіть відповідність між термінами та кількістю частинок у атома:
1 нуклонне число А кількість електронів на останньому
2 протонне число енергетичному рівні
3 № головної підгрупи Б кількість протонів та нейтронів
В кількість протонів
17. Встановіть відповідність між назвою елемента та електронною формулою його атома:
2 2 2
1 Гелій А 1S 2S 2P
2
2 Карбон Б 1S
2 2 4
3 Сульфур В 1S 2S 2P
2 2
4 Берилій Г 1S 2S
18. Установіть відповідність між назвами мікроелементів, що містяться в лікувальних водах, та будовою зовнішніх електронних шарів їхніх атомів
|
1. Літій 2. Іод 3. Магній |
А. 5s25p5 Б. 2s1 |
|
4. Арсен |
В. 3d54s2 Г. 4s24p3 Д. 3s2 |
ІІІ. ЗАВДАННЯ НА ВСТАНОВЛЕННЯ ПРАВИЛЬНОЇ ПОСЛІДОВНОСТІ. (0,5 бала)
19. Встановіть ланцюжок, що показує зростання основних властивостей сполук: А SrO
Б CaO
B MgO
Г BeO
20.Встановіть ланцюжок, що показує посилення неметалічних властивостей елементів:
А Сульфур
Б Хлор
В Фосфор 4444
Г Силіцій
IV. ЗАВДАННЯ ВІДКРИТОЇ ФОРМИ З КОРОТКОЮ ВІДПОВІДДЮ. (0,5 бала)
21.Назвіть елемент, якому відповідає електронна формула атома
1S22S22P63S23P5
22. Кількість електронів на зовнішньому енергетичному рівні в атомі елемента на 2 більша, ніж в атомі Алюнію. Електрони в атомі елемента розміщені на трьох енергетичних рівнях. Визначте формулу водневої сполуки цього елемента та обчисліть суму індексів.
23. Яке число неспарених електронів на останньому рівні у атома Плюмбуму?
24. Яку найменшу валентність проявляє Полоній?
Бланк відповідей
Тестування з теми «Періодичний закон. Будова атома»
Дата ______________________
Учень (учениця) 8 класу
_________________________________________________________
Варіант _____
|
А |
Б |
В |
Г |
|
|
|
|
|
1.
9.
|
А |
Б |
В |
Г |
|
|
|
|
|
2.
4545
3.
|
А |
Б |
В |
Г |
|
|
|
|
|
|
А |
Б |
В |
Г |
|
|
|
|
|
4.
12.
|
А |
Б |
В |
Г |
|
|
|
|
|
5.
|
А |
Б |
В |
Г |
|
|
|
|
|
6.
7.
|
А |
Б |
В |
Г |
|
|
|
|
|
|
А |
Б |
В |
Г |
|
|
|
|
|
8.
|
А |
Б |
В |
Г |
|
|
|
|
|
|
|
|
|
|
|
А |
Б |
В |
Г |
|
|
|
|
|
|
|
|
|
|
|
А |
Б |
В |
Г |
|
|
|
|
|
|
|
|
|
|
|
А |
Б |
В |
Г |
|
|
|
|
|
9.
10.
11.
12.
|
А |
Б |
В |
Г |
|
|
|
|
|
13
|
А |
Б |
В |
Г |
|
|
|
|
|
14
|
|
А |
Б |
В |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
15.
4646
|
|
А |
Б |
В |
Г |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
16
|
|
А |
Б |
В |
Г |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
17.
|
|
А
|
Б |
В |
Г |
Д |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
18.
|
А
|
Б |
В |
Г |
|
|
|
|
|
19.
|
А |
Б |
В |
Г |
|
|
|
|
|
20.
|
|
|
|
|
|
|
21.
|
|
|
|
|
22.
|
|
|
|
|
23.
|
|
|
|
|
24.
Відповіді до всіх варіантів(кожне завдання – 0,5 бала)
|
А |
Б |
В |
Г |
|
|
Х |
|
|
1.
9.
|
А |
Б |
В |
Г |
|
|
Х |
|
|
2.
3.
|
А |
Б |
В |
Г |
|
|
|
|
Х |
|
А |
Б |
В |
Г |
|
|
Х |
|
|
4. 4747
12.
|
А |
Б |
В |
Г |
|
Х |
|
|
|
5.
|
А |
Б |
В |
Г |
|
|
Х |
|
|
6.
7.
|
А |
Б |
В |
Г |
|
|
|
|
Х |
|
А |
Б |
В |
Г |
|
|
|
|
Х |
|
|
|
|
|
|
А |
Б |
В |
Г |
|
|
|
Х |
|
|
|
|
|
|
|
А |
Б |
В |
Г |
|
Х |
|
|
|
8.
9.
10.
|
А |
Б |
В |
Г |
|
Х |
|
|
|
|
|
|
|
|
|
А |
Б |
В |
Г |
|
|
Х |
|
|
|
|
|
|
|
|
А |
Б |
В |
Г |
|
|
|
|
Х |
|
|
|
|
|
|
А |
Б |
В |
Г |
|
Х |
|
|
|
11.
12.
13
14
|
|
А |
Б |
В |
|
1 |
|
|
Х |
|
2 |
Х |
|
|
|
3 |
|
Х |
|
15.
|
|
А |
Б |
В |
Г |
|
1 |
|
Х |
|
|
|
2 |
|
|
Х |
|
|
3 |
Х |
|
|
|
16
4848
|
|
А |
Б |
В |
Г |
|
1 |
|
Х |
|
|
|
2 |
Х |
|
|
|
|
3 |
|
|
Х |
|
|
4 |
|
|
|
Х |
17.
|
|
А |
Б |
В |
Г |
Д |
|
1 |
|
Х |
|
|
|
|
2 |
Х |
|
|
|
|
|
3 |
|
|
|
|
Х |
|
4 |
|
|
|
Х |
|
18.
|
А |
Б |
В |
Г |
|
4 |
3 |
2 |
1 |
|
|
|
|
|
|
А |
Б |
В |
Г |
|
3 |
4 |
2 |
1 |
19.
20.
|
|
|
Х |
Л |
О |
Р |
21.
|
|
|
|
3 |
22.
|
|
|
|
2 |
23.
|
|
|
|
2 |
24.
Відповідь на тести для самоконтролю
1. А 21. Г
2. 22. Г
|
1 |
2 |
3 |
4 |
|
А |
Г |
Б |
В |
23. Б
24. Г
3. Г 25. А
4. Г
5. Б 4949
6. А
7. Г
8. В
9. В
10. Б
11. Б
12. А
13. SO3 сума індексів - 4
14. Г
15. В
16. А
17. В
18. А
|
|
А |
Б |
В |
Г |
|
1 |
|
|
Х |
|
|
2 |
|
Х |
|
|
|
3 |
|
|
|
Х |
|
4 |
Х |
|
|
|
19.
20. Б
5050


про публікацію авторської розробки
Додати розробку
