План-конспект уроку для 10 класу "Ізопроцеси в газах"
План-конспект уроку з фізики у 10 класі рівня стандарт. План уроку дозволяє повністю розкрити тему на рівні стандарту. Актуалізація матеріалу прповодиться у вигляді заповнення таблиці, що дозволяе потім використовувати її для повторення на інших уроках. Новий матеріал структурований у таблиці, що допомагає здійснювати якісне узагальнення знань. Достатня кількістиь задач дозволяє відпрацювати навички розв*язання задач з теми.
Лепська В.М.
Клас 10 б
ІІ семестр, урок 7.
Тема. Ізопроцеси.
Мета.
Освітня. Ввести поняття ізопроцесу, сформувати три газових закони для ізопроцесів.
Розвиваюча. Розвивати логічне мислення, творчу уяву та фізичну компетентність.
Виховна. Виховувати інтерес до предмету та культуру оформлення розв’язків задач.
Тип уроку. Комбінований.
План уроку.
- Організаційний момент.
- Актуалізація знань.
- Вивчення нового матеріалу.
- Первинне закріплення матеріалу.
- Домашнє завдання (§46, №291)
Хід уроку.
- Організаційний момент.
Привітання, перевірка готовності
- Актуалізація опорних знань
|
Формула |
Назва |
Формула |
Назва |
|
|
Відносна молекулярна маса |
|
Основне рівняння МКТ |
|
|
а.о.м. |
|
Середня кінетична енергія молекул |
|
|
Кількість речовини |
|
Зв'язок між тиском та середньою кінетичною енергією |
|
|
Число Авогадро |
|
Перевод 0С у К |
|
|
Кількість молекул |
|
Зв'язок середньої кінетичної енергії та температури |
|
|
Молярна маса |
|
Стала Больцмана |
|
|
Зв'язок молярної та молекулярної маси |
|
Швидкість руху молекул |
|
|
Кількість молекул |
|
Зв'язок між температурою та тиском |
|
|
Густина речовини |
|
Рівняння стану |
|
|
Кількість молекул |
|
Універсальна газова стала |
|
|
Маса речовини |
|
Рівняння Менделеєва-Клапейрона |
|
|
Концентрація |
|
Рівняння Клапейрона |
|
|
Основне рівняння МКТ |
|
|
|
|
Середня кінетична енергія молекул |
|
|
- Вивчення нового матеріалу.
За допомогою рівняння стану ідеального газу (або рівняння Менделеєва-Клапейрона) можна дослідити процеси, у яких маса і один з макроскопічних параметрів залишаються незмінним.
Процес – це перехід системи з одного стану у інший.
Кількісна залежність між двома параметрами газу за фіксованого значення третього параметру, називається газовим законом.
|
Ізотермічний |
Ізобарний |
Ізохорний |
|
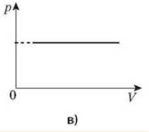
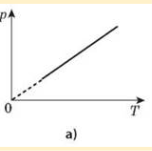
Процес зміни стану термодинамічної системи за сталої температури називається ізотермічним.
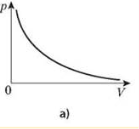
Закон Бойля-Маріотта: для деякої маси газу добуток тиску газу на об’єм за Т =const є сталою величиною pV = const.
Графічну залежність тиску від об’єму за умови Т = const можна зобразити у вигляді кривої — ізотерми в координатах р, V і прямих ліній у координатах p, Т або V, Т.
|
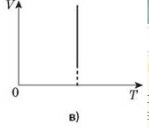
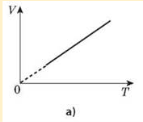
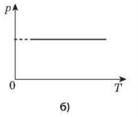
Процес зміни стану термодинамічної системи за сталого тиску називається ізобарним.
Закон ГейЛюссака: для даної маси газу відношення об’єму до температури стале, якщо тиск газу не змінюється. V/T=const.
Графік залежності об’єму від температури за сталого тиску є прямою лінією, яку називають ізобарою.
|
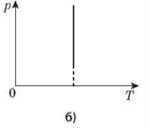
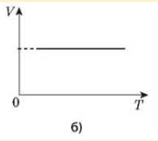
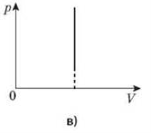
Процес зміни стану термодинамічної системи за сталого об’єму називається ізохорним.
Закон Шарля: для даної маси газу відношення тиску до температури стале, якщо об’єм газу не змінюється.
Графіком залежності тиску від температури за сталого об’єму є пряма лінія, яку називають ізохорою.
|
- Первинне закріплення матеріалу
- За температури -230С газ займає об’єм 60 л. Яким буде об’єм газу за температури 1270С? Тиск не міняється.
- Тиск газу у балоні за температури 270С дорівнює 240 кПа. Яким стане тиск після нагрівання газу на 1000С?
- У циліндрі під поршнем знаходиться 6 л газу за температури 323 К. До якого об’єму необхідно ізобарно стиснути цей газ, щоби його температура знизилася до 220 К?
- При ізохорному охолодженні ідеального газу, який був при температурі 480 К, його тиск зменшився у 1,5 разу. Якою стала кінцева температура газу?
- Як зміниться тиск газу в циліндрі, якщо поршень повільно опустити на 1/3 висоти циліндру?
- Домашнє завдання ((§46, №291)


про публікацію авторської розробки
Додати розробку