Поняття про гальванічний елемент


















Італійський фізіолог, професор медицини Болонськогоуніверситету Л. Гальвані вперше виявив електричний струм, що виникав у разі контакту різних металів. Він провів та описав дослід скорочення м’язів задніх кінцівок жаби, закріплених на мідних гачках, під час дотику до них сталевим скальпелем.
Перша електрична батарея з'явилася в 1799 році. Її винайшов італійський фізик Алессандро Вольта (1745 - 1827) - італійський фізик, хімік і фізіолог, винахідник джерела постійного електричного струму Він винайшов оригінальний пристрій, що виробляв електричний струм. Це був немов товстий «бутерброд» iз металічних пластин (міді і цинку) i тканини, яка заздалегідь була просякнута розчином сульфатної кислоти. До першої та останньої пластинок припаювали дротинки. Якщо ix занурювали у воду, то на поверхні кожної дротинки починалося виділення газу. Це відбувався електроліз води. Отже, крізь воду проходив електричний струм. Винайдене джерело струму було названо гальванічним елементом на честь Луїджі Гальвані.
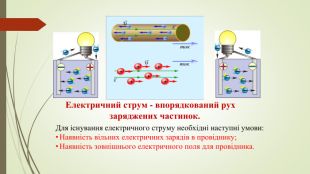
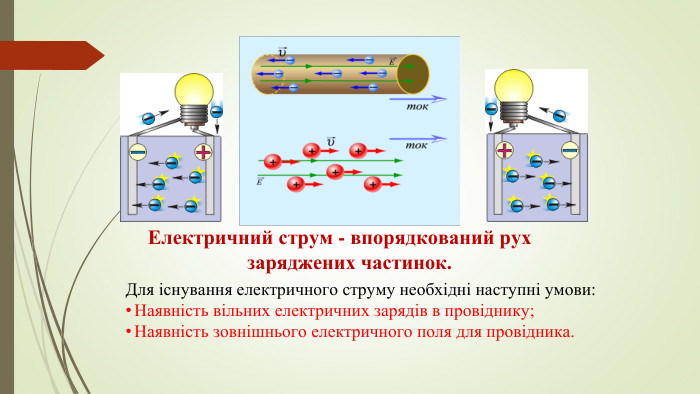
Принцип дії гальванічного елемента. Гальванічний елемент Даніеля-Якобі складається з двох посудин. В одній міститься розчин цинк сульфату, у який занурено пластинку з цинку, в іншій – купрум(ІІ) сульфату у який занурено пластинку з міді. Розчини з’єднано трубкою (сольовим містком), що заповнена розчином електроліту, йони якого ʜе взаємодіють з іншими йонами в гальванічному елементі, наприклад натрій нітрату. У такий спосіб забезпечується електричний контакт між посудинами. Для того щоб розчин не виливався, кінці трубки закривають скловатою чи гелем, просоченим електролітом. Якщо електроди з’єднати дротинками з електричною лампочкою, то вона засвітиться.
Принцип дії гальванічного елемента. Через деякий час в обох склянках можна спостерігати хімічні перетворення: цинкова пластинка розчиняється, а на мідній пластинці з розчину осаджується мідь. Розмір цинкової пластинки зменшується, а мідної - збільшується. Водночас послаблюється забарвлення розчину купрум(ІІ) сульфату (концентрація йонів Сu2+ знижується). Ці хімічні зміни є результатом перенесення електронів з однієї частини елемента до іншого, тобто це типовий електрохімічний процес.
У гальванічному елементі відбуваєтьсятиповий електрохімічний процес, що пояснюється окисно-відновними реакціями. Атоми цинку, утрачаючи електрони,окиснюються й перетворюються на катіони Цинку: Zn – 2ē = Zn2+. На цинковому електроді концентруються електрони, тому він набуває негативного заряду. Цинковий електрод називають анодом. На поверхні мідної пластини електрони захоплюються катіонами Купруму з розчину, відновлюючи їх до атомів міді, які й осідають на пластині. Відбувається процес відновлення: Сu2+ + 2ē = Сu. Мідний електрод унаслідок відновлення набуває позитивного заряду; такий електрод дістав назву катод. Сумарне рівняння окисно-відновного перетворення в гальванічному елементі: Cu2+ + Zn = Сu + Zn2+.
Однак у гальванічному елементі процеси окиснення й відновлення йдуть окремо на поверхні кожного з двох електродів. Електрони, що залишаються від атомів Цинку на аноді, рухаються електричним ланцюгом до катода, де їx отримують катіони Купруму. Струм буде текти до тих пір, поки весь цинк не розчиниться або всі катіони Купруму з розчину не відновляться до міді. Під час роботи гальванічного елемента в розчині купрум(ІІ) сульфату зменшується кількість катіонів Cu2+, а в розчині цинк сульфату збільшується кількість катіонів Zn2+. Тому сольовий місток не тільки забезпечує електричний контакт між двома розчинами, а й підтримує електронейтральність розчинів, «постачаючи» катіони стороннього електроліту (у нашому випадку Na+) у розчин купрум(ІІ) сульфату, а аніони (NO3−) – у розчин цинк сульфату.
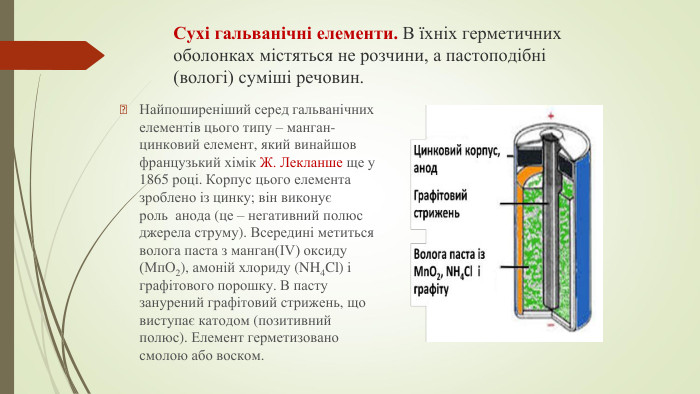
Сухі гальванічні елементи. В їхніх герметичних оболонках містяться не розчини, а пастоподібні (вологі) суміші речовин. Найпоширеніший серед гальванічних елементів цього типу – манган-цинковий елемент, який винайшов французький хімік Ж. Лекланше ще у 1865 році. Корпус цього елемента зроблено iз цинку; він виконує роль анода (це – негативний полюс джерела струму). Всередині метиться волога паста з манган(ІV) оксиду (Мп. О2), амоній хлориду (NH4 Cl) i графітового порошку. В пасту занурений графітовий стрижень, що виступає катодом (позитивний полюс). Елемент герметизовано смолою або воском.
Під час роботи елемента відбуваються такі процеси. Цинк зазнає окиснення: Zn − 2ē = Zn2+. Через це корпус елемента iз середини поступово руйнується. На графітовому катоді відновлюється Манган: Мn+4 + ē =Мn+3. Протікає хімічна реакція, що описується рівнянням Zn + 2 Mn. O2 + 2 NH4 Cl = 2 Mn. O(OH) + Zn. Cl2 + 2 NH3 На полюсах елемента створюється напруга в 1,5 В.
Батарейка зазвичай мається на увазі невеличкий за розміром елемент, але розмір не головне,Батарейкою називається гальванічний елемент котрий не можна перезаряджати. Чому на електромобілях «батареї» які можна перезаряджати. На англійські мові батарейка перекладається як battery і акумулятор також battery. Крім того батарея це те що складене з частин, а на електромобілях, зокрема Тесла джерела живлення складаються із багатьо частин.
В літій-іонному акумуляторі накопичення заряду відбувається за рахунок міграції іонів літію між катодом і анодом, розділених електролітом. Матеріалом катода служить кераміка зі значним вмістом літію (наприклад, Li. Co. O2. Матеріалом анода зазвичай служить графіт. Що важливо процес оборотній при підклічен струму. Принцип дії
Літій в УкраїніДержавна служби геології і надр. України відзвітувала у 2020 році про перспективні родовища літію. «За запасами цього металу ми посідаємо друге місце в Європі»На сьогодні поклади літію є в Кіровоградській (Полоховське родовище), Донецькій (Шевченківське) та Запорізькій областях (родовище «Крута балка»). Високий попит на літій збережеться років 20–30 Одна з об'єктивних переваг України – прагнення Євросоюзу зменшити залежність від занадто віддалених виробників літію. «У Європі будуються нові потужності з виробництва катодів і батарей – це драйвер зростання попиту на літій у ЄС, а ми знаходимося поруч»
Електронні властивості За своїми електронними властивостями графен відрізняється від тривимірного графіту. Його можна охарактеризувати як напівметал, або ж як надпровідник. Існують проекти графенових акумуляторів, на відміну звичайних він екологічно безпечний. Графенові батареї - це ті, які обіцяють триваліший термін служби, кращі характеристики та нижчу ціну. Також графен може бути гнучким, тому гаджети з графеновими акумулятроми, теж будуть гнутися. Крім того, його можна інтегрувати в розумний одяг


про публікацію авторської розробки
Додати розробку