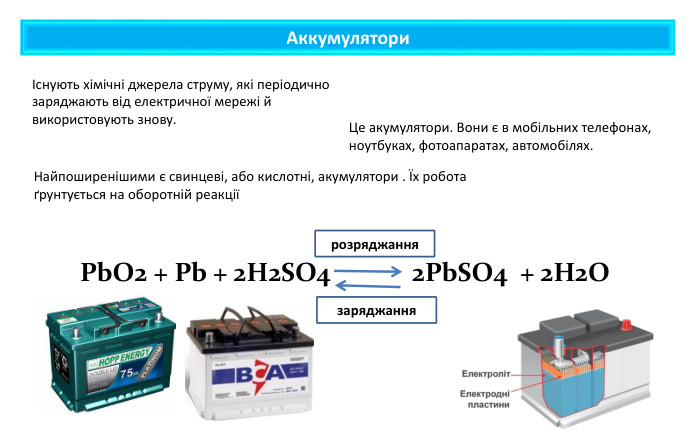
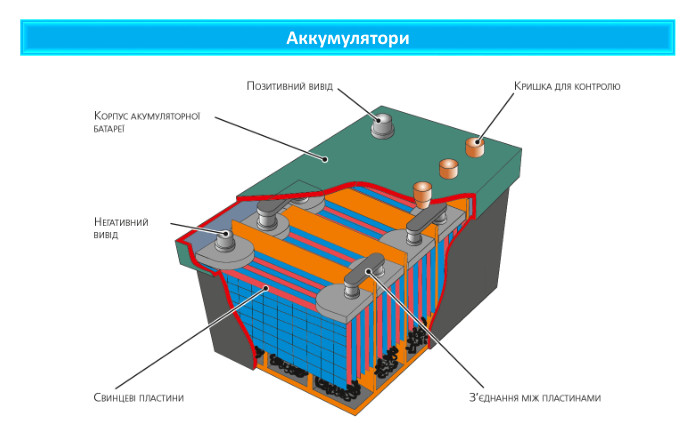
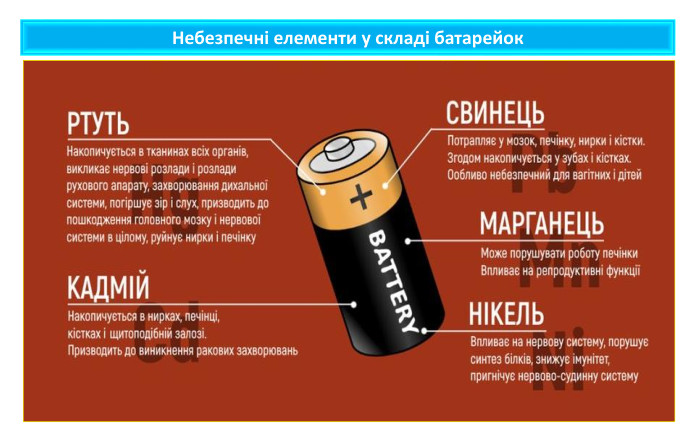
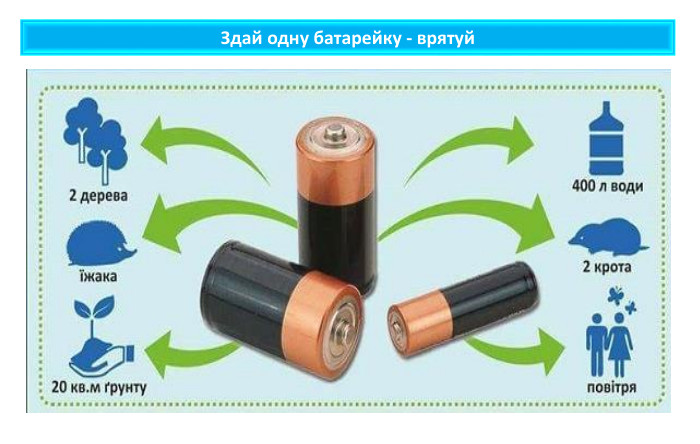
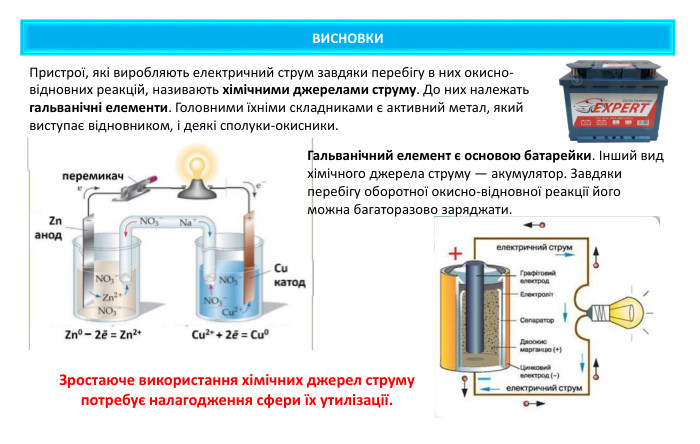
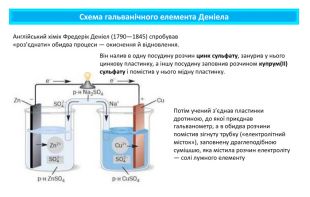
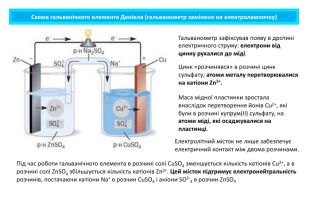
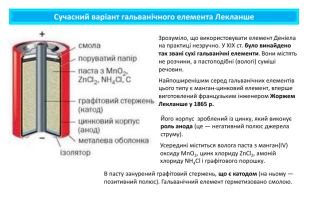
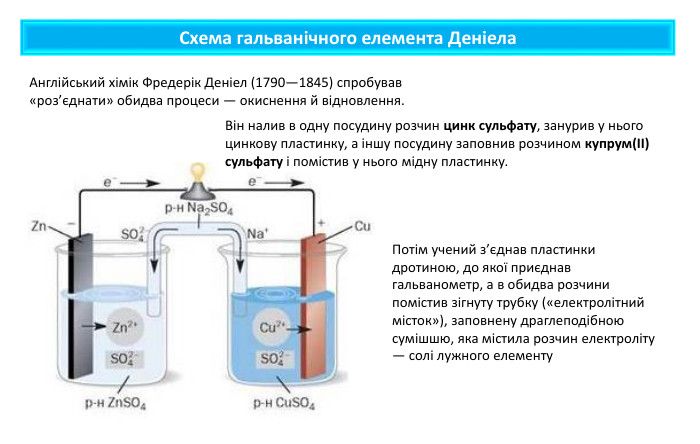
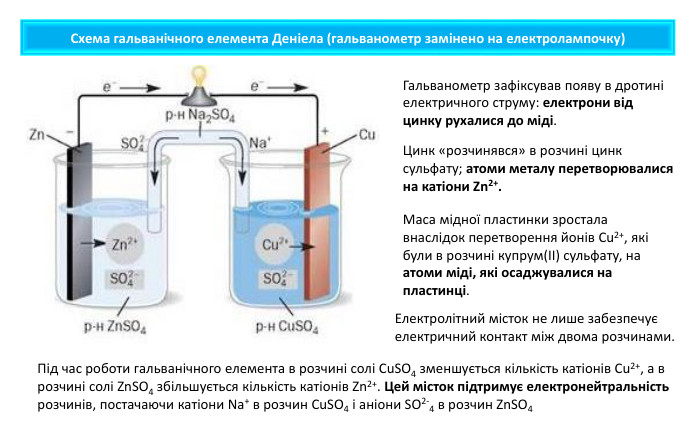
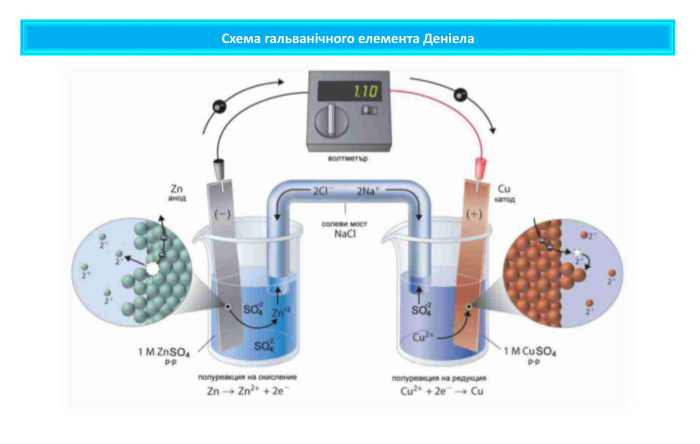
Поняття про гальванічний елемент-як хімічне джерело електричного струму
Про матеріал
Презентація містить навчальний матеріал до уроку в 11 класі з хімії. Звертається увага на проблему утилізації хімічних джерел електричного струму. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку





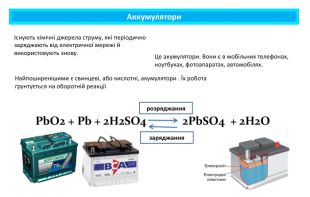
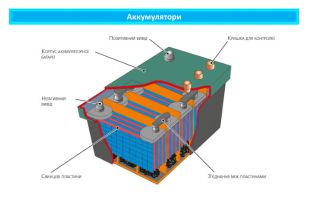
![компактні хімічні джерела струму з тривалим періодом роботи Більшість із них мають цинкові аноди. У цинк-срібному гальванічному елементі , крім цинку, містяться аргентум(І) оксид Ag2 O і калій гідроксид. В останні десятиліття значного попиту набули компактні хімічні джерела струму з тривалим періодом роботи. Під час його роботи відбувається окисно-відновна реакція. Zn + Ag2 O + 2 КОН + Н2 О = K2[Zn(OH)4] + 2 Ag. Батарейка для годинника Батарейку можна використати лише один раз. компактні хімічні джерела струму з тривалим періодом роботи Більшість із них мають цинкові аноди. У цинк-срібному гальванічному елементі , крім цинку, містяться аргентум(І) оксид Ag2 O і калій гідроксид. В останні десятиліття значного попиту набули компактні хімічні джерела струму з тривалим періодом роботи. Під час його роботи відбувається окисно-відновна реакція. Zn + Ag2 O + 2 КОН + Н2 О = K2[Zn(OH)4] + 2 Ag. Батарейка для годинника Батарейку можна використати лише один раз.](/uploads/files/2596188/376189/431447_images/8.jpg)