Поняття про лужні, інертні елементи, галогени.
Тема. Поняття про лужні, інертні елементи, галогени. 8 клас
Мета: навчальна: розширити знання про хімічні елементи та їх властивості на прикладі природних родин хімічних елементів ( лужні метали, галогенів, інертні елементи). Розкрити залежність властивостей усередині груп лужних металів і галогенів від порядкового номера елемента.
розвиваюча: розвивати пізнавальний інтерес, увагу, логічне мислення, вміння самостійно робити висновки та оцінювати свою роботу на уроці.
виховна: розвивати пізнавальні інтереси учнів.
Тип уроку:
- узагальнення та систематизації знань.
Форми роботи:
- розповідь учителя , робота з підручником,демонстраційний експеримент.
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, ніж, зразки лужних металів (Li, Na), галогенів (I2, Br2), спиртовий розчин йоду, склянка з водою, фенолфталеїн.
Хід уроку
І. Організація класу.
ІІ. Актуалізація опорних знань
1. Пригадайте, які були перші спроби класифікації хімічних елементів?
2. Які класифікації хімічних елементів ми використовували на попередніх уроках?
3.У чому полягає поділ елементів на тріади Йоганом Деберейнером ?
4.Який зв'язок між повторюваністю властивостей елементів і музикою ?
5.Укажіть,як називають елементи сьомої групи Періодичної системи: а)халькогени;б) лужноземельні; в)рідкісноземельні.
ІІІ. Мотивація навчальної діяльності.
Здавна було помічено, що властивості деяких елементів, а також простих речовин та їх сполук, подібні. Такі елементи об’єднали в родини. Розглянемо три найважливіші родини; лужні метали, галогени і інертні елементи.
ІV. Вивчення нового матеріалу
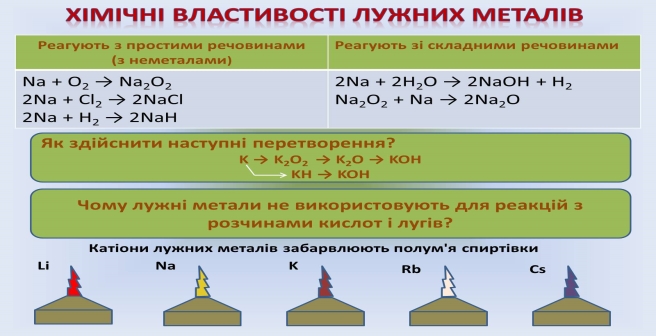
Родина лужних металів.
Прослухайте кілька рядків вірша, прокоментуйте його зміст:
Ось родина в першій групі
Є у головній підгрупі.
Це метали надактивні,
Інколи аж дуже дивні.
У воді іскру пускають,
Вони – лужні, всі це знають.
А зараз дамо характеристику лужних металів.
До лужних металів належать Li, Na, К, Rb, Cs, Fr (Францій - це штучний, дуже радіоактивний метал). Розташовані у 1 групі головній підгрупі.
Валентність лужних металів – І
Фізичні властивості лужних металів.

Родина галогенів.
Прослухайте кілька рядків вірша, прокоментуйте його зміст:
В сьомій групі – галогени,
Ніби справжні джентльмени.
Люблять завжди в парі бути –
Це їх звичні атрибути.
З Гідрогеном дуже дружать
І тоді кислотам служать.
.
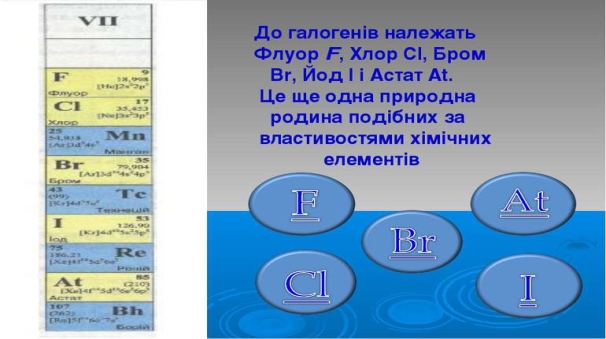
- Галогени — типові неметали, у періодичній системі розташовані в VII групі головної підгрупи, їх назва походить від слів галос — «сіль» і ген — «той, що народжує».
- Усі прості речовини галогенів – двохатомні молекули: F2, Cl2, Br2, І2, Аt2
(астат нестабільні темно-сині кристали, радіоактивний, самий рідкісний із всіх елементів, що зустрічаються не Землі)

Демонстрації брому, кристалічного йоду.

Родина інертних елементів (благородних газів)
Прослухайте кілька рядків вірша, прокоментуйте його зміст:
Що за горді, наче ружі,
І до всіх завжди байдужі,
Елементи в восьмій групі
Є у головній підгрупі?
Це спокійні, благородні
Гази, що з усіма згодні,
В поведінці неактивні,
У житті вони пасивні.
В назві їх ці всі моменти,
Це – інертні елементи.

Інертні елементи — це елементи головної підгрупи VIII групи періодичної системи
Гелій, Неон, Аргон, Криптон, Ксенон, Радон, і, відкритий нещодавно, у 2002 р. Оганесон (№118).
Прості речовини цих елементів – одноатомні гази, що не мають запаху і кольору. Особливим є Оганесон, який при нормальних умовах є твердою речовиною. Він та радон є радіоактивними.



VІ. Узагальнення і систематизація знань
І. Завдання на закріплення.
1. Які характеристики лужних металів указують на їхні металічні властивості? Запишіть рівняння реакцій, що підтверджують металічні властивості лужних металів. 2. З якими з наведених речовин взаємодіє натрій гідроксид: магній оксид, карбон(ІV) оксид, хлоридна кислота? Запишіть рівняння можливих реакцій.
3. Відносна густина за воднем деякого галогеноводню становить 40,5. Обчисліть відносну молекулярну масу галогеноводню, запишіть його хімічну формулу.
4. Із наведених нижче ознак виберіть ті, що стосуються калію й натрію: а) тверді, не ріжуться ножем; б) важкі, тонуть у воді; в) у результаті взаємодії з водою утворюють луги; г) хімічно дуже активні.
5. Хімічний елемент Галій подібний за властивостями до Алюмінію, а Селен — до Сульфуру. Запишіть формули оксидів, гідроксидів та солей, до складу яких входять ці елементи. Складіть рівняння реакцій, що характеризують хімічні властивості добутих сполук.
VІІ. Домашнє завдання, інструктаж щодо його виконання
1. Завдання для всього класу.
Підручник
2. Індивідуальне завдання.
Підготуйте повідомлення на тему «Історія відкриття Періодичного закону».
VІІІ. Підбиття підсумків уроку
Учитель пропонує учням відповісти на запитання:
— Що вам здалося найбільш цікавим?
— Що найбільше запам’яталося?
— Що виявилося для вас складним?
— Що здивувало?
1


про публікацію авторської розробки
Додати розробку
