Поняття про рН розчину. Значення рН для характеристики кислотного чи лужного середовища.
Урок 12
Поняття про рН розчину. Значення рН для характеристики кислотного чи лужного середовища.
Мета: формування ключових компетентностей:
― cпілкування державною мовою;
― комунікатиіна;
―математична грамотність;
―уміння вчитися упродовж життя;
―дослідницька;
формування предметних компетентностей:
―формувати поняття про рН розчину, визначати рН розчину за допомогою індикаторів;
―розвивати хімічну мову, виховувати інтерес до хімії.
Обладнання: штатив з пробірками, індикатори, реактиви― розчин хлоридної кислоти, оцту, натрій гідроксиду, натрій хлориду. Харчові продукти – лимон, виноградний сік, вода «Поляна квасова»,солодка газована вода. Косметична продукція― господарське мило, шампунь, зубна паста. Таблиці рН різних продуктів харчування, рН фізиологічних рідин, косметичних препаратів.
Форми роботи: розповідь, пояснення, прийом «Вірю― не вірю», захист навчальних проектів, лабораторний дослід
Хід уроку
І. Організація класу
ІІ. Оголошення теми та мети уроку
ІІІ. Актуалізація опорних знань
IV.Мотивація навчальної діяльності
Проблемне питання
Чому індикатори змінюють своє забарвлення в розчинах кислот та лугів? Як це пов’язано з електролітичною дисоціацією, та ступенем.?
V.Вивчення нового матеріалу
Історія водневого показника pH Поняття водневого показника введено датським хіміком Серенсеном в 1909 році. Показник називається pH (по перших буквах латинських слів potentia hydrogeni — сила водню, або pondus hydrogeni — вага водню). У хімії поєднанням pX зазвичай позначають величину, яка дорівнює lg X, а буквою H в цьому випадку позначають концентрацію іонів водню (H+), або, вірніше, термодинамічну активність гідроксоній-іонів. В чистій воді при 25°C концентрації іонів водню ([H+]) і гідроксид-іонів ([OH−]) виявляються однаковими і дорівнюють 10-7 моль/л, це чітко випливає з визначення іонного добутку води, який дорівнює [H+] · [OH−] і дорівнює 10-14 моль2/л2 (при 25°C). Якщо концентрації двох видів іонів в розчині виявляться однаковими, в такому випадку кажуть, що у розчину нейтральна реакція. При додаванні кислоти до води, концентрація іонів водню зростає, а концентрація гідроксид-іонів знижується, при додаванні основи — навпаки, збільшується вміст гідроксид-іонів, а концентрація іонів водню зменшується.
Коли [H+] > [OH−] говориться, що розчин виявляється кислим, а при [OH−] > [H+] — лужним. Щоб було зручніше представляти, для позбавлення від негативного показника ступеня, замість концентрацій іонів водню використовують їх десятковий логарифм, який береться з протилежним знаком, який є водневим показником pH.
Трохи меншу популяризацію має зворотна величина pH — показник основності розчину, pOH, яка дорівнює десятичному логарифму (негативному) концентрації в розчині іонів OH−:
Значення рH у розчинах різної кислотності. Врозріз з поширеною думкою, pH може змінюватися крім інтервалу 0-14. pH може виходити за ці межі. Наприклад, при концентрації іонів водню [H+] = 10-15 моль/л, pH = 15, при концентрації іонів гідроксиду 10 моль /л pOH = -1.
Тому при 25°C (стандартних умовах) [H+] [OH−] = 10-14, то ясно, що при такій температурі pH + pOH = 14.
Тому в кислих розчинах [H+] > 10-7, значить, у кислих розчинів pH < 7, відповідно, у лужних розчинів pH > 7, рН нейтральних розчинів дорівнює 7. При більш високих температурах константа електролітичної дисоціації води збільшується, значить, збільшується іонний добуток води, тоді нейтральною буде pH = 7 (що відповідає одночасно підвищеним концентраціям як H+, так і OH−); з пониженням температури, навпаки, нейтральна рН збільшується.
Методи визначення значення pH
Існує декілька методів визначення значення pH розчинів. Водневий показник приблизно оцінюють за допомогою індикаторів, які точно вимірюють за допомогою pH-метра або визначають аналітичним шляхом, проводячи кислотно-основне титрування. Для грубої оцінки концентрації водневих іонів часто використовують кислотно-основні індикатори — органічні речовини-барвники, колір яких залежить від pH середовища.
Найпопулярніші індикатори: лакмус; фенолфталеїн; метил оранжевий (метилоранж) та ін. Індикатори можуть бути у 2-х по-різному забарвлених формах — або в кислотній, або в основній. Зміна кольору всіх індикаторів відбувається в своєму інтервалі кислотності і найчастіше становить 1-2 одиниці. Для збільшення робочого інтервалу вимірювання pH застосовують універсальний індикатор, який є сумішшю з кількох індикаторів. Універсальний індикатор послідовно змінює колір з червоного через жовтий, зелений,синій до фіолетового при переході з кислої області в лужну. Визначення pH індикаторним способом утруднено для каламутних або забарвлених розчинів. Застосування спеціального приладу — pH-метру — дає можливість вимірювати рН в більш широкому діапазоні і більш точно (до 0,01 одиниці pH), ніж за допомогою індикаторів. Іонометричний метод визначення pH ґрунтується на вимірюванні міллівольтметром-іонометром ЕРС гальванічного ланцюга, яка включає скляний електрод, потенціал якого залежить від концентрації іонів H+ у навколишньому розчині. Спосіб володіє високою точністю і зручністю, особливо після калібрування індикаторного електрода в обраному діапазоні рН, що дає можливість вимірювати pH непрозорих і кольорових розчинів і тому часто застосовується. Аналітичний об’ємний метод — кислотно-основне титрування — теж дає точні результати визначення кислотності розчинів. Розчин відомої концентрації (титрант) краплями додають до розчину, який досліджується. При їх змішуванні відбувається хімічна реакція. Точка еквівалентності — це момент, коли титранта точно вистачає для повного завершення реакції, — фіксується за допомогою індикатора. Після цього, якщо відома концентрація і обсяг доданого розчину титранта, визначається кислотність розчину.
Вплив температури на значення pH:
0,001 моль/л HCl при 20°С має рН=3, при 30°C pH=3;
0,001 моль/л NaOH при 20°С має рН=11,73, при 30°C pH=10,83,
Вплив температури на значення pH пояснюють дисоціацією іонів водню (H+) і не є помилкою експерименту. Температурний ефект можна компенсувати за рахунок електроніки pH-метра.
Роль pH в хімії і біології
Кислотність середовища має важливе значення для більшості хімічних процесів, і можливість протікання результату тієї чи іншої реакції часто залежить від pH середовища. Для підтримки певного значення pH в реакційній системі при проведенні лабораторних досліджень або на виробництві застосовують буферні розчини, які дозволяють зберігати майже постійне значення pH при розведенні або при додаванні в розчин маленьких кількостей кислоти або лугу. Водневий показник pH часто застосовують для характеристики кислотно-основних властивостей різних біологічних середовищ. Для біохімічних реакцій велике значення має кислотність реакційного середовища, які протікають в живих системах. Концентрація в розчинах іонів водню часто впливає на фізико-хімічні властивості і біологічну активність білків і нуклеїнових кислот .тому для нормального функціонування організму підтримання кислотно-основного гомеостазу є завданням виняткової важливості.
1.Кислотність середовища
Кислотність розчинів характеризує вміст кислот. або лугів у розчині, тому можна сказати, що визначитися з характеристикою кислотності середовища можна за допомогою умісту іонів Н+, та ОН-.
У чистій воді концентрація таких іонів однакова, чому? ( вода слабкий електроліт – в 1л на іони дисоціює 1* 10-7 моль молекул) ― середа нейтральна.
У розчинах кислот йонів Н+ більше ніж ОН—середовище кисле, чому? Дайте пояснення. Тоді, яке середовище буде лужним? Поясніть. Як це можна довести лабораторним шляхом? Які індикатори вам відомі та як вони діють? Учень у дошки проводить експеримент дії індикаторів фенолфталеїну на лужне середовище, лакмусу на кисле. Другий перевіряє дію метилового оранжевого на луги та кислоти. Третій учень доводить, що розчин натрій хлориду має нейтрале середовище.
2. Кількісна характеристика середовища.
Кількісно кислотність середовища характеризується водневим показником рН, що пов’язаний з вмістом катіонів Гідрогену в 1л розчину. В чистій воді та нейтральних розчинах , його 1* 10-7, тому рН = 7, в кислому середовищі більше, а в лужному менше.
Кисле середовище 0 < рН < 7
Нейтральне середовище рН = 7
Лужне середовище 7 < рН < 14
рН розчину обчислюється як негативний (узятий з оберненим знаком) десятковий логарифм активності водневих іонів, вираженої в молях на літр: pH = - lg [H+]
Це поняття було введено в 1909 датським хіміком Серенсеном. Показник називається pH, за першими літерами латинських слів potentia hydrogeni - сила водню. Для визначення значення pH розчинів широко використовують кілька методик. Водневий показник можна приблизно оцінювати з допомогою індикаторів, точно вимірювати pHметром ( до 0,001 -0,01), або визначати аналітично шляхом, проведенням кислотно-основного титрування. Для грубої оцінки концентрації водневих іонів широко використовуються кислотно-основні індикатори - органічні речовини- барвники, колір яких залежить від pH середовища. До найбільш відомих індикаторів належать лакмус, фенолфталеїн, метиловий оранжевий (метилоранж) та інші. Для розширення робочого інтервалу вимірювання pH використовують так званий універсальний індикатор що представляє собою суміш з кількох індикаторів(метилового червоного, бромтимолового синього, фенолфталеїну розчинених у етанолі). Вимірює такий індикатор з точністю до0,5 Універсальний індикатор послідовно змінює колір з червоного через жовтий, зелений, синій до фіолетового при переході з кислої області в лужну. Визначення pH індикаторним методом утруднено для каламутних або забарвлених розчинів.

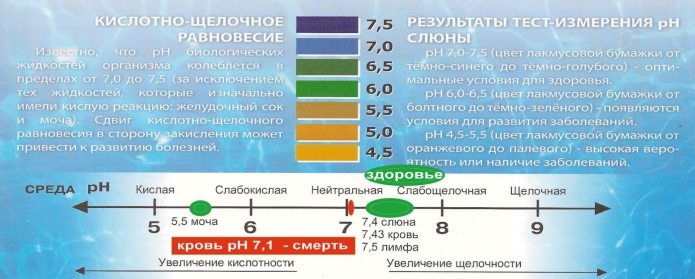
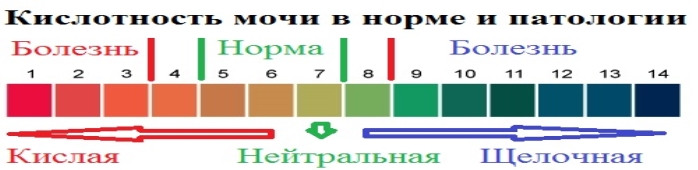
Для здорового життя людини дуже неприємний стан, коли рН не норма. Живі істоти теж реагують на показники рН. Вся риба гине при рН = 4,2, яйця жаби, пуголовки, мухи- одноденки гинуть при рН=5. Для використовування косметичних засобів теж необхідно мати уявлення про рН. Наприклад - рН шкіри людина 5,5, тому важливо використовувати різні косметичні засоби з близким до природного рН шкіри. Однако кожний з нас настільки індивідуальний, що говорити про те, що рН шкіри у всіх повинен бути 5,5 – не можна. Навідь різні частинки тіла мають різнф значення рН: шкіра голови: 4,5 – 5,5; облича: 4,3 – 5,9; пахви: 5,8 – 7,5; груди: 5,3 – 5,6; спина:
5,0- 5,3; долоні: 5,0 – 5,3;ступні: 6,5.
рН різного типу шкіри теж р різний: жирної буде нижче, чим у сухої. 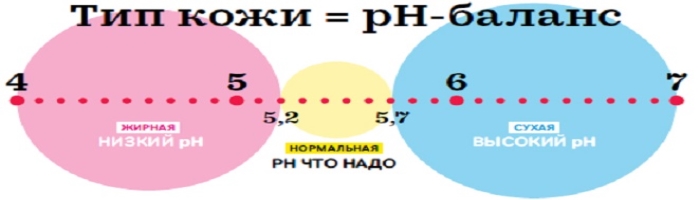
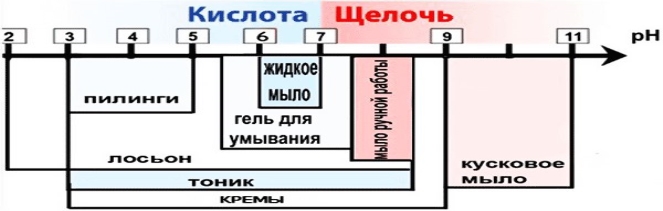
Якщо людина хвора, рН шкіри так само може бути вище або нижче норми. Наприклад, при грибкових інфекціях, екземі шкіри – рН підвищується. Тим більше рН шкіри змінитися, якщо умитися водою з милом або навіть просто обполоскатися водою із крана. Тому важливо знати рН різних косметичних засобів.
Г) Доповідь учнів про стан рН харчових продуктів

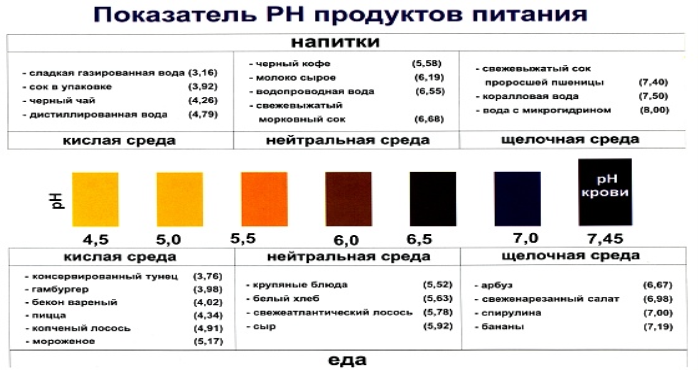


про публікацію авторської розробки
Додати розробку
